在无碳能源逐步取代传统化石能源的过程中,中国正通过积极发展氢技术,推动能源结构的优化和技术水平的提升。 氢能不仅是一种安全可靠、高效率且资源丰富的新型能源,更是具备广泛有效性和绿色可持续性的新型能源。 氨(NH3)因具有高能量密度、高转化效率以及清洁性的优势,而被视为极具前途的绿色能源之一[1,2]。 目前,质子交换膜燃料电池(PEMFC)的研究与发展势头迅猛,而通过氨分解制氢技术为燃料电池提供不含COx的H2在储能和经济效益方面展现了巨大潜力,有望在未来氢经济中扮演重要角色。 因此,开发高活性的NH3分解催化剂对于未来氢经济的发展至关重要。
迄今为止,研究者们已经探索了几种金属催化剂,如Ru、Ni、Fe和Co基催化剂以及金属氮化物,用于氨分解反应。 在这些催化剂中,Ru基催化剂被报道为活性最高的催化剂[3]。 然而,高昂的成本和资源的有限是大规模应用的障碍。 相比之下,钴基催化剂因其Co-N结合能较低,有益于氮的脱附,从而展现出更出色的催化性能[4]。 然而,目前针对氨分解的钴基催化剂的研究仍相对有限。 因此,进一步研究和优化钴基催化剂,特别是在载体选择、制备工艺以及促进剂的使用方面,是提升催化性能的有效途径。
在氨分解反应中,载体对催化剂性能的影响至关重要。 据报道,具有较高的表面积的载体可以改善活性金属的分散度,增加活性位点的数量;具有良好碱性的载体可以促进催化剂的催化性能,载体的碱性越强,催化剂性能越好[5,6]。 Podila等[7]研究了载体组成(Mg-La)对Co催化剂活性的影响。 结果发现,Co催化剂活性的提高的主要是源于镧的添加增强了催化剂的碱性。 Su等[8]发现通过控制促进剂Mg的含量可以增加催化剂的活性,提高氨的转化率。 这是因为Mg的添加改善了催化剂的碱性,有利于氮的复合解吸,加速氨分解反应的控制步骤。 Lucentini等[9]研究了负载在Al2O3和CeO2载体上的Ru基催化剂的性能,其中Ru/CeO2催化剂的活性最高,但Ru的稳定性有限。 Co基催化剂的制备方法也对氨分解的催化性能有显著影响,合适的制备方法可以调节活性物质与载体的相互作用[10]。 在金属氧化物中,氧化铝(Al2O3)具有比表面积大、热稳定性好、成本低等优点[11,12],被广泛用作工业反应的催化剂载体,如氨合成[13,14]、甲醇合成[15,16]、水煤气变换反应[17] 等。 此外,二氧化铈(CeO2)作为一种金属稀土氧化物,具有特殊的氧化还原性质,可有效调节Co活性相的氧化态。 此外,CeO2的热稳定性, 也能够有效抑制催化剂的烧结[18,19]。
因此,本研究使用混合氧化物CeO2-Al2O3作为Co催化剂的载体,以改善金属-载体之间的相互作用,提高催化剂的催化性能。 研究了不同载体制备方法(浸渍法、沉淀法、溶胶凝胶法)对催化活性的影响。
1 实验方法
1.1 CeO2-Al2O3 载体的制备
1.1.1 共沉淀法
将Ce(NO3)3·6H2O和Al(NO3)3·9H2O分别配置成0.5 mol·L-1Ce液 和0.5 mol·L-1Al液,以n(Ce) ∶n(Al)= 1∶2制备混合物,25%的氨水逐滴加入混合溶液,直至出现白色沉淀,pH值调至9,在水浴锅中加热至90 ℃搅拌6 h。 将沉淀物过滤洗涤后在120 ℃的烘箱中保持9 h,将干燥的物质在管式炉中空气气氛下600 ℃煅烧5 h,得到淡黄色的(1∶2)CeO2-Al2O3载体。
1.1.2 浸渍法
保持n(Ce) ∶n(Al)= 1∶2的前提下,称取一定量的γ-Al2O3,加入到溶解的Ce(NO3)3·6H2O水溶液中,在搅拌下浸渍反应24 h。 随后同沉淀法步骤(洗涤、干 燥、煅 烧) 一 致,得 到(1 ∶2) CeO2-Al2O3载体。
1.1.3 溶胶凝胶法
将Ce(NO3)3·6H2O和Al(NO3)3·9H2O以n(Ce) ∶n(Al)= 1∶2溶解在50 mL去离子水中。 在混合溶液中加入相当于 Al (NO3)3·9H2O和Ce(NO3)3·6H2O物质的量总和1.5倍的柠檬酸,随后在90 ℃水浴锅搅拌下获得透明溶胶。 将溶胶在烘箱中120 ℃干燥过夜,随后以同样的方法煅烧获得(1∶2)CeO2-Al2O3载体。
1.2 Co/CeO2-Al2O3 催化剂制备
通过沉积沉淀法制备了负载量为10%的Co催化剂。 将载体(1∶2)CeO2-Al2O3分散在60 mL去离子水中,然后加入一定量的Co(NO3)3·6H2O。 用预先配置的K2CO3和KOH碱性溶液调整混合溶液pH值至约11获得沉淀物,将沉淀物80 ℃反应12 h。 过滤、洗涤、真空干燥,随后进入管式炉在500 ℃、N2气氛中煅烧5 h,获得10%Co/(1 ∶2)CeO2-Al2O3催化剂。
1.3 催化剂的表征
通过X射线衍射(XRD)对催化剂样品的晶相进行表征。 使用Rigaku MiniFlex 600衍射仪,在30 kV和15 mA下使用Cu_Kα 辐射(λ=0.154 056 nm)进行的。 样品以每步0.02°的速率从2θ=10°~80°扫描,扫描时间为每步2 s。 用扫描电子显微镜(SEM)(日立SU-8800)在5 kV的工作电压下对所获得的材料进行了形貌检测。
N2吸附-解吸实验在Micromeritics TriStar 3000表面积和孔隙率分析仪上进行,温度为77 K。 样品的比表面积(SBET)通过多点BET(Brunauer-Emmett-Teller)方法获得,并且孔径分布通过BJH(Barett-Jovner-Halenda)等温线的吸附分支计算。 在分析之前,将样品在400 ℃下在总真空中脱气4 h。 采用程序升温解吸法(CO2-TPD)评价催化剂的酸碱性。 实验前,将催化剂通过550 ℃的He预处理1 h,然后在He流中冷却到50 ℃,将CO2气体预处理催化剂1 h。 将反应器温度提高到100 ℃,用氦气冲洗1 h,以去除物理吸附的CO2。 然后温度以10 ℃·min-1的速率从100 ℃线性增加到900 ℃。 采用H2程序升温还原法(H2-TPR)研究了样品的还原性。 在连接热导检测器(TCD)的石英反应器中,每种催化剂(50 mg)在体积分数5%的H2/Ar(30 mL·min-1)气氛下以10 ℃·min-1加热至950 ℃,通过热导检测器监测氢气消耗。
1.4 催化剂活性评价
氨分解实验在大气压下的不锈钢固定床反应器中进行,反应管内径为10 mm,催化剂填装质量为0.2 g。 在反应前,将所有催化剂在550 ℃下用体积分数10% H2/Ar在550 ℃下还原2 h,然后在N2流下冷却至室温以吹扫残留的氢气。 然后以30 mL·min-1的流量通入纯NH3,将反应温度从350升温至600 ℃,600 ℃前间隔50 ℃,在稳定状态下测定转化率。 氨的转化率采用靛酚蓝法测定[20]。 氢气产率通过气相色谱仪检测:出口气流通过配备Porapak Q柱、热导检测器(TCD)和可实现自动采样的6通阀的气相色谱仪(Agilent 7820A)。
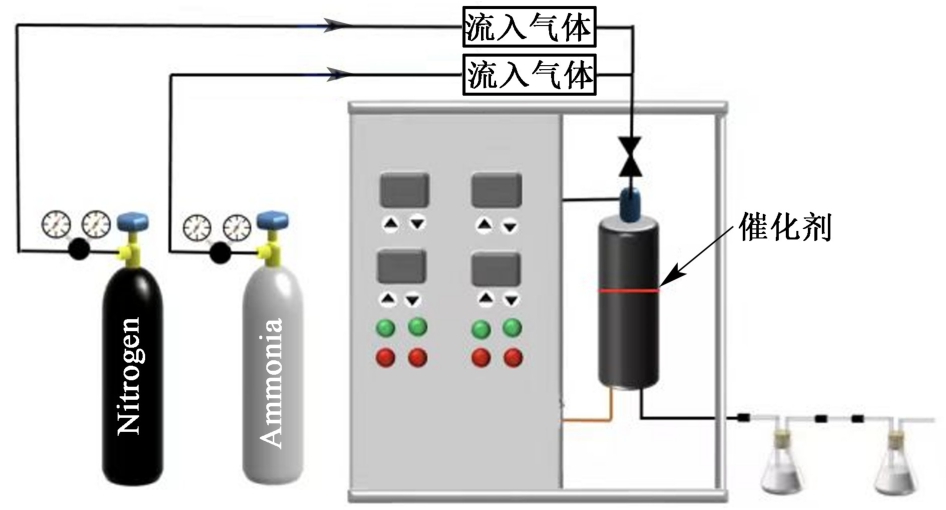
图1 氨分解催化剂的评价装置
Fig.1 Evaluation device for the ammonia decomposition catalyst
2 结果与讨论
2.1 10%Co/(1∶2)CeO2-Al2O3 催化剂的结构
图2 显示了利用XRD表征的3种不同制备方法的(1 ∶2)CeO2-Al2O3载体和沉淀法制备的10%Co/(1∶2)CeO2-Al2O3催化剂的晶相结构。 在所有载体的谱图中均检测到立方结构CeO2的衍射峰(JCPDS NO.43-1002),以及Al2O3的衍射峰(JCPDS NO.81-1667),表明CeO2-Al2O3载体的成功合成。
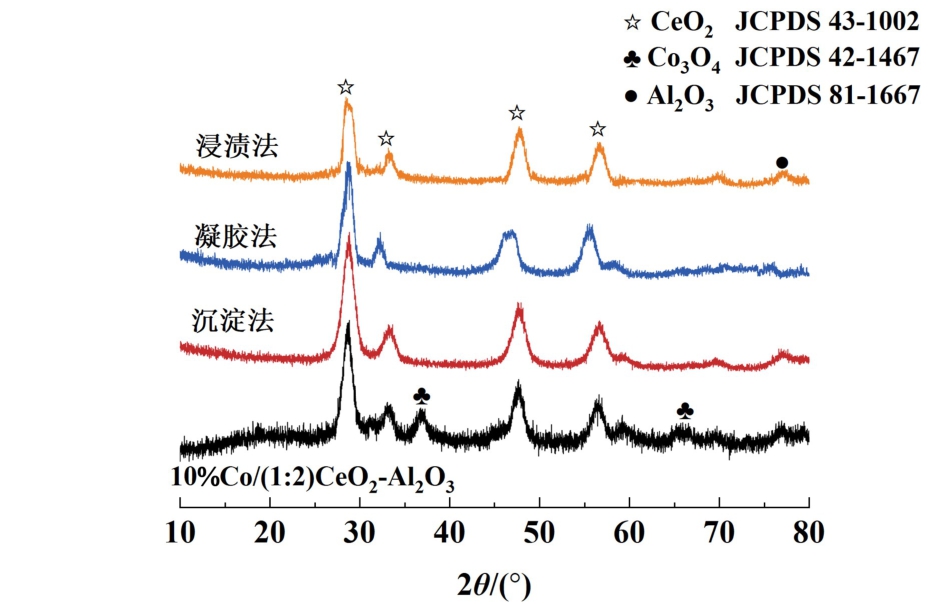
图2 3种不同制备方法的(1∶2) CeO2-Al2O3载体和10%Co/(1∶2)CeO2-Al2O3催化剂的XRD图
Fig.2 XRD patterns of (1∶2) CeO2-Al2O3 supports prepared by three different methods and 10%Co/(1∶2) CeO2-Al2O3 catalysts
此外,可以看出,沉淀法制备的CeO2-Al2O3载体中,CeO2和Al2O3的衍射峰强度高于浸渍法和凝胶法。 新鲜的10%Co/(1 ∶2) CeO2-Al2O3出现了Co3O4的衍射峰(JCPDS NO. 42-1002),证实了Co物种在还原前主要以Co3O4的形态负载在载体上。观察到负载Co物质后CeO2的衍射峰强度显著减弱,这可能是CeO2-Al2O3载体与Co物质的相互作用引起的。
图3 为共沉淀法制备的(1∶2)CeO2-Al2O3载体和催化剂和10%Co/(1∶2)CeO2-Al2O3催化剂的N2吸附-脱附等温线和相应的孔径分布曲线。 所有样品的等温线均为IV型,滞后回线为H3型,表明样品出现了颗粒聚集现象,图3(b)显示的孔径分布曲线说明所有材料大部分为介孔结构。 通过N2吸附-解吸实验研究了不同制备方法对10%Co/(1 ∶2)CeO2-Al2O3催化剂结构性能的影响,总结在表1中。共沉淀法制备的(1∶2)CeO2-Al2O3载体显示出较高的比表面积(158.6 m2·g-1),而浸渍法和溶胶法制备的载体表面积相对较低。 负载Co金属后,催化剂的比表面积和平均孔径均有所减小,表面Co金属成功负载到CeO2-Al2O3载体上。
表1 不同制备方法催化剂的结构性质
Table 1 Structural properties of catalysts prepared by different methods

样品SBET/DP /(m2·g-1)VP /(cm3·g-1)nm沉淀法(1∶2)CeO2-Al2O3 158.6 0.43 5.5浸渍法(1∶2)CeO2-Al2O3 124.3 0.45 6.3凝胶法(1∶2)CeO2-Al2O3 143.5 0.37 4.8沉淀法10%Co/(1∶2)CeO2-Al2O3 139.3 0.45 4.8
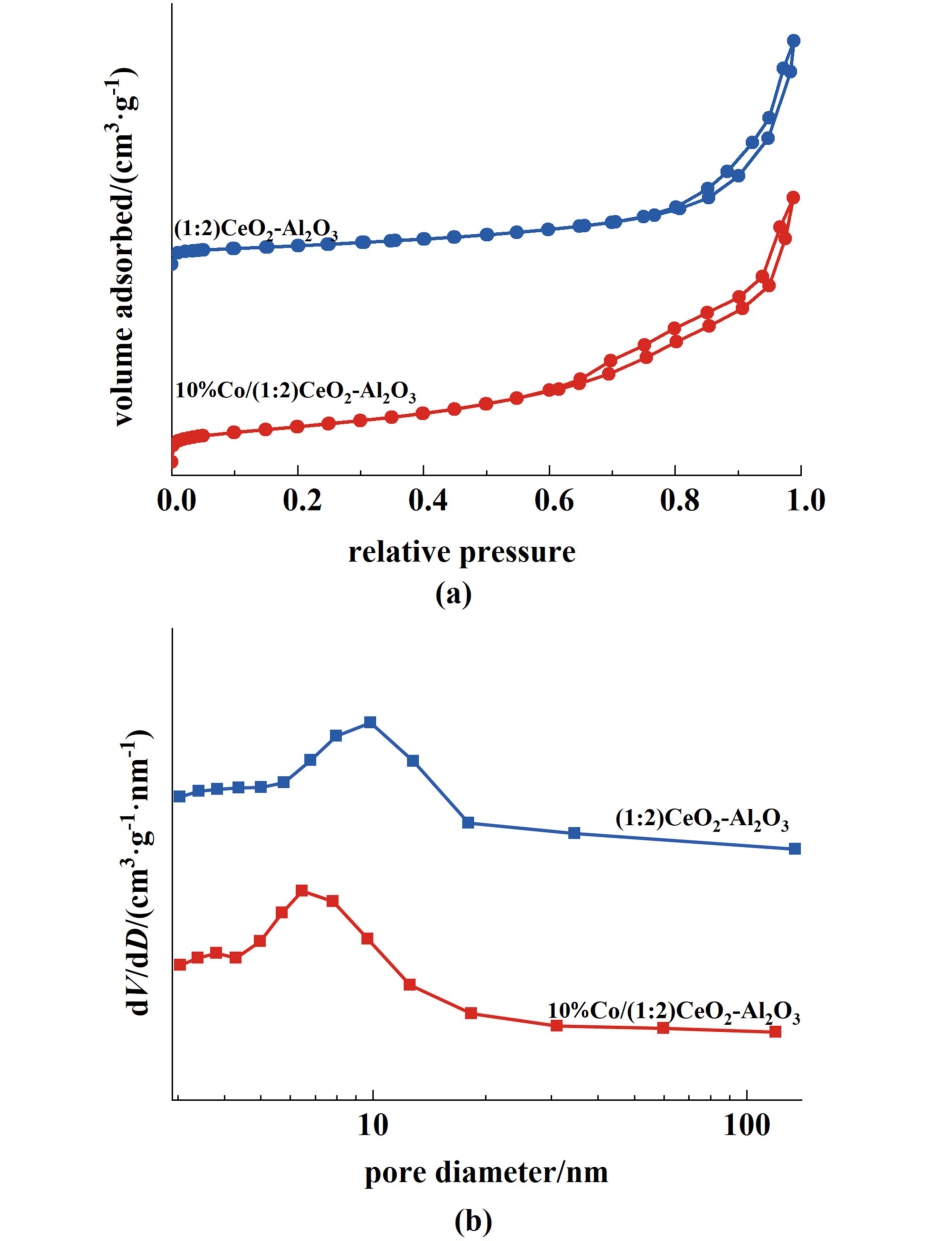
图3 共沉淀法制备的(1∶2) CeO2-Al2O3载体和10%Co/(1∶2) CeO2-Al2O3的(a)N2吸附-脱附等温线和(b)相应的孔径分布曲线
Fig.3 The N2 adsorption-desorption isotherms(a) and pore size distribution curves (b) of (1∶2)CeO2-Al2O3 support and 10%Co/(1∶2) CeO2-Al2O3 prepared by co-precipitation method
采用扫描电镜(SEM)对样品进行了形貌研究。如图4(a)、图4(b)和图4(c)所示,共沉淀法制备的CeO2-Al2O3载体呈现出块状分布,这可能与制备过程中的沉淀条件或煅烧步骤有关。 此外,我们还发现CeO2-Al2O3载体表面存在许多微观的不规则性和缺陷结构。 图4(d)、图4(e)和图4(f)展示了10%Co/(1∶2)CeO2-Al2O3催化剂的表面形貌,其表面粗糙结构可能有助于提高催化剂与NH3的接触效率,从而增加催化活性。 特别是在图4(e)中,我们可以清晰地观察到丰富的孔结构,这些孔不仅为催化剂提供了更大的表面积,还促进了反应物和产物的有效扩散,进一步提升了催化剂的性能。

图4 沉淀法制备的(1∶2) CeO2-Al2O3载体(a、b、c)和10%Co/(1∶2) CeO2-Al2O3 (d、e、f)催化剂的SEM图像
Fig.4 SEM images of (1∶2) CeO2-Al2O3 supports (a, b, c) and 10%Co/(1∶2) CeO2-Al2O3 (d,e, f) catalyst prepared by precipitation method
通过X射线光电子能谱分析(XPS)评价了沉淀法制备的10%Co/(1∶2)CeO2-Al2O3催化剂的表面组成和物种状态。 图5(a)所示,催化剂的Co 2p能谱中位于781.4和796.8 eV的峰分别归属于Co 2p1/2和Co 2p3/2。 根据2个峰之间的能量差为15.4 eV,可以确定该Co氧化物为Co3O4。 催化剂的Ce 3d的谱图如图5(b),886.2和901.4 eV的特征峰分别对应于Ce4+和Ce3+的结合能[21,22]。 二者与标准结合能(884.0和902.0 eV) 之间的差异是由于CeO2和Al2O3结合形成CeO2-Al2O3复合物时,Ce和Al的氧化态及其配位环境可能发生变化,从而导致Ce 3d的峰发生偏移。 此外,混合价态的Ce 3d揭示了CeO2表面具备氧化还原特性,其表面氧迁移的增强得益于Ce3+/Ce4+之间的氧化还原反应。图5(c)中,Al 2p的谱图中74.3和75.3 eV处的Al 2p峰分别对应于Al2O3结合能和的Al的本征氧化物。 如图5(d),O 1s在531.1和532.7 eV处的峰归因于晶格氧和表面吸附氧。
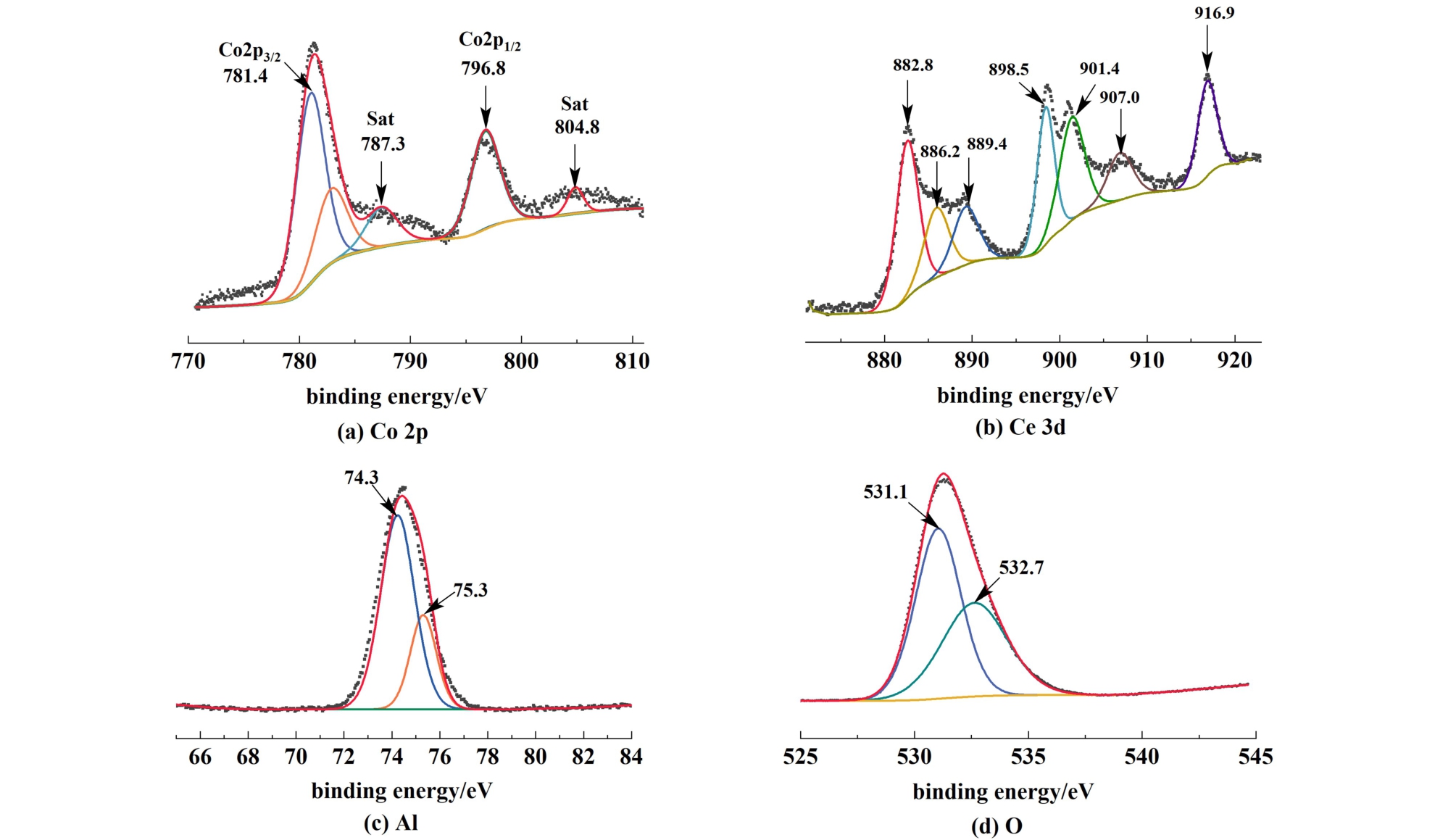
图5 沉淀法制备的10%Co/(1∶2) CeO2-Al2O3催化剂的XPS谱图
Fig.5 XPS spectra of 10%Co/(1∶2) CeO2-Al2O3 catalyst prepared by precipitation method
采用CO2-TPD技术对不同载体制备方法的10%Co/(1∶2)CeO2-Al2O3催化剂进行了碱度研究。CO2的解吸数量和温度是估算催化剂表面碱性位点数量和强度的关键指标。 由于脱附峰的强度非常低,因此没有显示在CeO2-Al2O3载体上负载钴催化剂的CO2-TPD研究。 如图6所示,100 ~ 250 ℃、300~525 ℃和725~875 ℃处的峰分别对应与催化剂弱、中、强碱性位点与CO2的相互作用。 沉淀法制备的催化剂上中等碱性位点的数量明显高于浸渍法和凝胶法。 此外,沉淀法的强碱性位点向更高温度区域移动,这说明沉淀法制备的催化剂具有更强的碱性,有利于提高Co催化剂的活性。
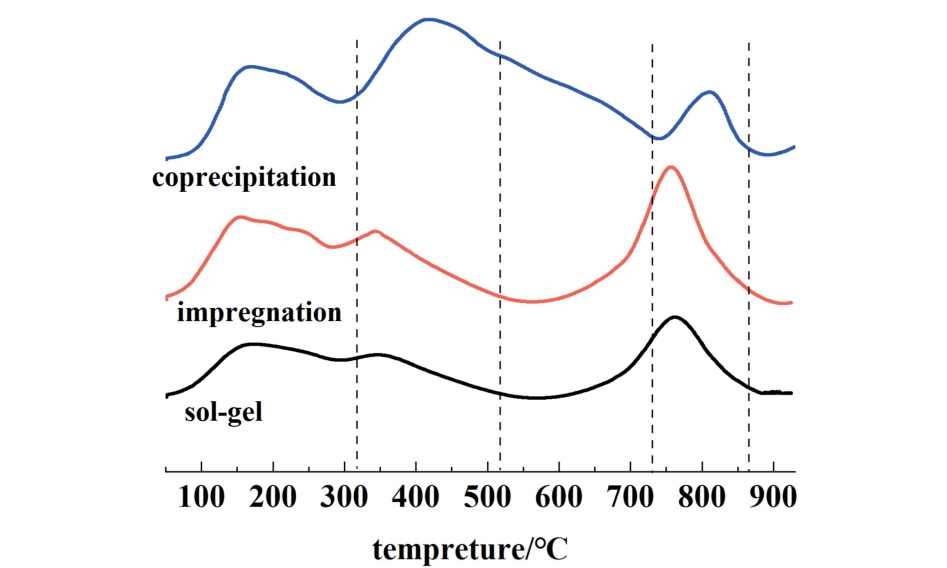
图6 3种不同载体制备方法的10%Co/(1∶2)CeO2-Al2O3催化剂的CO2-TPD谱图
Fig.6 CO2-TPD spectra of 10%Co/(1∶2)CeO2-Al2O3 catalysts prepared by three different support preparation methods
通过H2-TPR技术探究焙烧后钴催化剂的还原性,结果如图7所示。 10%Co/Al2O3催化剂的TPR谱图在368和677 ℃的还原峰分别对应于Co3O4还原为CoO和CoO进一步还原为Co的过程[23]。10%Co/CeO2催化剂在369 ℃的峰值是Co3O4的还原,而CoO还原为Co的过程明显向更高温度区域移动。 所以,单纯的CeO2作为Co催化剂的载体,不利于氧化钴的还原。 对于10%Co(1 ∶2)CeO2-Al2O3催化剂,在359和706 ℃的还原峰分别归属于上面两种钴氧化物的还原,其中,CoO还原为Co向高温区移动,这可能是CeO2-Al2O3载体与Co物种相互作用的结果。 此外513 ℃处的峰对应于CeO2中晶格氧的还原。
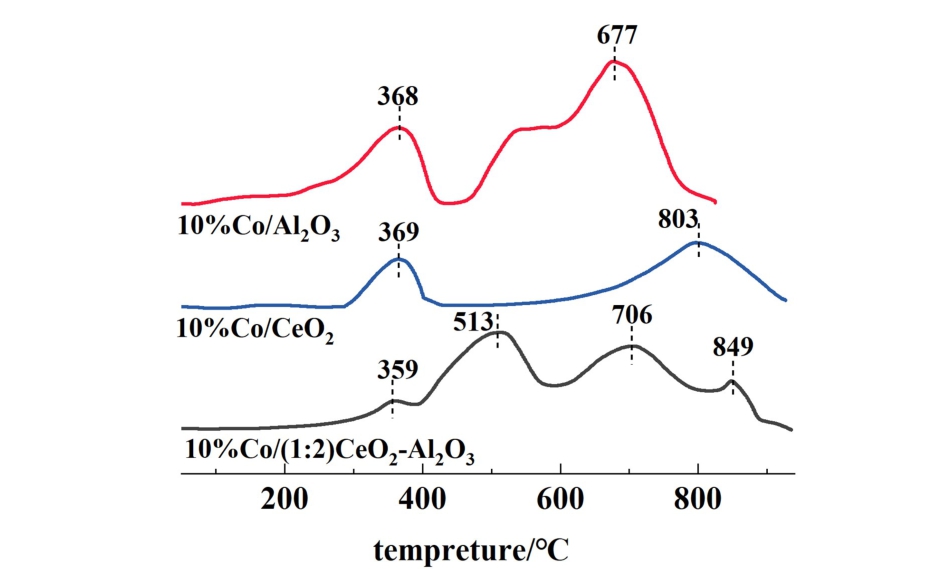
图7 沉淀法10%Co/Al2O3、10%Co/CeO2和10%Co(1∶2) CeO2-Al2O3催化剂的H2-TPR谱图
Fig.7 H2-TPR spectra of 10%Co/Al2O3, 10%Co/CeO2 supports, and 10%Co(1∶2) CeO2-Al2O3 catalyst
2.2 10%Co/(1∶2)CeO2-Al2O3 催化剂的催化性能
在气体空速为9 000 mL·h-1·g-1下,我们检测了沉淀法、浸渍法和凝胶法3种制备方法对Ce掺杂Al2O3的钴基催化剂在氨分解反应中的催化性能。图8(a)展示了这3种催化剂在350~600 ℃温度范围内对氨的转化率。 由于氨分解是一个吸热过程,因此随着温度的升高,氨的转化率也逐渐增加。 值得注意的是,在600 ℃时,所有催化剂的氨转化率均接近95%。 然而,在较低的温度下,不同制备方法得到的催化剂表现出明显的转化率差异。 沉淀法制备的(1∶2)CeO2-Al2O3载体负载Co金属催化剂在550 ℃时表现出最高的氨转化率,达到86%。 相比之下,浸渍法和凝胶法制备的催化剂在相同温度下的转化率分别为84%和82%,略低于沉淀法制备的催化剂。 此外,图8(b)还展示了这3种催化剂在550和600 ℃时的氢气产率。 结果显示,沉淀法制备的(1∶2)CeO2-Al2O3载体负载Co催化剂在550和600 ℃时的氢气产率分别为8.6 mmol·g-1·min-1和9.7 mmol·g-1·min-1,表现出较高的氢气生成能力。10%Co/(1∶2)CeO2-Al2O3催化剂的催化性能主要是由于Ce的加入提高了Co物种的分散度,阻止了活性Co的烧结,从而提高了催化剂的活性。
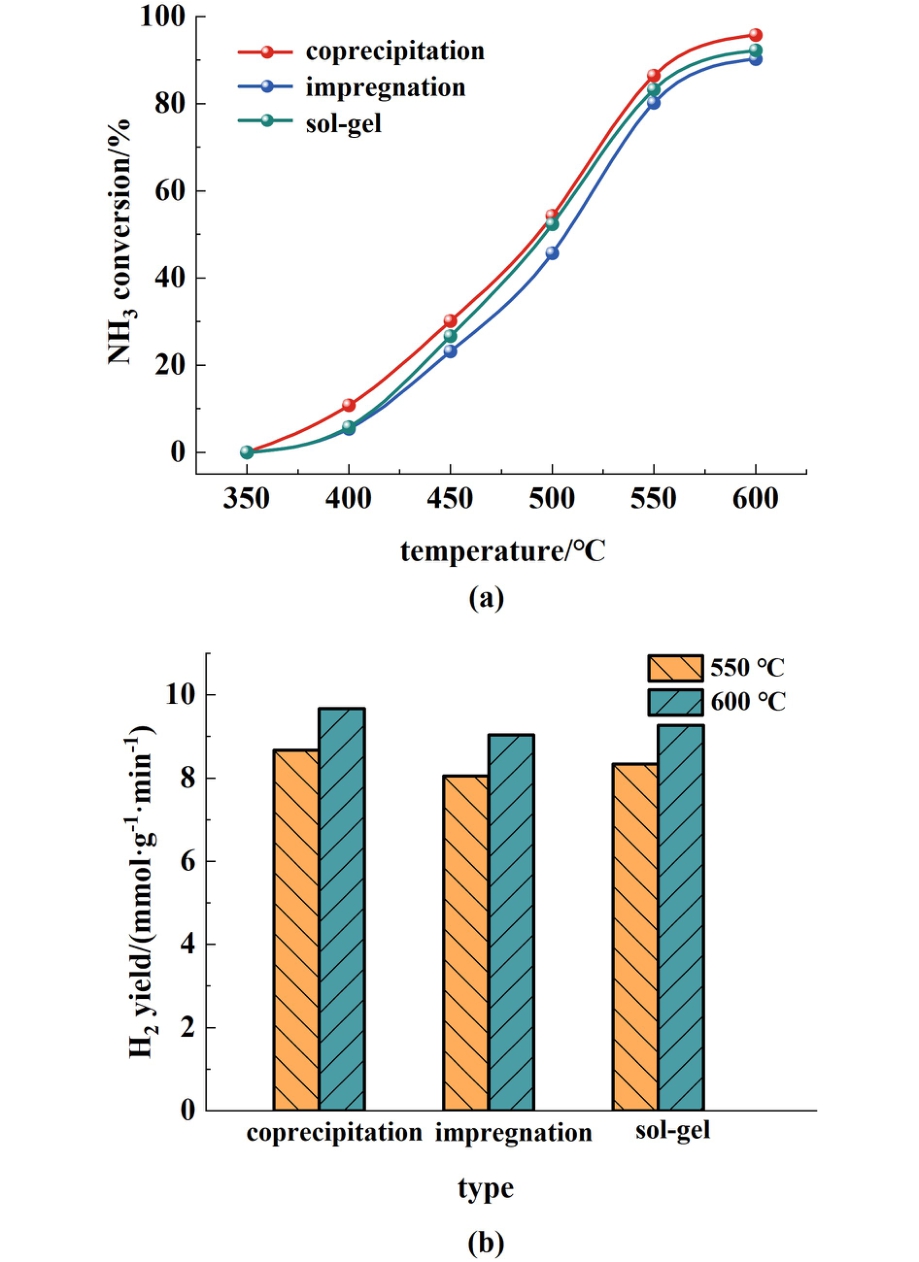
图8 不同制备法的10%Co/(1∶2) CeO2-Al2O3催化剂在GHSV为9 000 mL·h-1·g-1时的(a)氨转化率;(b)催化剂的氢气产率
Fig.8 The ammonia conversions (a) and hydrogen yield(b) of 10%Co/(1∶2) CeO2-Al2O3 catalysts prepared by different preparation methods at different temperatures and gas-space velocity of 9 000 mL·h-1·g-1
如图9所示,为了进一步考察沉淀法制备的催化剂活性情况,研究了10%Co/(1∶2)CeO2-Al2O3催化剂在不同GHSV下的氨转化率。 结果表明,在相同温度下,随着GHSV从6 000增加到30 000 mL·h-1·g-1,氨转化率逐渐降低。 在600 ℃和9 000 mL·h-1·g-1条件下,10%Co/(1∶2)CeO2-Al2O3催化剂的转化率约为96%。 此外,在600 ℃和高达15 000 mL·h-1·g-1的条件下,10%Co/(1∶2)CeO2-Al2O3催化剂的转化率也能达到87%。
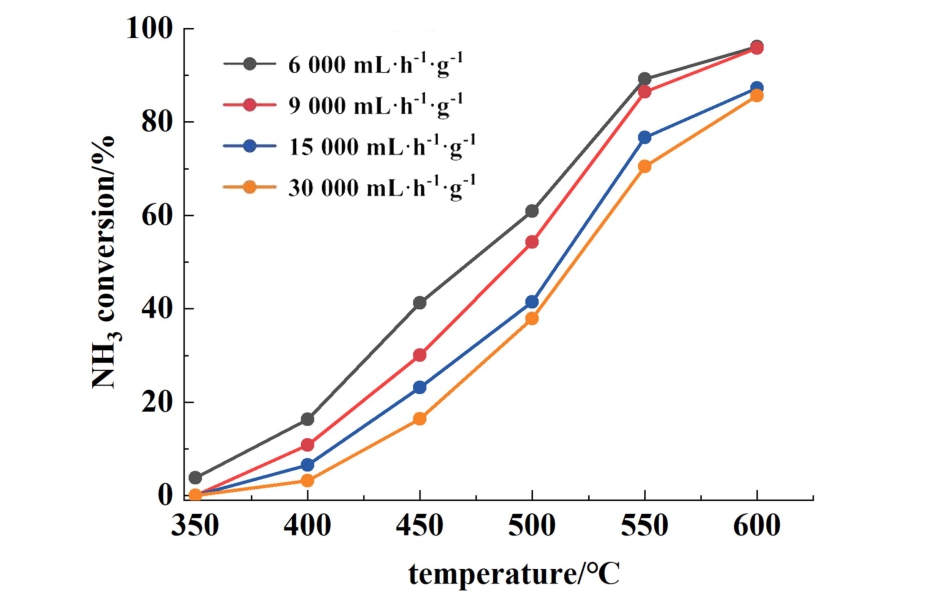
图9 沉淀法制备的10%Co/(1∶2) CeO2-Al2O3在不同GHSV条件下的氨分解性能
Fig.9 Ammonia decomposition of 10%Co/(1∶2)CeO2-Al2O3 prepared by precipitation method under different GHSV conditions
3 结论
采用共沉淀法、浸渍法和溶胶凝胶法制备了CeO2-Al2O3载体,并负载Co催化剂用于氨分解制氢反应。 通过共沉淀法制备的CeO2-Al2O3载体负载Co催化剂获得了较好的催化性能。 BET结果显示,相较于浸渍法和凝胶法具有更大的比表面积,有助于活性物种Co的均匀分散,增加活性位点数量。 同时,CeO2的存在有效阻止了Co颗粒的烧结,从而提高了催化剂性能。 H2-TPR和CO2-TPD结果证实了沉淀法获得的催化剂催化活性的增强得益于CeO2-Al2O3之间的强相互作用,从而提高了催化剂碱性。
[1] JUANGSA F B, IRHAMNA A R, AZIZ M. Production of ammonia as potential hydrogen carrier: Review on thermochemical and electrochemical processes[J]. International Journal of Hydrogen Energy, 2021, 46(27): 14455-14477
[2] CHEHADE G, DINCER I. Progress in green ammonia production as potential carbon-free fuel[J]. Fuel, 2021, 299: 120845
[3] ZOU X, SU H, SUN X, et al. Interplay between surface structure, reaction condition and mechanism for ammonia decomposition on Ru catalyst [J]. Applied Surface Science, 2024,649: 159175
[4] ZHANG H, ALHAMED Y A, CHU W, et al. Controlling cosupport interaction in Co/MWCNTs catalysts and catalytic performance for hydrogen production via NH3 decomposition[J].Applied Catalysis A: General, 2013, 464: 156-164
[5] IM Y, MUROYAMA H, MATSUI T, et al. Ammonia decomposition over nickel catalysts supported on alkaline earth metal aluminate for H2 production[J]. International Journal of Hydrogen Energy, 2020, 45(51): 26979-26988
[6] KURTO ˇGLU S F S, SARP S, YıLMAZ AKKAYA C, et al.COx-free hydrogen production from ammonia decomposition over sepiolite-supported nickel catalysts[J]. International Journal of Hydrogen Energy, 2018, 43(21): 9954-9968
[7] PODILA S, ALHAMED Y A, ALZAHRANI A A, et al. Hydrogen production by ammonia decomposition using Co catalyst supported on Mg mixed oxide systems[J]. International Journal of Hydrogen Energy, 2015, 40(45): 15411-15422
[8] SU Q, GU L, YAO Y, et al. Layered double hydroxides derived nix(Mgy AlzOn) catalysts: Enhanced ammonia decomposition by hydrogen spillover effect[J]. Applied Catalysis B: Environmental, 2017, 201: 451-460
[9] LUCENTINI I, CASANOVAS A, LLORCA J. Catalytic ammonia decomposition for hydrogen production on Ni, Ru and NiRu supported on CeO2[J]. International Journal of Hydrogen Energy,2019, 44(25): 12693-12707
[10] LARA-GARCÍA H A, MENDOZA-NIETO J A, PFEIFFER H,et al. COx-free hydrogen production from ammonia on novel cobalt catalysts supported on 1D titanate nanotubes[J]. International Journal of Hydrogen Energy,2019,44 ( 57 ):30062-30074
[11] ZHANG Z, FU X, WANG W, et al. Promoted porous Co3 O4-Al2 O3 catalysts for ammonia decomposition[J]. Science China Chemistry, 2018, 61(11): 1389-1398
[12] HUO L, LIU B, LI H, et al. Component synergy and armor protection induced superior catalytic activity and stability of ultrathin Co-Fe spinel nanosheets confined in mesoporous silica shells for ammonia decomposition reaction[J]. Applied Catalysis B: Environmental, 2019, 253: 121-130
[13] REINA T R, IVANOVA S, CENTENO M A, et al. Boosting the activity of a Au/CeO2/Al2 O3 catalyst for the WGS reaction[J].Catalysis Today, 2015, 253: 149-154
[14] ZHAO L, QI Y, SONG L, et al. Solar-driven water-gas shift reaction over CuOx/Al2 O3 with 1.1% of light-to-energy storage[J]. Angewandte Chemie International Edition, 2019, 58(23):7708-7712
[15] LAM E, CORRAL-PÉREZ J J, LARMIER K, et al. CO2 hydrogenation on Cu/Al2 O3: Role of the metal/support interface in driving activity and selectivity of a bifunctional catalyst[J].Angewandte Chemie ( International Ed), 2019, 58 ( 39):13989-13996
[16] GUO Q, LI S, LI J, et al. Enhanced CO2 hydrogenation to methanol on the mesostructured Cu-ZnO/Al2O3-ZrO2 catalyst[J]. ACS Applied Energy Materials, 2021, 4(8): 8311-8321
[17] LETERME C, FERNÁNDEZ C, ELOY P, et al. The inhibitor role of NH3 on its synthesis process at low temperature, over Ru catalytic nanoparticles [J]. Catalysis Today, 2017, 286:85-100
[18] ZHANG Y, ZHAO S, FENG J, et al. Unraveling the physical chemistry and materials science of CeO2-based nanostructures[J]. Chem, 2021, 7(8): 2022-2059
[19] LIU H, LI S, WANG W, et al. Partially sintered copper-ceria as excellent catalyst for the high-temperature reverse water gas shift reaction[J]. Nature Communications, 2022, 13(1): 867
[20] LI C, GUO L, CHEN G, et al. CoNi alloy catalyst supported on Zr-modified Y2 O3 for ammonia decomposition to COx-free hydrogen[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2023, 671: 131671
[21] ZHANG R, LU K, ZONG L, et al. Control synthesis of CeO2 nanomaterials supported gold for catalytic oxidation of carbon monoxide[J]. Molecular Catalysis, 2017, 442: 173-180
[22] KONSOLAKIS M, SGOURAKIS M, CARABINEIRO S A C.Surface and redox properties of cobalt-ceria binary oxides: On the effect of co content and pretreatment conditions[J]. Applied Surface Science, 2015, 341: 48-54
[23] MORLANÉS N, SAYAS S, SHTERK G, et al. Development of a Ba-CoCe catalyst for the efficient and stable decomposition of ammonia[J]. Catalysis Science & Technology, 2021, 11(9):3014-3024