在20世纪里,因氮肥增产的粮食养活了大约50%的世界人口。 尿素是一种重要的氮肥,氮含量高,发展尿素工业对满足日益增长的人口需求具有重要的意义。 目前,尿素合成主要是用Bosch-Meiser工艺,需要在高温高压的反应条件(150 ~200 ℃,15~25 MPa)通过氨气与二氧化碳反应合成。 该过程不仅能耗较大,且需要消耗全球约80%的氨[1]。 作为原料的氨在目前工业生产上还是由传统的Haber-Bosch法主导。 仅工业产氨每年消耗的能源占世界每年能源供应总量的1%~2%。 每1 t氨的合成还伴随着约1.9 t的二氧化碳排放,大幅增加了碳减排工作的难度[2]。 因此,通过清洁、可持续、环境友好的方式合成尿素成为越来越多研究者关注的重点。 电化学合成尿素,是以CO2和N2/NO-3作为碳氮源,通过水中C—N偶联反应合成尿素,能够将原料一步转化为高附加值的化学品。 其反应条件温和、产物清洁无污染,对于解决能源危机和环境污染问题有着重大的价值和意义,是一项极具潜力的替代方案。
对于目前电化学合成尿素的相关研究,设计高效的催化剂是提高尿素产率和选择性的关键。 其中围绕金属铜Cu设计的多金属催化剂,利用了表面多金属位点的协同催化作用,从而表现出较高的尿素选择性。 Chen等[3] 设计了Pb1-Cu1/TiO2-400催化剂,实现水中偶联氮气和二氧化碳选择性地合成尿素,法拉第效率FE为8.92%。 Gao等[4]通过在金属-有机框架中的配位策略设计了2种类型的电催化尿素催化剂Cu (III)-HHTP和 Cu (II)-HHTP,相比之下Cu(III)-HHTP在-0.6 V下的尿素法拉第效率提高到23.09%。 此外,针对惰性气体N2中![]() 的较高解离能
的较高解离能![]()
![]() 以及N2在水中低溶解度的问题,不少研究者选择解离能低得多的硝酸盐
以及N2在水中低溶解度的问题,不少研究者选择解离能低得多的硝酸盐![]() 作为氮源的替代
作为氮源的替代![]() 与CO2偶联从而提高电化学尿素合成的性能,这是目前另一条可行的途径。Josh等[5]报道了一种单原子铜催化剂Cu-N-C,能够电催化偶联
与CO2偶联从而提高电化学尿素合成的性能,这是目前另一条可行的途径。Josh等[5]报道了一种单原子铜催化剂Cu-N-C,能够电催化偶联![]() 和CO2合成尿素,FE可达到28%。Xu等[6] 报道了一种单原子铜合金Pd催化剂(Pd4Cu1),通过控制Cu掺杂水平和Pd4Cu1/FeNi(OH)2界面来调节和匹配CO2和
和CO2合成尿素,FE可达到28%。Xu等[6] 报道了一种单原子铜合金Pd催化剂(Pd4Cu1),通过控制Cu掺杂水平和Pd4Cu1/FeNi(OH)2界面来调节和匹配CO2和![]() 的还原动力学,电 荷 极 化 的Pdδ--Cuδ+ 双 位 点 稳 定 了 关 键 的∗CO和∗NH2中间体从而促C—N耦合。 Zhao等[7]报道了一种具有铜钨交替的双金属位点催化剂CuWO4,这种交替的双金属位点有效地改善了反应中间体在催化剂表面的形成和覆盖,提高了C—N偶联反应以及尿素合成的选择性,从而实现了53%的高尿素FE。
的还原动力学,电 荷 极 化 的Pdδ--Cuδ+ 双 位 点 稳 定 了 关 键 的∗CO和∗NH2中间体从而促C—N耦合。 Zhao等[7]报道了一种具有铜钨交替的双金属位点催化剂CuWO4,这种交替的双金属位点有效地改善了反应中间体在催化剂表面的形成和覆盖,提高了C—N偶联反应以及尿素合成的选择性,从而实现了53%的高尿素FE。
本研究通过Ru掺杂策略制备了一种氯掺杂钌铜氧化物催化剂RuCuO-Cl,相比使用较为广泛的水热法制备金属有机配合物以及高温热解法制备单原子和双原子催化剂等策略来设计多金属位点[4-6,8,9],该方法反应条件温和且合成周期短。 利用Ru和Cu分别对于氮还原反应(NRR)和二氧化碳还原(CO2RR)的高催化活性[10-15]及卤素Cl对反应中间体生成的促进作用[16,17],构建了多金属协同催化体系。 电化学性能测试结果表明,RuCuO-Cl在![]() 体系以及N2/CO2体系下均具有较好的尿素合成选择性,在-0.3 V下的尿素法拉第效率可分别达到22.04%和14.83%,对应产率为77.16和5.64 μg·h-1·cm-2。 与氯掺杂铜氧化物(CuO-Cl)的催化性能进行对比,Ru掺杂策略使得催化剂整体的尿素合成性能得到了显著的提升,证明了该策略可应用于尿素合成催化剂的优化。 通过调控Ru掺杂的条件,研究了2种N源体系下Ru对于尿素催化性能的影响,分析了性能变化趋势及对应最适宜的掺杂条件。 结果显示,不同体系下的Ru掺杂最适宜条件并不相同,需要针对对应的反应体系进行优化调控。
体系以及N2/CO2体系下均具有较好的尿素合成选择性,在-0.3 V下的尿素法拉第效率可分别达到22.04%和14.83%,对应产率为77.16和5.64 μg·h-1·cm-2。 与氯掺杂铜氧化物(CuO-Cl)的催化性能进行对比,Ru掺杂策略使得催化剂整体的尿素合成性能得到了显著的提升,证明了该策略可应用于尿素合成催化剂的优化。 通过调控Ru掺杂的条件,研究了2种N源体系下Ru对于尿素催化性能的影响,分析了性能变化趋势及对应最适宜的掺杂条件。 结果显示,不同体系下的Ru掺杂最适宜条件并不相同,需要针对对应的反应体系进行优化调控。
三氯化钌( RuCl3)、 一水合乙酸铜[Cu(CH3COO)2·H2O]、盐酸羟胺(NH2OH·HCl)、碳酸氢钾(KHCO3)、硝酸钾(KNO3)、亚硝酸钾(KNO2)、硫酸钾(K2SO4)、氨基硫脲(TSC)、二甲氨基苯甲醛(C9H11NO)、对氨基苯磺酰胺(C6H8N2O2S)、二甲亚砜-d6(DMSO-d6)购自天津希恩思奥普德科技有限公司;浓磷酸(H3PO4)、浓硫酸(H2SO4)、浓盐酸(HCl)、次氯酸钠(NaClO)、肼(N2H4)购自南通江天化学股份有限公司;二乙酰一肟(DAMO)、N-(1-萘基)-二盐酸乙二胺(C12H16Cl2N2)购自上海麦克林生化科技股份有限公司;尿素[CO(NH2)2]、氢氧化钠(NaOH)、乙醇(C2H5OH)、水杨酸(C7H6O3)购自天津科密欧化学试剂有限公司;三氯化铁(FeCl3)、亚硝基铁氰化钠{Na2[Fe(CN)5NO]·2H2O}购自上海阿拉丁生化科技股份有限公司;碳纸(Sinero YLS-30T)购自苏州晟尔诺科技有限公司;Nafion溶液购自美国杜邦公司;石墨板购自北京晶龙特碳科技有限公司;高纯氮气(N2)、高纯二氧化碳(CO2)购自天津市百思达气体有限公司;去离子水(≥3 MΩ·cm)购自天津市永清源蒸馏水经营部。
1.2.1 制备CuO-Cl催化剂
配制20 mL 25 mmol·L-1Cu(CH3COO)2·H2O水溶液,在持续磁力搅拌下将2 mL 1 mol·L-1氢氧化钠水溶液快速注入溶液后持续反应30 min生成Cu(OH)2。 之 后 快 速 注 入0.9 mL的1 mol·L-1 NH2OH·HCl水溶液,继续反应10 min生成CuO-Cl。通过离心分离收集固相产物CuO-Cl,用去离子水和无水乙醇重复洗涤,真空干燥后储存,以供后续实验使用。
1.2.2 制备RuCuO-Cl催化剂
取0.1 g CuO-Cl样品加入20 mL 0.2 g·L-1 RuCl3,持续磁力搅拌条件下在60 ℃保持2 h得到RuCuO-Cl,然后通过抽滤分离产物,经去离子水和无水乙醇洗涤和真空干燥后储存。
为研究Ru掺杂对于催化性能的影响,分别以0.1、0.2、0.3和0.4 g·L-1RuCl3浓度作为控制变量,制备得到不同的Ru掺杂催化剂分别记为1-Ru-CuO-Cl、2-RuCuO-Cl、3-RuCuO-Cl和4-RuCuO-Cl。
取2 mg的催化剂粉末和25 μL 5% Nafion溶液加入475 μL的无水乙醇中,超声至催化剂完全分散,制得催化剂墨水。 随后,以碳纸作为基底,取催化剂墨水喷涂在碳纸的整平层一侧,在120 ℃下干燥,制得催化剂/CP电极(催化剂实际负载量为0.1 mg·cm-2)。
用配置能量色散X射线能谱仪(Energy Dispersive X-ray Speictrometer, EDS)的日本日立8100型扫描电子显微镜(Scanning Electron Microscope,SEM)对制备样品进行形貌观测及成分分析。 采用布鲁克铜靶X射线衍射仪(X-Ray Diffraction,XRD)和美国赛默飞Thermo Scientific ES CALAB Xi+型X射线光电子能谱(X-ray Photoelectron Spectroscopy,XPS)分析了样品的分子结构及原子价态。
电化学测试采用连接CHI760E工作站的三电极体系。 以制备的催化剂电极(1 cm×1 cm)作为工作电极,高纯石墨板(3 cm×3 cm)作为对电极,饱和甘汞电极(Saturated calomel electrode,SCE)作参比电极,采用H型电解槽,阴极室与阳极室之间用经过预处理的Nafion-117膜分隔(预处理:在80 ℃的H2O2(5%)水溶液中煮沸1 h;在80 ℃的超纯水中煮沸1 h;在0.05 mol·L-1H2SO4中处理1 h;在超纯水中处理3 h)。 测试过程中所有电位均转化为相对于可逆氢电极(Reversible hydrogen electrode,RHE)的电位,转换公式为见式(1)。
对于电化学尿素合成性能测试实验,以CO2饱和的0.2 mol·L-1KHCO3和0.1 mol·L-1KNO3作为硝酸盐体系电解质,以CO2、N2饱和的0.1 mol·L-1 KHCO3作为氮气体系电解质,阴极室和阳极室的电解液体积各为60 mL,N2与CO2在测试前需要向电解液中通气30 min处理使气体达到饱和,且在催化反应过程中保持20 mL·min-1的气体流量并持续对电解液进行磁搅拌。
对于尿素产物的定量分析,所采用的方法是二乙酰一肟法,显色试剂的配制如下。 试剂A:将100 mL浓磷酸(质量分数为 85%, 密度 1.67 g·cm-3)和300 mL浓 硫 酸(95% ~ 98%, 1.84 g·cm-3)加入至600 mL蒸馏水中,混合均匀后将100 mg氯化铁溶解于上述溶液。 试剂B:将500 mg二乙酰一肟(DAMO)和10 mg氨基硫脲(TSC)溶解在蒸馏水中,稀释至100 mL。 显色方法:将2.00 mL A和1.00 mL B加入1.00 mL含尿素的待测溶液中,充分混合。 然后,将溶液加热到100 ℃,并在此温度下保持15 min。 待上述溶液冷却到25 ℃后,使用紫外分光光度计(北京普析 TU-1900) 测量525 nm处的吸光度。 利用尿素标准溶液的浓度与对应吸光度测定尿素标准曲线,将待测样品的吸光度代入标准曲线可计算尿素浓度。
对于尿素的1H NMR分析,采用二甲亚砜-d6(DMSO-d6) 作为氘化试剂,将400 μL待测样与200 μL DMSO-d6混合,然后将液体转移到核磁共振管中进行测试。 测试在600 MHz的JEOL JNM ECZ600R光谱仪上进行,所得数据是经过512次扫描的累积结果。 利用尿素标准溶液的浓度与对应1H NMR谱图中尿素峰的积分面积测定尿素标准曲线,将待测样品的尿素峰面积代入标准曲线可计算尿素浓度。
对于氨NH3产物的定量分析,采用靛酚蓝分光光度法。 取1 mL待测样品于10 mL的比色管中,用水定容至刻度线。 在比色管中依次加入0.5 mL的水杨酸溶液(5%),0.1 mL的亚硝基铁氰化钠溶液(1%)和0.1 mL的NaClO溶液(0.05 mol·L-1)。 室温下显色1 h后,在697 nm处测定显色溶液的吸光度。 利用氨标准溶液的浓度与吸光度绘制氨标准曲线,将待测样品的吸光度代入标准曲线可计算氨的浓度。
对于肼N2H4的浓度使用Watt和Chrisp法进行检测。 显色试剂的配制如下:将0.6 g对二甲氨基苯甲醛溶于3 mL浓盐酸和30 mL无水乙醇的混合溶液中。 显色方法:比色管中加入1 mL待测样和1 mL显色液,显色10 min后,在455 nm处测定显色后溶液的吸光度。 利用肼标准溶液与显色后溶液的吸光度绘制肼的标准曲线。 将待测样品的吸光度代入标准曲线可计算肼的浓度。
亚硝酸根![]() 的测定:采用分光光度法对亚硝酸盐进行了定量测试。 显色剂配置如下:对于亚硝酸根的检测,将25 mL去离子水和5 mL磷酸混合,加入2 g对氨基苯磺酰胺和0. 1 g的N-(1-萘基)-二盐酸乙二胺得到显色剂。 显色方法:取1 mL待测样,将其稀释到5 mL,在该稀释液中加入0. 1 mL显色剂,混合均匀后在室温下静置20 min,读取540 nm处紫外吸光度的数值。通过标准样品浓度与吸光度绘制标准曲线,将待测样品的吸光度代入标准曲线可计算亚硝酸根的浓度。
的测定:采用分光光度法对亚硝酸盐进行了定量测试。 显色剂配置如下:对于亚硝酸根的检测,将25 mL去离子水和5 mL磷酸混合,加入2 g对氨基苯磺酰胺和0. 1 g的N-(1-萘基)-二盐酸乙二胺得到显色剂。 显色方法:取1 mL待测样,将其稀释到5 mL,在该稀释液中加入0. 1 mL显色剂,混合均匀后在室温下静置20 min,读取540 nm处紫外吸光度的数值。通过标准样品浓度与吸光度绘制标准曲线,将待测样品的吸光度代入标准曲线可计算亚硝酸根的浓度。
对于气相中的H2和CO产物,采用气相色谱法进行检测。 测试仪器为海欣-GC-950;载气为Ar(体积分数为99. 99%);检测器为TCD;色谱柱为碳分子筛填充柱(规格3 m×3 mm,粒度80~100目);进样体积为1 mL;气化温度为120 ℃;柱温箱温度设定为100 ℃;检测器温度设定为120 ℃;定量方法为校正面积归一化法。
产物的法拉第效率及产率计算公式如式(2)和式(3)。
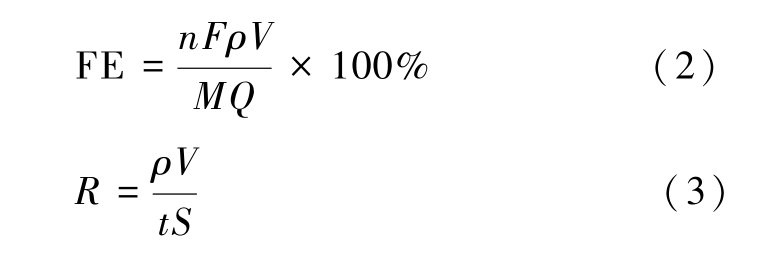
式(2)和式(3)中:n为电子转移数(硝酸盐体系下尿素、氨、肼、亚硝酸根分别为16、8、4和2;氮气体系下尿素、氨、肼分别为6、3和4;H2和CO均为2);F为法拉第常数,96 485.3 C·mol-1;ρ 为浓度,μg·mL-1;V为电解液总体积,mL;M为相对分子质量(尿素为60.06 g·mol-1;氨为17.03 g·mol-1;肼为32.05 g·mol-1;亚硝酸根为46.01 g·mol-1;H2为2.02 g·mol-1;CO为28.01 g·mol-1);Q为通过工作电极的总电荷,C;t为电催化反应时间,h;S为工作电极的表观面积,cm2。
2.1.1 SEM表征
图1 为催化剂样品以及负载于碳纸上制得催化电极的SEM图。

图1 材料的SEM图
Fig.1 SEM images of the prepared materials
图1(a)和图1(b)所示,经过Ru掺杂得到的RuCuO-Cl表面形貌较CuO-Cl而言相对不规则,说明催化剂表面的物质组成和结构很可能发生了改变。 图1(c)和图1(d)为利用喷涂法制得的RuCuO-Cl/CP电极的表面形貌,结果显示催化剂均匀分布于电极表面,无结块开裂现象,这种疏松多孔的表面形貌有利于气体的吸附及传质。
2.1.2 EDS表征
图2 为RuCuO-Cl的EDS图。

图2 RuCuO-Cl的EDS图
Fig.2 EDS images of RuCuO-Cl
通过表征分析,在催化剂样品表面检测到了Ru、Cu和Cl对应的元素分布。 其中Cu的元素占比较高,Ru、Cl的元素占比较低。 为了确认Ru生长在了催化剂的表面或是形成Ru沉淀后再与CuO-Cl均匀混合,测试了催化剂制备实验中的不同环境下Ru的沉淀情况。 结果表明,本实验所用浓度的RuCl3溶液在常态下以及0.1 mol·L-1NaOH的碱性环境下均可维持溶液态超过24 h无沉淀生成,而仅在加入固相CuO-Cl后与之发生反应。 反应现象为液相由黑色溶液变为透明溶液,固相催化剂由黄色变为暗黄色,表明Ru与CuO-Cl发生反应并生长在了CuO-Cl表面。 综合上述结果,证明了Ru掺杂策略成功在CuO-Cl的结构基础上引入了Ru。
2.1.3 XRD表征
图3 为CuO-Cl和RuCuO-Cl的XRD谱图。 结果显示,在RuCuO-Cl中检测到明显的Cu2O衍射峰,表明Cu主要以Cu(I)氧化物形式存在。 与CuO-Cl及CuO标准卡片的2个主峰相对比,发现RuCuO-Cl的峰出现了略微的偏移并且峰强度变弱,表明CuO-Cl引入Ru后发生了晶格变化,晶粒尺寸变小。 但可能是由于负载量偏低导致无法检出,Ru与Cl的相关物质(RuCl3、RuO2、CuCl、CuCl2)未能在XRD表征中检测到明显的特征峰。 因此仅通过XRD表征无法分析确定Ru和Cl在RuCuO-Cl的具体存在形式。
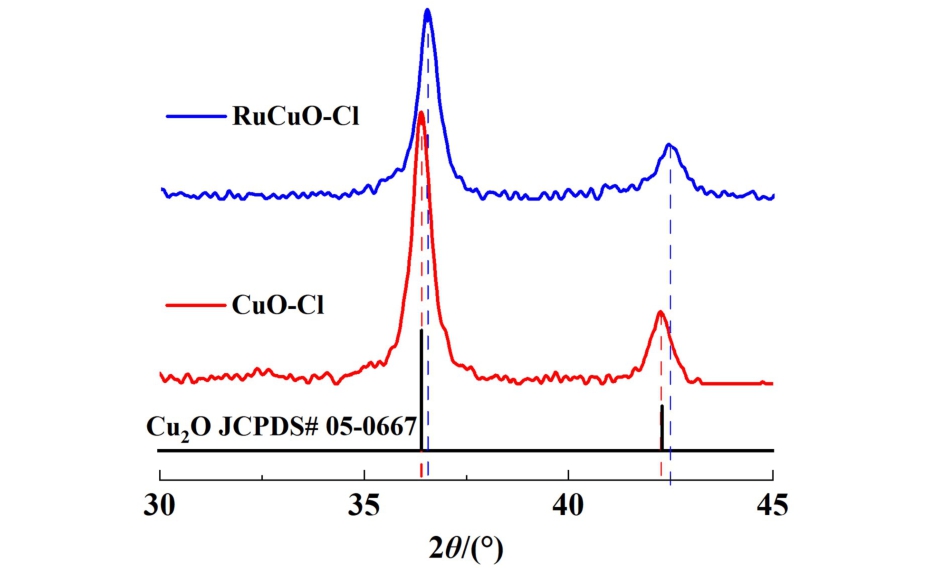
图3 CuO-Cl和RuCuO-Cl的XRD谱图
Fig.3 XRD pattern of CuO-Cl and RuCuO-Cl
2.1.4 XPS表征
图4 为RuCuO-Cl的XPS图。 图4(a)所示为Cu 2p的XPS图,图4(a)中具有932.56/952.38 eV结合能峰的Cu 2p3/2和Cu 2p1/2信号归因于Cu+,表明催化剂中存在Cu+物种[18],与XRD表征结果相吻合。结合能934.37/953.91 eV的峰信号对应为Cu2+,并且在每个Cu 2p之后均出现的峰信号为Cu(II)氧化物对应卫星峰[19],该结果说明体系还存在部分Cu2+物种,可能与Cu2O表面发生的氧化反应有关。 Ru 3p的XPS图如图4(b)所示,结果显示Ru具有2组Ru 3p峰信号,结合能为463.78/486.01 eV和466.56 /487.78 eV的峰分别对应为Ru3+和Ru4+的Ru 3p3/2和Ru 3p1/2[20-22],说明催化剂中存在Ru3+和Ru4+物种。根据图4(c)的Cl 2p XPS图显示,Cl存在2组Cl 2p峰信号,其中结合能为197.84/199.3 eV的峰对应为Ru-Cl的Cl 2p3/2和Cl 2p1/2信号[22],另一组198.44/200.07 eV的峰则归因于Cu-Cl的Cl 2p3/2和Cl 2p1/2信号[23],表明RuCuO-Cl中的Cl不仅以CuO-Cl的形式掺杂,还有一部分来源于Ru-Cl。 这一结果表明利用RuCl3成功向CuO-Cl催化体系引入Ru的同时使部分Cl以Ru-Cl形式掺杂入催化体系,从而RuCuOCl的Cl掺杂量较CuO-Cl有进一步提升。 图4(d)所示为O 1s的XPS图,图4(d)中结合能为533.01 eV的峰归因于H2O中O—H的O 1s信号[24],结合能为530.45 eV的峰对应Cu—O的O 1s信号[25],结合能为531.62 eV的峰对应Ru—O的O 1s信号[26]。 图4(d)的结果表明催化剂中存在结晶水以及Ru、Cu的氧化物(可能为RuO2·H2O、Cu2O、CuO),该结果与Cu和Ru的XPS分析结果相匹配。 综合XPS结果分析,可说明该催化剂为氯掺杂的钌铜氧化物。
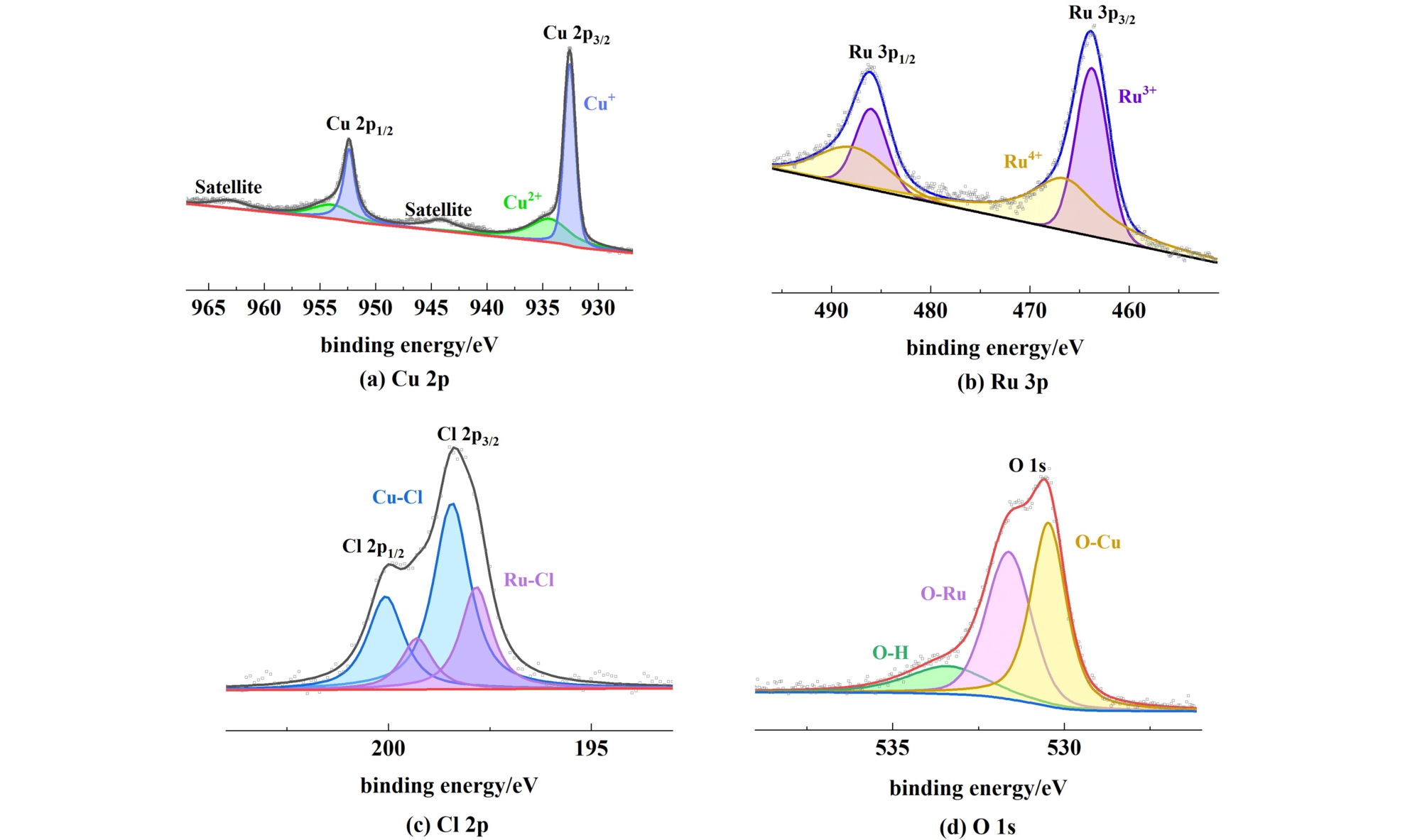
图4 RuCuO-Cl的XPS谱图
Fig.4 XPS spectrums of RuCuO-Cl
2.2.1 LSV测试
图5 所示为RuCuO-Cl在不同供气条件0.1 mol·L-1KHCO3电解液的线性伏安曲线。
图5 RuCuO-Cl的LSV曲线
Fig.5 LSV curve of RuCuO-Cl
由图5可看出,N2和CO2的通入均会影响Ru-CuO-Cl的LSV曲线,表明水中的CO2与N2参与了催化反应,初步证明了RuCuO-Cl的NRR及CO2RR催化活性。 对比同电位下的电流密度,发现饱和CO2 > 饱 和 N2 + CO2 > 饱 和 N2。 这 是 由 于 相 对CO2RR,NRR以及C—N偶联合成尿素的反应活性较差,受其竞争影响,故同时通入CO2和N2的反应电流密度低于仅通入CO2。
2.2.2 尿素合成性能测试
图6(a)为RuCuO-Cl与CuO-Cl在0.1 mol·L-1 KNO3和0.2 mol·L-1KHCO3体系中不同电位下的尿素合成性能。 图6(a)中显示,CuO-Cl催化剂在该体系下具有一定尿素合成的催化活性,在-0.3 V vs.RHE下FE达到12.37%,对应尿素产率为30.86 μg·h-1·cm-2。 对比分析RuCuO-Cl与CuO-Cl的性能测试,发现Ru的掺杂有效改良了CuO-Cl的整体催化性能。 特别在-0.3 V下,RuCuO-Cl的尿素产率和法拉第效率均明显优于 CuO-Cl,FE达到22.03%同时可实现77.14 μg·h-1·cm-2的较高尿素产率。
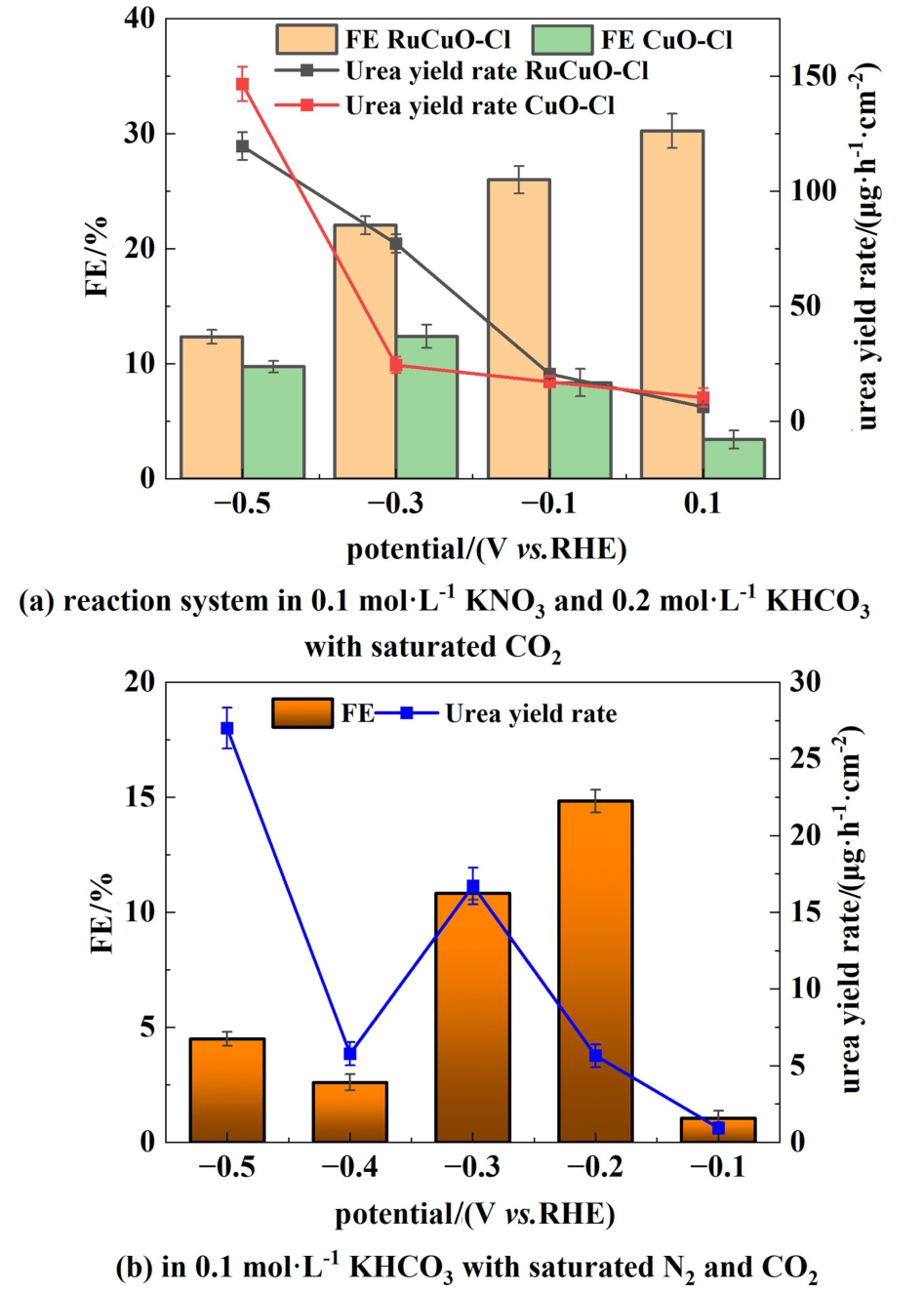
图6 RuCuO-Cl的尿素合成性能测试
Fig.6 Performance test of RuCuO-Cl for urea synthesis
图6(b)为RuCuO-Cl在N2和CO2饱和的0.1 mol·L-1 KHCO3体系中不同电位下的尿素合成性能。 对于该反应体系,在CuO-Cl的催化产物中未检测到尿素生成,而RuCuO-Cl在该体系中具有尿素合成的催化活性。 当阴极电位达到-0.2 V时,RuCuO-Cl的尿素FE攀升至14.83%,对应产率5.64 μg·h-1·cm-2,之后尿素的FE随电位的提高呈现下降趋势。 并且,RuCuO-Cl氮气合成尿素的高性能电位区间相对较窄,仅在-0.2~-0.3 V的电位区间显示出了较高尿素FE。 随着电位增大,电流密度提升虽然使尿素产率得到增长,但由于析氢等副反应的竞争加剧,FE呈现出较低的水平。 受限于氮气N N的高解离能以及水中的低溶解度等影响因素,与硝酸盐体系相比,氮气作为氮源的尿素合成FE以及产率偏低。 上述趋势与国内外同类研究报道的结果趋势相同[3-9]。
N的高解离能以及水中的低溶解度等影响因素,与硝酸盐体系相比,氮气作为氮源的尿素合成FE以及产率偏低。 上述趋势与国内外同类研究报道的结果趋势相同[3-9]。
为了定性分析生成的尿素产物,对RuCuO-Cl在不同反应体系下的反应产物进行了1H NMR表征,分别分析了-0.3 V下在CO2饱和的0.1 mol·L-1KNO3 +0.2 mol·L-1KHCO3体系反应2 h以及N2+CO2饱和的0.1 mol·L-1KHCO3体系反应4 h后的液相产物,结果如图7所示。 2种体系的反应产物均在化学位移5.32附近出现了单峰,且与尿素标准样品的1H NMR谱图相匹配,可表明生成产物中确有尿素。 利用1H NMR表征,通过标准曲线法对尿素进行了定量分析,硝酸盐反应体系的尿素浓度为5.35,氮气体系为1.62,该定量结果与二乙酰一肟法接近,从而证明了尿素产物定量方法的可靠性。
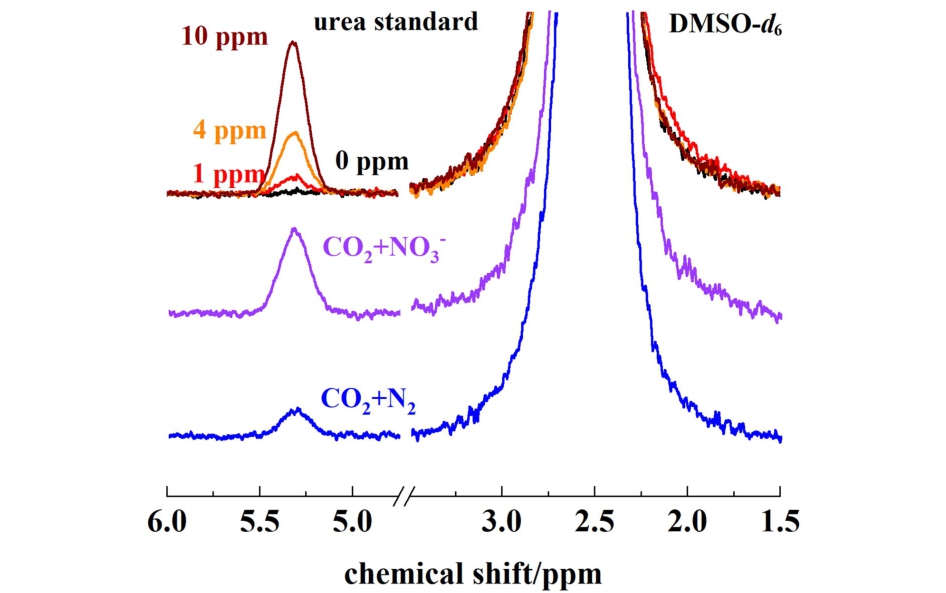
图7 RuCuO-Cl在不同反应体系下的产物的1H NMR测试
Fig.7 1H NMR tests of the products of RuCuO-Cl in different reaction systems
图8 所示为RuCuO-Cl在不同反应体系下的电流-时间曲线。
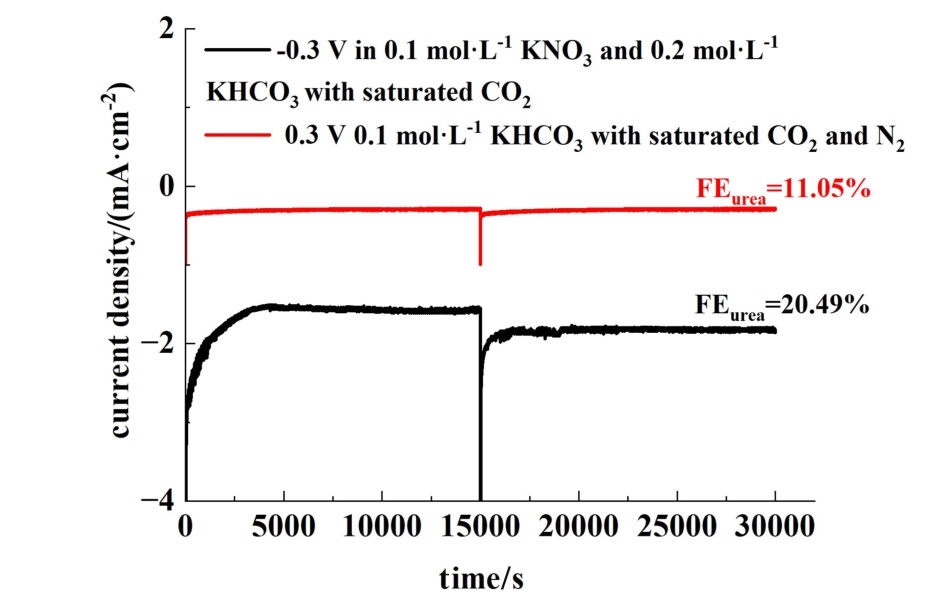
图8 RuCuO-Cl的i-t曲线
Fig.8 i-t curve of RuCuO-Cl
图8 显示,在-0.3 V下经过30 000 s的电催化反应,RuCuO-Cl对于硝酸盐体系和氮气体系分别能维持1.82和0.29 mA·cm-2的电流密度。 通过对30 000 s反应后的尿素产物进行检测,硝酸盐体系和氮气体系的FE可分别维持20.49%和11.05%。RuCuO-Cl在长时间的反应过程中未出现明显的性能衰退,说明该催化材料具有较好的稳定性。
对RuCuO-Cl在不同的反应体系下可能生成的相关产物![]() 进行了检测。 图9(a)为RuCuO-Cl在0.1mol·L-1KNO3和0.2 mol·L-1KHCO3体系中不同电位下的产物检测。结果显示,RuCuO-Cl在硝酸盐体系下未检测到N2H4生成,在-0.1~ -0.5 V的电位范围中检测到了微量
进行了检测。 图9(a)为RuCuO-Cl在0.1mol·L-1KNO3和0.2 mol·L-1KHCO3体系中不同电位下的产物检测。结果显示,RuCuO-Cl在硝酸盐体系下未检测到N2H4生成,在-0.1~ -0.5 V的电位范围中检测到了微量![]() 的生成。 在所有含氮产物中,尿素产物的选择性最高,而随着电位的提高,尿素选择性呈下降趋势。 该反应体系下,NH3是尿素合成反应中最主要的含氮副产物,其选择性随电位提高呈现先增后减的趋势,在-0.4 V达到峰值,FE为14.02%。由图可以看出,在-0.1~ -0.4 V的电位区间内,NRR的总FE几乎不变,而尿素和NH3的FE变化趋势相反,说明了尿素与NH3副产物的竞争是影响FE的重要因素。 当电位提高到-0.5 V,NRR总FE及含氮产物的选择性均下降,而H2作为HER对应产物,其选择性出现大幅提升,对应FE达到了65.82%。 这表明高电位下的HER竞争使得NRR整体受到抑制是尿素FE下降的重要因素。
的生成。 在所有含氮产物中,尿素产物的选择性最高,而随着电位的提高,尿素选择性呈下降趋势。 该反应体系下,NH3是尿素合成反应中最主要的含氮副产物,其选择性随电位提高呈现先增后减的趋势,在-0.4 V达到峰值,FE为14.02%。由图可以看出,在-0.1~ -0.4 V的电位区间内,NRR的总FE几乎不变,而尿素和NH3的FE变化趋势相反,说明了尿素与NH3副产物的竞争是影响FE的重要因素。 当电位提高到-0.5 V,NRR总FE及含氮产物的选择性均下降,而H2作为HER对应产物,其选择性出现大幅提升,对应FE达到了65.82%。 这表明高电位下的HER竞争使得NRR整体受到抑制是尿素FE下降的重要因素。
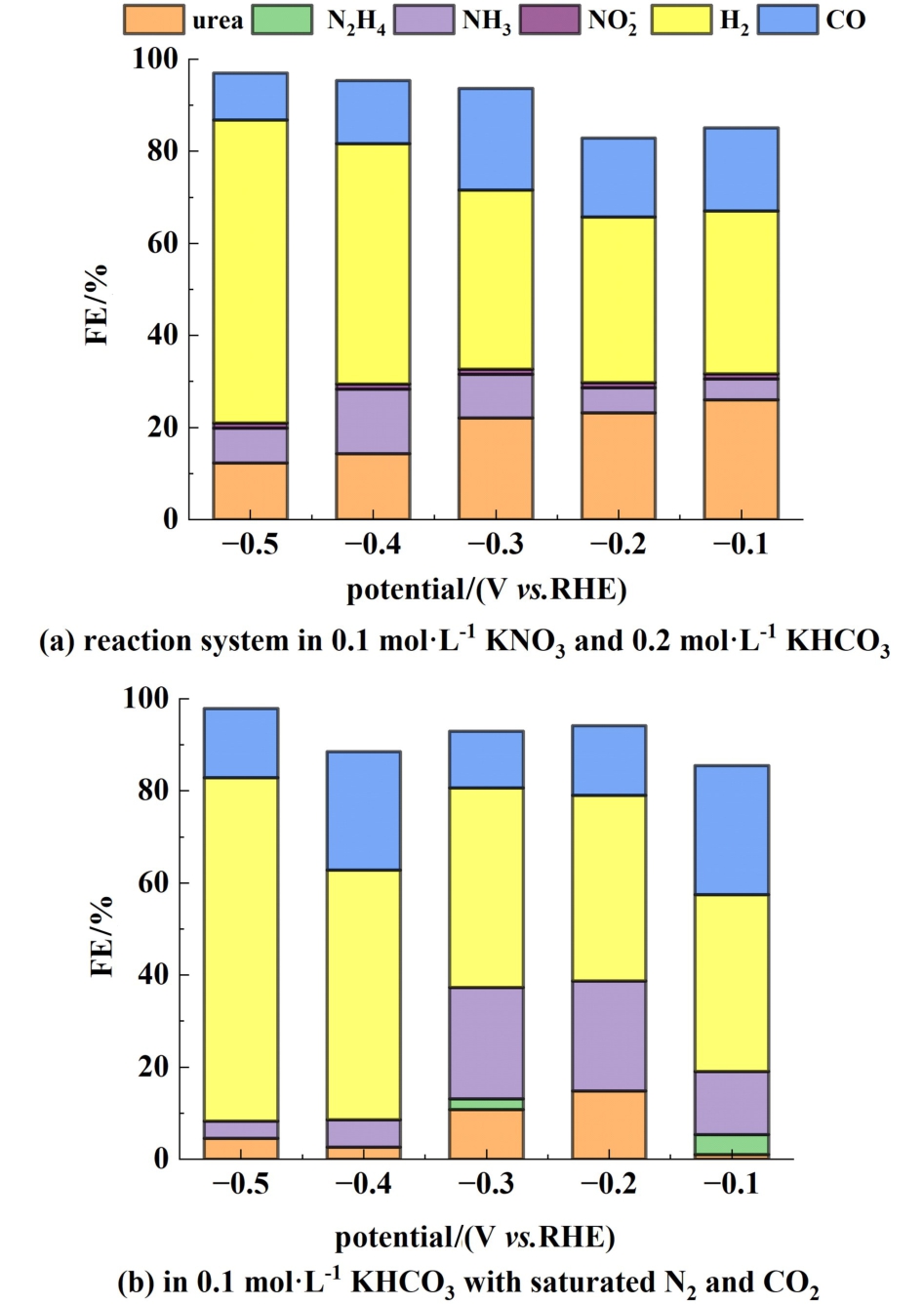
图9 RuCuO-Cl的反应产物检测
Fig.9 Reaction products detection of RuCuO-Cl
图9(b) 为RuCuO-Cl在N2和CO2饱和的0.1 mol·L-1KHCO3体系中不同电位下的反应产物检测。 与![]() 氮源体系不同,该体系在-0.1和-0.3 V下检测到了一定量的N2H4产物(-0.1 V下的FE为4.32%)。 在该体系下,NH3具有较高的选择性,在-0.3 V下的FE达到24.15%。 NH3性能变化趋势随电位提高呈现先增后减趋势,且在-0.2~-0.3 V区间表现出较好的性能。 在-0.1~-0.4 V的电位区间内,CO作为该反应体系中最主要的CO2RR产物与NRR的FE变化趋势呈现出了明显的竞争趋势,而在-0.4~ -0.5 V,随着电位增大,HER选择性出现显著的提升,相应的CO2RR及NRR均受到抑制。 在该体系下,NRR总FE及尿素和NH3的FE变化趋势均相同,当NRR总FE较高时对应尿素和NH3的选择性也较高。 这表明在该体系下,N2较低的NRR催化活性是限制尿素合成性能的重要因素。 该结果也进一步佐证了RuCuOCl对高溶解度、易解离的硝酸盐作为氮源相较于氮气具有更高的NRR催化活性,因此在硝酸盐氮源反应体系下的尿素合成性能整体优于氮气氮源体系。
氮源体系不同,该体系在-0.1和-0.3 V下检测到了一定量的N2H4产物(-0.1 V下的FE为4.32%)。 在该体系下,NH3具有较高的选择性,在-0.3 V下的FE达到24.15%。 NH3性能变化趋势随电位提高呈现先增后减趋势,且在-0.2~-0.3 V区间表现出较好的性能。 在-0.1~-0.4 V的电位区间内,CO作为该反应体系中最主要的CO2RR产物与NRR的FE变化趋势呈现出了明显的竞争趋势,而在-0.4~ -0.5 V,随着电位增大,HER选择性出现显著的提升,相应的CO2RR及NRR均受到抑制。 在该体系下,NRR总FE及尿素和NH3的FE变化趋势均相同,当NRR总FE较高时对应尿素和NH3的选择性也较高。 这表明在该体系下,N2较低的NRR催化活性是限制尿素合成性能的重要因素。 该结果也进一步佐证了RuCuOCl对高溶解度、易解离的硝酸盐作为氮源相较于氮气具有更高的NRR催化活性,因此在硝酸盐氮源反应体系下的尿素合成性能整体优于氮气氮源体系。
2.2.3 Ru掺杂的调控
针对Ru的掺杂情况对于尿素催化性能的影响进行了研究,通过控制RuCl3的浓度制备了4种不同Ru掺杂量的RuCuO-Cl。 如图10所示,在CO2饱和的0.1 mol·L-1KNO3和0.2 mol·L-1KHCO3反应体系以及N2、CO2饱和的0.1 mol·L-1KHCO3反应体系下,分别研究了不同Ru掺杂催化剂在-0.3 V的尿素催化性能。 图10(a)所示为CO2饱和的0.1 mol·L-1 KNO3和0.2 mol·L-1KHCO3体系下的测试结果,随着Ru掺杂量的提高,尿素产率呈先增后减的趋势,其中4-RuCuO-Cl的产率以及FE均相对较高, FE达到了22.1%, 对应产率为92.59 μg·h-1·cm-2。 图10(b)为N2、CO2饱和的0.1 mol·L-1 KHCO3体系下的测试结果,研究发现随着Ru掺杂量的提高,尿素产率和FE均呈现先增后减的趋势,并且2-RuCuO-Cl的产率以及FE可同时达到最优,-0.3 V下尿素产率可达到17.36 μg·h-1·cm-2,对应FE为11.24%。 结果表明改变Ru的掺杂量会影响尿素的催化性能,该影响在氮气体系下尤其明显,其中4-RuCuO-Cl与2-RuCuO-Cl分别在硝酸盐和氮气作为氮源的反应体系下表现出了最优的尿素催化性能。
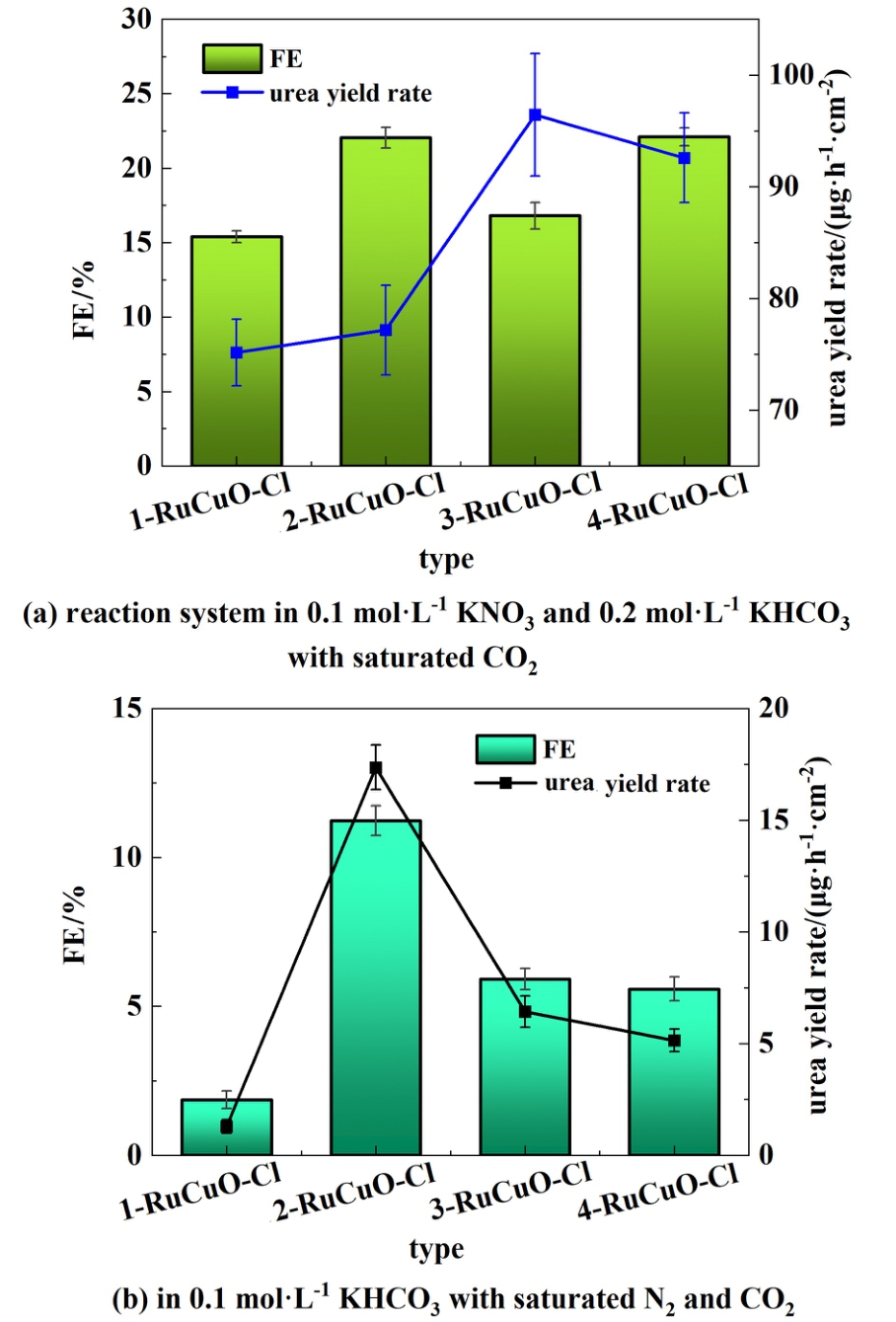
图10 不同RuCuO-Cl在-0.3 V下的尿素合成性能测试
Fig.10 Performance test of different RuCuO-Cl for urea synthesis at -0.3 V
利用Ru掺杂策略在CuO-Cl结构基础上引入Ru,制备了RuCuO-Cl催化剂,并通过一系列表征证明了Ru以及Cl的成功引入。
RuCuO-Cl催化剂在硝酸盐以及氮气2种氮源的反应体系下均表现出了良好的电化学尿素合成性能,且明显优于未掺杂Ru的CuO-Cl,证明Ru、Cu多金属位点的协同催化相较单一Cu金属位点催化具有更高的尿素选择性和产率。
本研究提出了一种相对简单且有效的多金属位点设计策略,为后续相关的催化剂研究提供了一种可行的思路,有利于推动电化学尿素合成领域的进一步发展,为未来实现绿色尿素合成的工业化生产做出贡献。
[1] GIDDEY S, BADWAL S P S, KULKARNI A. Review of electrochemical ammonia production technologies and materials[J]. International Journal of Hydrogen Energy, 2013, 38(34): 14576-14594
[2] CHEN J, CROOKS R M, SEEFELDT L C, et al. Beyond fossil fuel-driven nitrogen transformations[J]. Science, 2018, 360(6391): 6611
[3] CHEN C, ZHU X, WEN X, et al. Coupling N2 and CO2 in H2 O to synthesize urea under ambient conditions[J]. Nature Chemistry, 2020, 12(8): 717-724
[4] GAO Y, WANG J, YANG Y, et al. Engineering spin states of isolated copper species in a metal-organic framework improves urea electrosynthesis[J]. Nano-Micro Letters, 2023, 15(1): 158
[5] LEVERETT J, TRAN-PHU T, YUWONO J A, et al. Tuning the coordination structure of Cu-N-C single atom catalysts for simultaneous electrochemical reduction of CO2 and ![]() to urea[J].Advanced Energy Materials, 2022, 12(32): 2201500
to urea[J].Advanced Energy Materials, 2022, 12(32): 2201500
[6] XU M, WU F, ZHANG Y, et al. Kinetically matched C-N coupling toward efficient urea electrosynthesis enabled on copper single-atomalloy [J].NatureCommunications,2023,14(1): 6994
[7] ZHAO Y, DING Y, LI W, et al. Efficient urea electrosynthesis from carbon dioxide and nitrate via alternating Cu-W bimetallic C-N coupling sites [J]. Nature Communications, 2023, 14(1): 4491
[8] ZHANG X, ZHU X, BO S, et al. Electrocatalytic urea synthesis with 63.5% faradaic efficiency and 100% N-selectivity via onestep C-N coupling [J]. Angewandte Chemie, 2023, 135(33): e202305447
[9] ZHANG X, ZHU X, BO S, et al. Identifying and tailoring C-N coupling site for efficient urea synthesis over diatomic Fe-Ni catalyst[J]. Nature Communications, 2022, 13(1): 5337
[10] CHEN H, LIN J, CAI Y, et al. Novel multi-walled nanotubessupported and alkali-promoted Ru catalysts for ammonia synthesis under atmospheric pressure[J]. Applied Surface Science, 2001,180(3/4): 328-335
[11] LIANG C, WEI Z, XIN Q, et al. Ammonia synthesis over Ru/C catalysts with different carbon supports promoted by barium and potassium compounds[J]. Applied Catalysis A: General, 2001,208(1/2): 193-201
[12] HINRICHSEN O. Kinetic simulation of ammonia synthesis catalyzed by ruthenium [J]. Catalysis Today, 1999, 53 ( 2):177-188
[13] JACOBSEN C J H, DAHL S, HANSEN P L, et al. Structure sensitivity of supported ruthenium catalysts for ammonia synthesis[J]. Journal of Molecular Catalysis A: Chemical, 2000, 163(1/2): 19-26
[14] WOLDU A R, HUANG Z, ZHAO P, et al. Electrochemical CO2 reduction (CO2 RR) to multi-carbon products over copper-based catalysts [J].CoordinationChemistryReviews,2022,454: 214340
[15] KAS R, HUMMADI K K, KORTLEVER R, et al. Three-dimensional porous hollow fibre copper electrodes for efficient and highrate electrochemical carbon dioxide reduction[J]. Nature Communications, 2016, 7: 10748
[16] LI M, MA D, CHEN P, et al. Residual chlorine induced cationic active species on a porous copper electrocatalyst for highly stable electrochemical CO2 reduction to C2+[J]. Angewandte Chemie International Edition, 2021, 60(20): 11487-11493
[17] ROCHA T C R, HÄVECKER M, KNOP-GERICKE A, et al.Promoters in heterogeneous catalysis: The role of Cl on ethylene epoxidation over Ag [J]. Journal of Catalysis, 2014, 312:12-16
[18] JOLLEY J G, GEESEY G G, HANKINS M R, et al. Auger electron and X-ray photoelectron spectroscopic study of the biocorrosion of copper by alginic acid polysaccharide[J]. Applied Surface Science, 1989, 37(4): 469-480
[19] ROY A, MUKHOPADHYAY A K, DAS S C, et al. Surface stoichiometry and optical properties of Cux-Tiy Cz thin films deposited by magnetron sputtering [J]. Coatings, 2019, 9(9): 551
[20] FOLKESSON B, BJORØY M, PAPPAS J, et al. ESCA studies on the charge distribution in some dinitrogen complexes of rhenium, iridium, ruthenium, and osmium[J]. Acta Chemica Scandinavica, 1973, 27: 287-302
[21] FAN L, LI Q, WANG D, et al. Electrospun Ru-RuO2/MoO3 carbon nanorods with multi-active components: A Pt-like catalyst for the hydrogen evolution reaction[J]. Chemical Communications, 2020, 56(5): 739-742
[22] POLLINI I I. Photoemission study of the electronic structure of CrCl3 and RuCl3 compounds[J]. Physical Review B, 1994, 50(4): 2095-2103
[23] VASQUEZ R P. CuCl2 by XPS[J]. Surface Science Spectra,1993, 2(2): 160-164
[24] WAGNER C D, ZATKO D A, RAYMOND R H. Use of the oxygen KLL Auger lines in identification of surface chemical states by electron spectroscopy for chemical analysis[J]. Analytical Chemistry, 1980, 52(9): 1445-1451
[25] MCINTYRE N S, COOK M G. X-ray photoelectron studies on some oxides and hydroxides of cobalt, nickel, and copper[J].Analytical Chemistry, 1975, 47(13): 2208-2213
[26] SHEN J, ADNOT A, KALIAGUINE S. An ESCA study of the interaction of oxygen with the surface of ruthenium[J]. Applied Surface Science, 1991, 51(1/2): 47-60
Chlorine-doped ruthenium-copper catalyst for electrochem ical urea synthesis