随着石油化学工程的迅速发展,烯烃及其衍生物的需求愈来愈大,高效地生产烯烃及其衍生品成为化工领域研究的热点。 环氧环己烷(Cy-ep)是精细化工中重要的中间体,其结构中的环氧基十分活泼,可与胺、酚、醇、氨和羧酸等多种物质反应,产物广泛应用于医药、农药、航天、表面活性剂等多种领域[1]。 因此研究开发环氧环己烷生产工艺具有重要意义。
环氧环己烷主要由环己烯经环氧化反应制得,目前,生产方法主要有氯醇法、过氧化物法和O2环氧化法3种。 氯醇法是传统制备环氧环己烷的方法,虽然成本低廉,但是生产工艺涉及次氯酸、氢氧化钠等酸碱物质,对设备腐蚀极大,不符合绿色化学的标准[2]。 过氧化物法是利用H2O2、TBHP等过氧化物环氧化环己烯的方法,由于过氧化物法具有较高的环氧选择性(通常大于90%)[3,4],因此是近年来国内外学者研究的热点。 然而,过氧化物原料昂贵,不便运输和储存,因此过氧化物法利润率较低。 而O2来源广泛、成本低廉,因此是环氧化环己烯的潜在的理想氧化剂。
然而,目前O2直接环氧化环己烯的选择性很低,高选择性地利用O2环氧化环己烯一直是一个挑战[5,6]。 这主要是因为环己烯的烯丙基C—H键的解离能为350.7 kJ·mol-1,远低于乙烯基C—H键的解离能(457.3 kJ·mol-1)[7]。 因此,在与O2反应过程中,环己烯烯丙基位往往率先发生氧化反应生成环己烯烯丙基氧化产物,如2-环己烯-1-醇(Cyol)、2-环己烯-1-酮(Cy-one)以及2-环己烯-1-过氧化氢(Cy-OOH)等。 目前,研究报道O2直接氧化环己烯的环氧选择性不足20.0%[8]。 虽然加入溶剂(如乙基苯)或引发剂(如异丁醛、苯甲醛等)作为氧转移中间体可以提高O2氧化环己烯反应的环氧选择性[9,10]。 然而反应中会产生苯乙醇、苯乙酮或异丁酸等低价值的副产物,同时,这些副产物的分离与后处理也不可避免地增加了生产操作成本。 鉴于绿色化学的要求,开发在无溶剂和无引发剂条件下利用O2来环氧化环己烯的生产工艺意义重大。
O2直接氧化环己烯反应机理如方案1所示[8],环己烯首先与O2反应生成Cy-OOH,之后Cy-OOH再与环己烯反应生成等量Cy-ep与Cy-ol,因此理论环氧选择性为50.0%。 另一方面,Cy-OOH也可自分解为Cy-ol与Cy-one。 因此提高环氧选择性的关键在于抑制Cy-OOH的分解,促进Cy-OOH与环己烯的环氧化反应。
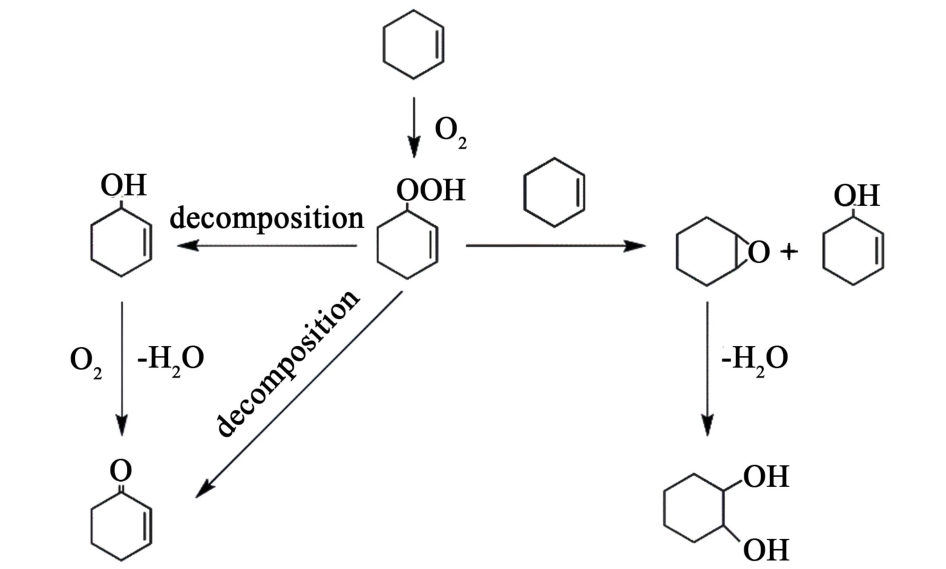
方案1 O2直接氧化环己烯的反应机理
Scheme.1 Reaction mechanism for the direct oxidation of cyclohexene by O2
MgO可以有效活化烷烃C—H键,其表面碱性位点(即带负电的晶格氧)可以吸附烷烃C—H键H,削弱C—H键,从而催化脱H形成相应的烷基自由基(R·)[11,12]。 然后,R·迅速捕获O2并转化为烷基过氧自由基(ROO·),后者可进一步转化为烷基过氧化物(ROOH)[13]。 另一方面,Mo(Ⅵ)基催化剂被证明在烷基过氧化物环氧化烯烃的反应中表现出高活性和环氧选择性,Mo(VI)空闲的d轨道能够接受电子对[14],从而与烷基过氧化物形成Mo-(η2—O2)中间物种,之后,该中间物种与烯烃的C C键发生氧转移反应,形成相应的环氧化物[15-18]。 例如,Doke等使用碳微球负载的MoO3催化TBHP与环己烯反应,可获得80%转化率与99%的环氧选择性[19]。
C键发生氧转移反应,形成相应的环氧化物[15-18]。 例如,Doke等使用碳微球负载的MoO3催化TBHP与环己烯反应,可获得80%转化率与99%的环氧选择性[19]。
基于上述研究,我们提出了MgO-MoO3接力催化策略,在无溶剂、无引发剂条件下,利用O2直接环氧化环己烯。 该体系表现出良好的催化性能,100 ℃、1 MPa O2压力下反应6 h可以实现26.7%的环己烯转化率以及43.7%的环氧选择性,接近50.0%的理论选择性值。 同时,我们通过淬灭实验、苯甲酸掩蔽实验以及过氧化物实验等对氧化过程机理进行探究,并提出了可能的催化机理。
1 实验部分
1.1 实验试剂与仪器
实验试剂见表1,均为分析纯。 实验仪器见表2。
表1 实验试剂
Table 1 Chemical reagents

名称 生产厂家环己烯(C6H10) 上海阿拉丁有限公司环氧环己烷(C6H10O) 上海阿拉丁有限公司钼酸铵[(NH4)6Mo7O24·4H2O] 上海阿拉丁有限公司乙醇(CH3CH2OH) 上海阿拉丁有限公司硝酸镁[Mg(NO3)2·6H2O] 上海阿拉丁有限公司尿素[CO(NH2)2] 上海阿拉丁有限公司2-环己烯-1-醇(C6H9OH) 上海阿拉丁有限公司2-环己烯-1-酮(C6H8O) 上海阿拉丁有限公司三苯基膦(C18H15P) 上海阿拉丁有限公司1, 2-环己二醇[C6H10(OH)2] 上海阿拉丁有限公司三氯甲烷(CHCl3) 上海阿拉丁有限公司对苯醌(C6H4O2) 上海阿拉丁有限公司乙腈(CH3CN) 上海阿拉丁有限公司叔丁基醇(C4H10O) 上海阿拉丁有限公司过氧化叔丁醇(C4HO2) 上海阿拉丁有限公司对苯二酚(C6H6O2) 上海阿拉丁有限公司邻叔丁基苯酚(C10H14O) 上海阿拉丁有限公司溴代氯仿(CBrCl3) 上海阿拉丁有限公司2, 4-己二烯(C6H10) 上海阿拉丁有限公司二丁基羟基甲苯(C15H24O) 上海阿拉丁有限公司苯甲酸(C7H6O2) 上海阿拉丁有限公司盐酸(HCl) 上海阿拉丁有限公司去离子水 天津市永清源蒸馏水
表2 实验仪器
Table 2 Experimental equipment
名称 型号 生产厂家气相色谱 Agilent 8860GC 美国安捷伦有限公司电子天平 BP121S 上海市精密科学仪器有限公司水热反应釜 50/100 mL 天津市腾崟商贸有限公司恒温水浴振荡器 THZ-82 天津市欧诺仪器仪表有限公司超声波清洗器 KQ5200DB 昆山市超声仪器有限公司磁力搅拌器 EMS-13 天津市欧诺仪器仪表有限公司马弗炉 SX2-4-10 天津市中环实验电炉有限公司鼓风干燥箱 DHG-9035A 上海一恒科学仪器有限公司高压反应釜 HT-25KC 上海霍桐实验仪器有限公司
1.2 催化剂制备
据之前文献所述方法[20,21],并作出一些改变,合成了球型MgO和带状MoO3。
球型 MgO: 在剧烈搅拌下, 将 1.280 g Mg(NO3)2·6H2O和3.000 g尿素加入到30 mL乙醇中,形成均匀的溶液。 然后,将溶液转移到50 mL水热反应釜中,密封并在200 ℃下保持24 h。 离心收集沉淀物,用乙醇和去离子水洗涤数次。 80 ℃真空干燥12 h,将沉淀物在马弗炉中550 ℃持续煅烧5 h,升温速率为5 ℃·min-1,制得球型MgO。
带状MoO3:将0.4 g (NH4)6Mo7O24·4H2O溶于24 mL去离子水中,然后加入2.4 mL HCl。 将所得溶液转移到100 mL水热反应釜中,在160 ℃下保持15 h。 离心收集沉淀物,并用乙醇和去离子水洗涤数次,80 ℃真空干燥12 h。 制得带状MoO3。
将所制备的MgO与MoO3以质量比1 ∶2、1 ∶1、2 ∶1混合后加入到乙醇中(20 g·L-1),超声30 min后。 离心收集沉淀物,80 ℃真空干燥12 h得到MgO、MoO3均匀混合物。 分别记为Mg-0.5、Mg-1.0、Mg-2.0。
1.3 氧气氧化环己烯实验
氧化反应在50 mL的高压釜反应器中进行。 具体步骤如下,在反应器中加入5 mL环己烯和50 mg催化剂,密封后向反应器充入O2到所需的O2压力,然后加热到所需的反应温度。 并在低于氧化反应设定温度5 ℃时开启搅拌,搅拌速度设定为500 r·min-1。 反应结束后,将反应混合物用0.22 μm的膜过滤,所得反应液分为2份,每份各1 mL,之后溶于5 mL乙腈中。 1个样品使用气相直接分析,另1个样品用适量的三苯基磷(PPh3)处理,使得可能生成的Cy-OOH分解为Cy-ol,之后使用气相分析,通过2个样品中Cy-ol的含量计算出Cy-OOH的含量。每份样品测定3次,取平均值。
1.4 淬灭实验
淬灭实验在50 mL的高压釜反应器中进行。 具体操作步骤以及产物定量方式与上述O2氧化环己烯实验相同,但在反应前向5 mL环己烯中分别加入20 mmol叔 丁 基 醇(TBA)、20 mmol苯 醌(BQ)、20 mmol 2,4-己二烯(2, 4-HD)、20 mmol对苯二酚(HQ)、10 mmol二丁基羟基甲苯(BHT)、10 mmol氯仿(CF)以淬灭反应过程中的相应自由基。
溴代氯仿(CBrCl3)淬灭实验用于验证环己烯脱H位点,实验也是在50 mL的高压釜反应器中进行。具体步骤如下,在反应器中加入4 mL环己烯、1 mL CBrCl3和50 mg催化剂,向反应器充N2至1.0 MPa压力,然后加热到所需的反应温度。 并在低于氧化反应设定温度5 ℃时开启搅拌,搅拌速度设定为500 r·min-1。 反应结束后,将反应混合物用0.22 μm的膜过滤,使用气相色谱进行的分析。
1.5 苯甲酸掩蔽碱性位点实验
反应中加入苯甲酸掩蔽催化剂碱性位点以探究对催化活性的影响,该实验在50 mL的高压釜反应器中进行。 具体操作步骤以及产物定量方式与上述O2氧化环己烯实验步骤相同,但在反应前向5 mL环己烯中加不同剂量的苯甲酸。
1.6 环己烯及其氧化产物定量分析
配备有HP-5 ms毛细柱(30 m × 0.32 mm ×0.25 μm)和氢离子火焰检测器(FID)的气相色谱仪(Agilent 8860 GC)定量分析环己烯、2-环己烯-1-醇、2-环己烯-1-酮和环氧环己烷等氧化产物。 色谱条件:初始温度为60 ℃,以10 ℃·min-1升温至110 ℃,保持2 min,之后25 ℃·min-1升温至250 ℃,分流比为30 ∶1,进样口温度为250 ℃,检测器温度为280 ℃,流速为1 mL·min-1。
环己烯转化率X和产物选择性S通过式(1)~(4)计算:
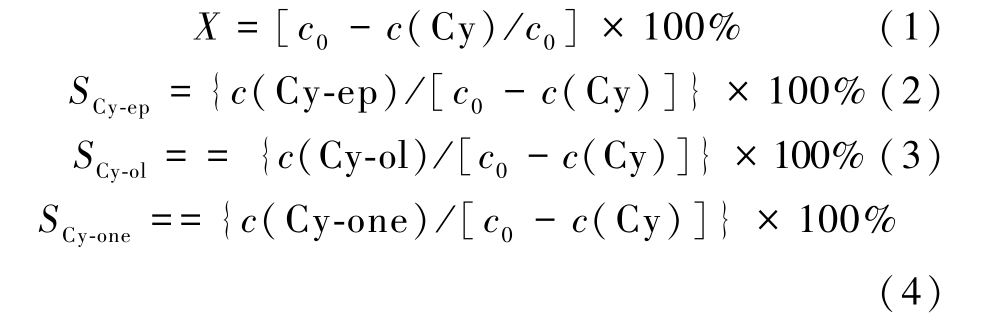
式(1)~式(3)中:c0表示1 mL环己烯溶于5 mL乙腈的浓度,c(Cy)、c(Cy-ep)、c(Cy-ol)和c(Cy-one)分别代表反应结束后1 mL样品溶于5 mL乙腈的环己烯、环氧环己烷、2-环己烯-1-醇和2-环己烯-1-酮的浓度。
1.7 催化剂表征
1.7.1 X射线衍射分析(XRD)
合成的催化剂的晶形结构采用X射线衍射仪分析,产自德国布鲁克AXS公司,型号为D8-Foucus,Cu_Kα 为射线源,扫描速率为10 (°)·min-1,扫描范围为10°~80°。
1.7.2 场发射扫描电子显微镜(SEM)
用牙签把少量催化剂粉末在导电胶上涂抹薄薄一层,然后用洗耳球吹去多余的催化剂粉末,对样品进行喷金处理,送样表征。 仪器产自日本日立公司,型号为S-4800。
1.7.3 Raman光谱测试(Raman spectra)
对合成的催化剂进行Raman测试,激发波长为532 nm。 仪器产自英国Renishaw公司,型号为Renishaw inVia Reflex。
1.7.4 傅里叶变换红外光谱(FT-IR)
对合成的催化剂进行FT-IR测试。 仪器产自日本Shimadzu公司,型号为FTIR-8400S。
1.7.5 X射线光电子能谱分析(XPS)
对合成的催化剂表面的Mo、Mg进行表征,采用单色Al_Kα 辐射(1 486.6 eV),基压为1.33×10-6 Pa。 并根据C 1s标准峰(284.4 eV)进行校准,数据用XPSpeak 4.1软件进行拟合。 仪器产自美国PE公司,型号为Pe PHI-1600 ESCA。
1.7.6 比表面积测试(BET)
用N2吸附法测试催化剂样品的比表面积和孔结构。 仪器产自美国micromeritics公司,型号为ASAP 2020。
2 实验结果和讨论
2.1 催化剂表征
图1 是合成的MgO、MoO3的XRD图谱以及相应的JCPDS标准卡片图谱,扫描角度2θ 在10° ~80°,扫描速率为10 (°)·min-1。 如图1所示,MgO在2θ= 36.9°、42.9°、62.3°和78.6°分别出现衍射峰,与MgO (JCPDS Card No. 45-0946)的衍射峰位置一致,分别对应于MgO的(111)、(200)、(220)和(222) 晶 面。 而 MoO3在 12.8°、 23.3°、 25.7°、27.3°、33.7°、39.0°、46.3°和58.8°处分别出现衍射峰,与α-MoO3 (JCPDS Card No. 05-0508)的衍射峰位置一致,分别对应于α-MoO3的(020)、(110)、(040)、(021)、(111)、(060)、(210)和(081)晶面。
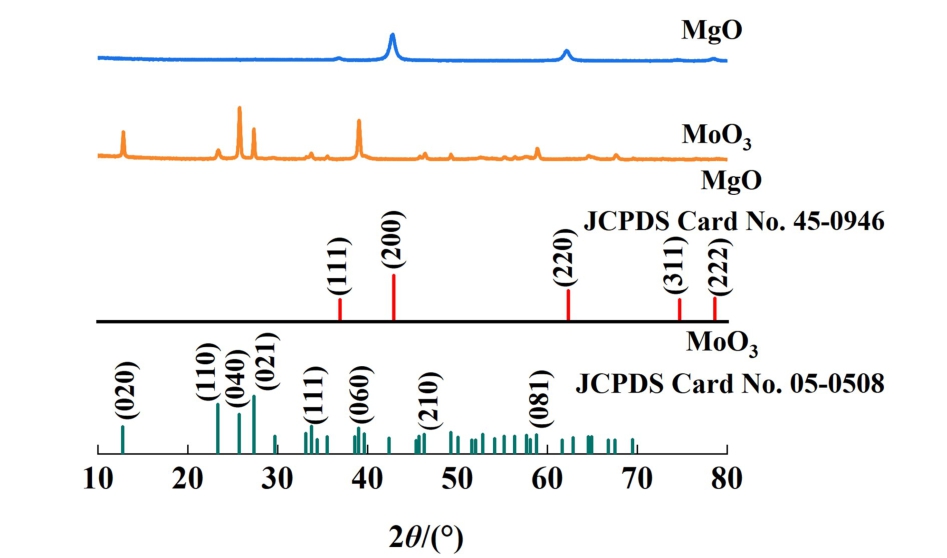
图1 MgO和MoO3的XRD图谱
Fig.1 XRD patterns of MgO and MoO3
样品的SEM表征如图2所示。 图2(a)表明MgO为纳米颗粒团聚成的球型结构。 图2(b)表明MoO3具有一维纳米带状结构,该结构赋予其更大的比表面积,以暴露更多催化位点,提高催化活性。图2(c)~图2(e)表明物理混合后,MgO与MoO3的整体形貌无显著变化,但部分MgO颗粒附着在MoO3表面,便于接力催化反应进行。 对Mg-1.0进行了元素分布分析,如图2(f) ~图2(h)所示,Mg、Mo以及O分布较均匀,表明MgO与MoO3已均匀混合。

图2 (a) MgO、(b) MoO3、(c) Mg-0.5、(d) Mg-1.0、(e) Mg-2的SEM图;(f)~(h) Mg-1.0的元素分布能谱
Fig.2 SEM images of (a) MgO, (b) MoO3, (c) Mg-0.5, (d) Mg-1.0, (e) Mg-2; (f)-(h) Elemental mapping of Mg-1.0
图3 为催化剂的N2吸附-脱附曲线与孔径分布图。
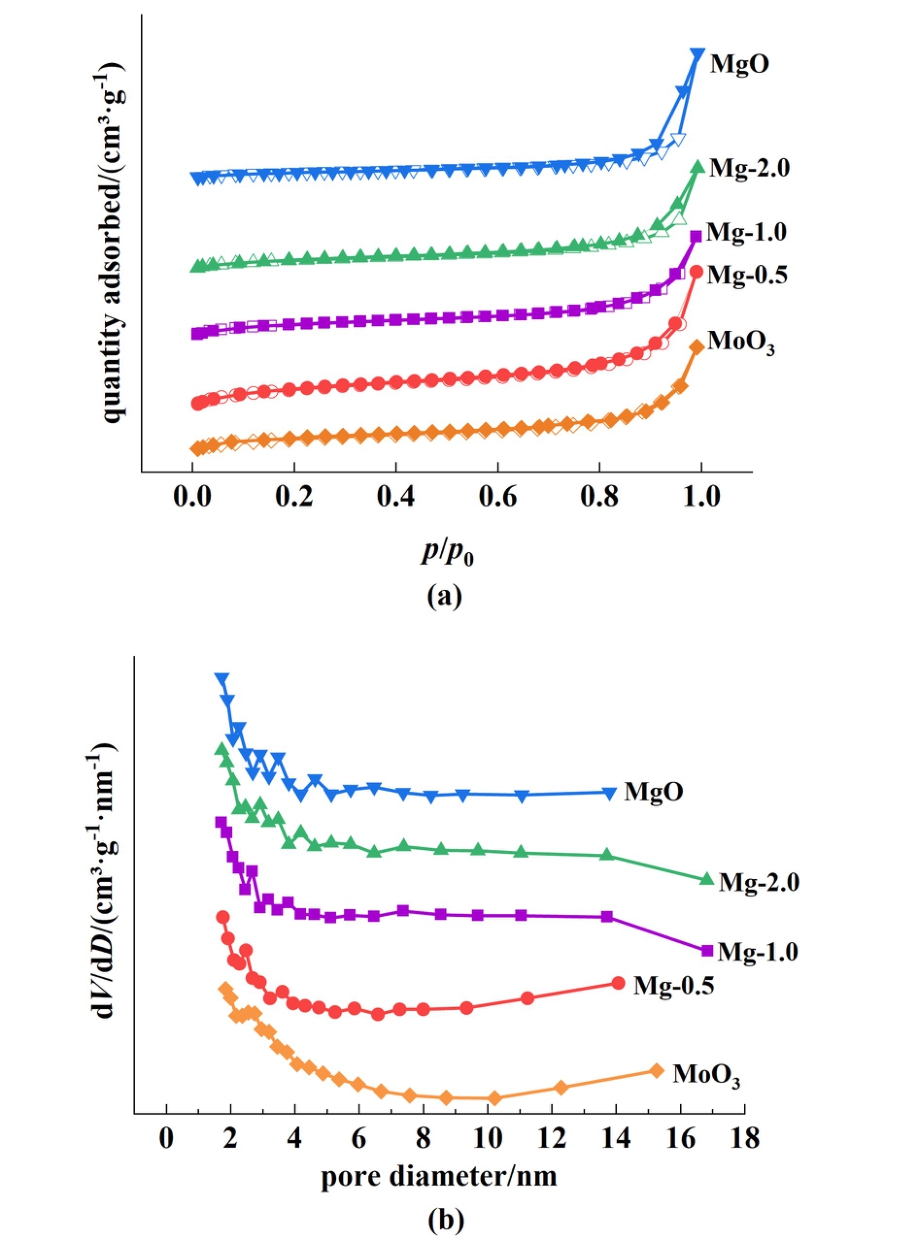
图3 (a) N2吸附-脱附曲线;(b)孔径分布图
Fig.3 (a) N2 adsorption-desorption curve;(b) pore size distribution
如图3(a)所示,所有的催化剂吸附等温线均呈现IV型吸附等温线[22],在高压区吸附-脱附等温线呈现出H3型回滞环,表明催化剂存在平板狭缝结构[23]。 另外,从孔径分布图[图3(b)]可以看出催化剂中存在孔径为2 ~ 5 nm的介孔结构。 还有,MoO3比表面积为16.8 m2·g-1,随着MgO混合比例增大,比表面积逐渐增大至20.1、25.5和31.7 m2·g-1(Mg-0.5、Mg-1.0和Mg-2.0)。 介孔结构与增大比表面积使得催化剂更好与底物结合,有利于提高催化效率。
图4 是MgO和MoO3的FT-IR与Raman图谱。
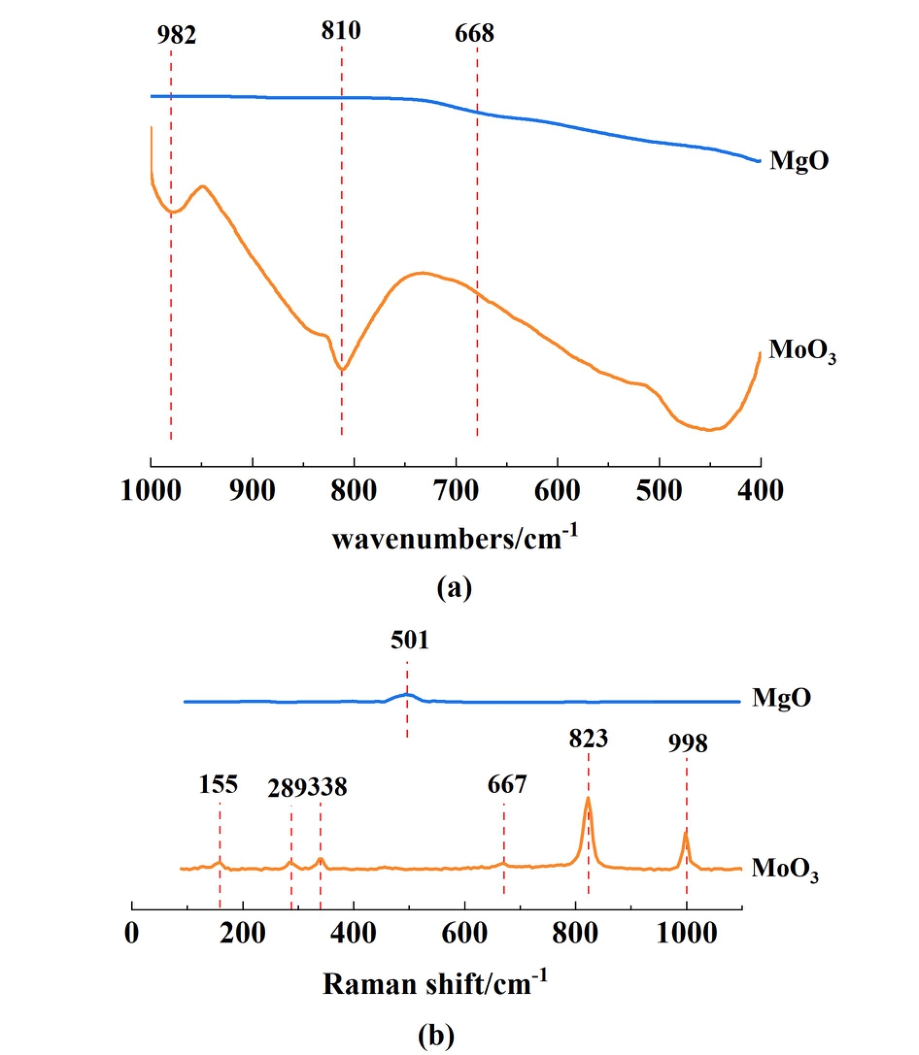
图4 (a) MgO和MoO3的FT-IR图谱;(b) MgO和MoO3的Raman图谱
Fig.4 (a) FT-IR patterns of MgO and MoO3;(b) Raman patterns of MgO和MoO3
如图4(a)所示,MgO的FT-IR图谱中668 cm-1处的峰代表Mg—O键振动[24]。 MoO3的FT-IR图谱在982和810cm-1处出现对应Mo O双键伸缩与Mo—O单键振动特征峰[25,26]。 MgO与MoO3的Raman图谱如图4(b)所示,MgO的Raman图谱中501 cm-1处的峰代表Mg—O键振动[24]。 155、289、338、667、823和998 cm-1处峰 代表MoO3的特征峰[27]。 其中667 cm-1代表Mo—O的弯曲振动[28]。
O双键伸缩与Mo—O单键振动特征峰[25,26]。 MgO与MoO3的Raman图谱如图4(b)所示,MgO的Raman图谱中501 cm-1处的峰代表Mg—O键振动[24]。 155、289、338、667、823和998 cm-1处峰 代表MoO3的特征峰[27]。 其中667 cm-1代表Mo—O的弯曲振动[28]。
如图5(a) 所 示, MgO的Mg 1s谱图只在1 303.8 eV处出现1个峰,该峰代表Mg(Ⅱ)[29]。如图5(b)所示,MoO3的Mo 3 d图谱在232.7和235.8 eV处出现了2个明显的峰,分别对应于Mo(VI)的Mo 3d5/2和Mo 3d3/2[30],表明MoO3中Mo主要存在形式是Mo(VI)。 Mo(VI)空闲的d轨道能够接受电子对,因此可以激活过氧化物O—O键,从而与烯烃的C C键发生氧转移反应,形成相应的环氧化物[14-18]。 另外,稳定的价态使得MgO和MoO3难以经由Haber-Weiss循环过程降解 Cy-OOH,从而提高环氧选择性[31]。
C键发生氧转移反应,形成相应的环氧化物[14-18]。 另外,稳定的价态使得MgO和MoO3难以经由Haber-Weiss循环过程降解 Cy-OOH,从而提高环氧选择性[31]。
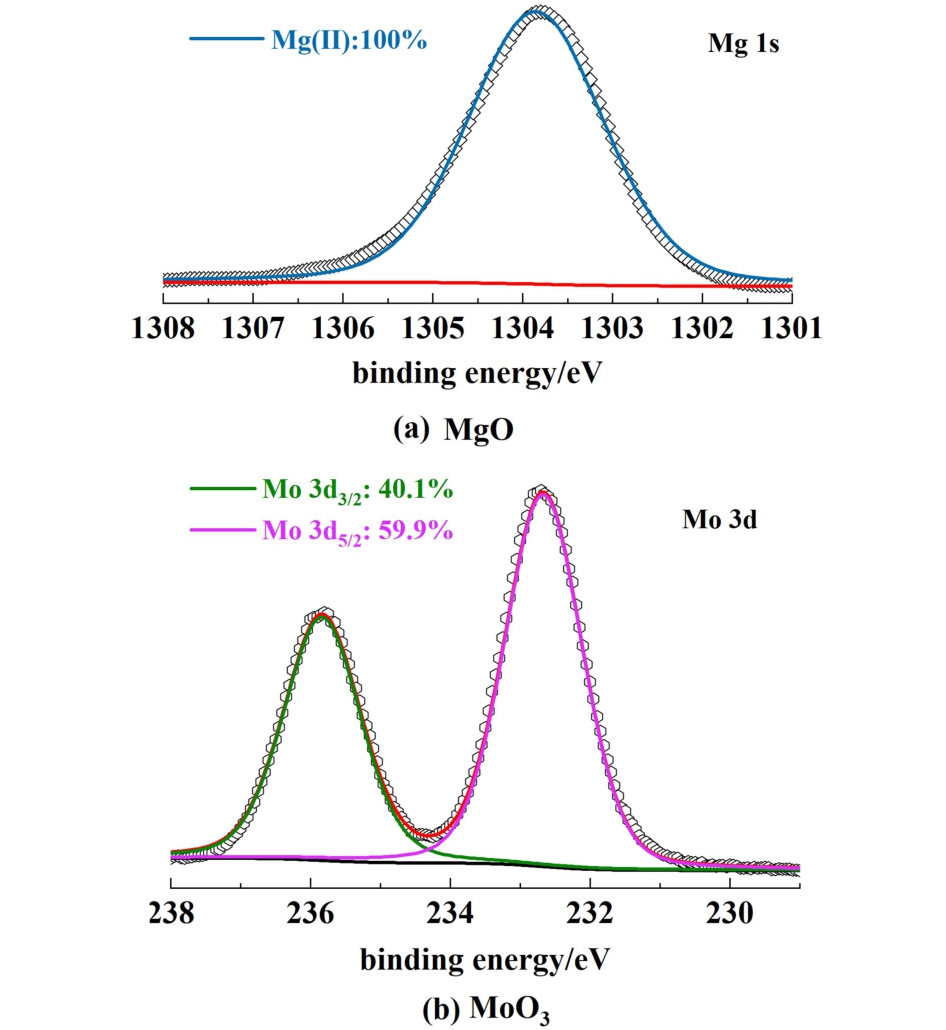
图5 MgO和MoO3的XPS图谱
Fig.5 XPS patterns of MgO and MoO3
利用CHCl3作为探针来表征催化剂的碱度,CHCl3吸附在催化剂碱性位点时,在氢键作用下,CHCl3的C—H键被拉伸,在FT-IR图谱中表现为特征峰向更低的频率移动[32,33]。
在25 ℃下,将CHCl3滴加到MgO和MoO3表面,之后进行FT-IR表征,另外,对CHCl3也进行了FT-IR表征。 结果如图6所示,CHCl3的FT-IR图谱在3 020 cm-1处峰代表C—H键特征峰,在CHCl3-MgO体系中, 该峰从 3 020 cm-1显著偏移到2988 cm-1,表明MgO表面存在碱性位点,同时也说明碱性位点对C—H具有吸附作用。 在CHCl3-MoO3体系中,该位置的特征峰没有发生偏移。
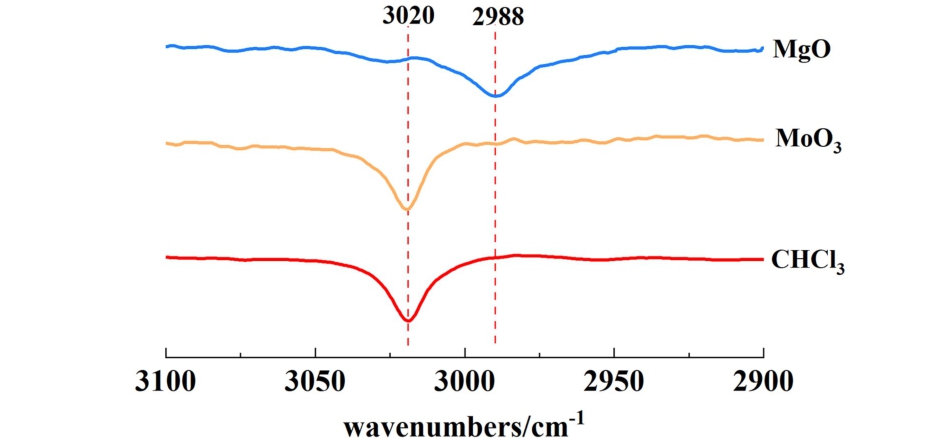
图6 25 ℃下MgO、MoO3吸附CHCl3的FT-IR图谱
Fig.6 FT-IR spectra with adsorbed CHCl3 at 25 ℃ for MgO and MoO3
2.2 催化性能测试
在高压釜反应器中评估了各种催化剂对O2环氧化环己烯反应的催化活性。 反应结果如图7所示,在没有催化剂的情况下,环己烯转化率为62.1%,但是环氧选择性只有5.8%,另外烯丙基氧化产物(Cy-ol和Cy-one)也只有37.0%。 这主要是由于环己烯热自氧化过程中发生了自由基聚合[15]。当以MoO3为催化剂时,环己烯转化率为11.1%,而环氧选择性高达49.6%,这表明MoO3在O2氧化环己烯的过程中具有低反应性和高环氧化物选择性的催化性能。 相反,在只存在MgO的反应中,环己烯的转化率高达79.7%,然而环氧选择性却不足1.0%,表明MgO在O2氧化环己烯的过程中具有高反应性和低环氧化物选择性的催化性能。 值得注意的是,MoO3和MgO催化环己烯反应活性与催化剂表面碱度相关(图6),表明催化剂表面碱性位点在催化O2氧化环己烯过程中起关键作用。 而当MoO3与MgO物理混合后加入反应时,随着m(MgO) ∶m(MoO3)从1 ∶2增大到2 ∶1,环己烯的转化率从18.5%上升到42.6%,而环氧选择性则从47.1%显著下降到30.4%。 表明提高MgO比例虽然有利于提高环己烯的转化率,但却会降低环氧选择性。 当m(MgO) ∶m(MoO3)为1 ∶1时,环己烯的转化率为26.7%,环氧选择性为43.7%。 综合转化率与选择性,m(MgO) ∶m(MoO3)为1 ∶1是最适宜质量配比。
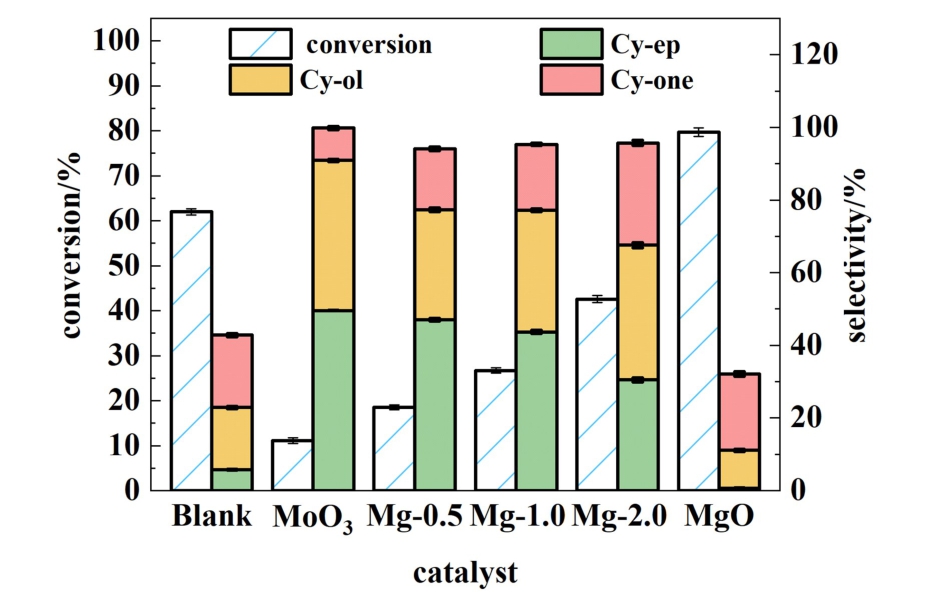
图7 各种催化剂催化氧化环己烯
Fig.7 Oxidation of cyclohexene by various catalysts
为了研究温度对环己烯氧化反应的影响,在60~140 ℃温度区间内以20 ℃梯度进行实验。 结果如图8(a)所示,随着反应温度从60升高到100 ℃,环己烯的转化率从5.2%提高到26.7%,环氧环己烷的选择性从45.7%略微下降到43.7%,这表明适当高温有利于提高反应活性。 而当反应温度从100 ℃进一步升高到140 ℃时,环氧环己烷的选择性从43.7%显著下降到9.1%,这可能是因为高温作用下,环氧环己烷发生了聚合或水解反应[15]。
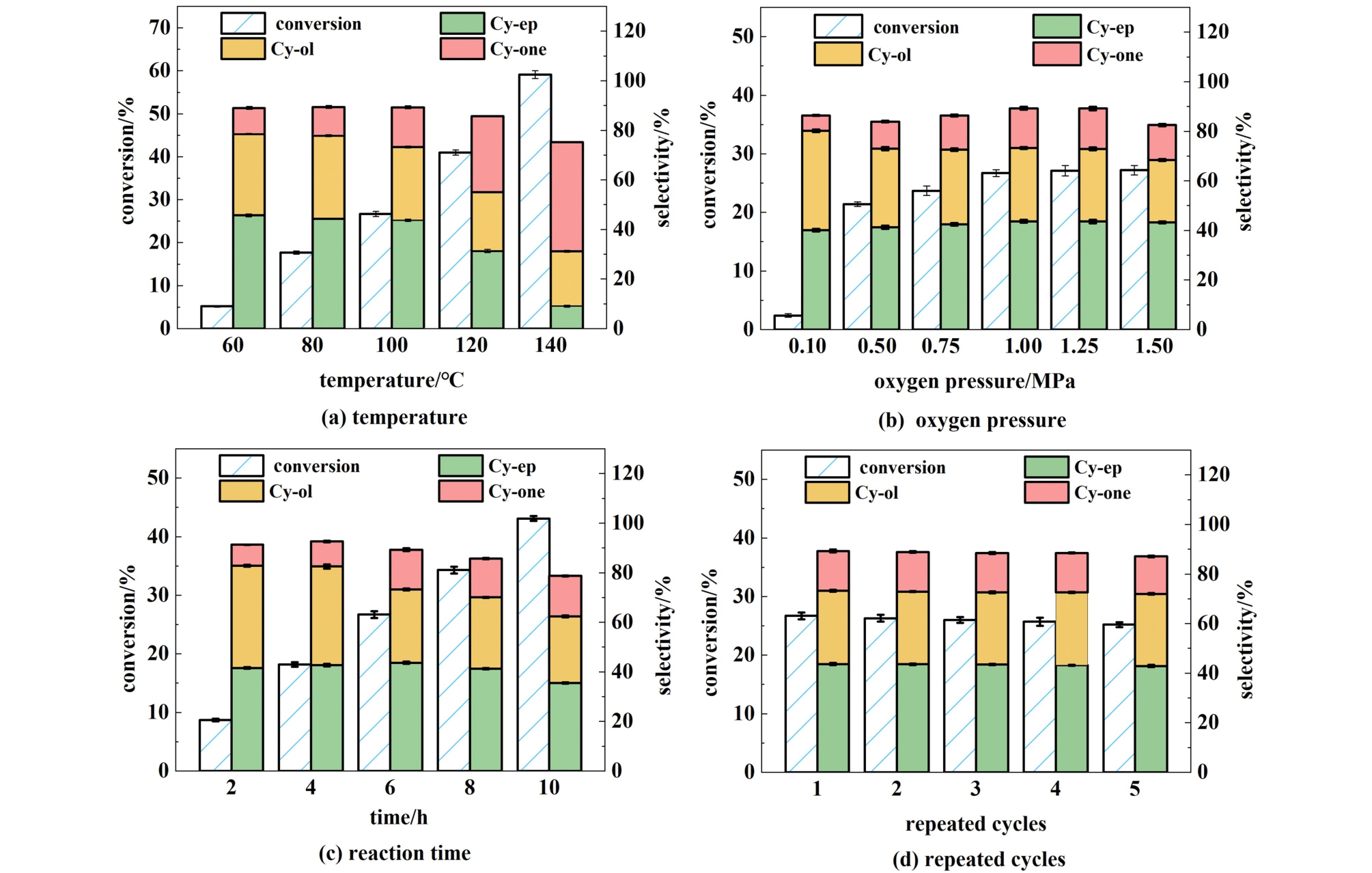
图8 不同因素对环己烯氧化反应的影响
Fig.8 The effects of different factors on the oxidation of cyclohexene
O2压力是影响O2环氧化环己烯反应的另一个重要因素,如图8(b)所示,在常压(0.1 MPa)条件下,环己烯的转化率仅为2.4%,环氧选择性为40.1%,而在0.5 MPa下,环己烯的转化率提高到21.4%,环氧选择性略微提高至41.3%,O2压力增加提高了O2的溶解度,使更多的O2分子可用于反应因此提高了反应的活性[34]。 当O2压力由0.5 MPa增加到1.0 MPa时,环己烯的转化率由21.4%增加 到 26.7%。 环氧选择性从 41.3% 提高到43.7%。 进一步提高O2压力到1.25 MPa时,环己烯转化率略微提高到 27.1%, 环氧选择性为43.6%。 另外,提高O2压力到1.5 MPa,环己烯的转化率与环氧选择性没有明显变化。 表明O2压力大于1.0 MPa时,增加O2压力对环己烯的转化无明显促进作用,因此O2压力为1.0 MPa是反应合适的O2压力。
图8(c)显示了反应时间对O2环氧化环己烯的影响,随着反应时间从2 h延长到6 h,环己烯的转化率从8.7%增加到26.7%,环氧环己烷的选择性从41.6%增加到43.7%,但反应时间进一步延长到10 h,选择性则下降到35.5%,这可能是由于环氧化物聚合生成了未检测的产物[35]。 另外,当反应时间为8 h,环己烯转化率为34.3%,环氧选择性为41.3%,环氧环己烷收率为14.2%,大于反应为6 h的环氧环己烷收率(11.7%),因此单纯从环氧选择性方面考虑,6 h是O2环氧化环己烯的适宜反应时间。 然而综合环氧选择性与环氧收率,8 h为O2环氧化环己烯的适宜反应时间。
为了探究催化剂的循环稳定性,对催化剂进行了循环催化测试。 在每次催化环己烯氧化反应后,在4 300 r·min-1下离心反应后的混合物以回收使用过的催化剂,并用乙醇洗涤3次,然后在下一个反应之前,将催化剂在80 ℃的真空下干燥12 h。 从图8(d)可以看出,连续5次氧化实验后,环己烯的转化率从26.7%略微下降到25.2%,环氧环己烷的选择性无明显下降,表明催化剂具有良好的循环稳定性,可多次重复利用。
2.3 淬灭实验
为了研究O2氧化环己烯过程中涉及的氧化活性物种,进行了淬灭实验。 实验结果如图9(a)所示。 氯仿(CF)是超氧阴离子![]() 的淬灭剂[36],然而反应中加入 CF, C6氧化产物(Cy-ep、 Cy-ol和Cy-one)的产率从23.9%略微下降到22.9%,这表明在O2氧化环己烯过程中
的淬灭剂[36],然而反应中加入 CF, C6氧化产物(Cy-ep、 Cy-ol和Cy-one)的产率从23.9%略微下降到22.9%,这表明在O2氧化环己烯过程中![]() 并非主要的活性物种。相反,当在反应中加入碳自由基(R·)淬灭剂HQ和BHT后[37,38],几乎没有C6氧化产物生成,这表明在O2氧化环己烯过程中,R·是十分重要的中间物种。也表明了环己烯脱H形成相应的自由基是反应的关键步骤。 同时,BQ既可以清除
并非主要的活性物种。相反,当在反应中加入碳自由基(R·)淬灭剂HQ和BHT后[37,38],几乎没有C6氧化产物生成,这表明在O2氧化环己烯过程中,R·是十分重要的中间物种。也表明了环己烯脱H形成相应的自由基是反应的关键步骤。 同时,BQ既可以清除![]() ,也是ROO·的有效淬灭剂[36,39],当BQ存在时,也没有C6氧化产物生成,结合CF淬灭结果,可以推断ROO·也是环己烯氧化过程中的的关键物种。此外,TBA是常用的·OH清除剂,但对ROO·没有淬灭作用,而2,4-HD可以同时清除ROO·和·OH,因此TBA与2,4-HD联用可以辨别·OH和ROO·在氧化过程中的贡献[40]。 在TBA存在时,C6氧化产物的产率从23.9%轻微下降到23.4%,这表明·OH在环己烯氧化过程中的贡献很小。相比之下,在2,4-HD存在时,C6氧化产物产率从23.9%显著降低到2.8%,再次证实了ROO·在O2氧化环己烯过程中的关键作用。
,也是ROO·的有效淬灭剂[36,39],当BQ存在时,也没有C6氧化产物生成,结合CF淬灭结果,可以推断ROO·也是环己烯氧化过程中的的关键物种。此外,TBA是常用的·OH清除剂,但对ROO·没有淬灭作用,而2,4-HD可以同时清除ROO·和·OH,因此TBA与2,4-HD联用可以辨别·OH和ROO·在氧化过程中的贡献[40]。 在TBA存在时,C6氧化产物的产率从23.9%轻微下降到23.4%,这表明·OH在环己烯氧化过程中的贡献很小。相比之下,在2,4-HD存在时,C6氧化产物产率从23.9%显著降低到2.8%,再次证实了ROO·在O2氧化环己烯过程中的关键作用。
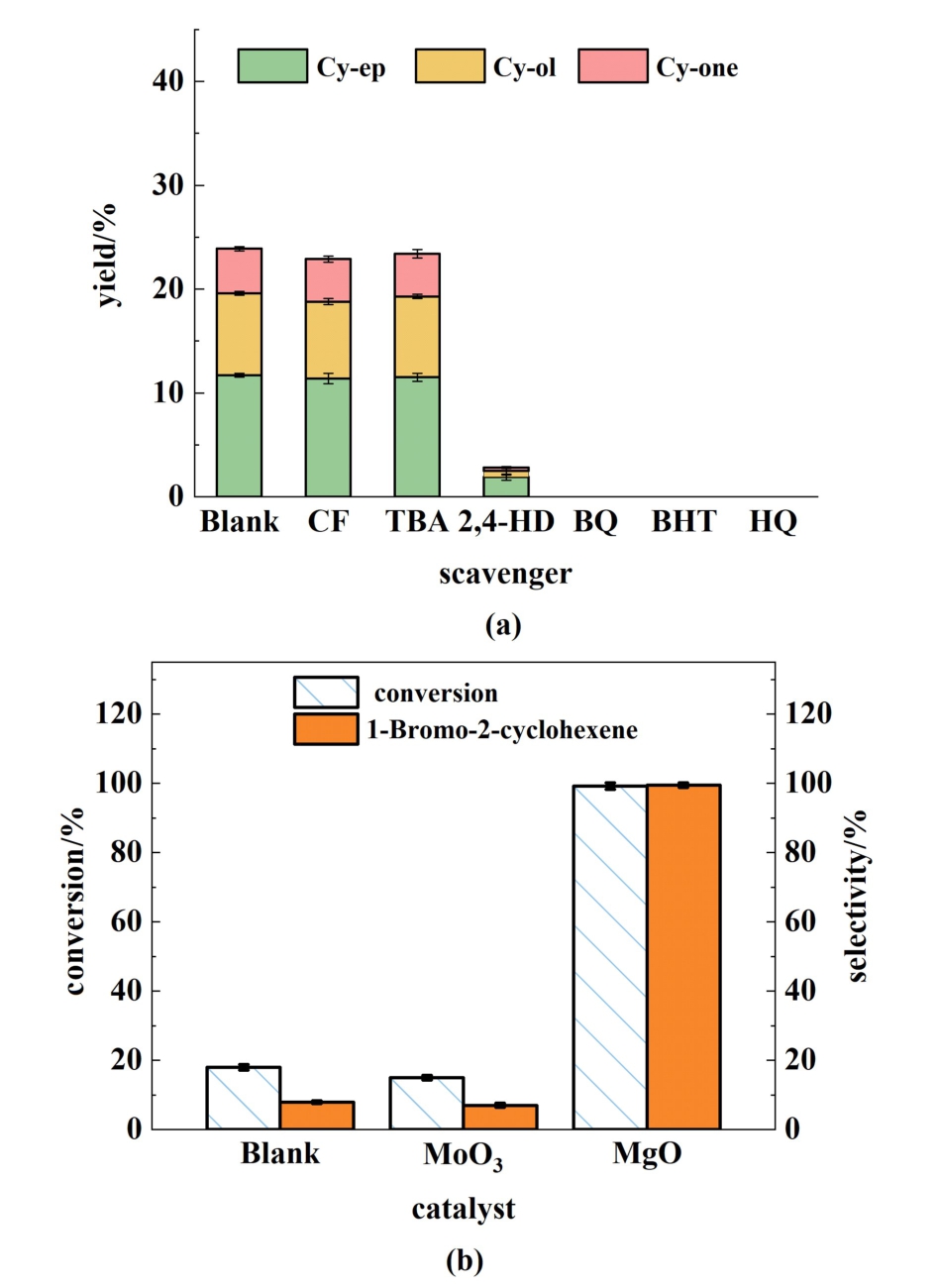
图9 (a)不同淬灭剂对环己烯氧化的淬灭实验,Blank是不加任何淬灭剂的实验;(b)加入CBrCl3实验,Blank是不加CBrCl3的实验
Fig.9 (a) Quenching experiments using various scavengers in the oxidation of cyclohexene. Blank is the experiment in the absence of any scavenger; (b) Addition of CBrCl3.Blank is the experiment in the absence of CBrCl3
为了进一步探究反应中环己烯脱H机制,在N2氛围下进行了环己烯与CBrCl3的一系列反应。CBrCl3的C—Br键很容易被R·攻击断裂并生成相应的溴取代化合物,因此可通过分析产物来推断环己烯脱H位置以及形成的碳自由基类型[41]。 如图9(b)所示,在MgO存在下,环己烯以99.5%的高选择性转化为1-溴-2-环己烯。 表明了Cy·是MgO催化环己烯脱氢的主要R·物种。相比之下,MoO3对1-溴-2-环己烯的选择性只有7.0%,这表明MoO3对催化环己烯烯丙基脱H的作用很小。 同时,以上反应都是在无氧条件下进行的,表明O2对环己烯的烯丙基C—H脱H无显著贡献,这与淬灭实验结果一致[图9(a)]。 同时也表明环己烯氧化始于环己烯的活化而非O2的活化。
2.4 苯甲酸掩蔽实验
苯甲酸能够有效掩蔽催化剂上的碱性位点[42],在Mg-1.0催化O2氧化环己烯反应中加入苯甲酸,如图10所示,随着苯甲酸加入剂量的增加,C6氧化产物的收率从23.9%逐渐下降到1.7%,证明了碱性位点在环己烯烯丙基脱H过程中发挥了关键作用。
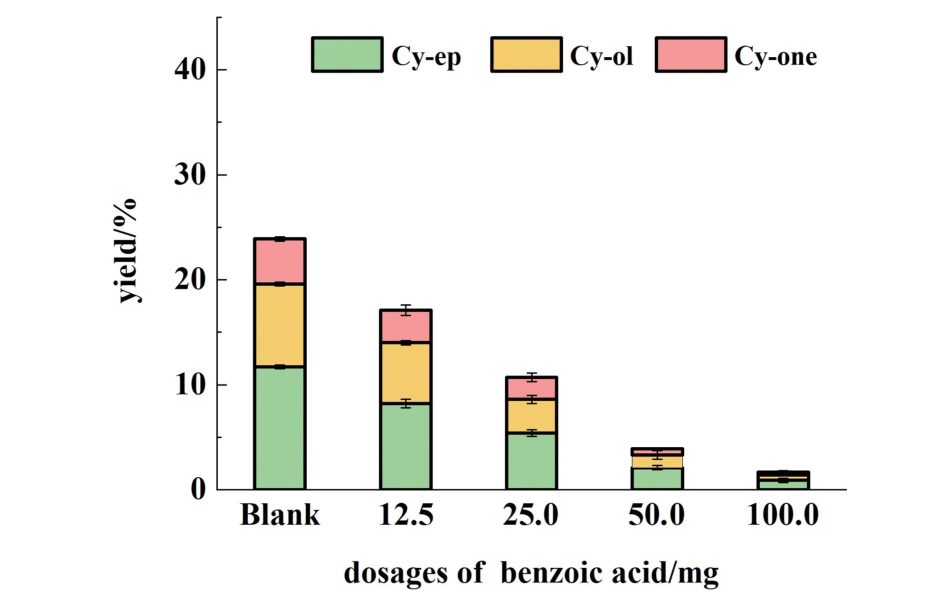
图10 加入苯甲酸对环己烯氧化的影响,Blank是不加苯甲酸的实验
Fig.10 Effect of addition of benzoic acid on the oxidation of cyclohexene. Blank is the experiment in the absence of benzoic acid
2.5 过氧化物实验
为探究Cy-OOH在反应过程中的作用,利用pph3法测定反应2 h后的样品。 结果如图11所示,在MgO组中检测到了Cy-OOH,而MoO3组分中未检测到Cy-OOH。 表明Cy-OOH是Cy烯丙基脱H后生成的重要中间产物。 可以推断如下反应过程:催化剂MgO位点吸附环己烯的烯丙基C—H,并脱H形成Cy·自由基,之后Cy·与O2反应生成CyOO·自由基,CyOO·再抽取另一个环己烯烯丙基H生成Cy-OOH。另外,空白组检测到Cy-OOH而MoO3组未检测到Cy-OOH则表明Mo(Ⅵ)催化Cy-OOH参与后续反应。
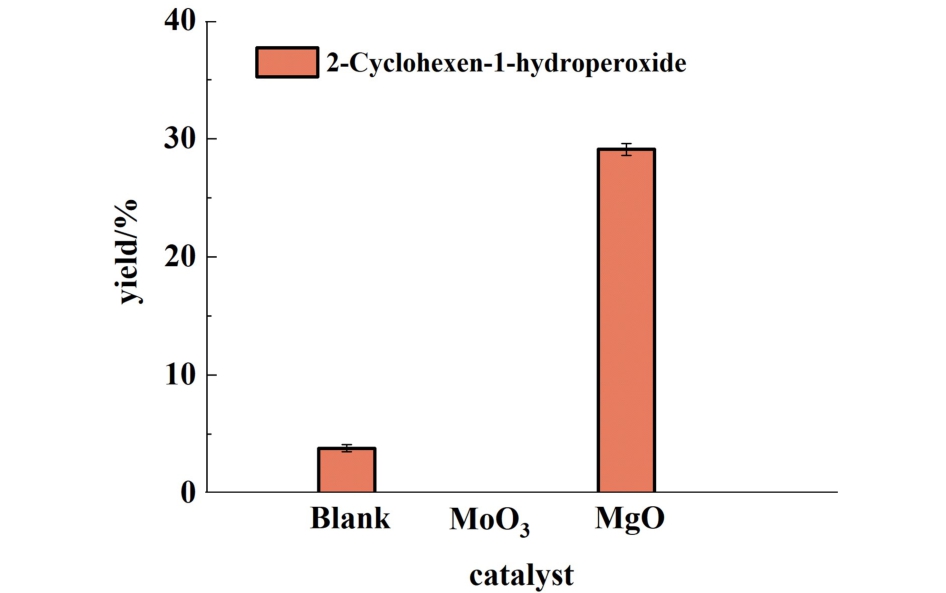
图11 测定Cy-OOH
Fig.11 Determination of Cy-OOH
之前的研究表明,Mo(Ⅵ)基催化剂在烷基过氧化物与环己烯环氧化反应中表现出高活性和选择性,Mo(VI)空闲的d轨道能够接受电子对,从而与烷基过氧化物形成Mo-(η2—O2)中间物种,进而与环己烯的C C键发生氧转移反应,形成环氧环己烷[14,17,19]。 为了进一步研究MoO3的催化反应活性,利用TBHP代替O2与环己烯反应。 如图12所示,在没有任何催化剂的情况下,环己烯转化率为6.3%,然而没有环氧环己烷生成。 同样,当MgO作为催化剂时,实验结果与空白组几乎一致,表明MgO在TBHP与环己烯的反应中几乎没有起到作用。 然而,当MoO3作为催化剂时,环己烯转化了21.1%,环氧选择性高达77.4%。 表明在环己烯的环氧化过程中,MoO3可以活化烷基过氧化物,进而与环己烯发生环氧化反应。
C键发生氧转移反应,形成环氧环己烷[14,17,19]。 为了进一步研究MoO3的催化反应活性,利用TBHP代替O2与环己烯反应。 如图12所示,在没有任何催化剂的情况下,环己烯转化率为6.3%,然而没有环氧环己烷生成。 同样,当MgO作为催化剂时,实验结果与空白组几乎一致,表明MgO在TBHP与环己烯的反应中几乎没有起到作用。 然而,当MoO3作为催化剂时,环己烯转化了21.1%,环氧选择性高达77.4%。 表明在环己烯的环氧化过程中,MoO3可以活化烷基过氧化物,进而与环己烯发生环氧化反应。
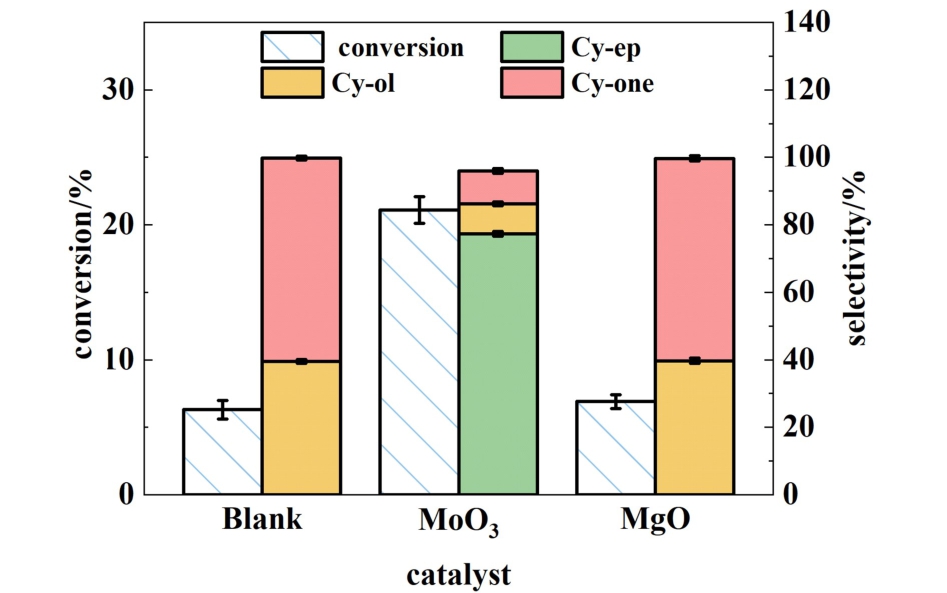
图12 TBHP氧化环己烯
Fig.12 Oxidation of cyclohexene with TBHP
可见MgO和MoO3相互协同形成了接力催化体系,其中,MgO有效地催化环己烯的烯丙基C—H脱H,形成Cy·自由基。之后,Cy·迅速捕获O2生成CyOO·自由基,然后CyOO·从另一个环己烯的烯丙基C—H中提取H生成Cy-OOH和Cy·自由基。MoO3则接力催化后续环氧化反应,活化Cy-OOH,形成Mo-(η2—O2)中间物种,最终将环己烯氧化为环氧环己烷。 与单一金属氧化物(Co3O4、CuO等)相比[8,31],这种接力催化策略显著提高了环氧化物的选择性。
2.6 催化机理分析
综上,在无溶剂和无引发剂的条件下,MgOMoO3催化O2氧化环己烯的机理可以总结如下(图13):(1) MgO中碱性位点(带负电的晶格氧)吸附环己烯的烯丙基H,拉长并削弱烯丙基C—H键,脱H形成Cy·自由基;(2) Cy·快速捕获O2生成CyOO·自由基;(3) CyOO·从另一个环己烯的烯丙基C—H中提取H,形成Cy-OOH和Cy·自由基;(4) MoO3随后激活Cy-OOH的O—O键,形成Mo-(η2—O2)中间物种;(5) Mo-(η2—O2)攻击环己烯C  C键生成环氧环己烷。
C键生成环氧环己烷。
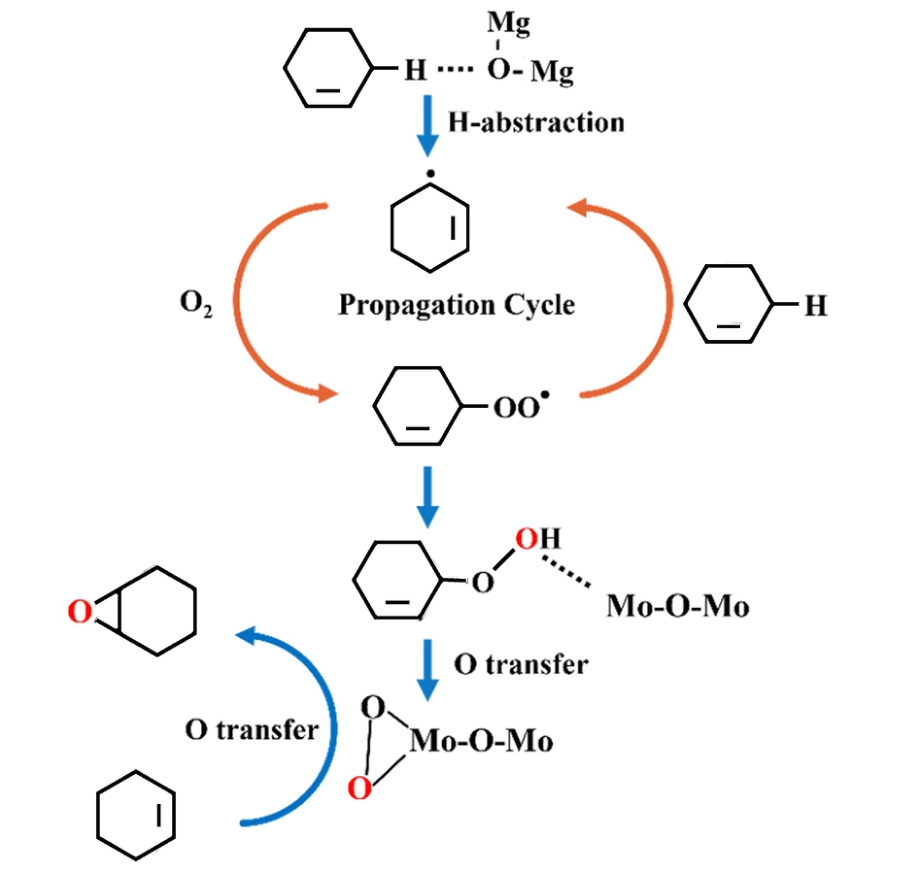
图13 MgO—MoO3催化O2氧化环己烯的可能的机理
Fig.13 Proposed mechanism involved in the oxidation of cyclohexene by MgO-MoO3
3 结论
合成了球型MgO与带状MoO3,物理混合并用于催化O2直接环氧化环己烯,利用XRD、SEM、FTIR、Raman、XPS和N2吸脱附法对催化剂结构与形貌进行了分析。 对不同比例MgO/MoO3混合物、温度、O2压力和反应时间等因素的影响进行实验评价,结果表明当m(MgO) ∶m(MoO3)为1 ∶1物理混合进行催化时,在100 ℃、1 MPa O2压力下反应6 h,环己烯的转化率为26.7%,环氧环己烷的选择性为43.7%。 此外,循环实验证明,催化剂在连续5次进行环己烯氧化反应后,依旧保持高催化活性。 自由基淬灭实验排除·OH和![]() 对环己烯氧化的贡献,同时,证明了环己烯烯丙基脱H产生的Cy·自由基是环己烯氧化中的重要氧化活性物种,同时Cy·与O2反应生成的Cy-OO·也在环己烯氧化过程中起重要作用。而O2对环己烯脱H过程无显著贡献,环己烯氧化始于环己烯活化而非O2活化。 苯甲酸掩蔽实验证明MgO表面碱性位点是催化环己烯脱H的活性位点。 Cy-OOH测定实验证明Cy-OOH是O2氧化环己烯过程中重要的中间物质,TBHP氧化环己烯实验表明MoO3可以高效地活化烷基过氧化物,进而将环己烯氧化成环氧环己烷。 这项工作为在无溶剂无引发剂条件下利用O2高选择性环氧化烯烃提供了新的见解。
对环己烯氧化的贡献,同时,证明了环己烯烯丙基脱H产生的Cy·自由基是环己烯氧化中的重要氧化活性物种,同时Cy·与O2反应生成的Cy-OO·也在环己烯氧化过程中起重要作用。而O2对环己烯脱H过程无显著贡献,环己烯氧化始于环己烯活化而非O2活化。 苯甲酸掩蔽实验证明MgO表面碱性位点是催化环己烯脱H的活性位点。 Cy-OOH测定实验证明Cy-OOH是O2氧化环己烯过程中重要的中间物质,TBHP氧化环己烯实验表明MoO3可以高效地活化烷基过氧化物,进而将环己烯氧化成环氧环己烷。 这项工作为在无溶剂无引发剂条件下利用O2高选择性环氧化烯烃提供了新的见解。
[1] 王新国, 程庆彦, 彭文静, 等. 环己烯环氧化反应催化剂研究进展[J]. 高校化学工程学报, 2020, 34(3): 563-571 WANG Xinguo, CHENG Qingyan, PENG Wenjing, et al. Progress on catalysts for cyclohexene epoxidation[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(3):563-571(in Chinese)
[2] 丁智俊. 负载型金属多氧酸盐杂化催化剂上分子氧环己烯环氧化工艺研究及概念设计[D]. 杭州: 浙江大学, 2019 DING Zhijun. Study and conceptual design of epoxidation of molecular cyclohexene on supported metal polyoxometalate hybrid catalyst[D]. Hangzhou: Zhejiang University, 2019 (in Chinese)
[3] CORDEIRO P J, GUILLO P, SPANJERS C S, et al. Titaniumgermoxy precursor route to germanium-modified epoxidation catalysts with enhanced activity[J]. ACS Catalysis, 2013, 3(10):2269-2279
[4] LI R, ZHU X, YAN X, et al. Oxygen-controlled hydrogen evolution reaction: Molecular oxygen promotes hydrogen production from formaldehyde solution using Ag/MgO nanocatalyst[J]. ACS Catalysis, 2017, 7(2): 1478-1484
[5] GUO Z, LIU B, ZHANG Q, et al. Recent advances in heterogeneous selective oxidation catalysis for sustainable chemistry[J].Chemical Society Reviews, 2014, 43(10): 3480-3524
[6] LI W, WU G, HU W, et al. Direct propylene epoxidation with molecular oxygen over cobalt-containing zeolites[J]. Journal of the American Chemical Society, 2022, 144(9): 4260-4268
[7] TIAN Z, FATTAHI A, LIS L, et al. Cycloalkane and cycloalkene C—H bond dissociation energies[J]. Journal of the American Chemical Society, 2006, 128(51): 17087-17092
[8] BÜKER J, HUANG X, BITZER J, et al. Synthesis of Cu single atoms supported on mesoporous graphitic carbon nitride and their application in liquid-phase aerobic oxidation of cyclohexene[J].ACS Catalysis, 2021, 11(13): 7863-7875
[9] ASGHARPOUR Z, FARZANEH F, ABBASI A. Synthesis,characterization and immobilization of a new cobalt(II) complex on modified magnetic nanoparticles as catalyst for epoxidation of alkenes and oxidation of activated alkanes[J]. RSC Advances,2016, 6(98): 95729-95739
[10] ZHOU X, JI H. Biomimetic kinetics and mechanism of cyclohexene epoxidation catalyzed by metalloporphyrins[J]. Chemical Engineering Journal, 2010, 156(2): 411-417
[11] XU S, HUANG C, ZHANG J, et al. Catalytic activity of Cu/MgO in liquid phase oxidation of cumene[J]. Korean Journal of Chemical Engineering, 2009, 26(6): 1568-1573
[12] XIAO Y, WANG Z, FAN G, et al. The promotional roles of multivalent metal ions and oxygen vacancies on nitrogen-doped carbon-combined CuMn-based catalysts for cyclohexylbenzene oxidation[J]. Applied Catalysis A: General, 2023, 651: 119022
[13] GÓMEZ-HORTIGÜELA L, CORÀ F, CATLOW C R A. Mechanism and energetics of secondary oxidation reactions in the aerobic oxidation of hydrocarbons catalyzed by Mn-doped nanoporous aluminophosphates[J]. The Journal of Physical Chemistry C,2012, 116(11): 6691-6702
[14] KÜHN F E, SANTOS A M, ABRANTES M. Mononuclear organomolybdenum(VI) dioxo complexes: Synthesis, reactivity, and catalytic applications[J]. Chemical Reviews, 2006, 106(6):2455-2475
[15] ZHONG W, LIU M, DAI J, et al. Synergistic hollow CoMo oxide dual catalysis for tandem oxygen transfer: Preferred aerobic epoxidation of cyclohexene to 1, 2-epoxycyclohexane[J]. Applied Catalysis B: Environmental, 2018, 225: 180-196
[16] GONZÁLEZ-NAVARRETE P, SENSATO F R, ANDRÉS J, et al. Oxygen atom transfer reactions from Mimoun complexes to sulfides and sulfoxides. A bonding evolution theory analysis[J].The Journal of Physical Chemistry A, 2014, 118 ( 31):6092-6103
[17] MIMOUN H. The role of peroxymetallation in selective oxidative processes[J]. Journal of Molecular Catalysis, 1980, 7(1):1-29
[18] AL-AJLOUNI A M, VELJANOVSKI D, CAPAPÉ A, et al. Kinetic studies on the oxidation of η5-cyclopentadienyl methyl tricarbonyl molybdenum(II) and the use of its oxidation products as olefin epoxidation catalysts[J]. Organometallics, 2009, 28(2):639-645
[19] DOKE D S, UMBARKAR S B, GAWANDE M B, et al. Environmentally benign bioderived carbon microspheres-supported molybdena nanoparticles as catalyst for the epoxidation reaction[J].ACS Sustainable Chemistry & Engineering, 2017, 5 ( 1):904-910
[20] MO Y, TAN Z, SUN L, et al. Ethanol-sensing properties of α-MoO3 nanobelts synthesized by hydrothermal method[J]. Journal of Alloys and Compounds, 2020, 812: 152166
[21] YAN X, TIAN Z, PENG W, et al. Synthesis of nano-octahedral MgO via a solvothermal-solid-decomposition method for the removal of methyl orange from aqueous solutions[J]. RSC Advances, 2020, 10(18): 10681-10688
[22] MUDULI S, PATI S K, SWAIN S, et al. MoO3@ ZnO nanocomposite as an efficient anode material for supercapacitors: A cost effective synthesis approach[J]. Energy & Fuels, 2021, 35(20): 16850-16859
[23] AL-ANSI N, SALAH A, GU Z, et al. TiO2-coated MoO3 nanorods for lithium/sodium-ion storage[J]. ACS Applied Nano Materials, 2023, 6(21): 19876-19886
[24] AKSAY S. Effects of Al dopant on XRD, FT-IR and UV-vis properties of MgO films[J]. Physica B: Condensed Matter,2019, 570: 280-284
[25] LI C, XIN Q, WANG K, et al. FT-IR emission spectroscopy studies of molybdenum oxide and supported molybdena on alumina, silica, zirconia, and titania [J]. Applied Spectroscopy,1991, 45(5): 874-882
[26] FADLALLA M I, FARAHANI M D, FRIEDRICH H B. Three inter-linked active sites in the dehydrogenation of n-octane over magnesium molybdate based catalysts and their influences on coking and cracking side reactions[J]. Molecular Catalysis, 2018,461: 86-96
[27] BAI J, SONG Y, WANG C, et al. Engineering the electronic structure of Mo sites in Mn—Mo—O mixed-metal oxides for efficient aerobic oxidative desulfurization [J]. Energy & Fuels,2021, 35(15): 12310-12318
[28] KRISHNA A G, RAVIKUMAR R V S S N, KUMAR T V, et al.Investigation and comparison of optical and Raman bands of mechanically synthesised MoO3 nano powders[J]. Materials Today:Proceedings, 2016, 3(1): 54-63
[29] MINAKSHI M, MITCHELL D R G, MUNNANGI A R, et al.New insights into the electrochemistry of magnesium molybdate hierarchical architectures for high performance sodium devices[J]. Nanoscale, 2018, 10(27): 13277-13288
[30] ZHENG C, LUO N, HUANG S, et al. Nanocomposite of Mo2 N quantum Dots@ MoO3 @ Nitrogen-doped carbon as a high-performance anode for lithium-ion batteries[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(12): 10198-10206
[31] FU Y, SUN D, QIN M, et al. Cu(II)-and Co(II)-containing metal-organic frameworks (MOFs) as catalysts for cyclohexene oxidation with oxygen under solvent-free conditions[J]. RSC Advances, 2012, 2(8): 3309
[32] LI G, NGO D T, YAN Y, et al. Factors determining selectivity of acid-and base-catalyzed self-and cross-condensation of acetone and cyclopentanone [J]. ACS Catalysis, 2020, 10 ( 21):12790-12800
[33] HAYASHI E, TAMURA T, AIHARA T, et al. Base-assisted aerobic C—H oxidation of alkylarenes with a murdochite-type oxide Mg6 MnO8 nanoparticle catalyst[J]. ACS Applied Materials& Interfaces, 2022, 14(5): 6528-6537
[34] WANG Y, ZHENG D, YANG X, et al. High rate oxygen reduction in non-aqueous electrolytes with the addition of perfluorinated additives[J]. Energy & Environmental Science, 2011, 4(9):3697-3702
[35] MAAYAN G, NEUMANN R. Direct aerobic epoxidation of alkenes catalyzed by metal nanoparticles stabilized by the H5 PV2 Mo10 O40 polyoxometalate[J]. Chemical Communications,2005(36): 4595-4597
[36] HAYYAN M, HASHIM M A, ALNASHEF I M. Superoxide ion:Generation and chemical implications[J]. Chemical Reviews,2016, 116(5): 3029-3085
[37] DAI J, ZHONG W, YI W, et al. Bifunctional H2 WO4/TS-1 catalysts for direct conversion of cyclohexane to adipic acid: Active sites and reaction steps[J]. Applied Catalysis B: Environmental, 2016, 192: 325-341
[38] YANG F, LI J, XIE J, et al. Copper-catalyzed cross dehydrogenative coupling reactions of tertiary amines with ketones or indoles[J]. Organic Letters, 2010, 12(22): 5214-5217
[39] POSPÍŠIL J, NEŠP ̊UREK S. Chain-breaking stabilizers in polymers: The Current status[J]. Polymer Degradation and Stability, 1995, 49(1): 99-110
[40] XIE M, ZHANG C, ZHENG H, et al. Peroxyl radicals from diketones enhanced the indirect photochemical transformation of carbamazepine: Kinetics, mechanisms, and products[J]. Water Research, 2022, 217: 118424
[41] COIN G, DUBOURDEAUX P, AVENIER F, et al. Experiments and DFT computations combine to decipher Fe-catalyzed amidine synthesis through nitrene transfer and nitrile insertion[J]. ACS Catalysis, 2021, 11(4): 2253-2266
[42] WANG M, ZUO Z, REN R, et al. Theoretical study on catalytic pyrolysis of benzoic acid as a coal-based model compound[J].Energy & Fuels, 2016, 30(4): 2833-2840