近年来,光催化有机化学反应受到有机合成工作者越来越多的关注,它在生产农药、医药、环境保护、新能源开发、化学合成、抗菌等领域中具有重要的应用。光催化由于其反应条件温和、氧化反应彻底、活性组分能量高和工艺绿色环保等特点,已在有机合成领域中得到了讯速发展,成为一种十分重要的有机转化工具。而苄位C—H键官能团化可以为复杂化合物的合成提供简单、高效的方法,通过导入各种各样的官能团来合成多样性的分子。因此,将光催化引入到苄位C—H键的官能团化反应中具有非常重要的研究意义。论文对近年来光催化苄位C—H键的官能化反应的研究进展进行了简要综述,主要包括:(1)烃基化反应;(2)烃氧基化反应;(3)羧基化反应;(4)酰基化反应;(5)磺酰基化反应;(6)酯基化反应;(7)氰基化反应;(8)异氰基化反应;(9)氟化反应;(10)氯化反应。
1 烃基化反应
1.1 烷基化反应
2017年,Wu等[1]首次报道了一种关于光催化苄位C—H键的烷基化反应,实现了苄位C—H键的烷基化(图1),利用光氧化还原催化剂使芳烃与缺电子烯腈进行偶联形成C—C键。相比之下,富电子的芳烃要比缺电子的芳烃反应效率高。在反应中,光诱导芳烃产生芳基自由基阳离子,接着脱质子形成苄基自由基,苄基自由基与迈克尔受体结合形成C—C键。该反应具有绿色环保、原子经济等优点,将会应用于天然产物C—H键选择性活化。例如,在室温的条件下将对二甲苯与苯亚甲基丙二腈放置到具有蓝光的DCE室中照射48 h,得到所需的烷基化产物。文献[1]的光催化苄位C—H键烷基化反应研究突破传统方法,实现了温和条件下的高效、环保C—H键活化,展示了光催化技术的潜力。该研究揭示了富电子芳烃的高反应效率,对理解反应机制有重要意义,并有望应用于天然产物合成和药物研发。光催化技术的发展将为有机合成领域带来更多创新和实用成果。
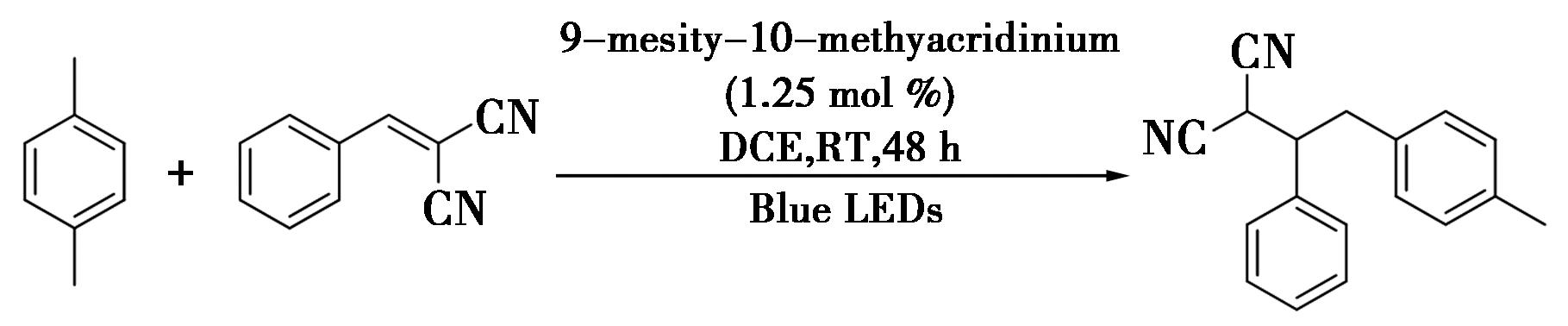
图1 苄位C—H键的烷基化反应[1]
Fig.1 Alkylation of benzyl C—H bond[1]
2018年,Liu等[2]报道了一种光氧化还原和铜双催化的苄位C—H键与烯酮的Giese反应(图2),实现了苄位C—H键的烷基化。在反应中,甲苯在激发态吖啶光催化剂的作用下被氧化,随后脱质子生成苄基自由基,在Cu(OTf)2活化烯酮中加入苄基自由基得到烷基自由基的加合物,接着由吖啶光催化剂中的中间体还原得到相应的阳离子中间体,最后阳离子中间体通过质子化得到目标产物γ-芳基酮[3]。该反应有效地避免了使用预官能化的金属亲核试剂,提供了一个得到增值γ-芳基酮的便捷途径。该反应不仅进一步扩展了光催化在C—H键活化领域的应用,而且通过双催化体系的创新设计,实现了苄位C—H键与烯酮的高效烷基化。这一方法无需使用预官能化的金属亲核试剂,简化了合成步骤,提高了反应效率,为合成γ-芳基酮类化合物提供了一种绿色、环保的新途径。此外,该反应的成功也再次证明了光催化技术在有机合成中的巨大潜力和应用价值。
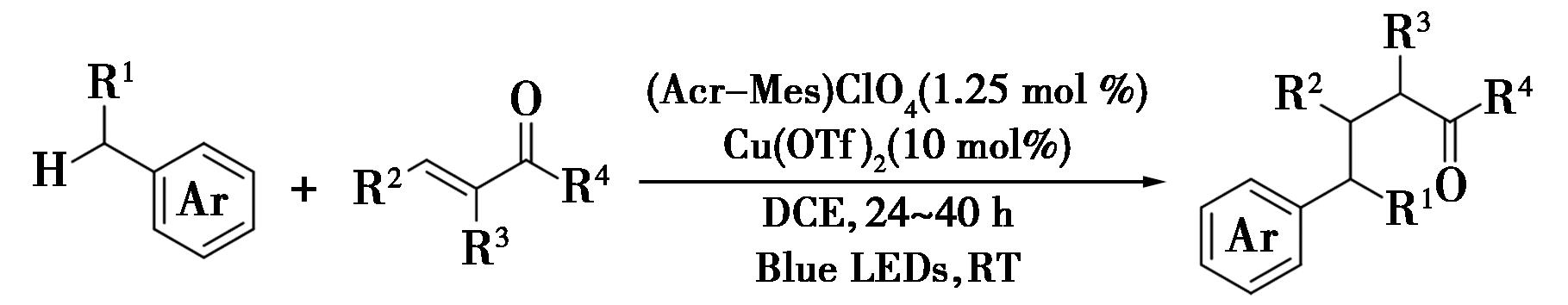
图2 Giese反应[2]
Fig.2 Giese reaction[2]
2018年,Perry等[4]报道了通过四丁基铵十聚钨酸盐(TBADT)与镍配合物协同催化芳基卤化物与饱和烷烃的交叉脱氢偶联反应(图3),实现了苄位C—H键的烷基化。该反应具有底物适用范围广、产率良好、官能团耐受性良好等优点。在反应中,以TBADT为光催化剂,在近紫外光的激发下,经过氢原子转移(HAT)过程生成烷基自由基。该反应为苄位C—H键的烷基化提供了一种高效且多功能的策略,展示了广泛的底物适用性,不仅产率良好,而且官能团耐受性也极佳,这对于复杂有机分子的合成具有重要意义。TBADT作为光催化剂,在近紫外光的激发下能高效地生成烷基自由基,进一步促进了交叉脱氢偶联反应的进行。这一研究成果不仅丰富了C—H键活化的方法学,还为合成含有苄位烷基化结构的复杂分子提供了方法。
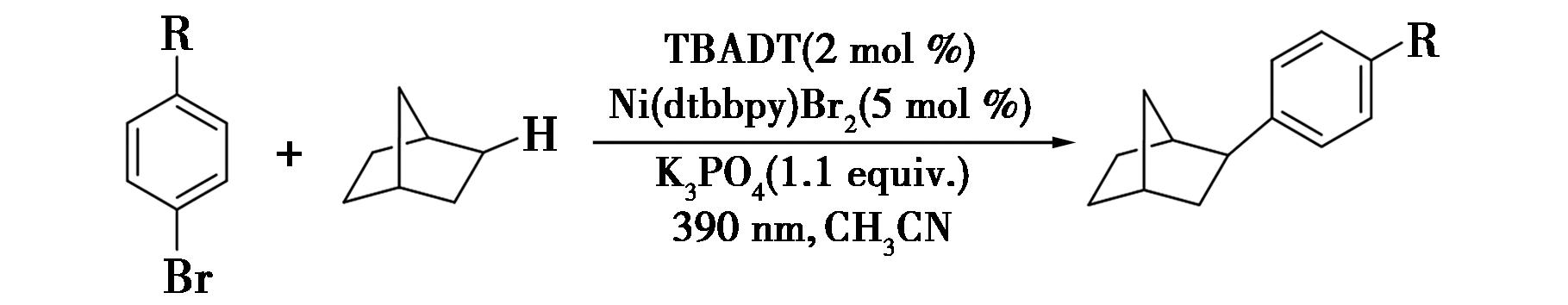
图3 芳基卤化物与饱和烷烃的交叉脱氢偶联反应[4]
Fig.3 Cross-dehydrogenation coupling reaction between aryl halides and saturated alkanes[4]
2018年,Abusalim等[5]报道了光催化苄位C—H键的三氟甲基化反应的研究(图4),实现了苄位C—H键的烷基化。该反应条件温和,能够兼容不同的官能团与碱性杂环,对阻碍最小的氢原子具有高度的选择性,可以应用于生物活性分子的晚期三氟甲基化以及在高功能化的药物分子上安装苄基三氟甲基。此外,该方案提供了一种环境友好的策略,能够在一个环保的丙酮/水的溶剂的体系中进行反应,在制作农业化学品、药物发现等领域具有广泛的应用。该反应不仅展示了其对生物活性分子晚期三氟甲基化的高效选择性,还在高功能化药物分子的修饰上展现了巨大的潜力。其环保的丙酮/水溶剂体系,进一步凸显了该策略在绿色化学和药物研发领域的重要性。这一研究为合成含有三氟甲基的生物活性分子提供了方法。
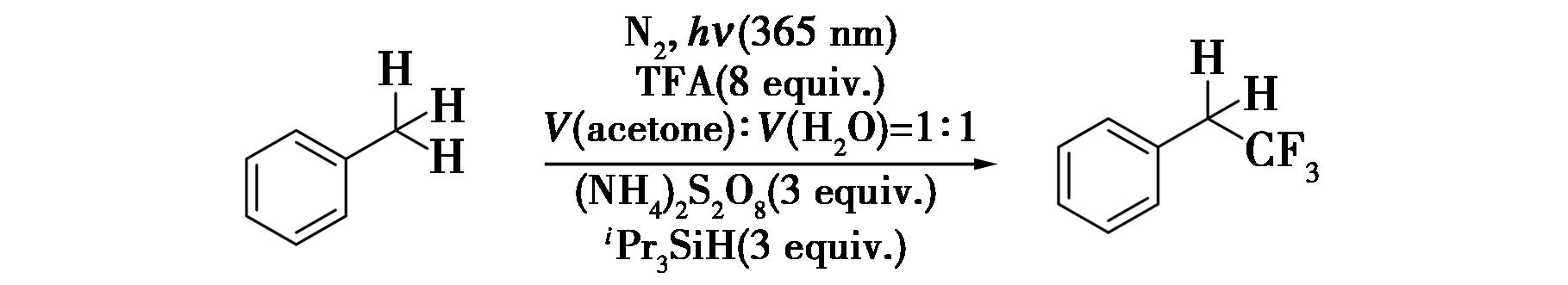
图4 苄位C—H键的三氟甲基化反应[5]
Fig.4 Trifluoromethylation of benzyl C—H bond[5]
2019年,Supranovich等[6]报道了一种光催化N-对甲苯磺酰亚胺类化合物苄位C—H键的烷基化反应(图5),在400 nm的光促进下,以四丁基铵十聚钨酸盐(TBADT)为光催化剂,实现了苄位C—H键的烷基化。以醚、酰胺或饱和烷烃作为自由基前体,完成了芳香族的N-对甲苯磺酰亚胺的烷基化反应,得到相应的目标产物磺酰胺,产率良好,最高可达92%[7]。
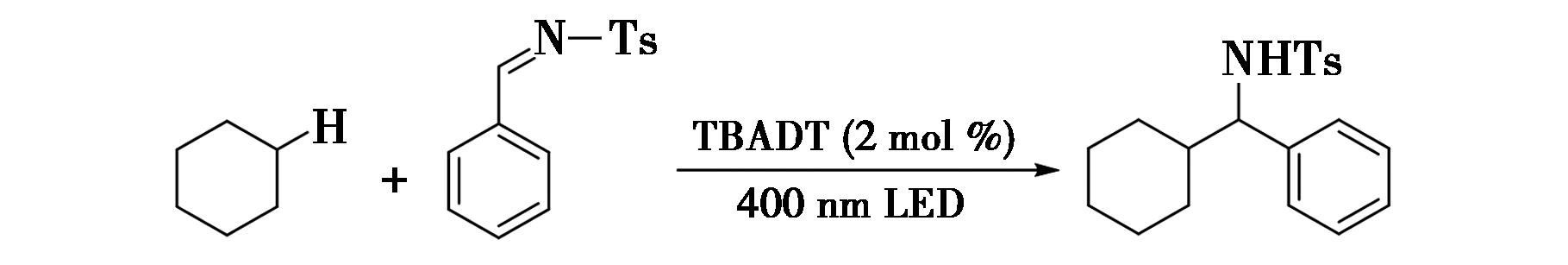
图5 N-对甲苯磺酰亚胺类化合物的烷基化反应[6]
Fig.5 Alkylation of N-p-toluenesulfonimide compounds[6]
经典的脱氢偶联反应一般都会添加少量的化学计量的氧化剂、金属还原剂、氢受体或者碱性添加剂来促进反应的进行[8],反应后产生的副产物为反应的后处理带来了不便。近几年出现了一种环境友好的反应方案,利用光催化的策略,脱氢偶联反应可以直接放出氢气[9],避免了化学计量的氧化剂、金属还原剂、氢受体或者碱性添加剂的使用,基于铱配合物与镍配合物在反应中起到的重要作用。2021年,Ishida等[10]报道了一种烷基芳烃的脱氢偶联反应的研究(图6),实现了苄位C—H键的烷基化。在生成的产物中,只有氢气是副产物,它不需要任何氧化剂、金属还原剂、氢受体以及爆炸性试剂。此外,该反应是基于他们之前的发现,即结合铱配合物、溴化阴离子和镍配合物光化学介导的烷基芳烃与醛的脱氢交叉偶联反应[11]。该方案具有原子经济、环境友好等优点,在形成空间有张力的C—C单键方面起着十分重要的作用。在没有醛的情况下,采用蓝光照射含有0.20 mmol异丙基苯、2 mol% Ir[dF(CF3)ppy]2(dtbbpy)]PF6和2 mol% NiBr2(dtbbpy)的乙酸乙酯溶液,在24 h之后,得到了减压下蒸发的混合物,随后在硅胶上进行制备薄层色谱(PTLC)的操作,得到产率为84%且含两个季碳的二聚体。

图6 烷基芳烃的脱氢偶联反应[10]
Fig.6 Dehydrogenation coupling reaction of alkyl aromatics[10]
2022年,Li等[12]报道了一种通过光氧化还原催化N-芳胺与环酮肟酯的交叉偶联反应构建C(sp3)—C(sp3)键的研究(图7),实现了苄位C—H键的烷基化。在温和的条件下,N-芳胺与环酮肟酯反应,得到产率较好的偶联产物。反应通过生成一系列亚胺基自由基,单电子转移形成氮自由基阳离子,C—C键裂解生成氰烷基自由基,脱质子化以及自由基-自由基的偶联进行,不使用任何的配体或者碱进行控制。该反应具有条件温和、环境友好性、可持续性[13,14]、产率良好等优点,可以应用于烷基化修饰,在有机化学和药物化学的领域具有较强的影响力。

图7 N-芳胺与环酮肟酯的交叉偶联反应[12]
Fig.7 Cross-coupling reaction of N-arylamine with cycloketoxime ester[12]
2022年,Xu等[15]报道了通过光氧化还原与铜协同催化的苄位C—H键对映选择性自由基的三氟甲基化的反应研究(图8),实现了苄位C—H键的烷基化。该反应具有温和的条件、良好的官能团耐受性、广泛的底物适用范围等优点,可以应用于具有生物活性的化合物与复杂化合物分子的后期三氟苄基化。
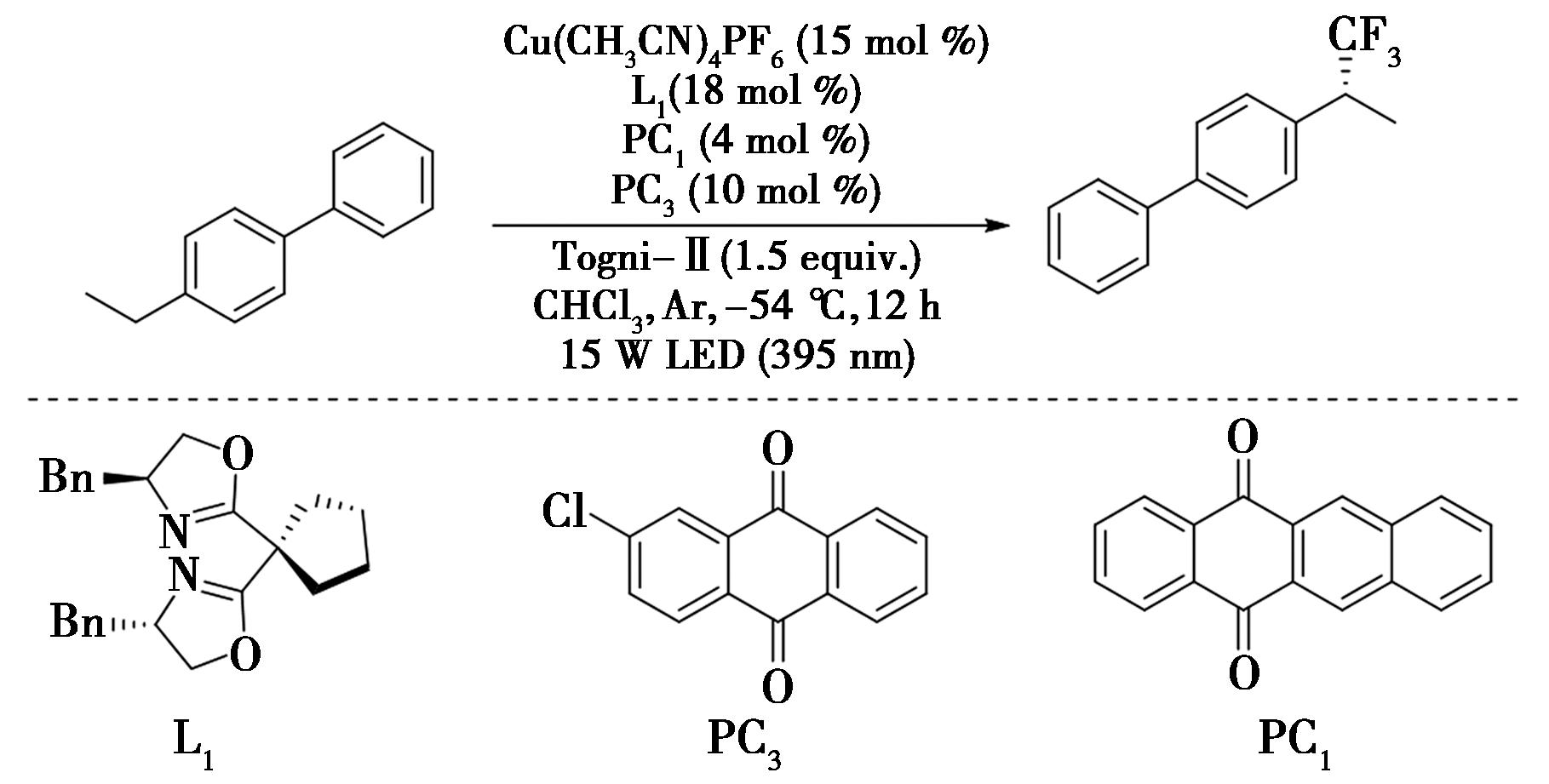
图8 光氧化还原与铜协同催化苄位C—H键的三氟甲基化反应[15]
Fig.8 Photoredox and copper co-catalyze the trifluoromethylation of benzyl C—H bond[15]
1.2 烯基化反应
2021年,Cheng等[16]报道了通过光氧化还原/镍协同催化对映与立体选择性的苄位C—H键的烯基化反应(图9),实现了苄位C—H键的烯基化。该反应具有温和的官能团耐受性,提供了一种新的可见光催化下立体合成烯烃的三重能的转移抑制的策略。例如,乙苯与(E)-2-(2-溴代甲酰基)萘的反应,以2 mol% Ir(dFCF3ppy)2(dtbbpy)Cl与10 mol% NiCl2·DME为光催化剂,在34 ℃的条件下利用蓝光照射24 h,得到具有对映选择性的烯基化产物。
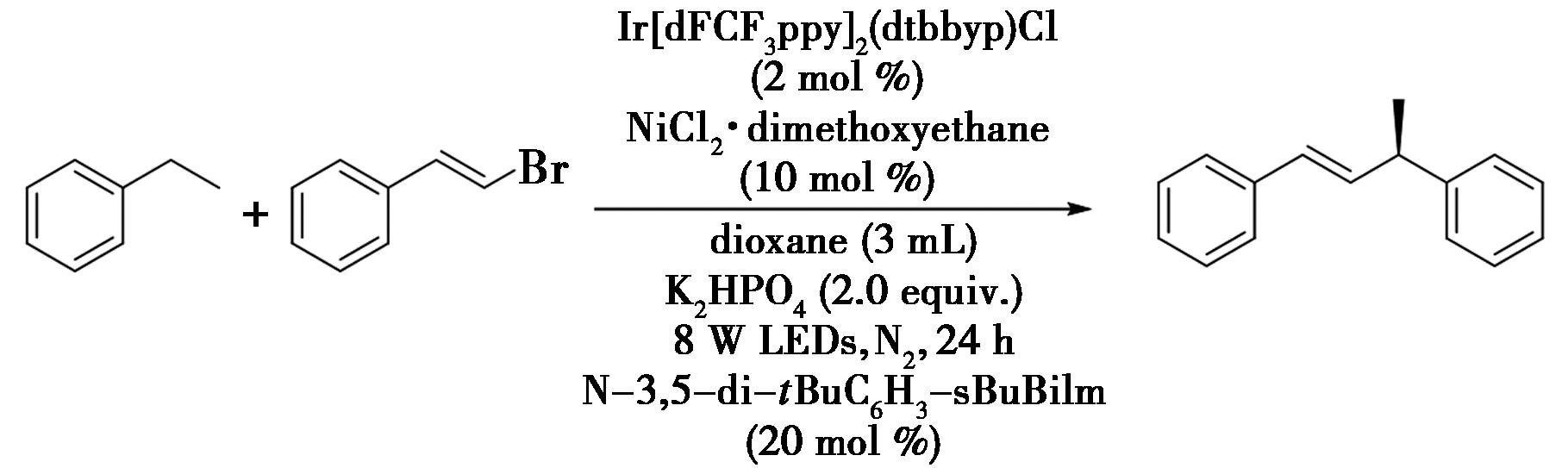
图9 光氧化还原/镍协同催化苄位C—H键的烯基化反应[16]
Fig.9 Photoredox/nickel synergistic catalysis of benzyl C—H bond alkylation[16]
1.3 芳基化反应
2015年,Cuthbertson等[17]报道了采用光氧化还原与硫醇有机催化相结合的策略,实现了苄位C—H键的芳基化(图10)。在反应中,通过硫醇和光氧化还原催化剂生成硫基自由基,随后硫基自由基从苄位C—H键中提取一个氢原子生成苄基自由基。最后,硫基自由基与苄基自由基进行偶联,得到所需的芳基化产物[18]。该反应为苄位C—H键的芳基化提供了新颖且高效的方法。通过光氧化还原与硫醇有机催化的结合,成功实现了苄位C—H键的选择性活化,并在温和条件下高效生成了芳基化产物。这一策略不仅丰富了有机合成的方法学,还为复杂分子的合成提供了路线。
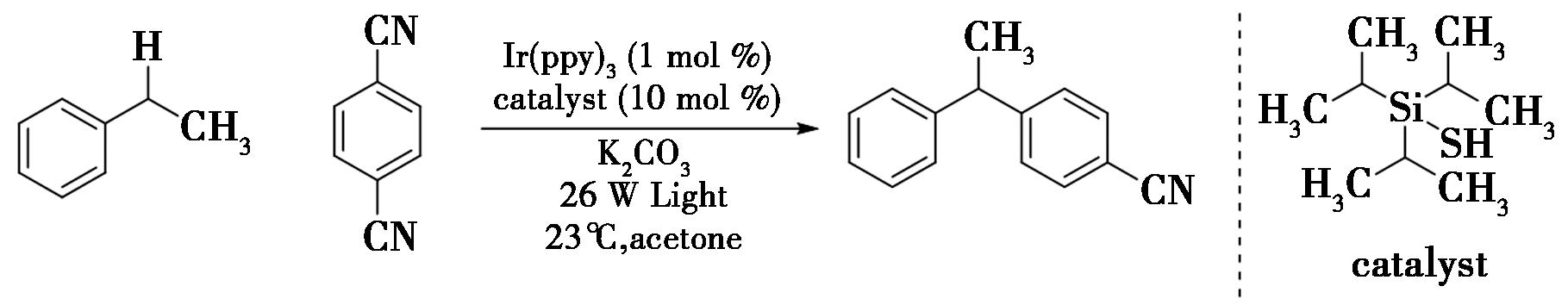
图10 有机和光氧化还原催化苄位C—H键的芳基化反应[17]
Fig.10 Arylation of benzyl C—H bond catalyzed by organic and photoredox[17]
2017年,Ishida等[19]报道了通过镍/联吡啶催化的策略,在紫外光的照射下实现了甲苯衍生物苄位C—H键的芳基化(图11)。该反应具有组分易得,操作简单的优点,为形成芳基-苄基键提供了一个便捷的途径。例如,在耐热管中,用365 nm的紫外光照射含0.20 mmol对溴酰苯醚、5 mol% NiCl2(dtbbpy)和0.40 mol(2.0 eq)2,6-二甲基吡啶的10 mL对二甲苯的溶液,18 h之后,将混合物通过硅藻土进行过滤,滤液采用薄层色谱(PTLC)进行纯化,得到所需的芳基化产物。
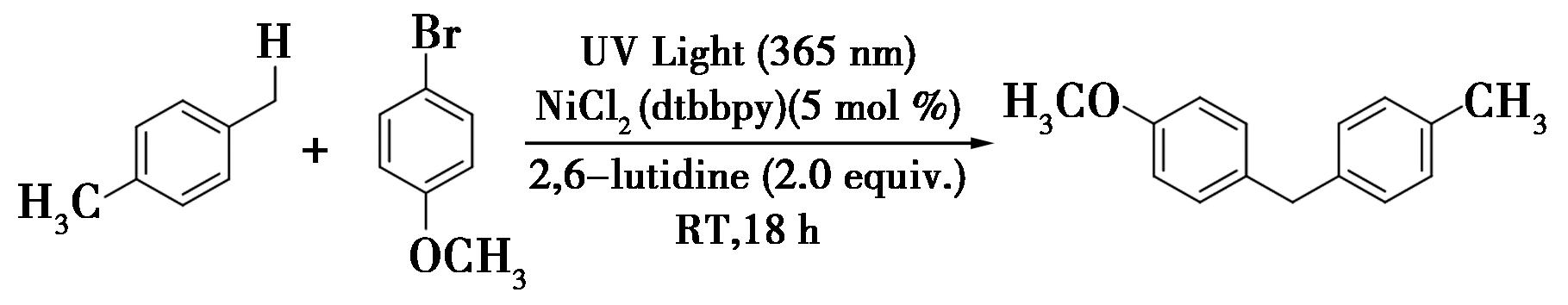
图11 镍/联吡啶催化苄位C—H键的芳基化反应[19]
Fig.11 Nickel/bipyridine catalyzes the arylation of benzyl C—H bonds[19]
近年来,十聚钨酸盐由于其特殊的光化学性能,在有机合成方面起着十分关键的作用。2018年,Pery等[20]报道了一种关于镍和十钨酸盐光催化苄位C—H键的芳基化反应的方案(图12),实现了苄位C—H键的芳基化。在反应中,十钨酸盐阴离子被光激发后,在温和反应条件下生成苄基自由基,进而苄基自由基与缺电子的芳基溴化物通过镍催化发生反应,得到所需的芳基化产物。该方案能够直接从化学原料和天然产物中获得各种复杂的药物相关分子。
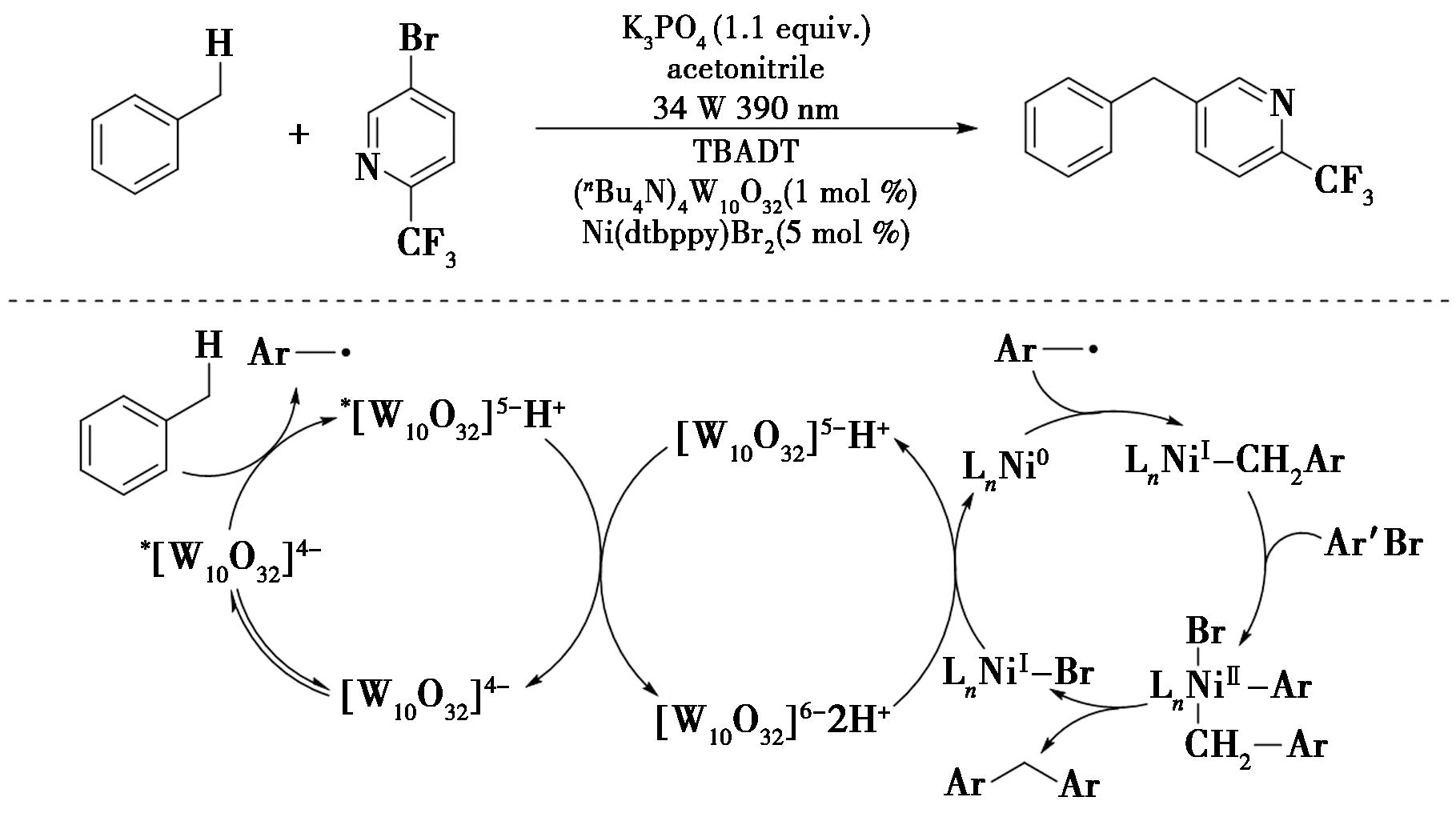
图12 镍和十钨酸盐光催化苄位C—H键的芳基化反应[20]
Fig.12 Photocatalytic arylation of C—H bond at benzyl site by nickel and decatungstate[20]
2019年,Dewanji等[21]报道了光氧化还原与镍协同催化苄位C—H键与芳基卤化物的交叉偶联反应(图13),实现了苄位C—H键的芳基化。在反应中,采用的光催化剂具有能量转移剂的功能,而二芳基酮可以作为光催化过程与氢原子转移(HAT)过程的试剂,具有原子转移和电子转移的作用。此外,该反应可以在不需要专门设备的情况下扩大规模。
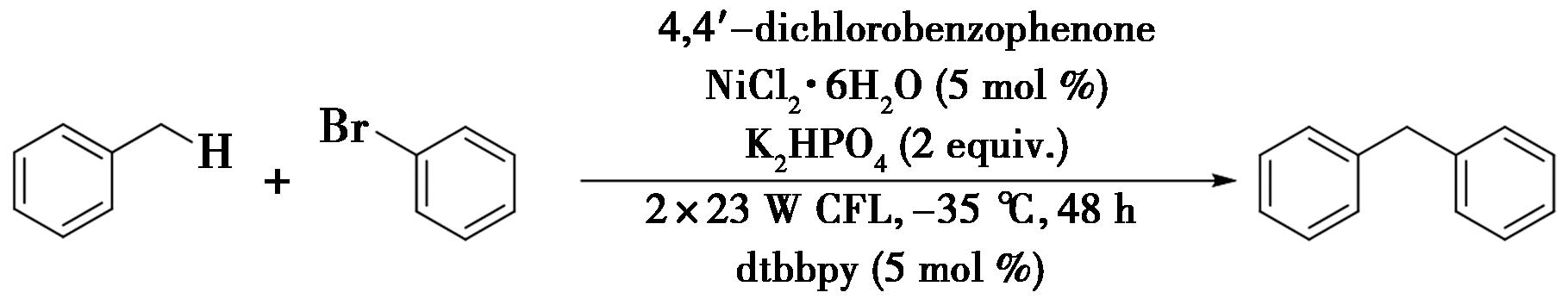
图13 苄位C—H键与芳基卤化物的交叉偶联反应[21]
Fig.13 Cross-coupling reactions of benzylic C—H bonds with aryl halides[21]
2020年,Andrew等[22]报道了一种利用富电子芳烃与烷基苯衍生物二者作为偶联伙伴的苄位C—H键交叉脱氢芳基化反应的方案(图14),实现了苄位C—H键的芳基化。在反应中,在原位产生具有反应性的苄基氟中间体,随后与亲核芳烃发生反应。该反应兼容各种官能团,其中包括未保护的极性官能团,可以应用于与生物学有关联的分子后期所进行的苄基化。此外,该反应提供了一个合成1,1-二芳基甲烷的有效途径。例如,0.4 mol 1-(tBu)-3-乙苯与2.0 eq甲苯在以9-氟酮为光催化剂,以选择氟为中间体,在室温下采用18 W CFL灯进行照射,在24 h后,加热到 90 ℃长达30 min,得到所需的芳基化产物。
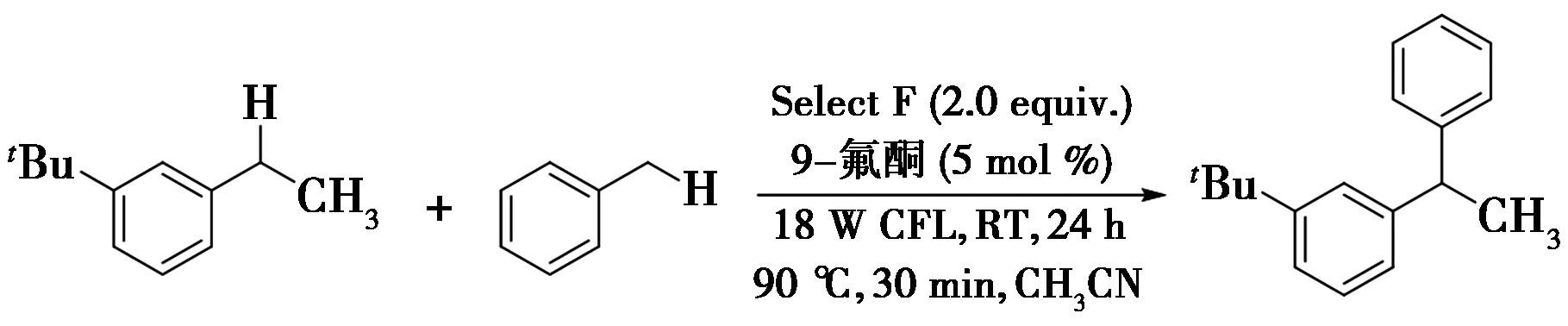
图14 苄位C—H键的交叉脱氢芳基化反应[22]
Fig.14 Cross dehydroarylation reaction of benzyl C—H bond[22]
2021年,Kim等[23]报道了一种光氧化还原与镍协同催化的苄位C—H键的芳基化反应(图15),实现了苄位C—H键的芳基化。在反应中,在光氧化还原的条件下在底物的苄基位置上生成苄基自由基,随后通过镍催化来完成整个反应的转化。该方案具有条件温和、高效性等特点,可以应用于复杂药物分子衍生物的生产制备中。
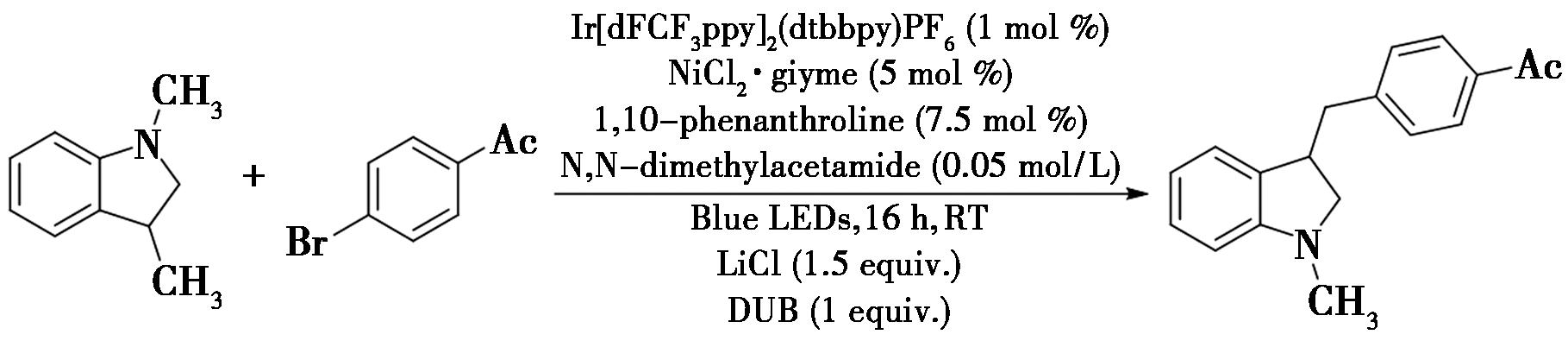
图15 光氧化还原与镍协同催化的苄位C—H键的芳基化反应[23]
Fig.15 Photoredox-catalyzed nickel-catalyzed benzylic C—H arylation[23]
2022年,Wang等[24]报道了关于可见光与镍双催化的甲基芳烃与芳基溴的偶联反应(图16),实现了苄位C—H键的芳基化。在反应中,由芳基溴提供溴自由基,随后溴自由基从苄位C—H键中提取一个氢原子生成苄基自由基,最后苄基自由基参与镍催化过程的芳基化偶联。该方案具有合成实用性,在复杂化合物分子与几种药物后期芳基化的应用中得到了证明。
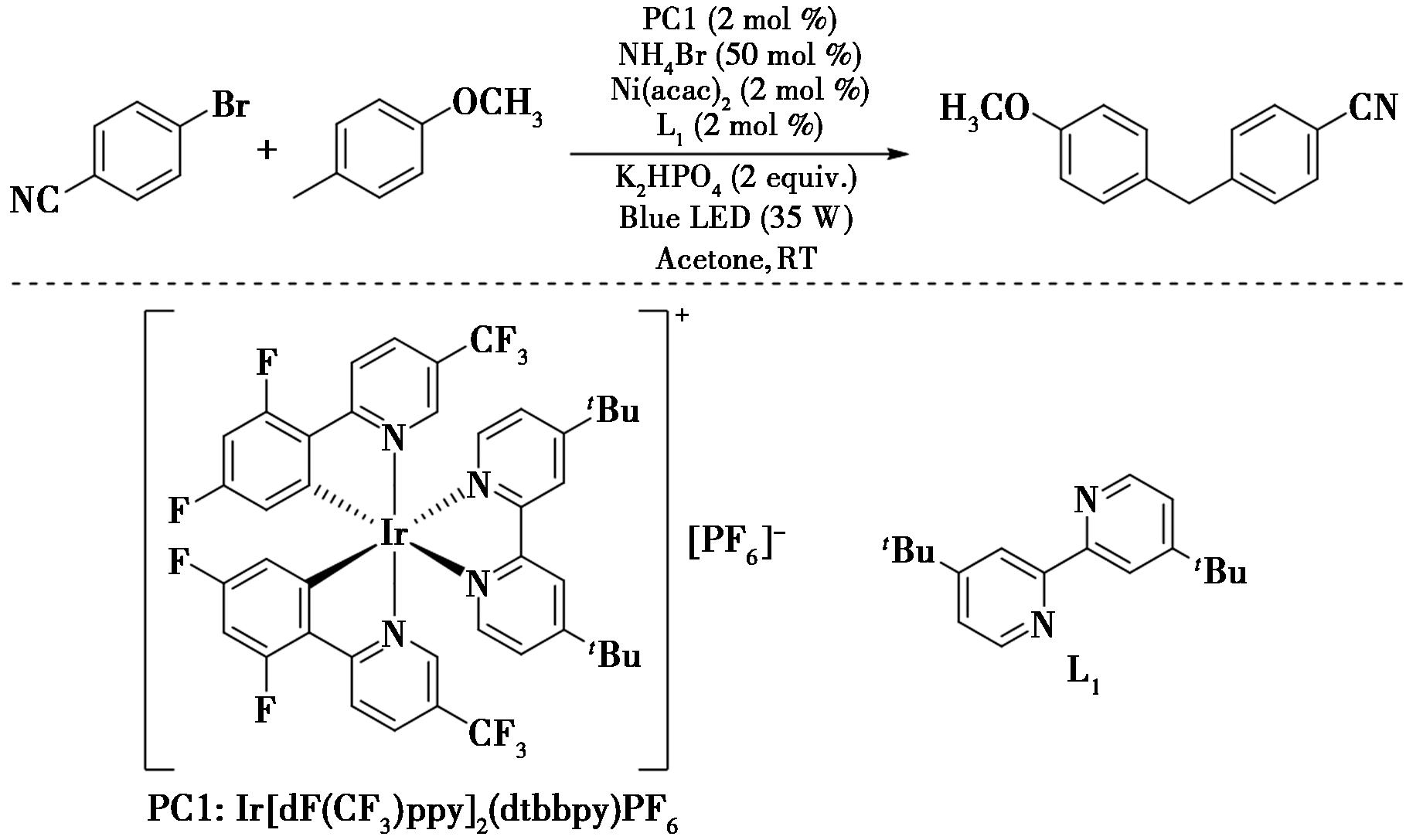
图16 甲基芳烃与芳基溴的偶联反应[24]
Fig.16 Coupling reaction of methyl aromatics with aryl bromide[24]
2 烃氧基化反应
2019年,Lee等[25]报道了通过光氧化还原催化剂与Cu(Ⅱ)氧化剂相结合的催化策略,将等效的亲核醇直接加到苄位C—H键中,实现了苄位C—H键的烃氧基化(图17)。在反应中,利用两个等效的醇作为偶联的伙伴,引入具有化学选择性、高位点选择性的苄基C—O键。该方案具有位点选择性、官能团兼容性的特点,便于适应复杂生物活性化合物的后期官能化,为有机合成和药物化学方面的潜在应用提供了一种实用性的新方法。这一研究在有机合成领域取得了重要突破。通过光氧化还原催化剂与Cu(Ⅱ)氧化剂的协同作用,实现了苄位C—H键的烃氧基化,且反应具有高化学选择性和位点选择性。这一策略不仅拓展了苄位C—H键活化的新方法,而且其官能团兼容性和对复杂生物活性化合物的适应性,为药物化学和有机合成领域提供了方法。
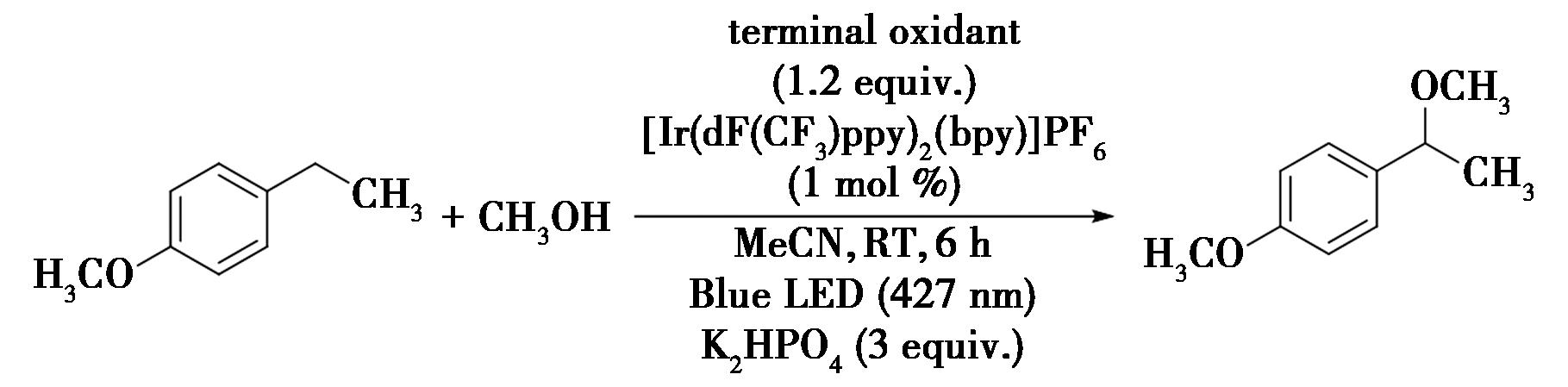
图17 苄位C—H键的烃氧基化反应[25]
Fig.17 Hydroxylation reaction of benzyl C—H bond[25]
3 羧基化反应
2015年,Masuda等[26]报道了通过紫外光激发苄位C—H键与二氧化碳的羧基化反应(图18),实现了苄位C—H键的羧基化。在反应中,在紫外光的激发下利用邻碳基引导基团对苄位C—H键进行羧基化。该反应实现了苄位C—H键与二氧化碳的羧基化反应,这一创新方法为C—H键的羧基化提供了新的途径。该方法不仅展示了紫外光在有机合成中的潜力,还通过邻碳基引导基团提高了羧基化的效率和选择性,为制备含羧基的有机化合物提供了绿色、高效的合成策略。
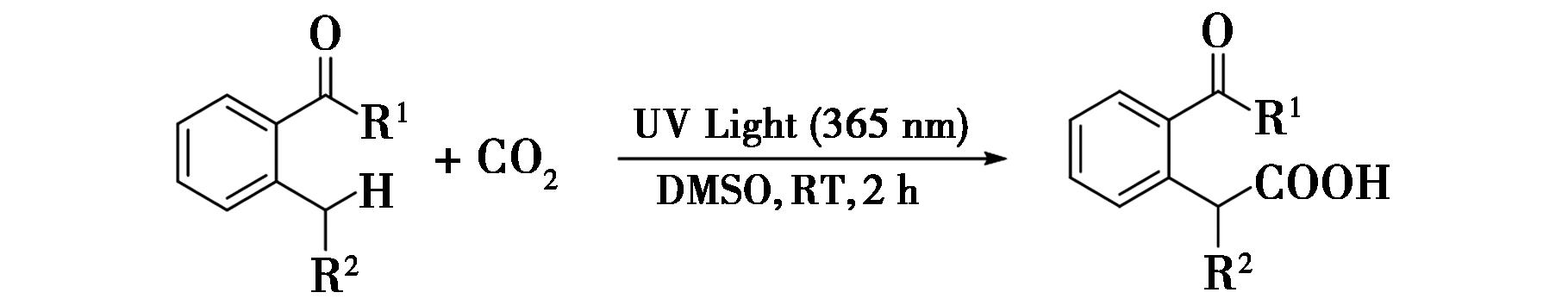
图18 苄位C—H键与二氧化碳的羧基化反应[26]
Fig.18 Carboxylation of the benzyl C—H bond with carbon dioxide[26]
2019年,Ishida等[27]报道了一种关于光催化苄位C—H键的羧基化反应(图19),将二氧化碳固定在苄位C—H键上,实现了苄位C—H键的羧基化。该反应可以拓展到一些饱和烃中,提供了一种直接的途径,从现成的碳氢化合物到相应的羧酸与单碳的延伸。在反应中,在芳香酮、镍配合物以及叔丁醇钾的存在下,甲苯衍生物在苄基的位置进行气态二氧化碳的捕获,生成所需的羧基化产物苯乙酸衍生物。
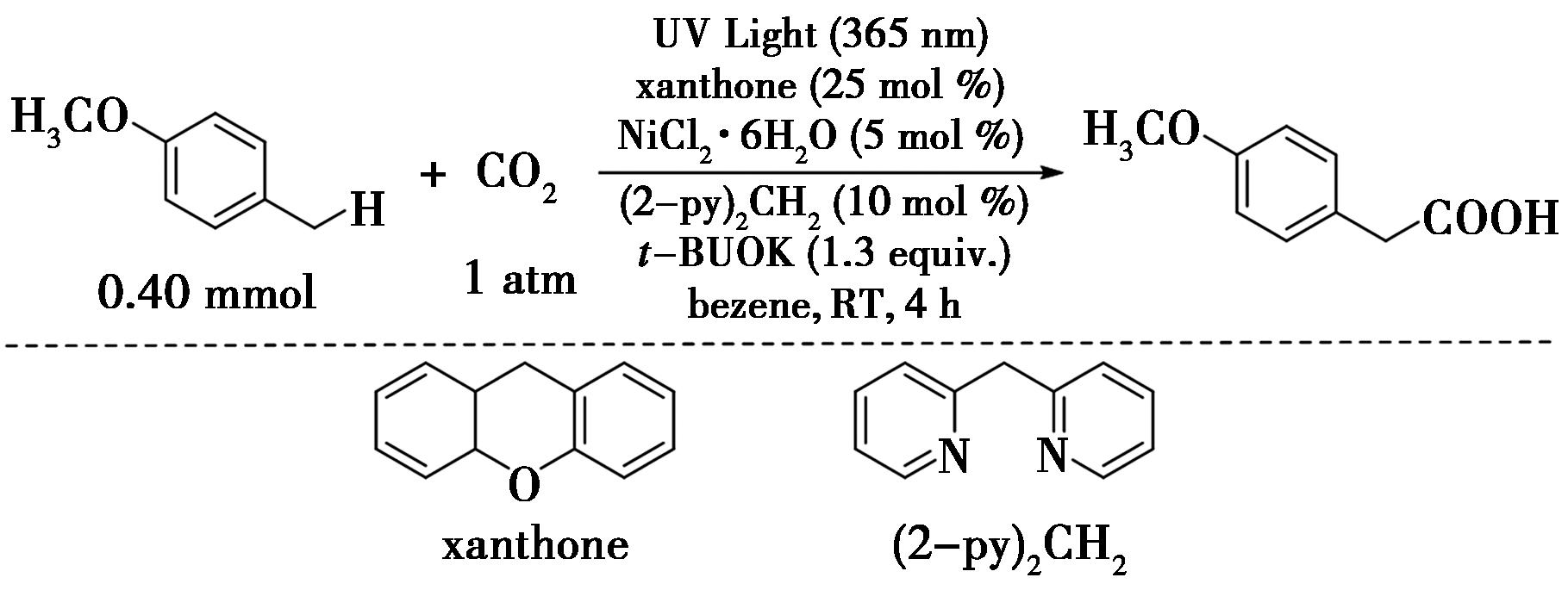
图19 苄位C—H键与二氧化碳的羧基化反应[27]
Fig.19 Carboxylation of the benzyl C—H bond with carbon dioxide[27]
2019年,Meng等[28]首次报道了一种通过光氧化还原与有机催化的策略(图20),在可见光的照射下实现了苄位C—H键的羧基化。在反应过程中,没有添加任何的电子受体、化学计量添加剂或者电子牺牲供体,只利用光氧化三异丙基硅乙基作为氢原子转移(HAT)的催化剂生成苄基自由基,随后苄基自由基接受2,3,4,6-四(9H-卡巴唑-9-基)-5-(1-苯乙基)苯甲腈电子后形成了苄基碳离子,最后苄基碳离子与二氧化碳通过质子化作用生成所需的目标产物羧酸。该反应具有产率较好、底物范围广等特点,可以应用于氟比洛芬、非诺洛芬等药物的合成。
图20 苄位C—H键与二氧化碳的羧基化反应[28]
Fig.20 Carboxylation of the benzyl C—H bond with carbon dioxide[28]
4 酰基化反应
2012年,Dirocco等[29]报道了一种通过N-杂环卡宾(NHC)/光氧化还原协同催化N-芳基四氢异喹啉的苄位C—H键的酰基化反应的研究(图21),实现了苄位C—H键的酰基化。在反应中,C—C键的形成是通过离子捕获具有Breslow中间体氧化所生成的亚胺离子进行的[30]。该反应成功实现了N-芳基四氢异喹啉的苄位C—H键的酰基化,这标志着在温和条件下对C—H键功能化领域的又一重要进展。利用中间体进行离子捕获的策略,不仅展示了高度的反应选择性,也为复杂有机分子的合成提供了新思路。
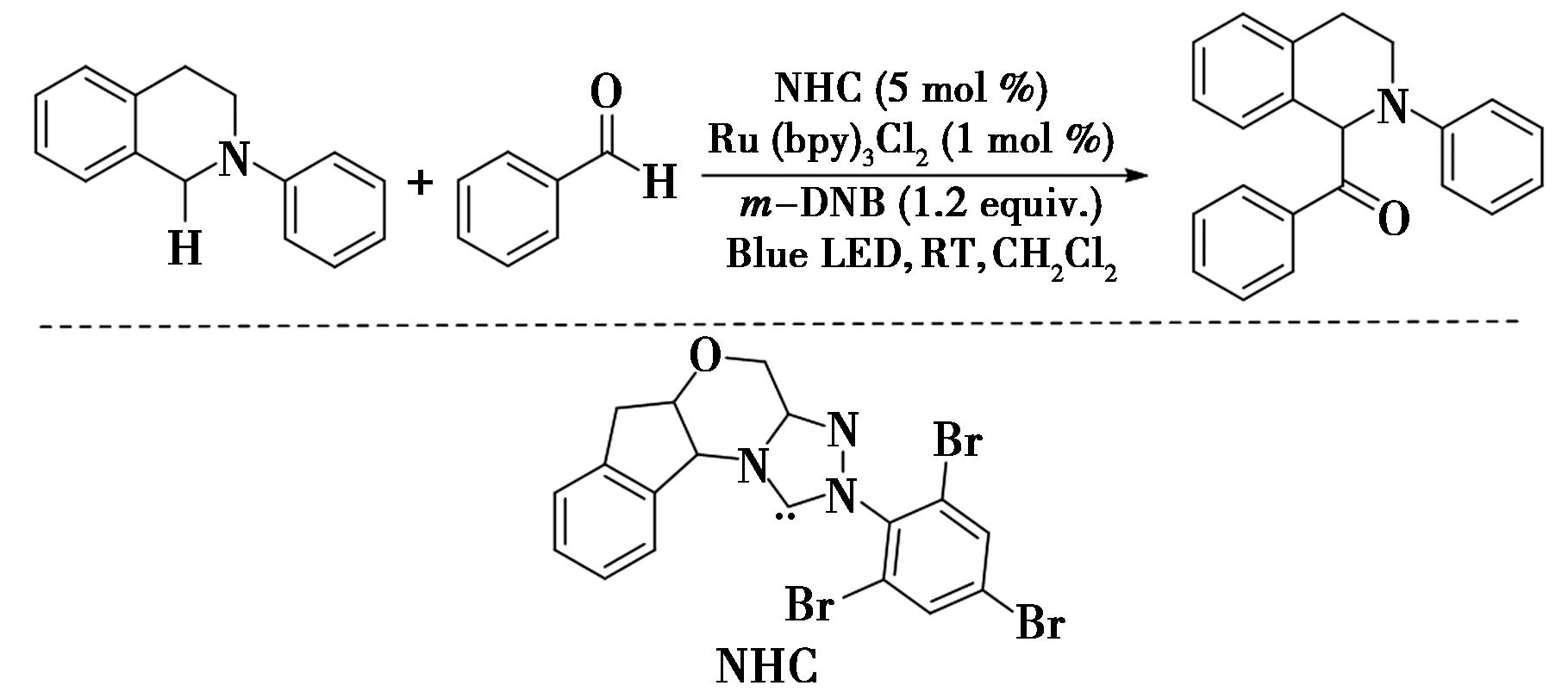
图21 N-芳基四氢异喹啉的苄位C—H键的酰基化反应[29]
Fig.21 Acylation of the benzylic C—H Bond of N-Aryltetrahydroisoquinolines[29]
2021年,Huan等[31]报道了通过光氧化还原和镍协同催化烷基芳烃与原位活化羧酸的酰基化反应(图22),实现了苄位C—H键的酰基化。在反应中,采用光催化过程生成的溴自由基进行苄位C—H键的裂解,随后激活烷基芳烃作为亲核偶联的伙伴,进而参与镍催化的不对称的酰基交叉偶联反应,得到相应的目标产物α-芳基酮。此反应具有条件温和、高对映选择性等特点,可以应用于医学相关分子的克量级合成和后期的修饰中。
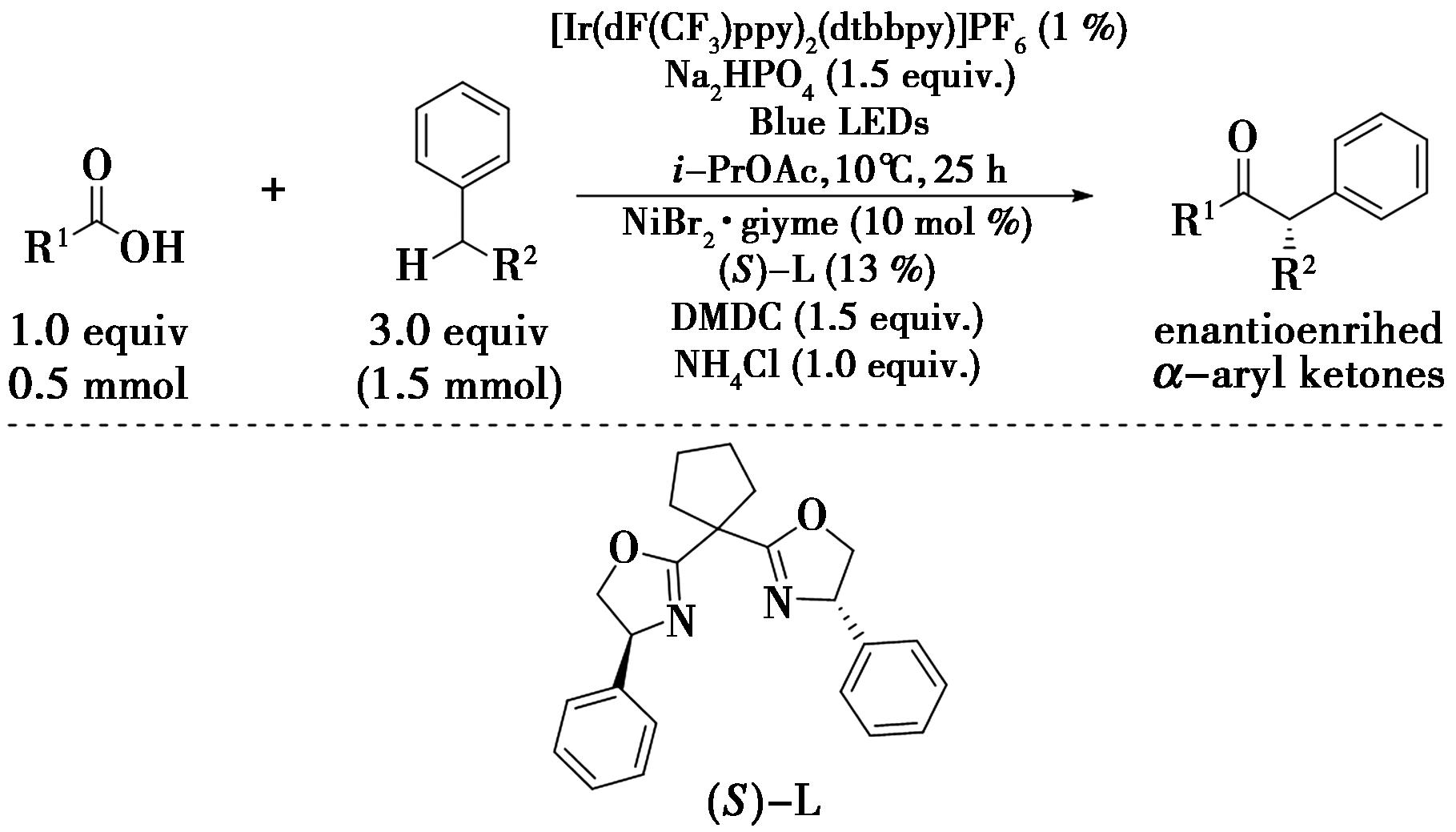
图22 光氧化还原和镍的协同催化的苄位C—H键的酰基化反应[31]
Fig.22 Photoredox- and nickel-catalyzed benzylic C—H acylation[31]
2020年,Kawasaki等[32]报道了一种关于苄位C—H键与醛的脱氢偶联反应(图23),实现了苄位C—H键的酰基化。在反应中,在铱和镍光催化剂的协同作用下,烷基苯与醛在乙酸乙酯的溶液中被可见光照射时,形成偶联的ɑ-芳基酮,并伴随有氢气的产生。该反应提供了一种直接合成ɑ-芳基酮的途径,是一种与药物相关且具有价值的结构基序。例如,在室温的条件下用蓝光照射含有1.0 mmol 4-甲氧基甲苯、0.20 mmol辛醛、0.004 mmol(2 mol%)Ir[dF(CF3)ppy]2(dtbbpy)PF6与0.01 mmol(5 mol%)NiBr2的乙酸乙酯溶液长达20 h,得到偶联的目标产物。
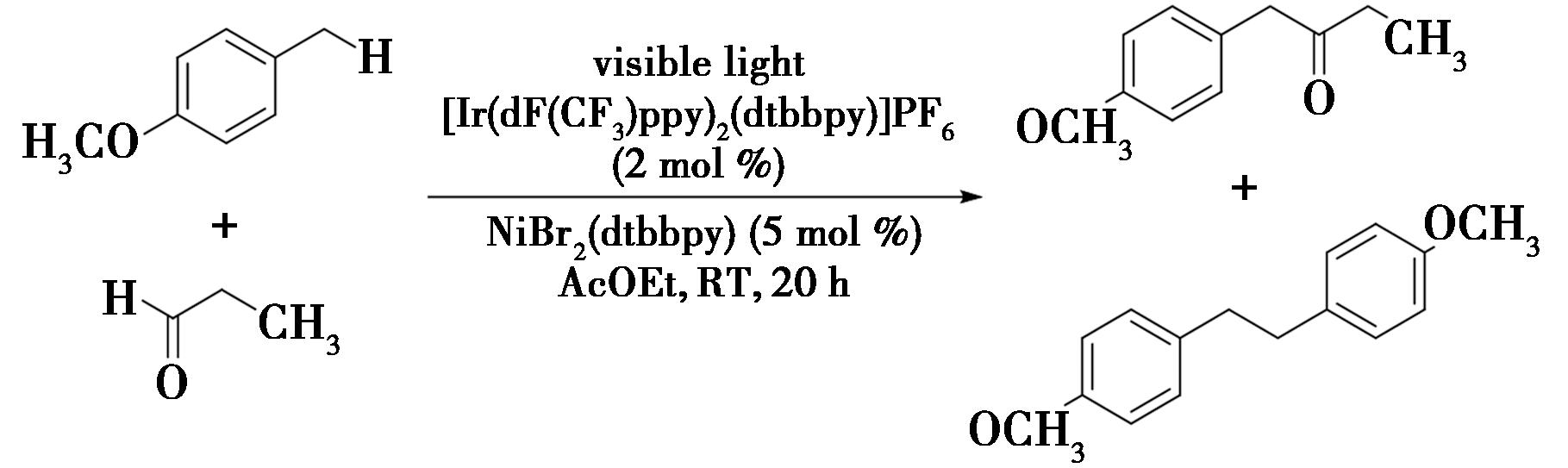
图23 苄位C—H键与醛的脱氢偶联反应[32]
Fig.23 Dehydrogenative coupling reaction of benzylic C—H bonds with aldehydes[32]
2021年,Meng等[33]报道了通过N-杂环卡宾(NHC)/光氧化还原协同催化的策略(图24),实现了苄位C—H键的酰基化。在反应中,首先芳烃的单电子转移氧化生成自由基阳离子,随后自由基阳离子通过脱质子化得到苄基自由基,接着通过单电子的转移还原生成酮基自由基,酮基自由基与苄基自由基进行交叉偶联,最后在N-杂环卡宾碎片化后生成目标产物苄基芳基酮。该反应具有条件温和、良好的官能团耐受性、良好的位点选择性等优点,适用于在高度功能化的天然产物衍生物上放置酰基。此外,采用N-杂环卡宾(NHC)与光氧化还原协同催化的策略为制备苄基芳基酮提供了选择。
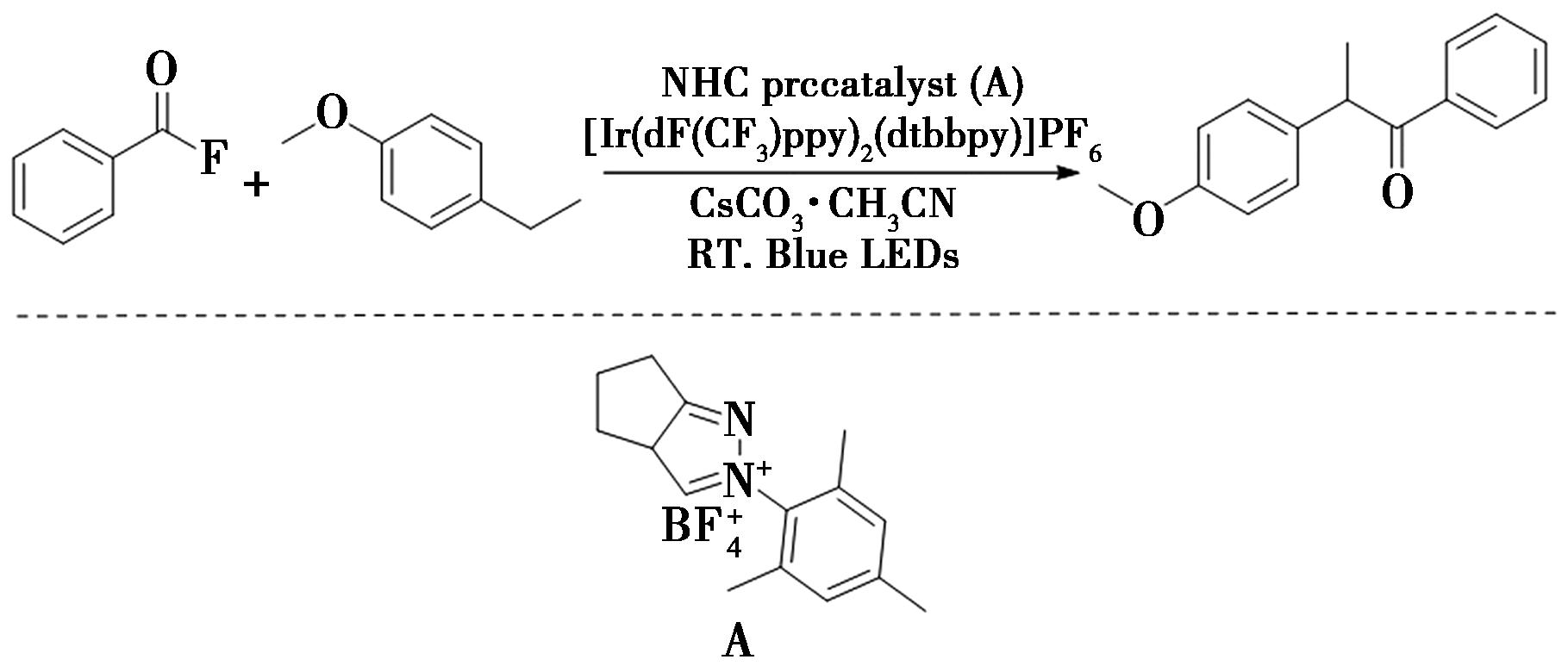
图24 苄位C—H键的酰基化反应[33]
Fig.24 Acylation of benzyl C—H bond[33]
5 磺酰基化反应
2018年,Wang等[34]报道了通过光氧化还原催化苄位C—H键的磺酰基化反应的研究(图25),实现了苄位C—H键的磺酰基化。在反应中,生成的苄基自由基与磺酰基自由基只作为中间体而存在。该反应具有条件温和、高度化学选择性、底物适用范围广等优点,其中底物包括烷基芳烃、炔基芳基甲烷、二芳基甲烷、芳基乙腈等。此外,反应生成的磺酰胺[35],具有独特的生物活性,能够广泛应用于药物化学、农业化学[36]等领域。例如,高价碘(Ⅲ)试剂与4-苯甲醚在室温的条件下,以1 mol% Ru(bpy)3(PF6)2作为甲腈中的光催化剂,用蓝光照射反应15 h,得到所需的磺酰基化产物。
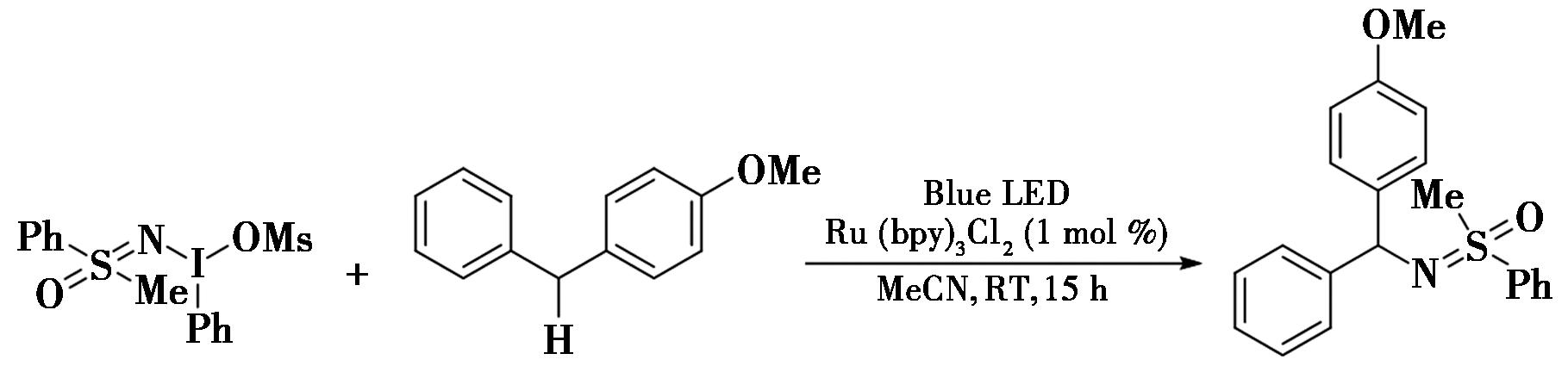
图25 光氧化还原催化苄位C—H键的磺酰基化反应[34]
Fig.25 Photoredox catalyzes the sulfonylation of C—H bond at benzyl site[34]
6 酯基化反应
2021年,Maeda等[37]报道了利用光氧化还原催化苄位C—H键的酯基化反应(图26),利用不同含苄基的底物与高价的碘试剂进行偶联,实现了苄位C—H键的酯基化。
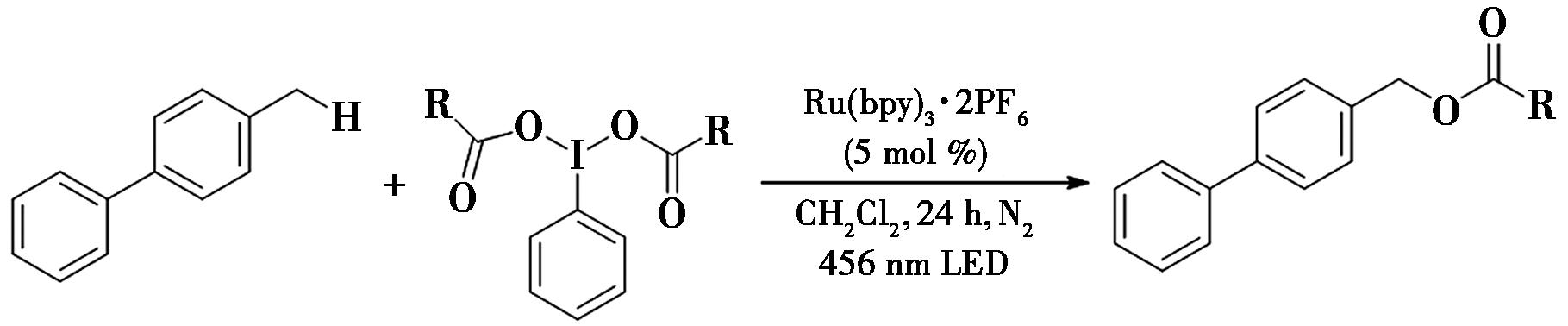
图26 光氧化还原催化苄位C—H键的酯基化反应[37]
Fig.26 Photoredox catalysis of benzyl C—H bond ester reaction[37]
2022年,Liu等[38]报道了在有氧氧化的条件下共轭聚光催化剂(CPPs)催化的苄位C—H键的酯基化反应的研究(图27),实现了苄位C—H键的酯基化。
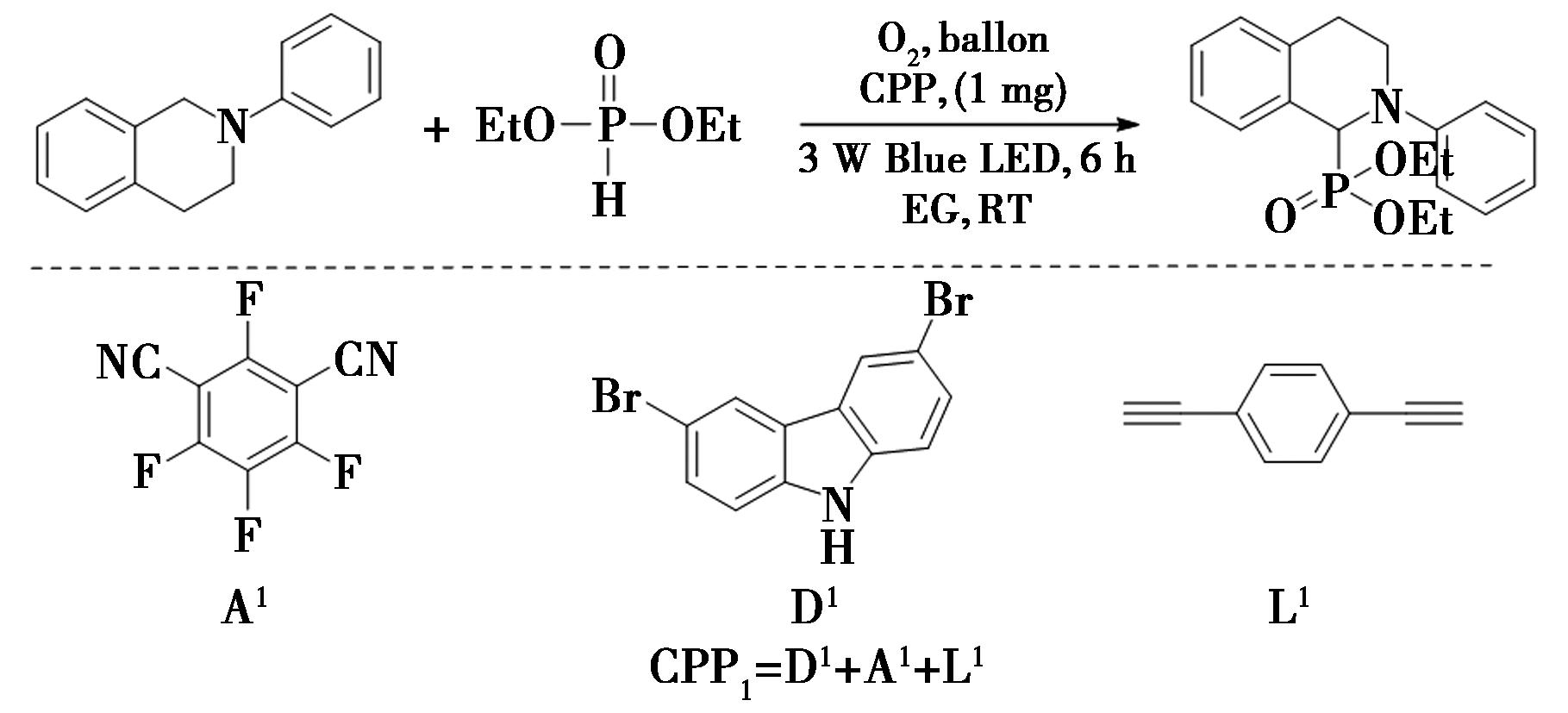
图27 光催化苄位C—H键的酯基化反应[38]
Fig.27 Photocatalytic benzylic C—H bond esterification[38]
2022年,Zhang等[39]报道了光氧化还原与铜双催化苄位C—H键的酯基化反应,通过Cu(Ⅱ)介导的自由基-极性交叉和光氧化还原介导的氢原子转移(HAT)结合的策略,实现了苄位C—H键的酯基化(图28)。动力学同位素效应实验表明了氢原子转移过程是苄位C—H键酯基化反应的速率限制步骤。该反应具有良好的官能团耐受性、条件温和、操作简单等优点。此外,将药物分子与该方法相结合,为新药物开发与功能酯的合成提供了一个有利的工具。例如,1.5 eq 1-乙基萘和苯甲酸在0.2 mol/L乙腈的溶剂中,以0.5 mol% [Ir{dF(CF3)ppy}2(dtbbpy)]PF6与10 mol% Cu(OAc)2为光催化剂,以及在10 mol% 2,9-二-甲基-1,10-苯和2 eq N-氟苯磺酰亚胺的存在下,在35 ℃的条件下采用蓝光在氮气环境氛围下照射16 h,得到所需的酯化产物。
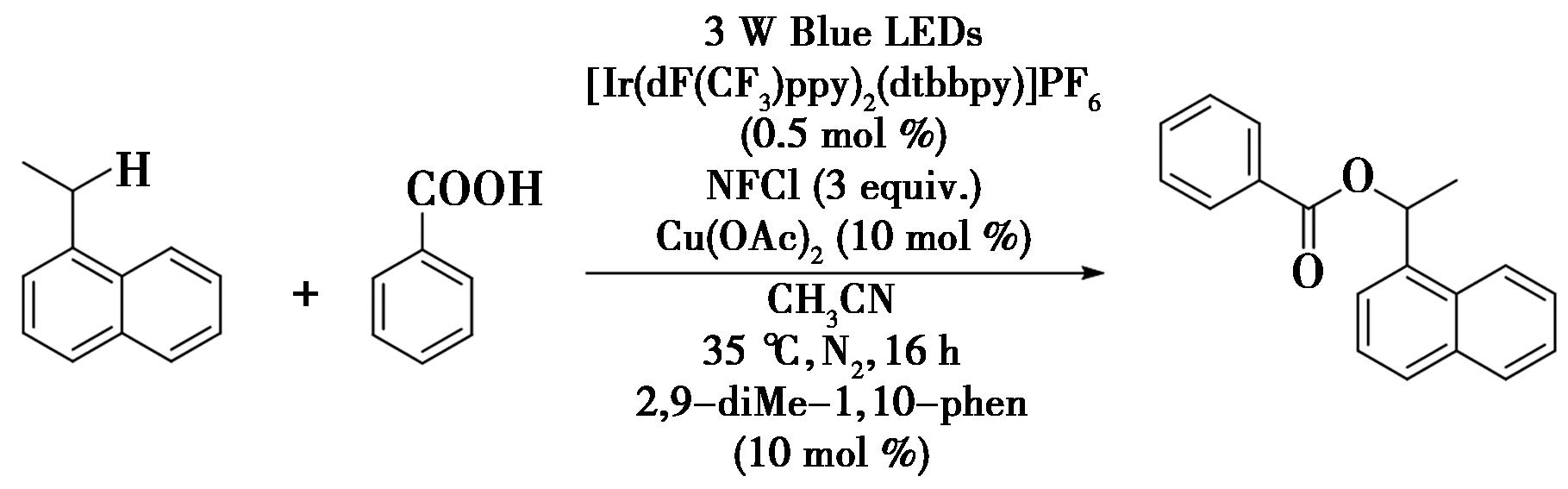
图28 光氧化还原/铜双催化的苄位C—H键的酯基化反应[39]
Fig.28 Photoredox/copper bicatalyzed ester reaction of benzyl C—H bond[39]
7 氰基化反应
2011年,Pan等[40]报道了一种有机染料玫瑰红(RB)与氧化石墨烯协同催化苄位C—H键的氰基化反应(图29),实现了苄位C—H键的氰基化。在反应中,以石墨烯氧化物为氧化剂,有效地避免了采用化学计量的过氧化物的化合物与金属催化剂作为末端氧化剂,提高了反应速率与产物收率。该反应具有条件温和、产率良好、原料廉价易得等优点,是第一个在可见光的照射下通过氧化石墨烯合成小分子有机化合物的例子。例如,0.1 mmol N-苯基四氢异喹啉与0.25 mmol TMSCN在1 mL甲腈中,以RB为光催化剂,以石墨烯氧化物为氧化剂,在室温下采用绿光照射进行反应,得到所需的氰基化产物。
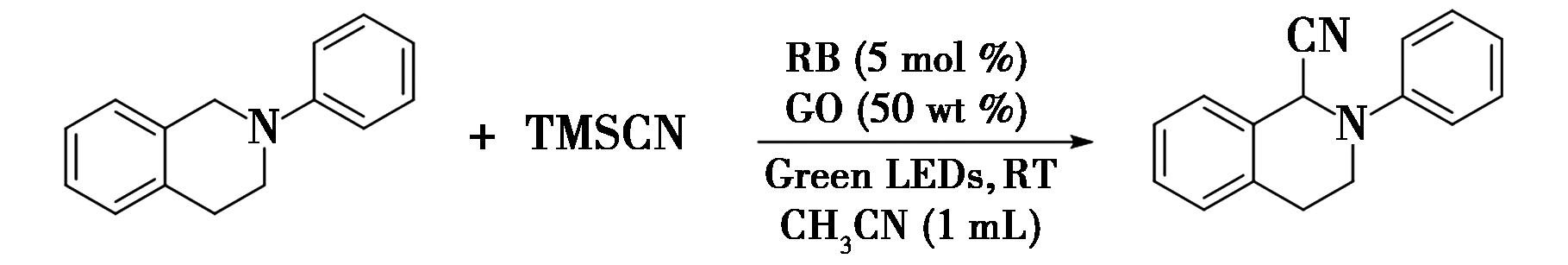
图29 有机染料与氧化石墨烯协同催化的苄位C—H键的氰基化反应[40]
Fig.29 Cyanation of benzylic C—H bonds catalyzed by organic dyes and graphene oxide[40]
8 异氰基化反应
2022年,Maeda等[41]报道了光诱导苄位C—H键异硫氰基化反应的研究(图30),实现了苄位C—H键的异氰基化。在反应中,首先苄位C—H键进行硫氰基化,随后通过一锅异硫氰基化法合成所需的异硫氰酸酯。在进行硫氰基化过程中,没有添加任何的路易斯酸和过渡金属。该课题通过调节反应温度来进行控制异硫氰酸酯进行异构化。例如,反应物甲苯与TMSNCS在二氯甲烷和1.5 eq选择氟的存在下,在65 ℃的条件下用蓝光照射3 h,得到硫氰酸酯的产物,再通过一锅异硫氰基化法,得到了目标产物异硫氰酸酯。
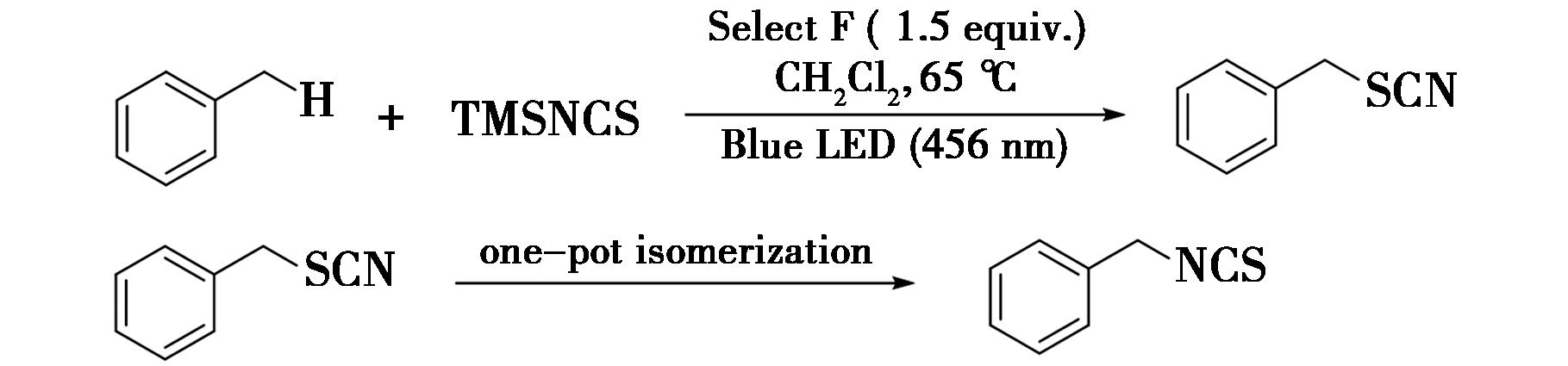
图30 光催化苄位C—H键的异硫氰基化反应[41]
Fig.30 Photocatalytic isothiocyanation of benzylic C—H bonds[41]
9 氟化反应
2017年,Xiang等[42]报道了通过利用吖啶基有机染料(Acr+-Mes)的还原能力完成苄位C—H键在可见光照射下进行的有效氟化反应的研究(图31),实现了苄位—H键的氟化。由于吖啶基有机染料(Acr+-Mes)的还原能力较弱,他们通过荧光开发其还原能力完成苄位C—H键的氟化反应。例如,将甲苯、5 mol%吖啶基有机染料以及选择氟加入到4 mL V(乙腈)∶V(水)=3∶1的溶剂中,采用蓝光在氩气的环境氛围下照射12 h,得到所需的氟化产物。
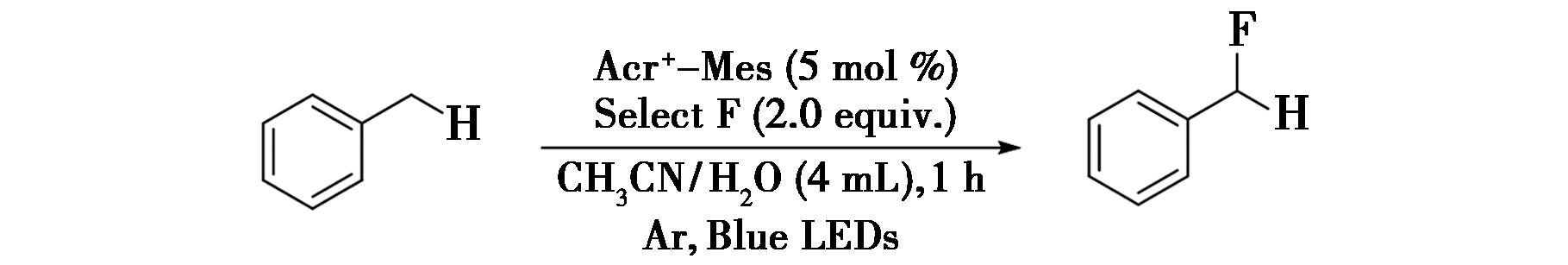
图31 苄位C—H键的氟化反应[42]
Fig.31 Fluorination of benzylic C—H bonds[42]
10 氯化反应
2020年,Xiang等[43]报道了光催化苄位C—H键的氯化反应(图32),在可见光照射下采用吖啶基有机染料(Acr+-Mes)与N-氯丁二酰亚胺相结合的策略,实现了苄位C—H键的氯化。该方案以吖啶基有机染料(Acr+-Mes)为光催化剂,以N-氯丁二酰亚胺(NCS)为氯源,安全且廉价。在反应中,利用吖啶基有机染料(Acr+-Mes)的还原能力,得到苄位C—H键的氢提取物,实现了氢原子转移(HAT)过程。该方案具有条件温和、产率良好、底物范围广泛等优点。例如,将甲苯、5 mol%吖啶基有机染料以及2.0 eq NCS加入到 3 mL二氯甲烷的溶剂中,在氩气氛围下用蓝光照射1 h,得到生成的氯化产物。
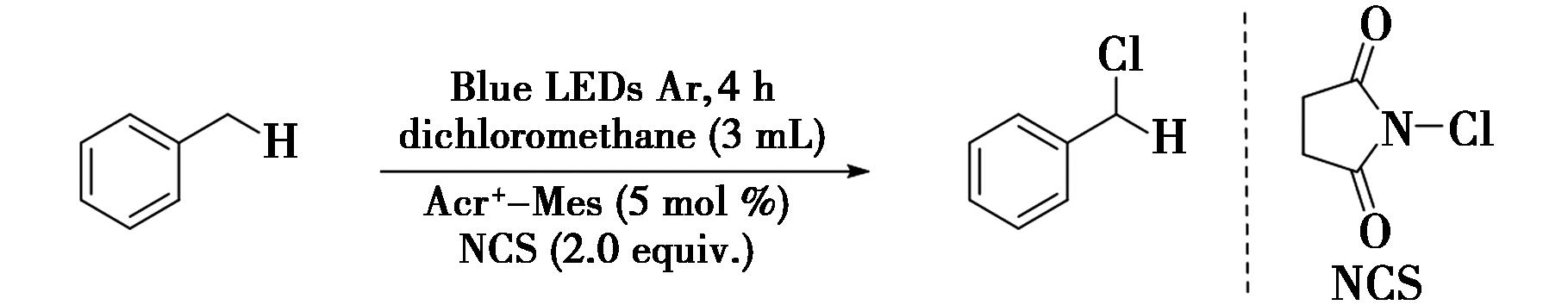
图32 光催化苄位C—H键的氯化反应[43]
Fig.32 Photocatalytic chlorination of benzylic C—H bonds[43]
11 总结与展望
综上所述,光催化为实现苄位C—H键的官能团化提供了诸多便利。苄位C—H键在光催化的条件下发生不同类型的官能化反应,反应条件温和、工艺环保,符合绿色化学的需求。目前,光催化苄位C—H键官能团化反应的底物结构复杂多样,未来将会有更广阔的发展空间,但仍需进行更多的研究来进一步拓展其在有天然产物与药物合成中的应用。
[1]WU J,LIU H,TAO H,et al.Metal-free direct alkylation of unfunctionalized allylic/benzylic C—H bonds via photoredox induced radical cation deprotonation[J].Chem.Sci.,2017,8(6):4 654-4 659.
[2]LIU H,ZHOU R,WU J,et al.One-pot photo-mediated giese reaction/friedel-crafts hydroxyalkylation/oxidative aromatization to access naphthalene derivatives from toluenes and enones[J].ACS Catal.,2018,8(7):6 224-6 229.
[3]YUE H,ZHU C,HUANG L,et al.Advances in allylic and benzylic C—H bond functionalization enabled by meallaphotoredox catalysis[J].Chem.Comm.,2022,58(2):171-184.
[4]PERRY I,MACMILLAN D,SARVER P,et al.Direct arylation of strong aliphatic C—H bonds[J].Nature,2018,56(7 716):70-75.
[5]ABUSALIM D,GUO S,COOK S,et al.Aqueous benzylic C—H trifluoromethylation for late-stage functionalization[J].J.Am.Chem.Soc.,2018,140(39):12 378-12 382.
[6]SUPRANOVICH V,DILMAN A,LEVIN V,et al.Radical addition to N-tosylimines via C—H activation induced by decatungstate photocatalyst[J].Org.Lett.,2019,21(11):4 271-4 274.
[7]袁晓亚,杨国平,於兵,等.光促进十聚钨酸盐催化的C—H键官能团化反应[J].有机化学,2020,40(11):3 620-3 632.
[8]孔瑶蕾,徐雯秀,叶飞霞,等.可见光诱导的无过渡金属催化交叉脱氢偶联反应研究进展[J].有机化学,2019,39(11):3 065-3 083.
[9]陈锋,陈浩,吴庆安,等.光催化有机物偶联/芳构化放氢反应研究进展[J].有机化学,2020,40(2):339-350.
[10]ISHIDA N,SON M,KAWASAKI T,et al.Photodriven dehydrogenative homocoupling of benzylic C—H bonds forming strained C—C bonds[J].Synlett,2021,32(20):2 067-2 070.
[11]KAWASAKI T,ISHIDA N,MURAKAMI M,et al.Dehydrogenative coupling of benzylic and aldehydic C—H bonds[J].J.Am.Chem.Soc.,2020,142(7):3 366-3 370.
[12]LI J,ZHANG D,LIU X,et al.Visible-light-driven photoredox-catalyzed C(sp3)—C(sp3) cross-coupling of N-arylamines[J].Org.Chem.Front.,2022,9(9):2 534-2 540.
[13]JULI F,CONSTANTIN T,LEONORI D,et al.Applications of halogen-atom transfer (XAT) for the generation of carbon radicals in synthetic photochemistry and photocatalysis[J].Chem.Rev.,2022,122(2):2 292-2 352.
F,CONSTANTIN T,LEONORI D,et al.Applications of halogen-atom transfer (XAT) for the generation of carbon radicals in synthetic photochemistry and photocatalysis[J].Chem.Rev.,2022,122(2):2 292-2 352.
[14]XUE H,GUO M,SHEN Y,et al.Photo-induced preparation of unnatural α-amino acis:Synthesis and characterization of novel leu5-enkephalin analogues[J].Org.Chem.Front.,2020,7(17):2 426-2 431.
[15]XU P,LIU G,CHEN P,et al.Enantioselective radical trifluoromethylation of benzylic C—H bonds via cooperative photoredox and copper catalysis[J].J.Am.Chem.Soc.,2022,144(30):13 468-13 474.
[16]CHENG X,LIU Y,LU Z,et al.Stereo- and enantioselective benzylic C—H alkenylation via photoredox/nickel dual catalysis[J].ACS Catal.,2021,11(17):11 059-11 065.
[17]CUTHBERTSON J,MACMILLAN D.The direct arylation of allylic sp3 C—H bonds via organic and photoredox catalysis[J].Nature,2015,519(7 541):74-77.
[18]YAZAKI R,OHSHIMA T.Recent strategic advances for the activation of benzylic C—H bonds for the formation of C—C bonds[J].Tetrahedron Lett.,2019,60(45):151 225.
[19]ISHIDA N,MURAKAMI M.Cooperation of a nickel-bipyridine complex with light for benzylic C—H arylation of toluene derivatives[J].Org.Chem.,2017,6(6):669-672.
[20]PERY I,PERY T,MACMILLAN D,et al.Direct arylation of strong aliphatic C—H bonds[J].Nature,2018,560(7 716):70-75.
[21]DEWANJI A,KRACH P,RUEPING M,et al.The dual role of benzophenone in visible-light/nickel photoredox catalyzed C—H arylations:Hydrogen atom transfer and energy transfer[J].Angew.Chem.Int.Ed.,2019,58(11):3 566-3 570.
[22]ANDREW R,SPENCE A,THOMAS J,et al.Transition metal-free cross-dehydrogenative arylation of unactivated benzylic C—H bonds[J].Chem.Comm.,2020,56(92):14 479-14 482.
[23]KIM W,KOO J,LEE H,et al.Benzylic C(sp3)—C(sp2) cross-coupling of indoles enabled by oxidative radical generation and nickel catalysis[J].Chem.Sci.,2021,12(11):4 119-4 125.
[24]WANG Q,SUN Z,DENG G,et al.Stoichiometric couplings of methylarenes through visible-light-induced broomo radical formation from aryl halides[J].Green Chem.,2022,24(8):3 293-3 299.
[25]LEE B,DEGLOPPER K,YOON T,et al.Site-selective alkoxylation of benzylic C—H bonds via photoredox catalysis[J].Angew.Chem.Int.Ed.,2019,59(1):197-202.
[26]MASUDA Y,ISHIDA N,MURAKAMI M,et al.Light-driven carboxylation of o-alkylphenyl ketones with CO2[J].J.Am.Chem.Soc.,2015,137(44):14 063-14 066.
[27]ISHIDA N,MASUDA Y,YAMAZAKI K,et al.Carboxylation of benzylic and aliphatic C—H Bonds with CO2 induced by light/ketone/nickel[J].J.Am.Chem.Soc.,2019,141(50):19 611-19 615.
[28]MENG Q,SCHIRMER T,BERGER A,et al.Photocarboxylation of benzylic C—H bonds[J].J.Am.Chem.Soc.,2019,141(29):11 393-11 397.
[29]DIROCCO D,ROVIS T.Catalytic asymmetric α-acylation of tertiary amines mediated by a dual catalysis mode:N-Heterocyclic carbene and photoredox catalysis[J].J.Am.Chem.Soc.,2012,134(19):8 094-8 097.
[30]刘薇,曾建国,程辟,等.可见光促进的叔胺C—H官能团化反应[J].有机化学,2017,37(1):1-19.
[31]HUAN L,SHU X,HUO H,et al.Asymmetric benzylic C(sp3)—H acylation via dual nickel and photoredox catalysis[J].Nat.Commun.,2021,12(1):3 536.
[32]KAWASAKI T,ISHIDA N,MURAKAMI M,et al.Dehydrogenative coupling of benzylic and aldehydic C—H bonds[J].J.Am.Chem.Soc.,2020,142(7):3 366-3 370.
[33]MENG Q,LEZIUS L,STUDER A,et al.Benzylic C—H acylation by cooperative NHC and photoredox catalysis[J].Nat.Commu.,2021,12(1):2 068.
[34]WANG H,ZHANG D,BOLM C,et al.Sulfoximidations of benzylic C—H bonds by photocatalysis[J].Angew.Chem.Int.Ed.,2018,57(20):5 863-5 866.
[35]BIZET V,HENDRIKSA C,BOLM C,et al.Sulfur imidations:Access to sulfimides and sulfoximines[J].Chem.Soc.Rev.,2015,44(11):3 378-3 390.
[36]FRINGS M,BOLM C,BLUM A,et al.Sulfoximines from a medicinal chemist′s perspective:Physicochemical and invitro parameters relevant for drug discovery[J].Eur.J.Med.Chem.,2017,126:225-245.
[37]MAEDA B,SAKAKIBARA Y,MURAKAMI K,et al.Photoredox-catalyzed benzylic esterification via radical-polar crossover[J].Org.Lett.,2021,23(13):5 113-5 117.
[38]LIU Y,CHEN X,YU B,et al.Polymerization-enhanced photocatalysis for the functionalization of C(sp3)—H bonds[J].ACS Catal.,2022,12(1):126-134.
[39]ZHANG Y,JIANG Y,WANG Y,et al.Photoredox/copper dual-catalyzed benzylic C—H esterification via radical-polar crossover[J].Org.Lett.,2022,24(14):2 679-2 683.
[40]PAN Y,DUBUISSON E,YANG Y,et al.Graphene oxide and rose bengal:Oxidative C—H functionalisation of tertiary amines using visible light[J].Green Chem.,2011,13(12):3 341-3 344.
[41]MAEDA B,AIHARA Y,SATO A,et al.Photoinduced synthesis of thiocyanates through hydrogen atom transfer and one-pot derivatization to lsothiocyanates[J].Org.Lett.,2022,24(40):7 366-7 371.
[42]XIANG M,XIN Z,CHEN B,et al.Exploring the reducing ability of organic dye (Acr+-Mes) for fluorination and oxidation of benzylic C(sp3)—H bonds under visible light irradiation[J].Org.Lett.,2017,19(11):3 009-3 012.
[43]XIANG M,ZHOU C,WU L,et al.Visible light-catalyzed benzylic C—H bond chlorination by a combination of organic dye (Acr+-Mes) and N-chlorosuccinimide[J].J.Org.Chem.,2020,85(14):9 080-9 087.