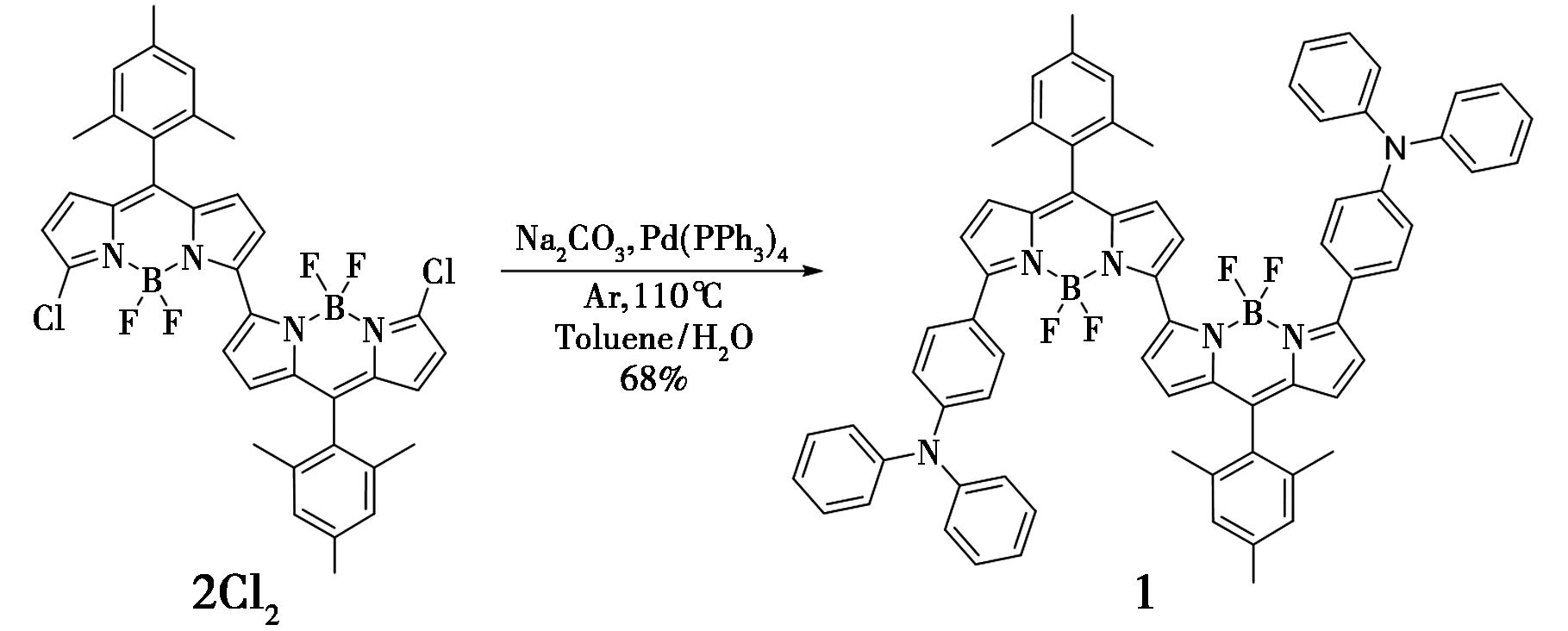
图1 化合物1的合成
Fig.1 Synthesis of compound 1
近年来,癌症发病率和死亡率逐年攀升[1],传统治疗手段如手术、放疗、化疗等存在治疗损伤大、严重的毒副作用以及易产生耐药性等问题[2],开发新型、精准有效的癌症治疗方法迫在眉睫[3,4]。光疗因其非侵入性、副作用小以及精准的时空可控性,显著提高治疗效果和患者生活水平,已成为一种肿瘤治疗领域的革新性治疗模式[5,6]。
光疗根据治疗原理可分为PDT和PTT。PDT通过光敏剂介导的光氧化催化反应生成活性氧(ROS),触发癌细胞氧化损伤、破坏肿瘤血管并激活免疫反应[7]。然而,乏氧肿瘤微环境限制了PDT疗效[8]。同时,PDT引发的氧气消耗进一步加剧了肿瘤内的缺氧状态。相比之下,PTT通过将光能转化为热能,且不需要氧气的参与,可以有针对性地在局部杀死癌细胞[9]。然而,治疗温度超过临界阈值时,不仅会触发热休克蛋白(HSPs)介导的细胞保护机制[10],同时热量向周边正常组织的扩散可能导致继发性热损伤。单纯的光动力疗法和光热疗法都有其局限性,但二者联合治疗策略通过时空协同效应取长补短,展现出独特优势[11]。PDT诱导的氧化应激可增强细胞对热的敏感性,从而降低PTT治疗温度[12],同时也可杀伤残留的耐热肿瘤细胞;而PTT的热效应可促进血液循环,增加肿瘤中的氧气含量,为PDT创造更有利的环境。因此,PDT与PTT的协同作用有望实现更高效、安全的肿瘤治疗[13]。
氟硼二吡咯(BODIPY)凭借其高摩尔消光系数、优异的光稳定性及极强的可拓展性,已成为当前研究的热点,在生物医疗领域主要应用有荧光探针[14,15]、光疗试剂[16]、荧光成像[17]等。然而,大多数用于肿瘤光疗的近红外BODIPY表现出单一的光疗效果,光热或者光动力[18]。在这项工作中,为了解决上述问题,本研究设计并合成了一种含有TPA基团取代的α-α连接的BODIPY二聚体。双BODIPY的分子内J型激子耦合不仅红移了分子吸收,还增强了系统间的跃迁过程,从而增强了PDT过程。此外,在BODIPY二聚体的两侧α位安装两个庞大的TPA基团,进一步扩展了近红外吸收,并可防止其在水性聚集时ROS淬灭。此外,富电子的TPA作为电子供体和缺电子的BODIPY核心作为电子受体的组合,形成了供体-受体(D-A)结构,可能增强自旋-轨道耦合并减小S1和T1态之间的能量差距,从而促进系统间的交叉。同时,可自由旋转的TPA基团的“转子”特性显著提高了其光热转换效率,因此该化合物具备PDT于PTT联合治疗的能力。其与表面活性剂F-127自组装成纳米颗粒后,在细胞模型中兼具高生物相容度与高4T1细胞消融能力,优于商业光疗试剂ICG,具有优秀的光疗潜力。
PX85ZH型准微量天平(奥豪斯仪器(上海)有限公司);LAB-500型液态金属浴(西安华太科思化学技术有限公司);RE-5298型旋转蒸发仪(上海亚荣生化仪器厂);VWP-2型循环水式多用真空泵(上海泰坦科技股份有限公司);2XZ-1型旋片式真空泵(济南奥鑫精机械设备有限公司);ZF-7型暗箱三用紫外线分析仪(上海嘉鹏科技有限公司);UVmini-1285型紫外可见分光光度计(岛津仪器(苏州)有限公司);DLSB-5/20型低温冷却液循环泵(郑州长城科工贸有限公司);SHZ-D(Ⅲ)型循环水式多用真空泵、Avance Ⅱ 400 MHz型核磁共振仪、Orbitrap Exploris120型质谱仪、Berthold LB941型微孔板式多功能酶标仪(德国Berthold公司)。
甲苯、三氯甲烷、吲哚菁绿(ICG)(分析纯或化学纯,安徽泽升科技股份有限公司)。
1.2.1 化合物1的制备
起始原料双氯代BODIPY二聚体(2Cl2)由文献[19]方法合成。之后经Suzuki偶连合成双TPA修饰的BODIPY二聚体(1)。

图1 化合物1的合成
Fig.1 Synthesis of compound 1
在史莱克管中,分别加入35 mg 2Cl2、116 mg 4-硼酸三苯胺、12 mg四(三苯基膦)钯、32 mg碳酸钠,将反应置于氩气氛围中,使用注射器依次加入5.0 mL甲苯、0.5 mL水,加热至 110 ℃反应 2 h。将反应液倒入50 mL二氯甲烷中,并用 50 mL水洗涤3次。使用无水硫酸钠干燥后,减压蒸馏除去有机溶剂,经硅胶柱层析得42.9 mg蓝黑色固体,产率为68%。
1HNMR(CDCl3,400 MHz),δ:7.86(d,4H,J=8.6 Hz);7.42(s,1H);7.33~7.23(m,10H);7.17(d,8H,J=8.0 Hz);7.09(t,4H,J=7.2 Hz);7.02(d,4H,J=8.6 Hz);6.96(s,4H);6.64(d,3H,J=2.4 Hz);6.52(d,2H,J=4.3 Hz);2.37(s,6H);2.19(s,12H)。13CNMR(CDCl3,101 MHz),δ:149.39,146.75,138.32,137.02,130.94,129.42,128.05,125.77,124.51,124.08,120.46,21.17,20.34。ESI-MS,m/z:1 127.473 1[M+Na]+。
1.2.2 光物理性能测试方法
紫外可见吸收光谱的测定:称量质量约为1.0 mg化合物1,用二氯甲烷配制成浓度为10-3 mol/L的母液。然后量取20 μL母液加入到4 mL离心管中。之后,加入所需测试的溶剂配制成浓度为10-5 mol/L测试样测试。在测试不同溶剂之前,用相应溶剂的空白样扫基线,然后再进行测试样品紫外可见吸收光谱。
荧光发射光谱的测定:荧光光谱测量在紫外可见光谱测试完成后马上进行,测试时适当调节样品浓度,或调整仪器参数,确保化合物不会因为荧光过强超出仪器测试上限,找到最佳的激发波长和发射波长测试。
化合物荧光量子产率计算公式(1)所示。
ΦX=ΦS(IX/IS)(AS/AX)(nX/nS)2
(1)
式中,下角标S和X分别代表标准物和各个测试化合物;Φ代表量子产率;A代表样吸收强度;I代表荧光光谱线下的积分面积;n代表溶剂的折射率。
1.2.3 ROS产率及类型测试方法
ROS产率测试使用二苯基苯并呋喃(DPBF)作为活性氧指示探针,使用市售光敏剂ICG作为活性氧产率的参比化合物测试化合物活性氧产率;ROS类型测试利用电子自旋共振波谱仪(EPR)采集化合物在捕获剂四甲基哌啶酮(TEMP)及5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)的溶液中产生的ROS(1O2和![]() 信号。
信号。
ROS产率测试过程如下,首先使用DCM溶解DPBF配制为浓度约为10 mmol/L的母液,称取约1 mg化合物配制为10-3 mol/L的母液,量取约20 μL DPBF母液与适量化合物母液使用3 mL甲苯稀释,将溶液在414 nm处吸光度控制在 1.0~1.2区间内,化合物1在808 nm处吸光度控制在0.15~0.25之间。随后使用808 nm激光器照射比色皿,选择合适光照时间监测DPBF在 415 nm处吸光度的降低过程,保存相关数据,使用Origin绘图软件处理相关数据,计算在 414 nm处吸光度为y轴进行线性拟合出的直线的斜率,使用以下公式(2)计算相关化合物活性氧产率。
ΦΔX=ΦΔS(SX/SS)(FS/FX)
(2)
式中,下角标X代表参与测试的样品,S代表了参比化合物ICG[20];Φ代表单线态氧产量;S是以照射时间为x轴,以对应照射时间后DPBF在414 nm处吸光度为y轴进行线性拟合出的直线的斜率,s-1;F代表吸收校正因子,计算公式为F=1-10-OD,OD代表化合物在808 nm下的吸光度。
ROS类型测试过程如下:制备500 μmol/L化合物1的甲苯溶液(预先配制TEMP浓度为 10 mmol/L或DMPO浓度为100 mmol/L),用毛细管取少量该溶液置于核磁管中固定在波谱仪谐振腔中测试,测试前使用氙灯(0.3 W/cm2)照射 15 min。设置无光照对照及无光敏剂组进行对照。
1.2.4 1 NPs的制备
称取一定质量的化合物1与F127溶解于氯仿中,配制浓度为1 mg/mL的化合物1母液与100 mg/mL的F127母液;移取1 mL的化合物1母液、1 mL F127母液与5 mL氯仿混合,将溶液置于超声波清洗仪中放置10 min,使其充分混匀;之后,将上述溶液转移至圆底烧瓶中,于室温旋转蒸发至充分蒸干有机溶剂,在瓶底形成薄膜;最后,向圆底烧瓶中加入5 mL PBS,将体系置于超声波清洗仪中处理5 min,使薄膜完全脱落并与PBS充分混合,制得化合物1浓度为0.2 mg/mL的1 NPs,将其于4 ℃冰箱储存以供进一步实验[21]。
1.2.5 细胞毒性实验方法
化合物1的细胞光毒性用CCK-8(Cell Counting Kit-8,BIOMIKY)检测试剂盒检测。首先将4T1细胞孵育于96孔板中,24 h后去除旧的培养基,在细胞中加入不同浓度(0~20 μmol/L)化合物1的含药培养基并继续培养24 h。对于光照组,除去含有化合物的旧培养基,用808 nm激光(0.5 W/cm2)持续辐照5 min,并继续培养24 h。24 h后,吸出每个孔中的旧培养基,添加100 μL含有10% CCK-8的新培养基,之后在37 ℃继续培养1.5 h后,用酶标仪测出每个孔在490 nm处的OD值。根据公式(3)计算细胞活性。
细胞活性(%)=
(加样品组的OD值/不加样品组的OD值)×100%
(3)
暗毒性的测试与光毒性类似,唯一的不同是细胞不会经过激光辐照。
表1汇总了化合物1在不同溶剂中的光谱数据。TPA基团的引入使得化合物1的紫外吸收波长表现出显著红移,其在甲苯中的最大吸收峰红移到796 nm,发射峰红移到876 nm(图2a、2b和表1),相较于BODIPY母体,其发射波长红移了376 nm。
表1 化合物1的基本光谱数据注
Tab.1 Photophysical properties of compound 1
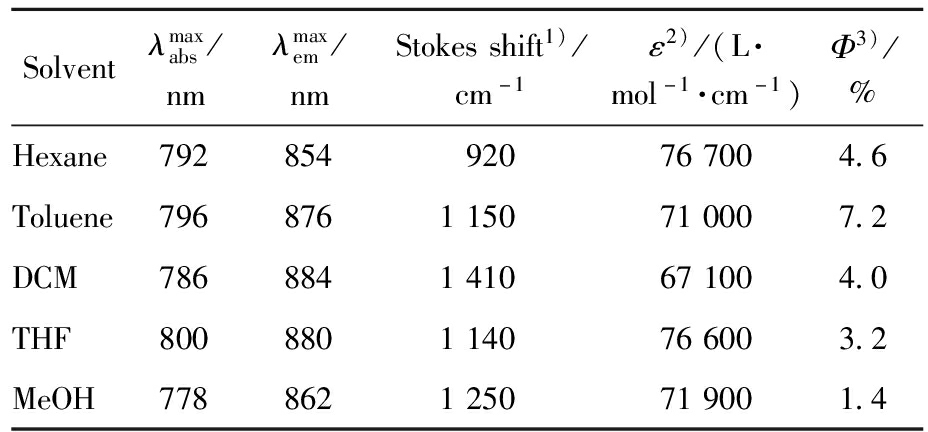
Solventλmaxabs/nmλmaxem/nmStokesshift1)/cm-1ε2)/(L·mol-1·cm-1)Φ3)/%Hexane792854920767004.6Toluene7968761150710007.2DCM7868841410671004.0THF8008801140766003.2MeOH7788621250719001.4
Note:1)The Stokes shift values were rounded to the nearest 10 cm-1;2)Corresponding to the strongest absorption maximum;3)Fluorescence quantum yields were measured by Hammatsu C11347 using integrating sphere,excited at 780 nm。
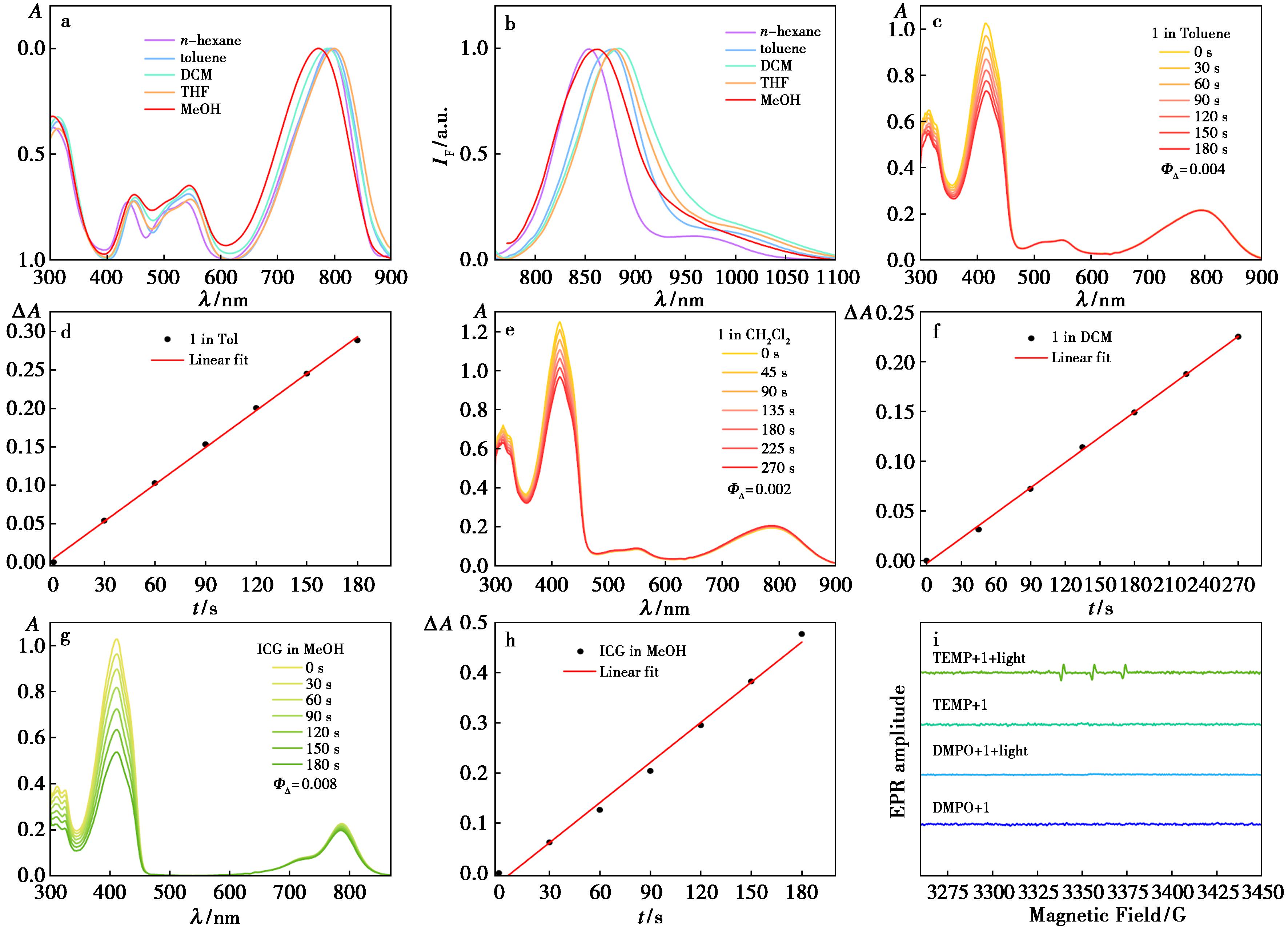
a.化合物1在不同溶液中的紫外吸收光谱;b.化合物1在不同溶液中的荧光发射光谱;c、e.功率密度为20 mW/cm2的 808 nm激光照射下DPBF在化合物1的甲苯、二氯甲烷溶液中的吸收光谱随照射时间的变化(记录间隔分别为30、45 s);d、f.在416 nm处的吸光度变化与照射时间的变化;g.功率密度为20 mW/cm2的808 nm激光照射下DPBF在ICG的甲醇溶液中的吸收光谱随照射时间的变化(记录间隔为30 s);h.在416 nm处的吸光度变化与照射时间的变化;i.光照后化合物1 在甲苯中的EPR光谱
图2 化合物1的光物理性能测试
Fig.2 Photophysical properties of compound 1
此外,由于双BODIPYs基元的紧密排列,增强了二聚体的分子内激子耦合,提高其系间窜跃的效率,从而提升其PDT性能。如图2c~2i所示,系统考察了化合物1的ROS生成能力及种类。在808 nm的照射下,化合物1溶液的DPBF吸收峰逐渐下降,当以ICG为参比时(图2c~2h),其在甲苯和二氯甲烷中的单线态氧产率分别为0.4%和0.2%。之后利用EPR对化合物1的ROS种类进行了特异性表征,如图2i所示,当使用TEMP作为捕获剂时,辐照后可以清晰的检测到 1O2的特征峰,而以DMPO作为捕获剂时,未检测到自由基信号,这说明化合物1主要经由Type Ⅱ型光敏化途径产生 1O2。
为了增强化合物1的生物相容度以便生物应用,采用薄膜水化法,利用两亲性泊洛沙姆(F127)引导其自组装形成纳米颗粒(1 NPs)[20]。如图3a所示,与氯仿中的化合物1相比,纳米粒在水中的吸收光谱保持了相似但稍宽的吸收谱,并能在避光条件下于水中储存20 d后仍保持>70%吸收强度(图3b),展现出优良的储存稳定性。
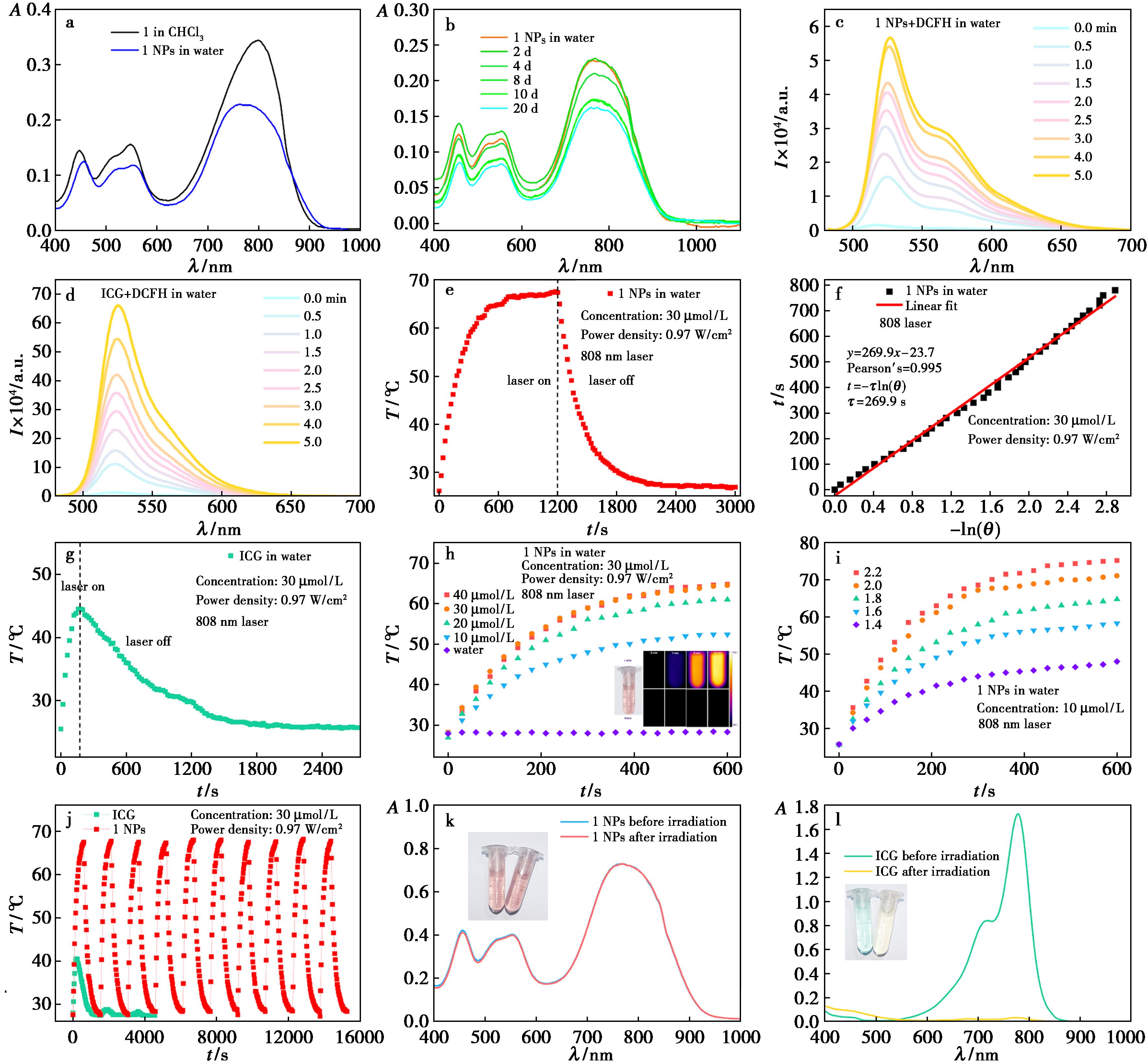
a.化合物1在氯仿及1 NPs在水溶液中的吸收光谱;b.1 NPs吸收光谱随储存时间的变化;c、d.在激光照射下(0.7 W/cm2、808 nm)DCFH (40 μmol/L)在1 NPs (30 μmol/L)和ICG(30 μmol/L)水溶液中的吸收光谱随照射时间的变化;e.1 NPs在激光照射下(0.97 W/cm2、808 nm、30 μmol/L)的光热曲线;f.1 NPs在激光照射下(0.97 W/cm2、808 nm、30 μmol/L)的时间常数;g.ICG在光照下(0.97 W/cm2、808 nm、30 μmol/L)的光热曲线;h.不同浓度的1 NPs在激光(0.97 W/cm2、808 nm)照射下温度变化;i.1 NPs(10 μmol/L)在不同功率的激光照射下的温度变化;j.1 NPs和ICG的光热稳定性;k、l.1 NPs和ICG光照前后的吸收光谱
图3 1 NPs的PDT/PTT性能测试
Fig.3 Photodynamic and photothermal properties of 1 NPs
之后,为评估1 NPs的PDT/PTT治疗潜力,对其光热性能进行了系统性研究。如图3c和3d所示,在相同的分子浓度(30 μmol/L)和辐照条件(808 nm、0.7 W/cm2)下,ICG显著提高了ROS指示剂2′,7′-二氯二氢荧光素(DCFH)的发射,与前面在有机相中测得的数据相符。当对其光热性能进行评估时,发现在808 nm光激发下,1 NPs展现出显著的光热转换效能(图3e~3l)。具体而言,化合物1的浓度为30 μmol/L的组装体水溶液在激光辐照4 min后迅速升温至 52.3 ℃,在照射15 min后最高温度达到61.0 ℃(ΔT=34.1℃,图3e)。与此相比,纯水对照组在同等辐照条件下温度仅升高了0.4 ℃。基于冷却曲线动力学分析(图3f),1 NPs的光热转换效率为60.6%,而商用ICG在相同条件下仅达到了28.5%的光热转换效率(图3g)。进一步研究揭示,当保持其他参数恒定时,通过梯度调节纳米粒的浓度(图3h)或激光功率密度(图3i),均可明显改变溶液的升温曲线,这表明该体系最大升温呈现明显的剂量依赖性,充分证实其光热性能具备优异的参数响应灵敏度与可控性。
有机小分子染料普遍存在光热稳定性不足的缺陷,不利于重复治疗且影响疗效,这使得材料的光热耐受性评估成为光热剂的关键性能指标[22]。值得注意的是,化合物浓度为30 μmol/L的1 NPs水溶液在6次间歇性光热循环测试(激光辐照 10 min/冷却15 min交替)后,展现出卓越的光热稳定性(图3j),其最高温度始终维持在约64 ℃,且循环前后吸收光谱未发生明显变化(图3k)。与之形成鲜明对比的是,ICG在单次循环后光热性能即出现显著性能衰减,最高温度从40.5 ℃急剧下降至28.8 ℃(图3l),溶液颜色发生明显改变并伴随着吸收峰强度的大幅下降(图3j)。综上所述,1 NPs不仅具有优异的光热转换效率,优秀的可调性,更展现出远超ICG的光热稳定性,具备成为新型光热剂的潜力。
在上述实验基础上,通过细胞实验进一步评估了化合物1的光疗疗效。在激光照射(808 nm、0.84 W/cm2)下,4T1细胞活力随着组装体中化合物1浓度的增加而显著降低(图4a),1 NPs的光毒性IC50值为10.5 μmol/L(图4c),较临床光敏剂吲哚菁绿(ICG,IC50=15.3 μmol/L)提升显著(图4d、4f)。暗毒性实验显示,当组装体中化合物1的浓度为100 μmol/L时,避光条件下孵育 48 h后仍保持了极高的细胞活性(图4b),而ICG在30 μmol/L浓度下细胞活性即出现明显下降(图4e),表明了1 NPs良好的生物安全性和广泛的光疗窗口。
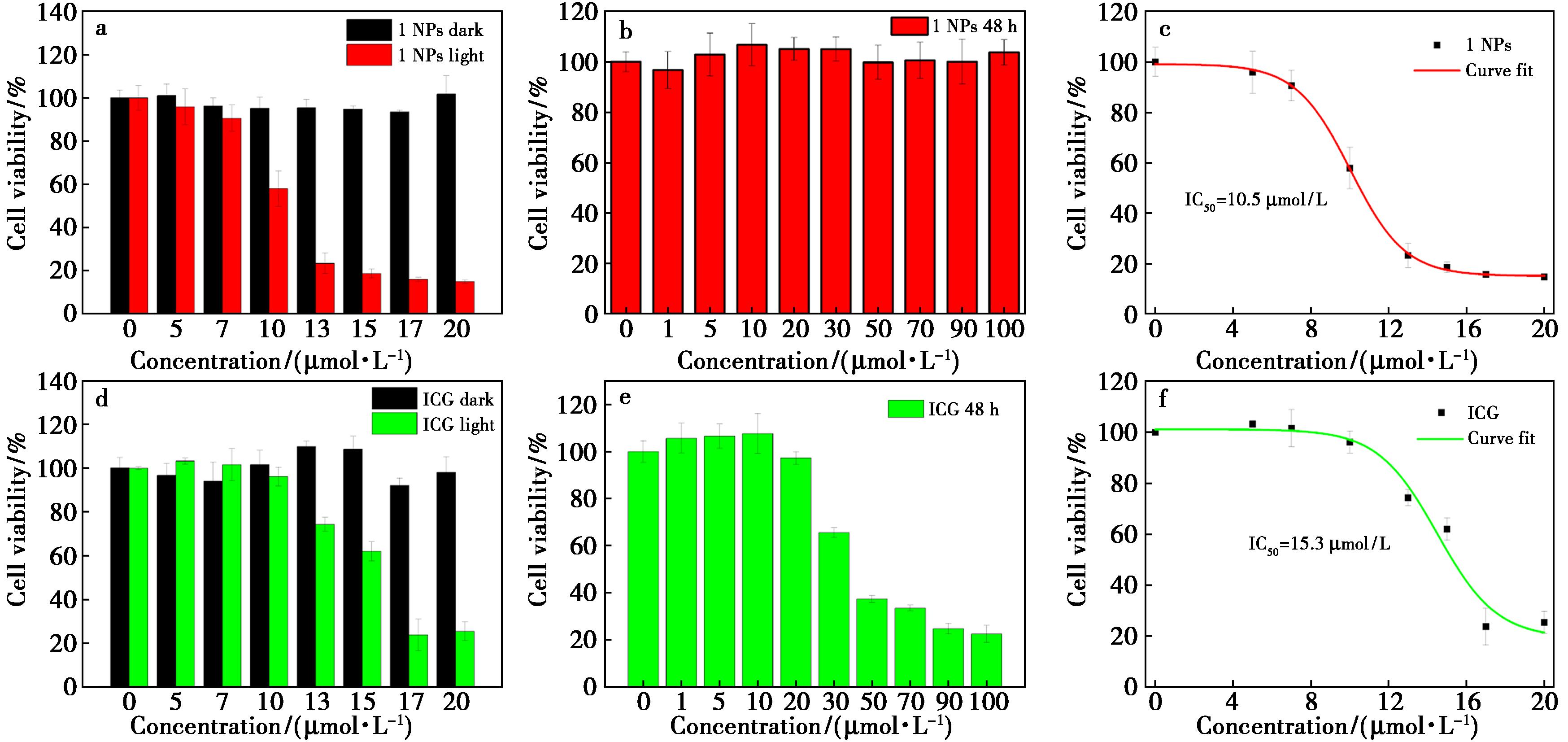
a、d.1 NPs和ICG在避光和激光(808 nm、0.84 W/cm2)照射10 min后的细胞活性变化;b、e.1 NPs和ICG孵育后避光48 h后的细胞毒性;c、f.1 NPs和ICG光照(808 nm、0.84 W/cm2、10 min)下的IC50(n=3)
图4 化合物1与ICG的细胞实验结果
Fig.4 Cell viability of compound 1 and ICG
如图5所示,使用ROS指示探针DCFH检测 1 NPs在细胞内的ROS生成能力,仅光照与仅含 1 NPs组均无明显荧光,只有当激光与1 NPs同时存在时才表现出显著的荧光增强,这说明 1 NPs在细胞内仍能有效产生ROS。

图5 4T1细胞孵育1 NPs后在光照(808 nm、0.84 W/cm2、10 min)后的ROS产生情况
Fig.5 CLSM images of ROS generation of 4T1 cells treated with 1 NPs under irradiation (808 nm,0.84 W/cm2,10 min)
上述测试初步验证了1 NPs的PDT与PTT治疗的能力,为了直观地评估1 NPs对4T1细胞的杀伤能力,使用吖啶橙(AO)和碘化丙啶(PI)染料进行了活-死细胞染色。结果如图6所示,只有当1 NPs与激光照射同时存在,细胞才表现出广泛的红色荧光,其余对照组细胞存活良好,表明细胞死亡主要是由于光照后1 NPs产生的 1O2和光热引发的细胞凋亡所致。
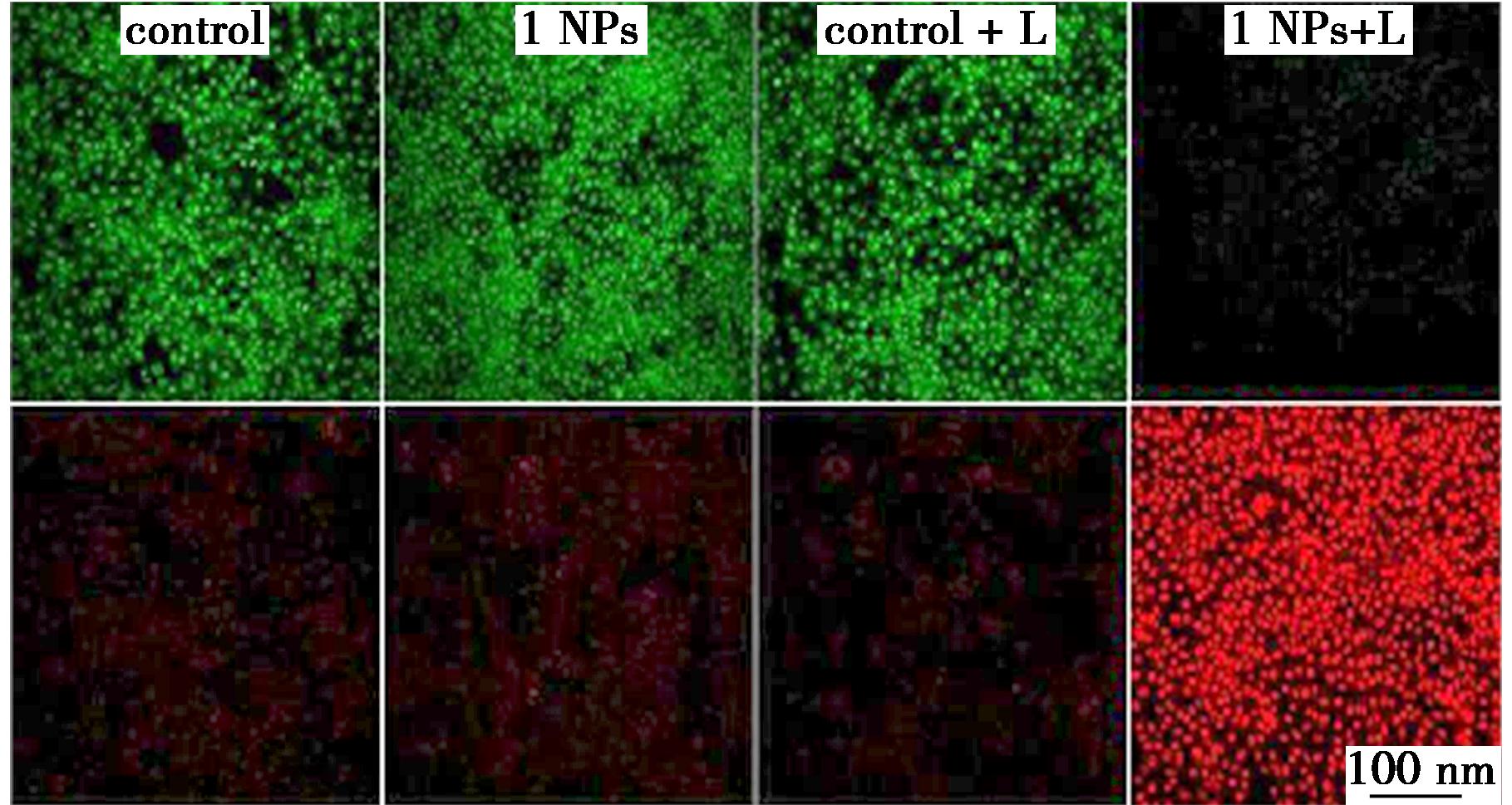
图6 经1 NPs处理后光照(808 nm、0.84 W/cm2、10 min)或避光条件下细胞染色图
Fig.6 Live/Dead Staining of 4T1 Cells treated with 1 NPs under laser irradiation (808 nm,0.84 W/cm2,10 min) and noirradiation
综上所述,本研究通过Suzuki反应合成了双TPA取代的BODIPY二聚体衍生物1,并通过NMR和HRMS确证了其结构。光谱分析表明,该化合物展现出显著的近红外吸收与发射特性(最大吸收/发射波长分别为800、884 nm),具有较强的组织穿透能力,并能产生单线态氧,适用于深层肿瘤诊疗。与试剂ICG相比,1 NPs还展现出优异的光热转换效率(高达60.6%)、光热稳定性及长期储存稳定性,同时表现出极低的暗毒性和强烈的光细胞毒性,为深层肿瘤联合光疗提供了新型候选光敏剂。
[1]Liu Q,Sun C,Dai R,Yan C,Zhang Y,Zhu W,Guo Z.Coord.Chem.Rev.,2024,503:215 652.
[2]Pham T C,Nguyen V,Choi Y,Lee S,Yoon J.Chem.Rev.,2021,121(21):13 454-13 619.
[3]Mitra A K,Agrahari V,Mandal A,Cholkar K,Natarajan C,Shah S,Joseph M,Trinh H M,Vaishya R,Yang X.J.Control.Release,2015,219:248-268.
[4]He G,Li Z,Zhang M,Li Z,Wang Y,Zhao F,Wang Y,Ma X.Bioorg.Chem.,2022,129:106 146.
[5]Zhao J,Zhang C,Wang W,Li C,Mu X,Hu K.Biomed.Pharmacother.,2022,155:113 714.
[6]Li K,Xu S,Xiong M,Huan S,Yuan L,Zhang X.Chem.Soc.Rev.,2021,50(21):11 766-11 784.
[7]Fowley C,Nomikou N,Mchale A P,Mccaughan B,Callan J F.Chem.Commun.,2013,49(79):8 934-8 936.
[8]Jia L,Hong Y,He X,Zhou Y,Ren L,Du H,Zhao B,Qin B,Yang Z,Gao D.Chin.Chem.Lett.,2025,36(2):109 957.
[9]Zou Y,Long S,Xiong T,Zhao X,Sun W,Du J,Fan J,Peng X.ACS Cent.Sci.,2021,7(2):327-334.
[10]Wang S,Xin J,Zhang L,Zhou Y,Yao C,Wang B,Wang J,Zhang Z.Int.J.Nanomedicine,2018,1:2 143-2 160.
[11]Li C M,Haratipour P,Lingeman R G,Perry J J P,Gu L,Hickey R J,Malkas L H.Cells,2021,10(11):2 908.
[12]Guo J,Dai J,Peng X,Wang Q,Wang S,Lou X,Xia F,Zhao Z,Tang B Z.ACS Nano,2021,15(12):20 042-20 055.
[13]Wang G,Lei M Y,Zhou Y L,Zou J M,Feng J F.Chem.Reagents,2022,44(4):504-513.
王刚,雷梦颖,周艳林,邹节明,奉建芳.化学试剂,2022,44(4):504-513.
[14]Zhu J B,Yan L Q,Wu X Z.Chem.Reagents,2022,44(5):633-642.
朱金彪,闫力强,吴雄志.化学试剂,2022,44(5):633-642.
[15]Lai S Z,Xie J Y,Li C Y,Liu Y,Xiao J.Chem.Reagents,2023,45(5):11-20.
赖申枝,谢俊英,李春艳,刘燕,肖洁.化学试剂,2023,45(5):11-20.
[16]Chang J,Yang T T,Wang S Y,Fu L L,Hu F,Wang X B,Hu M C.Chem.Reagents,2023,45(10):46-52.
常婧,杨田田,王淑云,付腊腊,胡芳,王小波,胡美纯.化学试剂,2023,45(10):46-52.
[17]Gonçalves R C,Belmonte-reche E,Pina J,Costa S M,Pinto S C,Gallo J,Costa S P,Raposo M M.Molecules,2022,27(22):8 065.
[18]Li Y,Jiang M,Yan M,Ye J,Li Y,Dehaen W,Yin S.Coord.Chem.Rev.2024,506:215 718-215 738.
[19]Kang Z,Wu Q,Guo X,Wang L,Ye Y,Yu C,Wang H,Hao E,Jiao L.Chem.Commun.,2021,57(77):9 886-9 889.
[20]James N,Chen Y,Joshi P,Ohulchanskyy T,Ethirajan M,Henary M,Strekowsk L,Pandey R.Theranostics,2013,3(9):692-702.
[21]Wang B,Zhou H,Chen L,Ding Y,Zhang X,Chen H,Liu H,Li P,Chen Y,Yin C,Fan Q.Angew.Chem.Int.Ed.,2024,63(39):e202 408 874.
[22]Kwon N,Jasinevicius G,Kassab G,Ding L,Bu J,Martinelli L,Ferreira V,Dhaliwal A,Chan H,Mo Y,Bagnato V,Kurachi C,Chen J,Zheng G,Buzza H.Angew.Chem.Int.Ed.,2023,62(28):e202 305 564.