中药是一类多成分、多靶点且治疗效果显著的天然药物。它的来源也很广泛,包括植物、动物和矿物质[1-3]。在临床应用中,大多数草本中药以及部分中药复方中多糖类成分具有较高的含量占比,因此探究中药多糖本身的药理活性是十分必要的。本文通过以下几个方面对中药多糖的药理活性、影响中药多糖药理活性的因素以及中药多糖的应用前景进行详细阐述,旨在提高中药的利用率,明确中药多糖的药理作用,加速中药多糖的成果转化。
1 中药多糖简述
中药多糖是一种高聚物,其中不同种类的单糖通过糖苷键结合形成复杂的高级结构,其分子量差异巨大[2]。在各种植物、动物和微生物来源的中药里多糖都普遍存在,并在生命活动中发挥出关键作用,已有研究报道,中药多糖与中药的药性分类密切相关[4]。
中药多糖有很多种,可根据来源不同划分为植物类、动物类以及菌类多糖[3]。其中,植物类中药多糖有纤维素、淀粉、黏液质、果聚糖、树胶等;微生物类的中药多糖主要是菌类多糖(灵芝多糖,香菇多糖)等[2];动物类的主要包括肝素、甲壳素等[3]。
根据其水溶性可分为水溶性多糖及水不溶性多糖,水不溶性多糖在中药材中主要起支持及保护组织的作用[5],例如纤维素和甲壳素,它们基本不具备药理活性。水溶性多糖则多为储能物质[6],例如黏液质、果胶等,中药多糖中发挥药理药效活性的多为此类多糖。
基于组成成分不同,中药多糖可划分为均一性、非均一性多糖。前一种由同一种单糖组成,例如由葡萄糖组分的纤维素、淀粉及甲壳素等,大多不具有生物活性;非均一性多糖中则包含了多种单糖成分,这种多糖常常表现出多方面的药理活性,如抗癌、调节血脂、抗炎和抗氧化等,因而目前中药多糖的开发多针对非均一性多糖。
2 中药多糖的主要药理活性
近年来,中药多糖因其较低的毒副作用,多样的药理活性以及广阔的应用领域[7],逐渐成为研究热点。但是中药多糖提取纯化工艺的不稳定以及药理活性研究的滞后,导致中药多糖的应用推广困难,因此,本文锚定中药多糖最新的药理活性研究,对其抗肿瘤、免疫调节、血糖代谢、肠道菌群、抗氧化等主要药理活性及作用机制进行了阐述,并汇总整理了目前临床常用的中药多糖制剂(表1)。为以后的中药多糖的药理研究提供基础,助力中药多糖的开发。
表1 中药多糖临床药品种类汇总
Tab.1 Summary of clinical drugs containing polysaccharides from traditional Chinese medicine
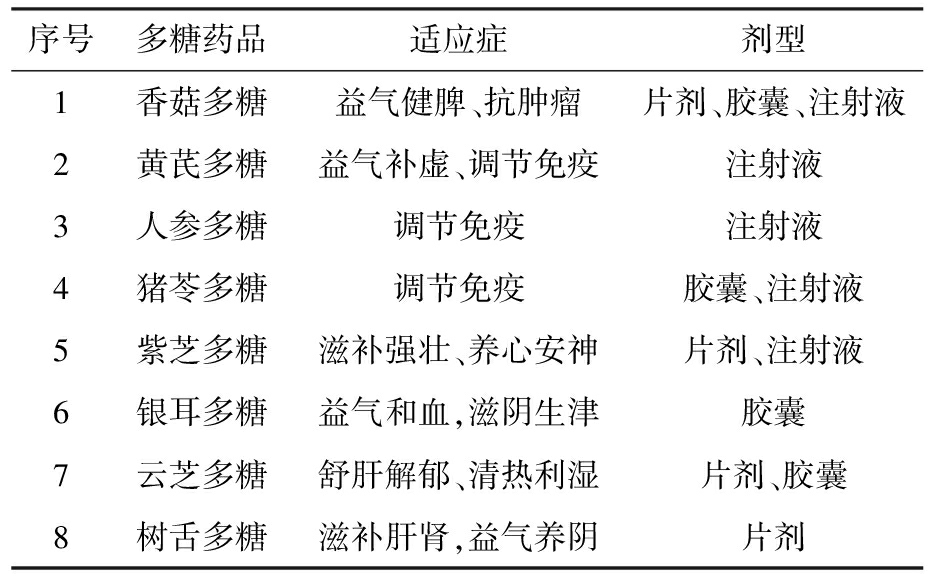
序号多糖药品适应症剂型1香菇多糖益气健脾、抗肿瘤片剂、胶囊、注射液2黄芪多糖益气补虚、调节免疫注射液3人参多糖调节免疫注射液4猪苓多糖调节免疫胶囊、注射液5紫芝多糖滋补强壮、养心安神片剂、注射液6银耳多糖益气和血,滋阴生津胶囊7云芝多糖舒肝解郁、清热利湿片剂、胶囊8树舌多糖滋补肝肾,益气养阴片剂
2.1 中药多糖的抗肿瘤活性
癌症是一种常见的恶性疾病,其对患者的生命健康会产生严重影响,在人类死亡原因调查中仅次于心血管类疾病,排在第二位[8]。目前针对癌症的主流治疗方案有:手术治疗、放射性及化学药物治疗、免疫治疗,而中药多糖因其较低的毒副作用以及独特的生物学活性被广泛应用于癌症患者的治疗及预后过程中。
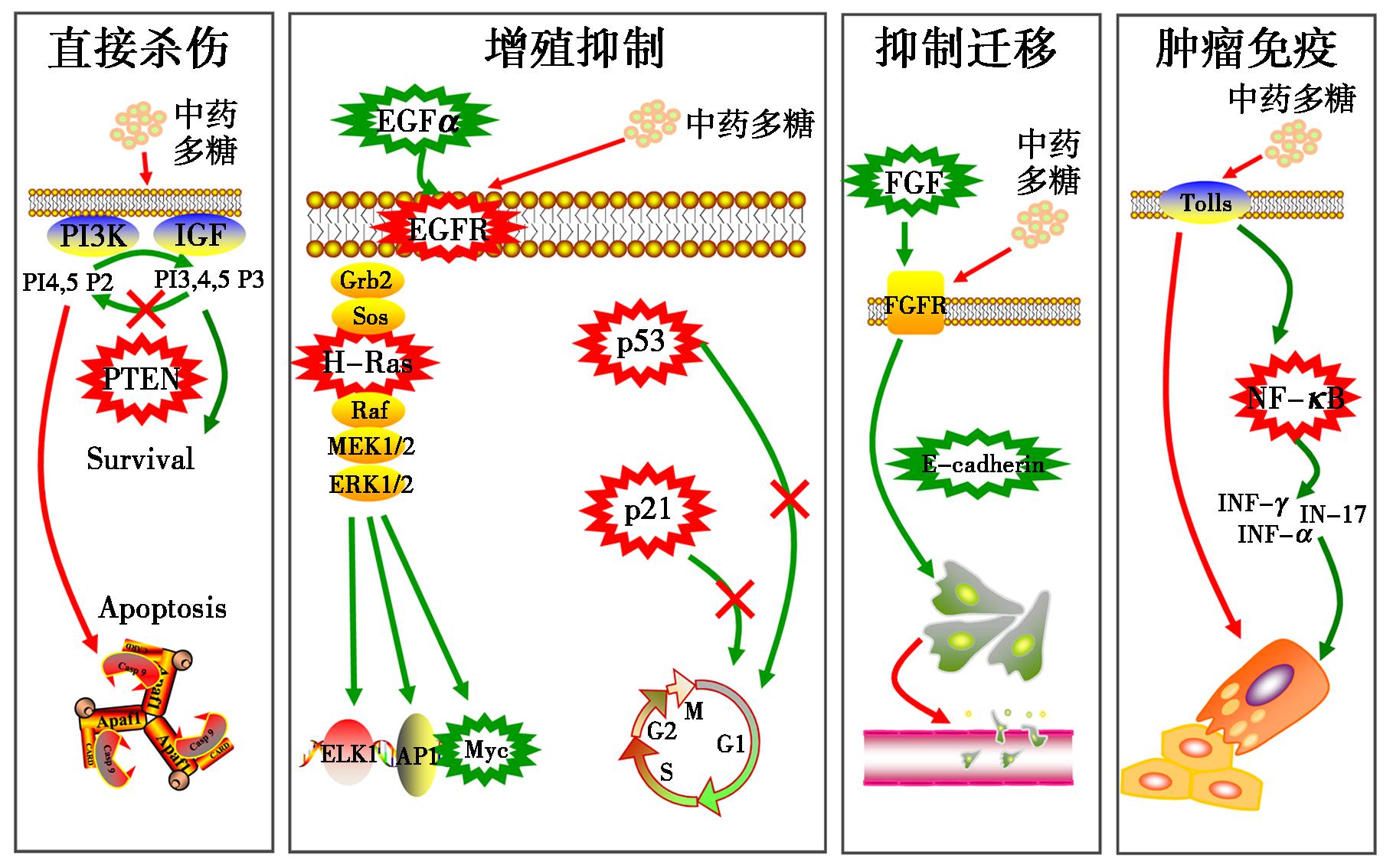
图1 中药多糖抗肿瘤作用机制
Fig.1 Mechanism of antitumor effect of polysaccharides in traditional Chinese medicine
目前中药多糖发挥抗肿瘤活性的作用机制大致可以分为4类:①对癌细胞的直接杀伤作用。研究表明,中药多糖能够通过凋亡、自噬、铁死亡等方式诱导肿瘤细胞死亡[9-11]。研究发现:螺旋藻多糖通过抑制IGF-IR信号通路和PI3K/Akt通路诱导胃癌AGS细胞发生凋亡[12]。菝葜多糖可靶向作用于ERα诱导乳腺癌细胞凋亡,同时也抑制了癌细胞的增殖[13]。灰树花多糖则可激活BAK-1基因,从而加速癌细胞凋亡[14]。②抑制肿瘤细胞生长增殖。中药多糖主要是从干扰细胞周期以及阻滞细胞有丝分裂这两方面来抑制肿瘤细胞的生长增殖。例如猴头菇多糖具有周期阻滞作用,能够将人结肠癌细胞的细胞周期阻滞在S期[15]。此外,灵芝多糖可以通过介导Erk信号通路发挥同样的作用[16]。③抑制肿瘤细胞的转移。中药多糖能够抑制肿瘤细胞的迁移及侵袭活力,干扰肿瘤微血管的形成,从而抑制了肿瘤的转移扩散。研究发现:部分改性后的壳聚糖通过抑制血管形成而具有抗肿瘤活性[17]。④通过激活机体免疫系统发挥抑癌作用。目前大多数中药多糖均是通过该方式发挥出良好的抗肿瘤活性。香菇多糖对T细胞、NK细胞有一定的激活作用,从而促进免疫细胞识别并清除肿瘤细胞,以此来实现抗癌效果。临床研究表明:注射用香菇多糖可以激活巨噬细胞,提高其吞噬能力,并且改善恶性胸腔积液,增强晚期恶性肿瘤患者的治疗效果[18]。此外,黄芪多糖注射液作为一种针对癌症相关疲劳患者的免疫调节剂,能够使接受免疫治疗晚期肺癌患者的中性粒细胞与淋巴细胞比率正常化[19]。此外,银耳孢糖胶囊具有升高白细胞、抗放射损伤和改善机体免疫功能的作用。多用于放疗、化疗或其他原因引起的白细胞减少症,亦可作为放射损伤的辅助治疗[20]。
2.2 中药多糖对免疫系统的调节作用
免疫系统在抗炎和抗肿瘤方面发挥着重要作用。中药多糖最主要的药理活性就是免疫调节作用,从而参与调控了众多机体生物学过程。
中药多糖对免疫系统的调控分为正向激活作用以及负向抑制作用。中药多糖中能够提高机体免疫力的主要有灵芝多糖、香菇多糖和黄芪多糖等,相关研究结果发现:这些多糖可激活多种免疫细胞从而提高其抗癌作用[16,18,19]。灵芝多糖可引发机体免疫反应,从而抑制癌细胞,同时还可以起到抗感染作用。据推测,这些中药多糖物质可特异性结合免疫细胞膜上的Toll样受体,进一步激活下游的NF-κB、Wnt及AMPK信号通路,促进多种细胞因子的表达,从而从不同路径和层次激活免疫系统,起到更强的免疫激活作用。紫芝多糖片作为辅助治疗药物,用于癌症治疗期间化疗/放疗引起的白细胞减少和造血损伤[21]。研究发现辽宁山楂多糖可激活一氧化氮合酶,促使其分泌出大量炎症因子,进而触发免疫级联放大反应[22]。另外,怀牛膝多糖能够使体内IL-2和TNF-α等因子的表达水平提高,从而改善机体免疫力[23]。
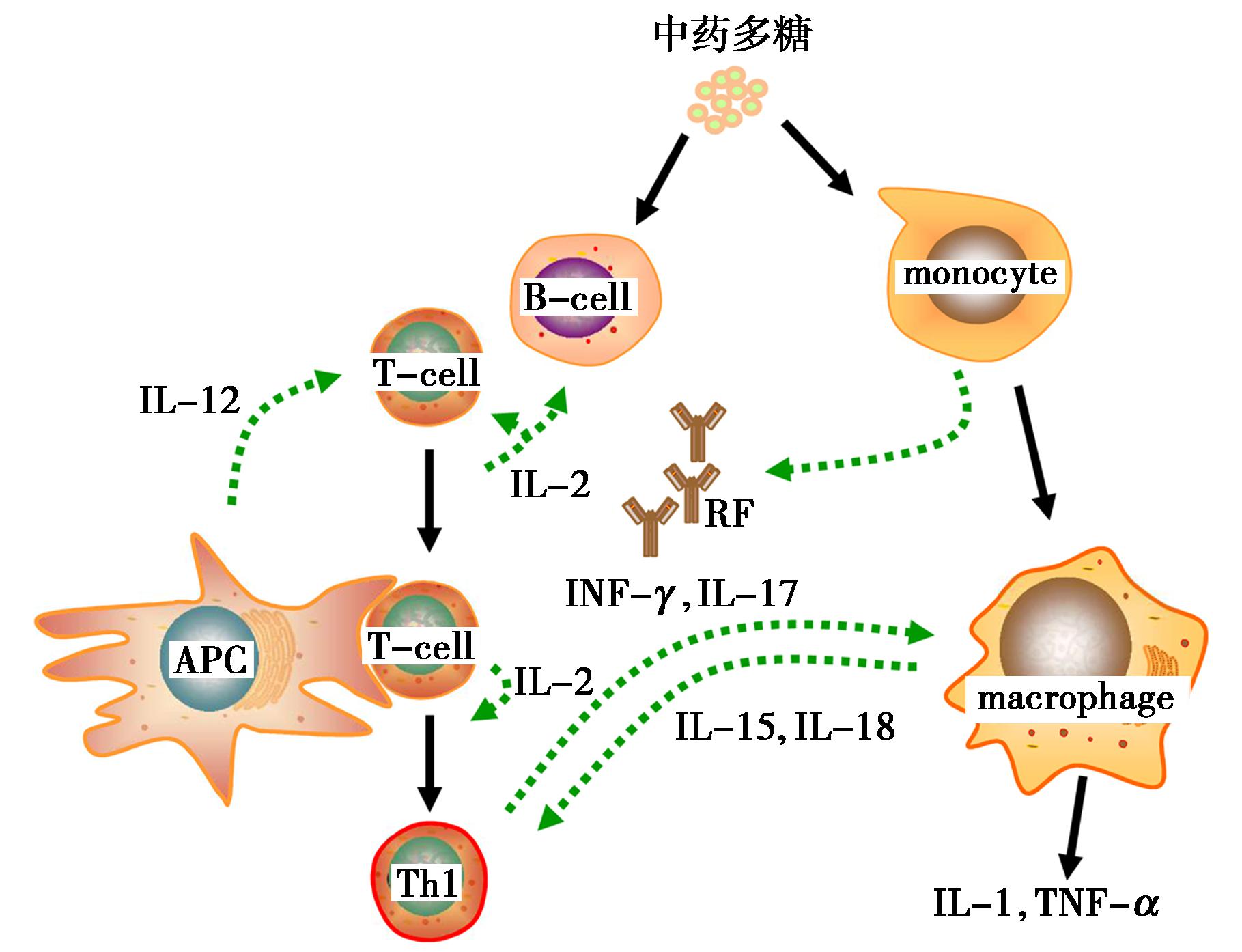
图2 中药多糖对多种免疫细胞的调节作用
Fig.2 Regulatory effect of polysaccharides in traditional Chinese medicine on various immune cells
此外,中药多糖对免疫系统亦具有抑制作用,防风多糖能够干扰RBL-2H3细胞的氧化磷酸化,从而抑制过度的自体免疫反应[24];白术多糖干预后,类风湿性关节炎小鼠的滑膜增生被明显抑制、炎症水平也有所下降,抑制了机体免疫的亢进[25]。
2.3 中药多糖对糖脂代谢紊乱的影响
研究发现,中药多糖对糖脂代谢异常相关疾病有良好的干预效果,不会出现明显的并发症。茯苓和灵芝多糖广泛应用于糖尿病、高脂血症方面的治疗[26,27]。有学者发现:苍术多糖在治疗基础代谢类疾病时,可通过保护胰岛β细胞,刺激其分泌出胰岛素,而促进血糖代谢,缓解相关症状[28]。黄刺多糖在治疗Ⅰ型糖尿病方面具有开发为临床药物的潜力,口服黄刺多糖可增加血浆中胰岛素,对糖脂代谢紊乱模型大鼠有一定调节作用,同时还可以抑制血管炎症[29]。五味子多糖、枸杞多糖对Ⅱ型糖尿病模型大鼠具有显著的降糖作用[30,31]。中药多糖除了显著的血糖调节作用,还具有细胞毒性低,安全性高,不会导致明显的并发症等诸多优点。
2.4 中药多糖对肠道菌群的影响
中药多糖的给药方式多为口服给药[32],因此中药多糖进入体内首先作用于肠道,吸收后对其他器官组织起作用,由此也反映出肠道是多糖起作用的首要靶点。研究表明,中药多糖主要通过作用于肠道菌群从而对各种肠道慢性疾病发挥了突出的疗效。
多糖本身就是一种能量物质,被肠道菌群吸收后可改善其结构,从而间接的实现机体调控效果。乳酸杆菌在抑制病原黏附,提高机体免疫力方面都有良好的效果[33],相关研究发现,嗜酸乳杆菌可对免疫细胞起到刺激作用,促使其释放出多种抗炎因子而发挥免疫保护作用,双歧杆菌也表现出类似的功能[33-37]。罗望子多糖在肠道中被降解后,所得产物对致病肠杆菌有抑制作用,降低了其增殖水平,促进有益菌种(乳杆菌属、副杆菌属)的生长,而乳杆菌可提高机体抗炎能力,同时还可以对胃肠道起到保护作用[34]。西洋参多糖可提高乳酸杆菌的丰度,同时改善大鼠肠道结构,缓解药物刺激引发的腹泻疾病,同时改善肠道功能,该研究为天然多糖抑制副反应的作用提供证据[35]。此外,虎杖多糖可降低类杆菌的丰度,对小鼠进行干预后,其血清中乙酸、丙酸相关物质的水平明显提高,且治疗效果与双歧杆菌丰度呈正相关[36]。一些学者开展的实验研究发现,枸杞多糖给药后,乳酸杆菌丰度增加,小鼠的胸腺和脾脏指数明显提高,同时血清中IL-6水平有所增加,由此可推断出枸杞多糖可能通过增加乳酸菌属丰度而发挥免疫调节作用[37]。
2.5 抗氧化作用
体内自由基水平过高会产生强烈氧化应激反应而导致细胞损伤、衰老和免疫异常,与多种疾病进程息息相关。自由基在正常水平时,可调节细胞生长,并发挥抗炎作用,不过其过量后也会引发明显的危害,如导致癌症、动脉硬化和心血管相关疾病[38]。低水平的活性氧自由基对多种生理过程可起到促进作用,相关研究发现:在细胞分化及增殖过程中,活性氧都起到调节作用,而活性氧浓度过高会导致机体的氧化还原稳态被破坏,从而引发氧化损伤[39]。天然的中药多糖有很显著的抗氧化作用,在清除自由基方面效果很显著。研究发现:中药多糖可提高SOD、CAT和GSH酶活性,而这些酶有良好的自由基清除作用,例如巴戟天和当归多糖可激活SOD、CAT的酶活性,降低细胞内丙二醛及氧自由基的含量,抑制脂质过氧化,从而缓解机体的氧化应激[40,41]。此外,黄芪多糖可抑制NF-κB通路,从而抑制氧自由基的生成[9]。冬虫夏草多糖可通过Erk/Akt通路对炎症起到抑制作用,同时还降低了活性氧的生成量[10]。
2.6 其他活性
研究发现,很多中药多糖都表现出一定止咳作用,如黄精多糖、五味子多糖[42,43]。在烟草烟雾诱导咳嗽模型豚鼠中,口服五味子多糖,具有显著的止咳及抗炎活性。据报道,栀子多糖具有肝保护作用[44]。冬虫夏草多糖表现出一定抗辐射活性作用,可以作为有效的放射保护剂或减少辐射诱导损伤的替代物[45]。含有树舌多糖的复方树舌片具有滋补肝肾,益气养阴的功效,广泛用于慢性乙型肝炎、肝硬化以及肝损伤的治疗[46]。天花粉及壳聚糖制备形成的复合水凝胶则能够促进皮肤伤口愈合[47]。
3 影响中药多糖药理活性的因素
大量研究表明,影响中药多糖药理活性的因素主要包括中药多糖自身的理化性质、相对分子量以及化学结构。
3.1 多糖理化性质
中药多糖自身理化性质对其药理活性的影响主要包括以下5方面,即多糖的溶解性、粘度、流变性、旋光度及电荷密度[48-52]。一般来说,水溶性越强、粘度越低的多糖具有更高的生物学活性。此外,多糖的凝胶、增稠、稳定以及乳化等流变特性对其药理活性以及实际应用产生了深刻影响。研究发现,部分中药多糖水化后随着浓度增加易凝胶化,导致其在体内吸收代谢困难[53],此时多糖本身并不具有很高的药理活性,因此多应用于药物递送载体及食品添加剂开发等方面。
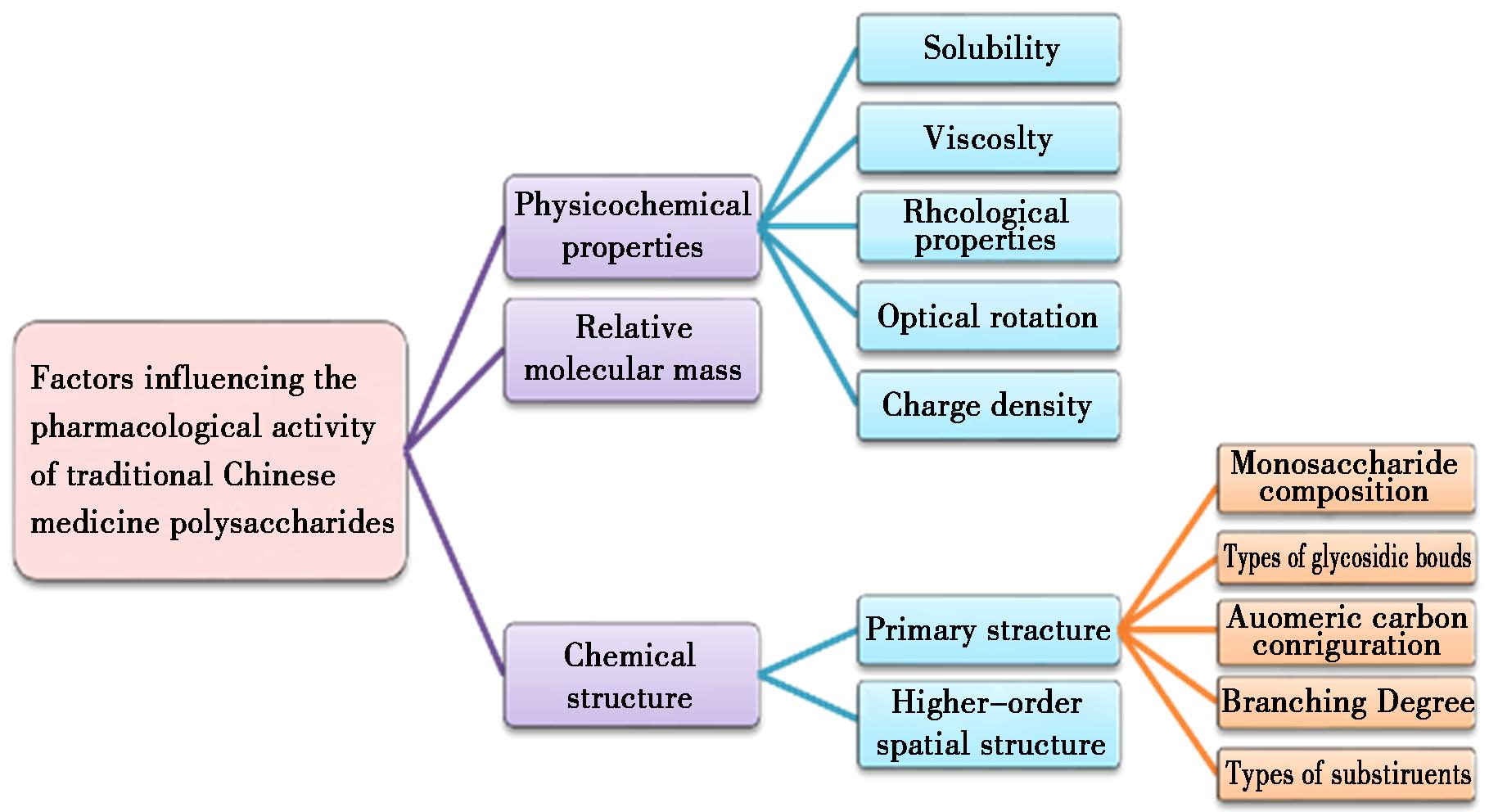
图3 影响中药多糖药理活性的因素
Fig.3 Factors influencing the pharmacological activity of polysaccharides in traditional Chinese medicine
3.2 多糖的相对分子量
中药多糖药理活性与其自身相对分子量存在密切关系。研究发现高分子多糖降解后,生物活性明显增加[53]。而分子量过低,则无法形成和活性密切相关的聚合结构。此外,对比实验结果表明:多糖的种类不同,其生物活性的最佳分子量也存在差异性。多糖的分子量过高,则难以进行跨膜转运,这对其生物作用的发挥产生不利影响;而分子量低于一定的阈值后也不具有活性[54]。分析其原因可能是由于大分子量多糖普遍表现出高黏性和低溶解性特征,减缓多糖在胃肠道系统中的转运速度和吸收效率,这些特性都限制了多糖的活性表达。而较低分子量的多糖经过机体消化酶及肠道菌群的降解变为单糖分子,从而作为供能物质被机体吸收,无法发挥出生物活性。
3.3 多糖的化学结构
中药多糖的化学结构也是决定其药理活性的关键因素。中药多糖的结构总体上可划分为一级结构和高级空间结构。目前,对中药多糖一级结构的构效关系研究已取得一系列成果。中药多糖的一级结构主要由单糖组成、糖苷键种类、分支度等因素决定,均对多糖的药理活性产生深远影响[55]。
①多糖的单糖组成会显著影响其活性,研究发现如果单糖中含葡萄糖、甘露糖,则一般表现出很强的抗癌和免疫调节效果[56,57];含有阿拉伯糖、鼠李糖及木糖的多糖具有较高的抗氧化、抗衰老活性[58]。②研究表明,以(1→3)糖苷键连接的活性半乳糖表现出较高的抗癌活性;不过在抗癌方面,以β-(1→6)连接的D-葡聚糖则很少表现出活性。香菇多糖、灵芝多糖主要是以β-(1→3)糖苷键进行连接,研究发现这类多糖的抗癌活性较高[59]。③异头碳构型也是一个影响因素,不过目前此领域的研究还不深入,目前学者普遍认为β构型的多糖在抗癌方面效果更优[56]。④多糖支链的分支度和长度也对其活性产生影响,不过具体影响机制还不明确。研究发现分支度需要在合理的范围内,才可以促使多糖发挥出良好的生物活性。分支度过大,则其连接松散,易解体,不利于功能发挥,而分支度过低,则无法让多糖分子形成立体空间结构。因此,适当的分支度可增加羟基的含量,这样可促使其结合水分子,使得结构更加稳定,可发挥更好的抗癌、抗凝血、抗炎和降糖效果[60]。此外,支链的长短对其活性也会产生显著影响,研究发现茯苓多糖支链过长导致其抗癌作用有一定幅度降低[61]。⑤多糖中取代基的种类同样影响到其药理活性。目前针对多糖的化学修饰研究已经取得重要进展,多种修饰方法已经被提出,如硫酸化、硒化、乙酰化等,均对中药多糖的改良增效产生巨大影响[62-64]。研究发现多糖有硫酸根官能团时,其表现出良好的抗病毒、抗癌效果,同时还具有抗凝效果。多糖中硫酸根数量以及位置对其抗病毒活性强弱密切相关[62]。多糖经过硒化修饰后,其抗氧化和抗肿瘤活性显著升高[63]。此外,乙酰基、羧甲基能够增强多糖抗氧化、抗炎、免疫调节等活性,磷酸基团能够增加多糖水溶性,提高抗肿瘤活性等[64]。
最后,中药多糖高级结构与其药理活性的关系还不是很明确,仍需进一步研究。多糖的高级结构主要包括4种:可拉伸带状、屈曲状螺旋、皱纹型带状、屈曲状线[65]。目前已有的研究表明,具有药理活性的多糖大部分都存在屈曲状螺旋结构,如香菇多糖存在3股螺旋结构,这种结构的稳定性与其药物活性密切相关。
4 中药多糖的应用前景及局限性
4.1 中药多糖的应用前景
目前中药多糖的应用与开发主要分为3种,一种是根据多糖的理化性质开发为药物递送载体。中药多糖自身特性与药物递送载体的开发理念具有很高的适配性,首先中药多糖具有较高的亲水性,易形成凝胶[66],可以改善药物的水溶性,因此选择多糖作为药物递送载体可显著提高药物溶解性,并且形成的凝胶基团能够包被药物,通过凝胶层扩散到体液中,达到缓释的效果,通过这种方法进行改进后,就可以长时间持续的发挥药物作用,减少用药频率,更好的满足治疗要求。例如,多糖铁复合物与罗沙司他联用在治疗肾性贫血过程中能够有效改善患者肾功能,减轻机体炎症反应,调节铁代谢,具有更好的临床疗效及安全性[67]。其次,中药多糖具有大量活性基团,能够与多种药物分子键合,从而具有很高的载药容量[68]。例如,壳聚糖纳米颗粒可用于抗肿瘤药物(多西紫杉醇、安罗替尼、甲氨蝶呤等)的递送[69],从而提高药物的生物利用度和治疗效果。并且,中药多糖的负电荷有助于其避免巨噬细胞的攻击,因此,中药多糖可作为保护层,增加载药体系的稳定性[70]。最后就是中药多糖普遍表现出药理活性,能够与所载药物相辅相成,发挥协同增效作用,从而达到减毒增效、药辅合一的效果。
另一种是根据中药多糖的药理活性进行开发。由于多糖分子量大,结构复杂等原因难以阐释清楚其结构及作用机制,所以获国家批准上市的多糖药品不多,大多只能作为保健食品使用。目前市场上大量应用并开发临床用药的多糖包括肝素、香菇多糖、黄芪多糖、人参多糖、猪苓多糖、紫芝多糖、银耳多糖、云芝多糖以及树舌多糖,在抗凝、抗肿瘤、调节免疫、保肝护肾等方面发挥着巨大的作用。因此,针对中药多糖进行深入研究是十分必要的,明确中药多糖的药理活性及机制作用,为其在临床治疗中的推广应用提供支持。
最后一种是多糖在组织工程中的应用。天然多糖具有良好的生物相容性和保水性,以及长聚合物链,修复或再生受损组织,可以用于制备生物支架。一些骨细胞可以在多糖基材料上附着和扩散,并且可以黏附和增殖,可能为骨组织工程再生提供一种有前途的支架基质[71]。
4.2 中药多糖研究中的局限性
中药多糖的研究目前仍处于起步阶段,多方面的研究都存在一定的局限性。(1)中药多糖的提取、分离工艺仍需进一步改良优化,在多糖提取分离过程中,其化学结构易被改变,多糖产品的稳定性差,难以大批量制备出性质稳定的功能多糖。为后续中药多糖的研究带来极大困难。(2)中药多糖结构解析及表征困难,目前的研究主要是初步确定了多糖的一级结构,而对多糖的高级空间结构知之甚少,研究进展远落后于蛋白质。因此这对其构效关系研究产生明显制约,因此仍需要针对这些内容进行深入研究。(3)对其药理活性研究还存在很多空白,中药多糖的药理活性研究目前仍处于“是否有效”的阶段,对中药多糖“如何起效”、“如何增效”、“如何转化推广”等问题研究不够透彻。虽然一些多糖的药理作用已在体外和动物实验中得到验证,但是还需要开展临床研究从而更好地验证其有效性和安全性。
5 展望
中药多糖由于来源广泛、价格低廉、药理活性多样等特点,近年来的研究取得了一系列成果。中药多糖基于自身理化性质开发出多种药物递送载体或辅料以及高分子生物医用材料,而根据中药多糖的药理活性开发出的抗肿瘤、调节免疫、补血生津,保肝护肾等药品也在临床上广为应用。中药多糖不仅为医药领域提供了新的药用资源,还为保健品行业和功能食品行业带来新的发展机遇。然而,中药多糖在实际应用过程中,依然面临一些挑战:(1)中药多糖的质量标准尚待完善,由于多糖成分复杂,分子量过大,导致其在大规模生产时难以制备出性质稳定的功能多糖。因此需要完善中药多糖的质量标准,为其大规模应用奠定基础。(2)中药多糖的体内吸收、分布、代谢以及毒性问题研究较少,大部分中药多糖具有较低的毒副作用,但是仍有一些异种来源的多糖或经过化学修饰的多糖可能会导致机体过敏反应或其他免疫副作用。因此,有必要系统性研究中药多糖的体内吸收代谢过程,全面考察中药多糖的安全性问题。
[1]Guan J,Zhao Y,Wang T,Fu R.J.Pharm.Pharm.Sci.,2023,26:11 863.
[2]Wang Y S,Zhang Q F,Chen Y C,Liang C L,Liu H Z,Qiu F F,Dai Z H.Biomed.Pharmacother.,2020,121:109 570.
[3]Zhang Y,Lou Y N,Wang J B,Yu C G,Shen W J.Front.Immunol.,2021,11:609 705.
[4]Hou H W,Li Q,OuYang H,Nie B,Du Y W,Chen L H,Zhu W F.J.Jiangxi University CM,2023,35(1):72-77.
侯恒威,李琼,欧阳辉,聂斌,杜玉文,陈丽华,朱卫丰.江西中医药大学学报,2023,35(1):72-77.
[5]Abatangelo G,Vindigni V,Avruscio G,Pandis L,Brun P.Cells,2020,9(7):1 743.
[6]Wang W,Meng Q,Li Q,Liu J B,Zhou M,Jin Z,Zhao K.Int.J.Mol.Sci.,2020,21(2):487.
[7]Wang J,Wu X,Chen J,Gao T,Zhang Y M,Yu N.Biomed.Pharmacother.,2024,173:116 330.
[8]Xia C,Dong X,Li H,Cao M,Sun D,He S,Yang F,Yan X,Zhang S,Li N,Chen W.Chin.Med.J.,2022,135(5):584-590.
[9]Li M,Duan F,Pan Z,Liu X,Lu W,Liang C,Fang Z,Peng P,Jia D.Cells,2023,12(6):866.
[10]Qi W,Zhou X,Wang J,Zhang K,Zhou Y,Chen S,Nie S,Xie M.Carbohydr.Polym.,2020,237:116 113.
[11]Zhai F G,Liang Q C,Wu Y Y,Liu J Q,Liu J W.Pharm.Biol.,2022,60(1):909-914.
[12]Chen L,He C,Zhou M,Long J Y,Li L.Molecules,2022,27(18):5 828.
[13]Syukriya A J,Bankeeree W,Prasongsuk S,Yanatatsaneejit P.Biomed.Rep.,2023,19(3):63.
[14]He Y,Li X,Hao C,Zeng P,Zhang M,Liu Y,Chang Y,Zhang L.Discov.Med.,2018,25(138):159-176.
[15]Liu J Y,Hou X X,Li Z Y,Shan S H,Chang M C,Feng C P,Wei Y.Int.J.Biol.Macromol.,2020,157:288-295.
[16]Zhu L P,Wu M,Li P,Zhou Y F,Zhong J Y,Zhang Z Q,Li Y,Yao W X,Xu J H.Front.Pharmacol.,2020,11:602 702.
[17]Jing B,Cheng G,Li J J,Wang Z A,Du Y G.Mar.Drugs,2019,17(7):415.
[18]Wang Y X,Wang H J,Chai K Y,Guo S Y,Gao Y F,Li J Q,Qiao C Q,Yang S Y,Zhou J Y,Lin Y F,Zhang X M,Wu J R.Medicine (Baltimore),2024,103(21):e38 032.
[19]Tsao S M,Wu T C,Chen J Z,Chang F C,Tsao T.Integr.Cancer.Ther.,2021,20:1 534 735 421 995 256.
[20]Yang D,Liu Y,Zhang L.Prog Mol.Biol.Transl.Sci.,2019,163:383-421.
[21]Zhang Y,Jiang Y,Zhang M,Zhang L.Prog Mol.Biol.Transl.Sci.,2019,163:165-177.
[22]Ligacheva A A,Sherstoboev E Y,Danilets M G,Trofimova E S,Krivoshchekov S V,Khasanova S R,Kudashkina N V,Gur′ev A M,Belousov M V.Bull.Exp.Biol.Med.,2021,172(2):151-154.
[23]Hu J P,Sun Y P,Su F Z,Wang Y Y,Kuang H X.Chem.Eng.,2021,35(10):52-55.
胡建平,孙延平,苏发智,王洋洋,匡海学.化学工程师,2021,35(10):52-55.
[24]Xu G,Qin M,Yu M Q,Liu T,Guo Y Y,Wang K H,Mu L X,Wang S F,Ma Q.J.Ethnopharmacol.,2024,320:117 425.
[25]Li M,Jiang J M,Ou D M,Huang L F,Xie L H,Zhang J.Acta Universitatis Med.Anhui,2022,57(4):552-557.
李梅,蒋锦梅,欧大明,黄丽芳,谢立虎,张济.安徽医科大学学报,2022,57(4):552-557.
[26]Wang J,Zheng D,Huang F,Zhao A,Kuang J,Ren Z,Chen T,Lei J,Lin J,Wang X,Jia W,Xie G,Zheng X.Front.Pharmacol.,2022,13:875 549.
[27]Jiao J,Yong T,Huang L,Chen S,Xiao C,Wu Q,Hu H,Xie Y,Li X,Liu Y,Cai M,Zhang R,Xie T,Liu R.Int.J.Biol.Macromol.,2023,226:1 178-1 191.
[28]He Z,Guo J,Zhang H,Yu J,Zhou Y,Wang Y,Li T,Yan M,Li B,Chen Y,Chen S,Lv G,Su J.Int.J.Biol.Macromol.,2023,253(4):126 987.
[29]Man N N,Han L J,Yang Y J,Suo Y R,Yuan Z Z,Ye Y.Sci.Technol.Food Ind.,2024,45(16):1-14.
马娜娜,韩丽娟,杨永晶,索有瑞,院珍珍,叶英.食品工业科技,2024,45(16):1-14.
[30]Liu R K,Hu Y Y,Li W C,Chen Y G.Chin.Tradit.Pat.Med.,2024,46(2):635-639.
刘枘岢,胡园园,李雯翀,陈毅光.中成药,2024,46(2):635-639.
[31]Guo F,Dong X T.Food Ind.,2024,45(3):136-140.
郭峰,董晓婷.食品工业,2024,45(3):136-140.
[32]Barclay T G,Day C M,Petrovsky N,Garg S.Carbohydr.Polym.,2019,221:94-112.
[33]Jayachandran M,Chen J L,Chung S S M,Xu B.J.Nutr.Biochem.,2018,61:101-110.
[34]Jiang K,Wang D,Su L,Liu X L,Yue Q L,Zhang S,Zhao L.Pharmaceuticals (Basel),2023,16(8):1 133.
[35]Zhou R,He D,Xie J,Zhou Q,Zeng H,Li H,Huang L.Front.Immunol.,2021,12:665 901.
[36]Su L L,Li X M,Guo Z J,Xiao X Y,Chen P,Zhang J B,Mao C Q,Ji D,Mao J,Gao B,Lu T L.J.Ethnopharmacol.,2023,310:116 351.
[37]Feng Y Q,Song Y T,Zhou J,Duan Y Q,Kong T Y,Ma H L,Zhang H H.Crit.Rev.Food Sci.Nutr.,2024,64(10):2 917-2 940.
[38]Hajam Y A,Rani R,Ganie S Y,Sheikh T A,Javaid D,Qadri S S,Pramodh S,Alsulimani A,Alkhanani M F,Harakeh S.Cells,2022,11(3):552.
[39]Zaric B L,Macvanin M T,Isenovic E R.Int.J.Biochem.Cell Biol.,2023,154:106 346.
[40]Zhou S,Huang G.Chem.Biol.Drug Des.,2022,99(4):603-608.
[41]Li K,Wang J,Huang Z,Tan C.Chem.Biodivers.,2023,20(3):e202 200 813.
[42]Gan Q,Wang X,Cao M,Zheng S,Ma Y,Huang Q.J.Ethnopharmacol.,2022,291:115 153.
[43]Lai S Q,Zhang J Q,Li M Q,Shen S R,Liu X D,Xiang J,Lai K F,Zhong S.CJTCMP,2022,37(3):1 644-1 647.
赖思琪,张嘉琪,黎美棋,沈水容,刘晓东,向娟,赖克方,钟山.中华中医药杂志,2022,37(3):1 644-1 647.
[44]Fang S,Wang T,Li Y,Xue H,Zou J,Cai J,Shi R,Wu J,Ma Y.Int.J.Biol.Macromol.,2022,205:23-36.
[45]Yang J,Nian Y,Duan Y,Xin Y,Zhu L,Liu G,Li X.Int.J.Med.Mushrooms.,2020,22(8):815-827.
[46]Chen C,Chen J,Wang Y,Fang L,Guo C,Sang T,Peng H,Zhao Q,Chen S,Lin X,Wang X.Phytomedicine,2023,110:154 626.
[47]Wu Y,Kou X Y,Wang Y Z,Liu T,Liu X Y,You X Y,Su J T.Chem.Reagents,2023,45(12):26-32.
吴燕,寇先勇,王峣姿,刘同,刘馨月,尤祥宇,苏江涛.化学试剂,2023,45(12):26-32.
[48]Ferreira S S,Passos C P,Madureira P,Vilanova M,Coimbra M A.Carbohydr.Polym.,2015,132:378-396.
[49]Fernandes P,Coinmbre M A.Carbohydr.Polym.,2023,314:120 965.
[50]Li W,Li J,Wang J,He Y,Hu Y C,Wu D T,Zou L.Front.Nutr.,2022,9:1 025 897.
[51]Huang H,Huang G.Chem.Biol.Drug.Des.,2020,96(5):1 209-1 222.
[52]Li W B,Lei J,Qu-Mo M M,Li J,Wei J,Liu Y,Wang S P,Hu Y C,Zou,L Wu D T.Ultrason.Sonochem.,2024,106:106 895.
[53]Camilleri M.Clin.Transl.Gastroen.,2021,12(1):e00 308.
[54]Wang Y,Sun M,Jin H,Yang J,Kang S,Liu Y,Yang S,Ma S,Ni J.Front.Microbiol.,2021,12:701 566.
[55]Xue H,Li P,Bian J,Gao Y,Sang Y,Tan J.Front.Nutr.,2022,9:1 005 181.
[56]Guo R,Chen M,Ding Y,Yang P,Wang M,Zhang H,He Y,Ma H.Front.Nutr.,2022,9:838 179.
[57]Luan F,Ji Y,Peng L,Liu Q,Cao H,Yang Y,He X,Zeng N.Carbohydr.Polym.,2021,261:117 863.
[58]Wang X Y,Zhang D D,Yin J Y,Nie S P,Xie M Y.Crit.Rev.Food Sci.Nutr.,2019,59(S1):96-115.
[59]Xiao Z,Zhou W,Zhang Y.Adv.Pharmacol.,2020,87:277-299.
[60]Yun D,Yan Y,Liu J.Carbohydr.Polym.,2022,291:119 618.
[61]Li J,Wang Y F,Shen Z C,Zou Q,Lin X F,Wang X Y.Int.J.Biol.Macromol.,2023,232:123 390.
[62]Yan Y,Wang M,Chen N,Wang X,Fu C,Li Y,Gan X,Lv P,Zhang Y.Front.Immunol.,2022,13:1 091 210.
[63]Huang S,Yang W,Huang G.Carbohydr.Polym.,2020,242:116 409.
[64]Zhao T,Yang M,Ma L,Liu X,Ding Q,Chai G,Lu Y,Wei H,Zhang S,Ding C.Molecules,2023,28(14):5 416.
[65]Sun Q,Kan J Q,Zhao G H,Chen Z D.Guangzhou Food Sci.Technol.,2004,1:104-106.
孙群,阚健全,赵国华,陈宗道.广州食品工业科技,2004,1:104-106.
[66]Wang P,Liao Q,Zhang H.Biomacromolecules,2023,24(12):5 479-5 510.
[67]Chen R F,Yu P,Wang Z T,Li Y,Zhang R X.Chin.J.Clin.Pharmacol.,2024,40(12):1 704-1 708.
陈瑞丰,于沛,王志婷,李妍,张蕊显.中国临床药理学杂志,2024,40(12):1 704-1 708.
[68]Liu H,Zhang M,Meng F,Su C,Li J.Carbohydr.Polym.,2023,321:121 284.
[69]Sun R S,Zhang J B,Fang J N,Lv X,Tang Z Y,Tian Y.Chin.J.Clinical Pharm.Thera.,2021,26(1):65-75.
孙仁凇,张建斌,房佳霓,吕侠,唐泽耀,田燕.中国临床药理学与治疗学,2021,26(1):65-75.
[70]Banerjee R,Kumar K J,Kennedy J F.Int.J.Biol.Macromol.,2023,243:125 092.
[71]Huang C B,You C Q,Xiong R H,Wang F.J.Forestry Eng.,2021,6(3):1-8.
黄超伯,游朝群,熊燃华,王飞.林业工程学报,2021,6(3):1-8.