肺炎链球菌是一种兼性厌氧的革兰阳性致病细菌,广泛分布于自然界,可引起脑膜炎、肺炎、中耳炎、鼻窦炎等肺炎链球菌疾病[1,2]。肺炎球菌多糖是存在于肺炎链球菌表面的主要毒力因子之一,由于其高度抗原特异性而成为生产各种肺炎类疫苗的基本成分[3]。目前市面上常见的肺炎球菌多糖制备工艺,大多是使用乙醇沉淀核酸,再利用苯酚抽提法去除蛋白完成肺炎球菌多糖的精制,工艺过程中引入的乙醇和苯酚等危险、高毒性物质残留会影响产品的安全性[4]。北京智飞绿竹生物制药有限公司对肺炎球菌多糖的生产工艺进行技术创新,采用十六烷基三甲基溴化铵(Hexadecyl Trimethyl Ammonium Bromide,CTAB)沉淀、氯化钠解离、碘化钠沉淀以及超滤、层析等一系列过程来完成肺炎球菌多糖的制备与纯化,以获得安全高效且免疫原性优良的肺炎球菌多糖疫苗[5]。
碘化钠(Sodium Iodide)作为CTAB沉淀剂而被引入到肺炎球菌多糖的生产工艺中。碘化钠溶液通过电离产生碘离子,降低CTAB的临界胶束浓度而使其沉降析出,而残余的CTAB与碘化钠可采用超滤纯化技术去除。目前对碘离子检测的方法有滴定法[6]、分光光度法[7,8]及电感耦合等离子体质谱法(ICP-MS)[9-13]等。其中滴定法的检测限和定量限较低,不适用于碘化钠残留量的检测;由于肺炎球菌多糖里的糖类物质与碘化钠的紫外吸收波长接近[8],使用分光光度法检测容易造成测定结果偏高,不建议用于肺炎球菌多糖中碘化钠的检测;ICP-MS作为近年来新发展起来的检测碘离子重要分析方法,虽然具有高灵敏度和高通量的优势,但由于样品制备困难而使其难以推广[14-16]。相比上述几种检测方法,离子色谱法具有较高的分离效率和精密度,无需复杂的样品前处理,即可完成对碘化钠残留量的测定。
本研究旨在建立检测9V、11A、19A型肺炎球菌多糖中碘化钠含量的离子色谱方法,并对该方法进行理论验证,以验证的离子色谱法对上述型别肺炎球菌多糖中碘化钠残留量进行痕量分析。
1 实验部分
1.1 主要仪器与试剂
ICS-6000型离子色谱仪、Multifuge X4R Pro型台式离心机(美国赛默飞世尔科技公司);MSA225P-1CE-DI十万分之一型电子天平(德国赛多利斯公司);Dionex IonPac AS11-HC型阴离子交换层析柱(4×250 mm)、Dionex IonPac AG11-HC阴离子交换保护柱(4×50 mm)(美国戴安公司);Macrosep型离心过滤器(10 KD,美国颇尔公司);0.45 μm水系滤膜(上海泰欧生物科技有限公司)。
氢氧化钠溶液(质量分数50%,阿法埃沙(中国)化学有限公司);无水碘化钠(≥99.0%,国药集团化学试剂有限公司)。
9V型肺炎球菌多糖(批号:层析前20230901T9V)、11A型肺炎球菌多糖(批号:层析前20231001T11A)、19A型肺炎球菌多糖(批号:层析前20230901T19A)、肺炎球菌多糖溶液(北京智飞绿竹生物制药有限公司)。
1.2 实验方法
1.2.1 溶液配制
1.2.1.1 淋洗液配制
40 mmol/L氢氧化钠溶液配制:量取13 mL 50%氢氧化钠溶液并用超纯水定容至1 L,置于 22~42 kPa的氮气环境保存。
1.2.1.2 对照品溶液配制
碘化钠对照品溶液的配制:精确称取0.1 g无水碘化钠粉末置于100 mL容量瓶中,淋洗液定容并摇晃均匀,配成质量浓度为1 000 μg/mL的碘化钠对照品储备液。
碘化钠标准曲线工作液的配制:取一定量的碘化钠对照溶液,用淋洗液逐级稀释,配制成终浓度为0.01、0.04、0.06、0.10、0.40、0.60、1.00 μg/mL的工作液,现配现用。
1.2.2 供试品处理
将9V、11A、19A型肺炎球菌多糖溶液置于离心过滤器中,以8 500 r/min的转速离心1 h,收集滤出液,以0.45 μm水系滤膜过滤后,待测。
1.2.3 色谱条件
色谱柱:Dionex IonpacAS11-HC型阴离子层析柱(4×250 mm)、Dionex IonPac AG11-HC型保护柱(4×50 mm);淋洗液:40 mmol/L氢氧化钠溶液;进样体积:25 μL;流速:1.5 mL/min;柱温:30 ℃;检测时间:20 min;检测器:安培检测器(Ag电极,Ag/AgCl参比电极);电位波形:积分脉冲安培检测,波形条件见表1。
表1 检测电位波形
Tab.1 Detector of potential waveforms
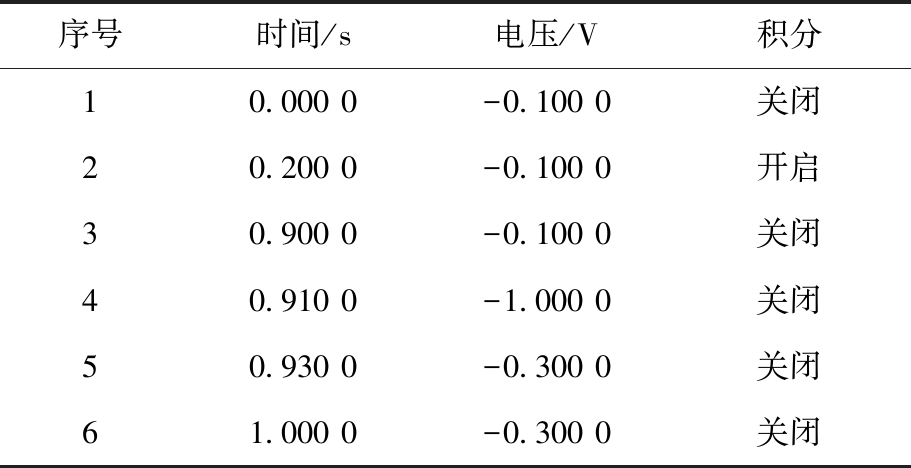
序号时间/s电压/V积分10.000 0-0.100 0关闭20.200 0-0.100 0开启30.900 0-0.100 0关闭40.910 0-1.000 0关闭50.930 0-0.300 0关闭61.000 0-0.300 0关闭
表2 线性回归方程及决定系数
Tab.2 Linear regression equation and correlation coefficient (n=6)

序号线性方程决定系数(R2)线性范围/(μg·mL-1)1Y=3.434 3X-0.004 01.000 00.01~1.002Y=3.417 7X-0.003 61.000 00.01~1.003Y=3.513 2X-0.006 60.999 90.01~1.004Y=3.442 3X-0.004 10.999 90.01~1.005Y=3.457 7X-0.003 10.999 90.01~1.006Y=3.294 3X-0.001 50.999 90.01~1.00
1.2.4 数据处理
使用Chromeleon 7软件处理结果图谱,采用Excel进行数据分析。
2 结果与讨论
2.1 淋洗液浓度的选择
离子色谱测定9V、11A、19A型肺炎球菌多糖中碘化钠含量时,分别采用30、40和50 mmol/L 3种不同浓度的氢氧化钠溶液对碘离子出峰情况进行考察,色谱图结果如图1所示。
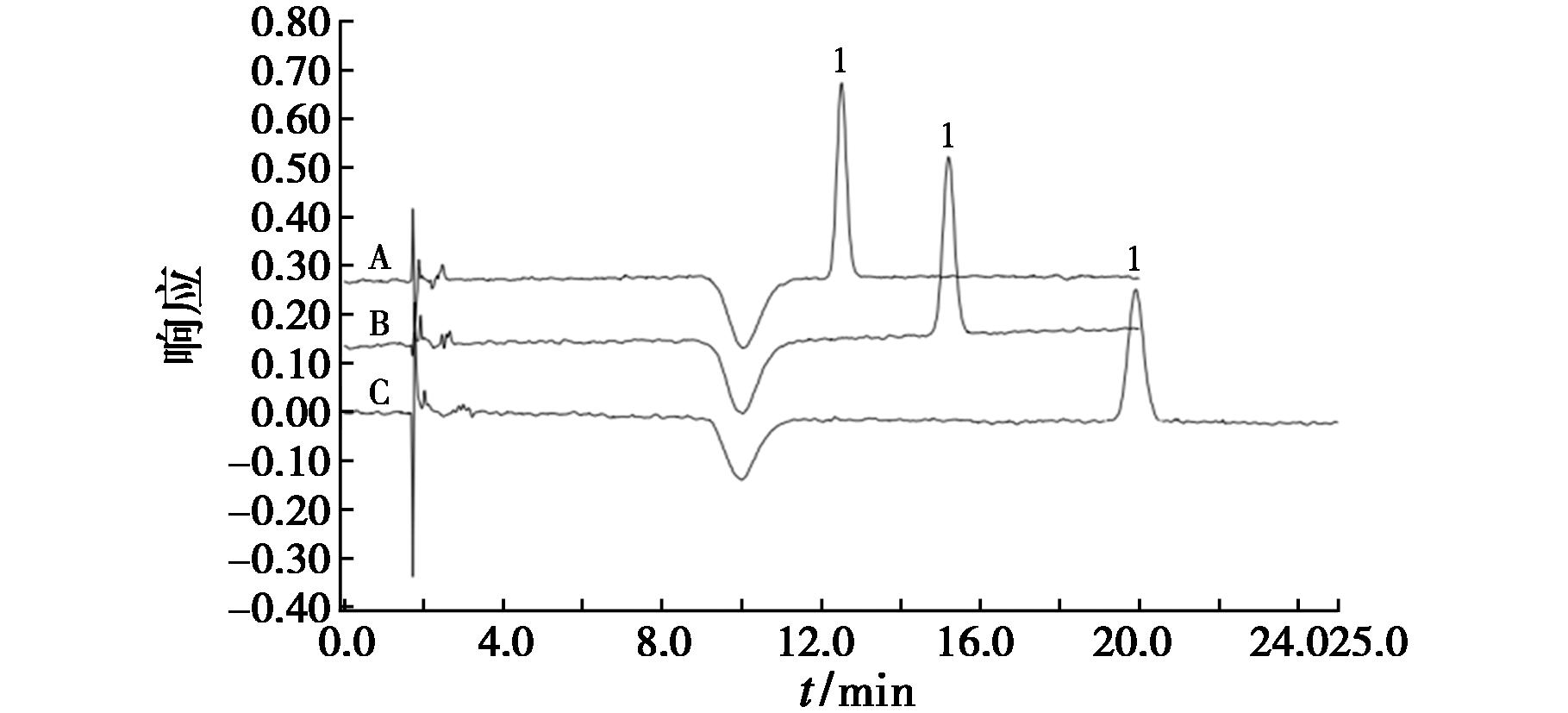
1表示碘离子色谱峰A、B、C分别为30、40、50 mmol/L氢氧化钠溶液
图1 不同浓度氢氧化钠淋洗液的出峰结果比较
Fig.1 Comparison of chromatographic peaks of different concentrations elutions of sodium hydroxide
结果表明,当淋洗液浓度为50 mmol/L时,碘离子的出峰位置附近存在水负峰而影响碘离子的积分;当淋洗液浓度降到30和40 mmol/L时,水负峰已不能干扰碘离子的出峰,综合考虑分离效果和检测时间,选择40 mmol/L氢氧化钠作为碘离子检测的淋洗液浓度。
2.2 方法的专属性
以40 mmol/L氢氧化钠作为空白对照,按1.2.3色谱条件,分别对5 mmol/L磷酸盐缓冲液、碘化钠对照品溶液及各型供试品溶液进行测定,色谱图结果如图2所示。
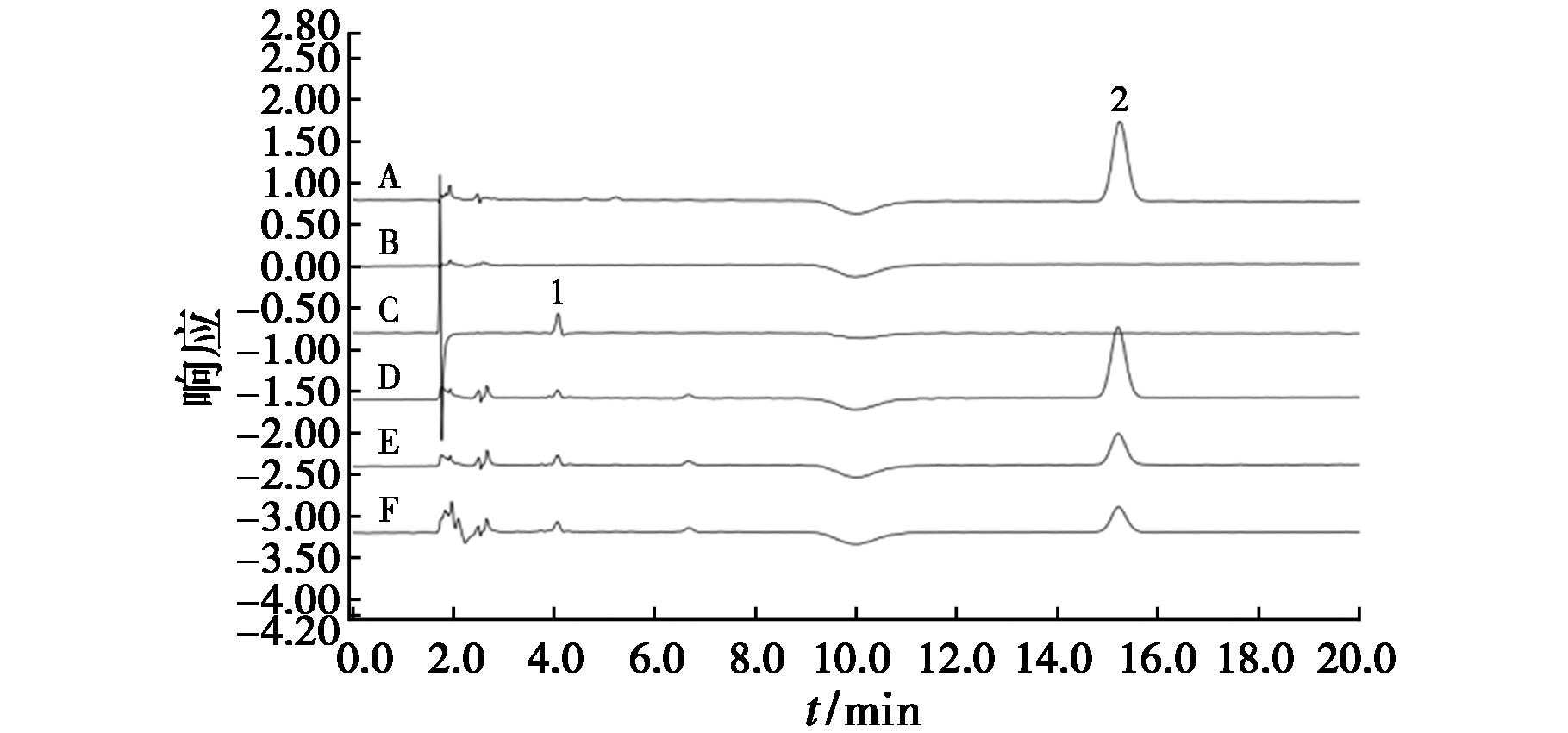
1表示磷酸根离子色谱峰;2表示碘离子色谱峰A:0.1 μg/mL对照品溶液;B:空白对照;C:5 mmol/L磷酸盐缓冲液;D:9V型肺炎多糖溶液;E:11A型肺炎多糖溶液;F:19A型肺炎多糖溶液
图2 专属性验证色谱图
Fig.2 Chromatogram for verification of specificity
结果表明,碘化钠溶液、9V型肺炎多糖溶液、11A型肺炎多糖溶液、19A型肺炎多糖溶液在相应位置均出现明显的碘离子色谱峰,而磷酸盐缓冲液和空白对照无对应色谱峰出现,并且磷酸根离子不影响目标离子出峰,表明该方法专属性良好。
2.3 方法的线性及范围
按1.2.1配制碘化钠标准曲线工作液,按照确定的色谱条件进样,平行检测6次,考察方法的线性和范围。以样品的质量浓度为横坐标,色谱峰面积为纵坐标,进行线性回归,计算决定系数(R2),结果见表1。
结果表明,碘化钠在0.01~1.00 μg/ml质量浓度范围内与峰面积呈良好的线性关系。在稀释剂的选择上,相较于去离子水,选择40 mmol/L的氢氧化钠作为稀释剂,可以得到决定系数R2更大的对照品标准曲线,R2可达到0.999 9,大大提高了测量值的可信程度,这可能是由于氢氧化钠提供的OH-离子可抑制碘离子的氧化所致。
2.4 方法的检出限及定量限
逐步稀释1.2.1.2配制的1 000 μg/mL的碘化钠对照品储备液,按确定的色谱条件进样,以碘离子色谱峰信噪比(S/N)≥3确定检出限,S/N≥10确定定量限,见表3。
表3 检出限及定量限测定结果
Tab.3 Determination results of the detection limit and the quantitation limit (n=6)
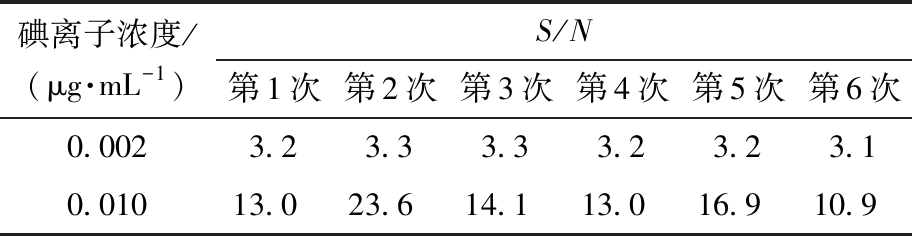
碘离子浓度/(μg·mL-1)S/N第1次第2次第3次第4次第5次第6次0.0023.23.33.33.23.23.10.01013.023.614.113.016.910.9
结果显示,6份0.002及0.010 μg/mL对照品平行检测的S/N范围分别为3.1~3.3和 10.9~23.6,确定方法的检出限及定量限分别为0.002 和0.010 μg/mL。
2.5 方法的准确度和精密度
精确称取9V、11A、19A型肺炎球菌多糖溶液离心滤出液,进行3水平加标回收实验,加标含量分别为0.01、0.05、0.10 μg/mL,每个水平做3次平行实验,记录色谱图,测得量与理论值的比值即为回收率,结果如表4~6所示。
表4 9V型肺炎球菌多糖的准确度与精密度验证结果
Tab.4 Validation results of accuracy and precision of serotype 9V pneumococcal polysaccharide (n=3)

本底值/(μg·mL-1)加标量/(μg·mL-1)测得量/(μg·mL-1)回收率/%平均回收率/%RSD/%0.042 50.010.050 90.052 30.051 896.8599.4598.5198.271.34
续表

本底值/(μg·mL-1)加标量/(μg·mL-1)测得量/(μg·mL-1)回收率/%平均回收率/%RSD/%0.042 60.050.088 90.088 80.088 096.0095.9795.0395.670.580.042 30.100.134 40.134 10.134 594.4794.2294.5194.400.17
表5 11A型肺炎球菌多糖的准确度与精密度验证结果
Tab.5 Validation results of accuracy and precision of serotype 11A pneumococcal polysaccharide (n=3)
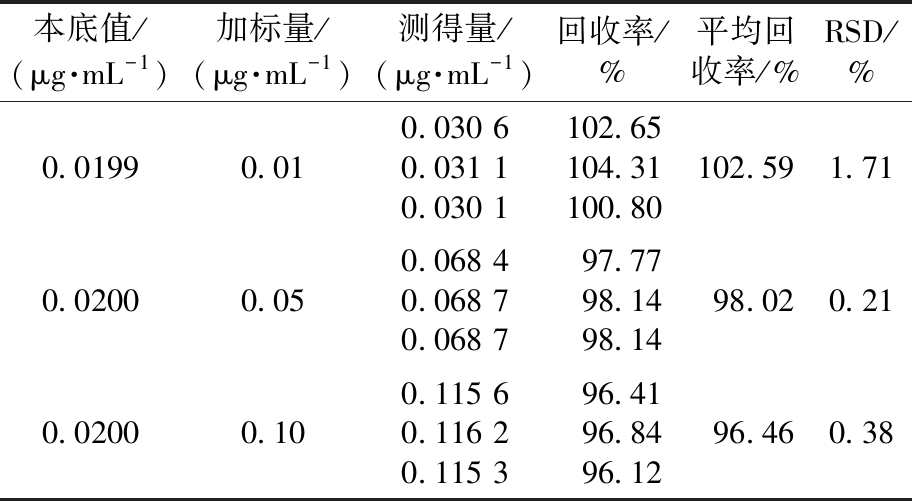
本底值/(μg·mL-1)加标量/(μg·mL-1)测得量/(μg·mL-1)回收率/%平均回收率/%RSD/%0.01990.010.030 60.031 10.030 1102.65104.31100.80102.591.710.02000.050.068 40.068 70.068 797.7798.1498.1498.020.210.02000.100.115 60.116 20.115 396.4196.8496.1296.460.38
表6 19A型肺炎球菌多糖的准确度与精密度验证结果
Tab.6 Validation results of accuracy and precision of serotype 19A pneumococcal polysaccharide (n=3)
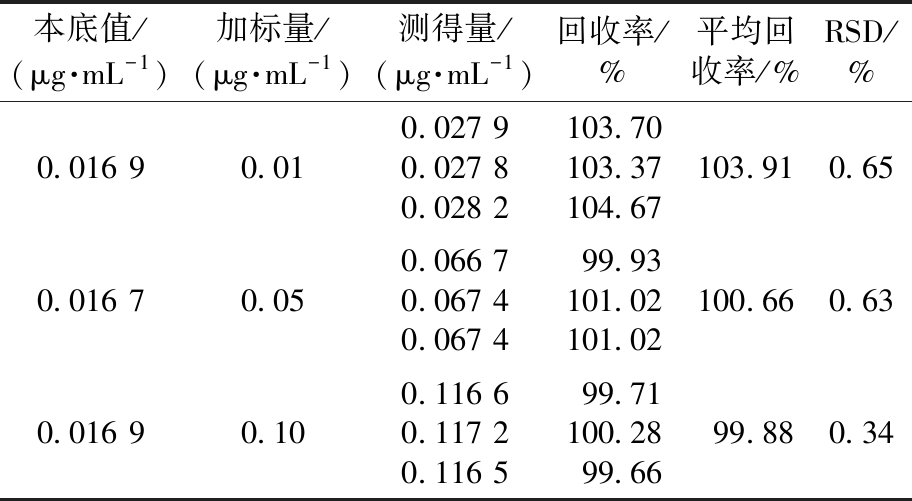
本底值/(μg·mL-1)加标量/(μg·mL-1)测得量/(μg·mL-1)回收率/%平均回收率/%RSD/%0.016 90.010.027 90.027 80.028 2103.70103.37104.67103.910.650.016 70.050.066 70.067 40.067 499.93101.02101.02100.660.630.016 90.100.116 60.117 20.116 599.71100.2899.6699.880.34
结果表明,9V、11A、19A型肺炎球菌多糖溶液的相对标准偏差均小于2%,平均回收率为94.22%~104.67%,符合分析要求,证明该方法准确、可靠、精密度高。
2.6 方法的耐用性
采用Dionex IonpacAS11-HC型阴离子层析柱(4×250 mm)和Dionex IonPac AG11-HC型保护柱(4×50 mm),取同一份供试品溶液,平行测试3次,考察该方法在(30±5) ℃的柱温条件下的耐用性,计算RSD和相对误差(RE),结果见表7~9。
表7 9V型肺炎球菌多糖的耐用性验证结果注
Tab.7 Validation results for durability of serotype 9V pneumococcal polysaccharides (n=3)
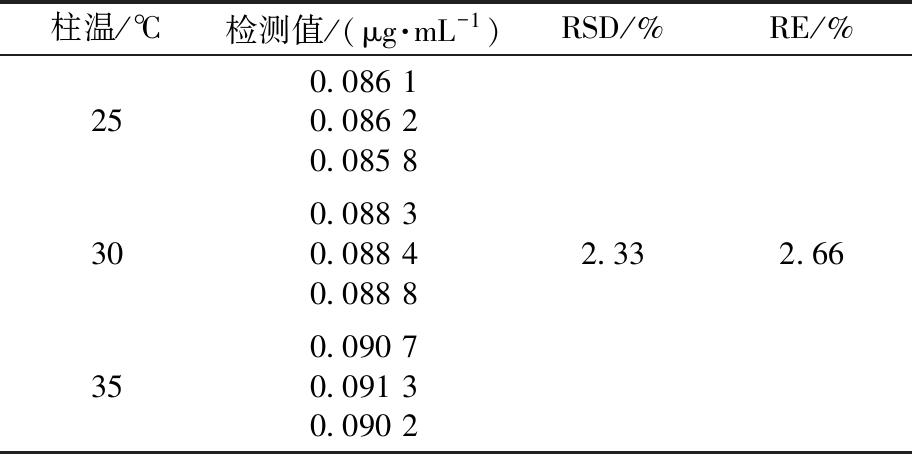
注:柱温均为(30±5)℃。
柱温/℃检测值/(μg·mL-1)RSD/%RE/%250.086 10.086 20.085 8 300.088 30.088 40.088 82.332.66350.090 70.091 30.090 2
表8 11A型肺炎球菌多糖的耐用性验证结果注
Tab.8 Validation results for durability of serotype 11A pneumococcal polysaccharides (n=3)
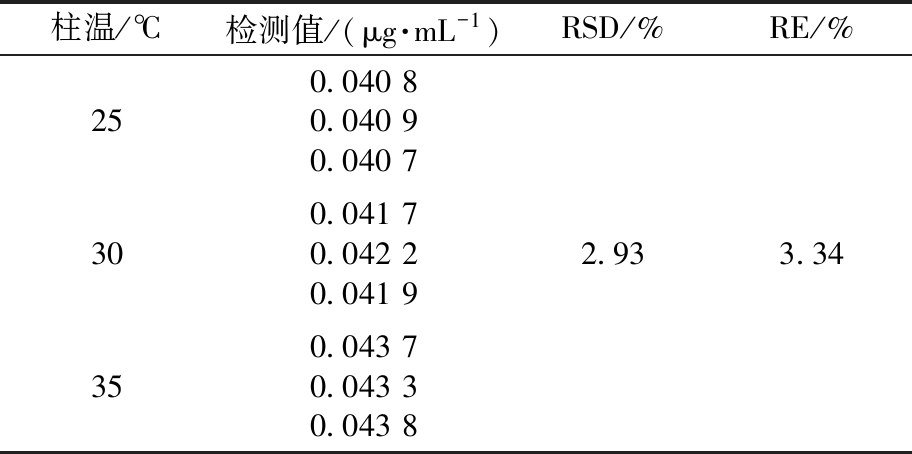
注:柱温均为(30±5)℃。
柱温/℃检测值/(μg·mL-1)RSD/%RE/%250.040 80.040 90.040 7 300.041 70.042 20.041 92.933.34350.043 70.043 30.043 8
表9 19A型肺炎球菌多糖的耐用性验证结果注
Tab.9 Validation results for durability of serotype 19A pneumococcal polysaccharides (n=3)
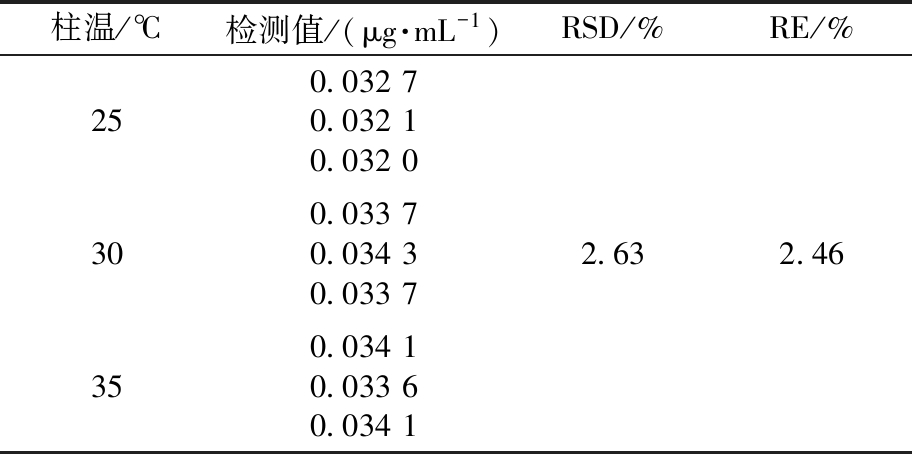
注:柱温均为(30±5)℃。
柱温/℃检测值/(μg·mL-1)RSD/%RE/%250.032 70.032 10.032 0 300.033 70.034 30.033 72.632.46350.034 10.033 60.034 1
结果表明,色谱柱温度(30±5) ℃的RSD和RE分别小于3%与4%,证明本方法的耐用性良好。
2.7 方法的初步应用
用建立的方法分别测定其他批次9V、11A、19A型肺炎多糖供试品中碘化钠含量,每种型别制备6份平行样品,计算RSD值,结果见表10。
表10 方法的初步应用
Tab.10 Preliminary application of developed method
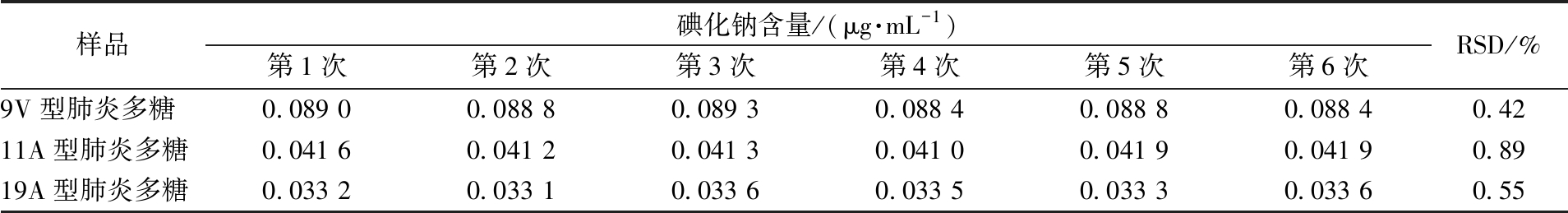
样品碘化钠含量/(μg·mL-1)第1次第2次第3次第4次第5次第6次RSD/%9V型肺炎多糖0.089 00.088 80.089 30.088 40.088 80.088 40.4211A型肺炎多糖0.041 60.041 20.041 30.041 00.041 90.041 90.8919A型肺炎多糖0.033 20.033 10.033 60.033 50.033 30.033 60.55
结果显示,对9V、11A、19A这3种型别肺炎多糖供试品溶液连续检测6次,检测结果适应内控要求,RSD均小于1%,符合中国药典收录的分析方法指导原则中的数值偏差要求,证明北京智飞绿竹生物制药有限公司研发的肺炎球菌多糖生产工艺技术稳定、质量优良。
3 结论
碘化钠作为一种新型的CTAB沉淀剂,优化至肺炎球菌多糖疫苗的生产工艺中,避免了危险性有机乙醇和高毒性苯酚的使用,因此可以得到更为安全有效的肺炎球菌多糖抗原原液。虽然通过后续的超滤工艺理论上可以除去绝大部分碘化钠,但仍需一种准确高效的检测方法来对肺炎球菌多糖中残留的碘化钠含量进行测定以监测多糖质量,但目前尚无针对肺炎球菌多糖中残留碘化钠检测的成熟方法。
本研究建立了离子色谱法检测9V、11A、19A型肺炎球菌多糖中碘化钠残留量的方法,使用超滤离心管离心除去分子量较大的多糖与蛋白质,避免大分子物质对AS11-HC柱造成损伤,实现大批量肺炎球菌多糖中碘化钠的同时检测。中国2010版《药品生产质量管理规范》质量管理的原则中明确要求保证药品的安全、有效和质量可控,肺炎球菌多糖中碘化钠残留量检测方法的建立一方面满足了药品注册的要求,即对所有工艺杂质都能有效监控,另一方面,作为过程控制指标,能够在日常生产或是与工艺有关的验证活动中提供准确的数据,有利于衡量判定生产工艺的稳定性和一致性,对提高产品质量控制能力提供方法基础。
[1]李亭,邓文君,张景锋,等.幼儿园儿童年龄与肺炎链球菌疫苗覆盖率间的剂量-反应关系[J].中国当代儿科杂志,2023,25(10):1 059-1 065.
[2]宗克强,罗树权,谭小梅.肺炎链球菌荚膜多糖纯化及质量控制方法的研究现状[J].微生物学免疫学进展,2021,49(3):82-87.
[3]齐秋焕,黄春华,郑学学,等.顶空气相色谱法测定6B型肺炎球菌精制多糖中乙醇、丙酮残留量[J].中国医药导报,2023,20(18):10-14.
[4]武晗燕,李文东,赵璇.HPLC测定肺炎球菌多糖疫苗中的苯酚[J].华西药学杂志,2023,38(3):329-331.
[5]北京智飞绿竹生物制药有限公司,重庆智飞生物制品股份有限公司,安徽智飞龙科马生物制药有限公司.一种23价肺炎球菌多糖疫苗的生产工艺:CN202111317637.X[P].2022-03-01.
[6]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2020.
[7]杨小骏,李红.紫外分光光度法测定碘化钠注射液的含量[J].现代应用药学,1995,(4):50.
[8]李学枚.亚甲蓝反萃取分光光度法测定碘化物的探讨[J].中国公共卫生,1990,6(9):413-414.
[9]LIU L J,LI X W,WANG H Y,et al.Reduction of iodate in iodated salt to iodide during cooking with iodine as measured by an improved HPLC/ICP-MS method[J].Nat.Clim.Change,2017,7(9):95-100.
[10]马康,宋增良,巢静波,等.高效液相色谱串联等离子体发射质谱分析食用色素赤藓红中痕量碘化钠[J].计量学报,2012,33(4):368-371.
[11]PICOLOTO R S,DONEDA M,FLORES E L M,et al.Simultaneous determination of bromine and iodine in milk powder for adult and infant nutrition by plasma based techniques after digestion using microwave-induced combustion[J].Spectrochim.Acta B,2015,107:86-92.
[12]BARBOSA J T P,SANTOS C M M,BISPO L D S,et al.Bromine,chlorine,and iodine determination in soybean and its products by ICP-MS after digestion using microwave-induced combustion[J].Food Anal.Method.,2013,6(4):1 065-1 070.
[13]LISARB O D,ANGELICA C,FROHLIC H,et al.Determination of bromine and iodine in edible flours by inductively coupled plasma mass spectrometry after microwave-induced combustion[J].Microchem.J.,2017,133:246-250.
[14]GUILLERMO G,JUAN M,MARGARETHA D L,et al.A systematic study on the influence of carbon on the behavior of hard-to-ionize elements in inductively coupled plasma-mass spectrometry[J].Spectrochim.Acta B,2013,86:42-49.
[15]MESKO M F,COSTA V C,PICOLOTO R S,et al.Halogen determination in food and biological materials using plasma-based techniques:Challenges and trends of sample preparation[J].J.Anal.Atom.Spectrom.,2016,31(6):1 243-1 261.
[16]任倩倩,李瑜哲,艾波,等.ICP-MS检测三氟化硼-苯甲醚配合物中11B同位素的丰度[J].化学试剂,2022,44(1):123-127.