生化与药用试剂
癌症的早期诊断对其治疗以及预后评估均具有重要意义[1,2]。目前基于抗体的检测方法已广泛应用,包括组织病理学、生物成像和光学/电化学生物传感[3-5],但它们依然面临着一些问题,如肿瘤细胞标志物的缺乏、抗体本身的高成本和固有免疫原性[6,7]。为了克服这种困境,模式识别可作为一种有前途的策略来实现肿瘤的精准诊断。不同于传统基于“锁和钥匙”的识别模式,它只依赖于传感元件与目标之间相互作用,由不同的非选择性受体组成的传感器阵列可以与不同的分析物相互作用,形成独特的光学“指纹图谱”,再通过主成分分析(PCA)进行聚类,从而可有效地识别不同的分析物,并具有令人满意的准确性[8,9]。因此,开发合适的传感器阵列来精确诊断肿瘤是迫切需要的。
活性氧(ROS)是生物体内具有高反应活性的自由基[10]。大量研究表明肿瘤微环境中由于肿瘤细胞代谢异常,通常具有高氧化应激状态,其特点是升高的ROS水平通过触发各种信号通路促进癌细胞增殖[11-13]。因此,异常的ROS水平已经成为肿瘤细胞的重要标志物之一,可作为传感器阵列的分析物来实现对肿瘤细胞的模式识别。然而,由于ROS具有稳态浓度极低、寿命短、反应性高等特点[14-16],建立ROS响应型传感器阵列识别癌细胞类型目前仍具有巨大的挑战。
近年来,许多类型的超小贵金属纳米团簇由于其易于制备和高荧光性能而引起了相当大的关注[17,18]。其中,金纳米团簇(AuNCs)是由几个到数百个原子组成,粒径约为2~3 nm,被认为是最有前景的传感元件[19,20]。相比于其他金属纳米团簇,AuNCs具有以下优势:1)AuNCs在复杂基质或较宽的pH范围内都更稳定;2)AuNCs具有良好的生物相容性[21,22],因此可用于生物分析。
本文通过调节pH,合成了3种不同荧光特性的组氨酸修饰的金纳米团簇(AuNCs@His),通过响应细胞内ROS类型和水平的差异,形成独特的光学“指纹图谱”。再结合PCA分析可有效区分肿瘤细胞类型及其增殖状态,展示出巨大的临床应用潜力。
F-7000型荧光分光光度计(日本日立公司);UV-1800型紫外分光光度计(日本岛津公司);HTX型多模式微孔板阅读器(美国BioTek公司);FLS980型荧光光谱仪(英国Edinburgh公司);JEOL 1011型透射电子显微镜(日本JEOL公司);ESCALAB 250Xi型X射线光电子能谱仪(美国Thermo Fisher Scientific公司);LSM 800型激光共聚焦显微镜(德国蔡司公司);Beckman FC500型流式细胞仪(美国贝克曼库尔特公司)。
亚硝酸钠、氯金酸水合物(HAuCl4·3H2O)(南京化学试剂股份有限公司);L-组氨酸、盐酸异丙肾上腺素(上海麦克林生化科技股份有限公司);二甲基亚砜(DMSO)、次氯酸钠(NaClO)、H2O2(30%)(国药集团化学试剂有限公司);氧化钾(KO2)、3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)、PMA、LPSs、TEMPO、胰蛋白酶(上海碧云天生物技术有限公司);胎牛血清(FBS,澳大利亚Life Technologies公司);N-乙酰半胱氨酸(NAC,上海阿拉丁生化科技股份有限公司)。以上所用试剂均为分析纯。
1.2.1 AuNCs@His的合成与表征
将新配制的100 mL(1.22 mmol/L)HAuCl4溶液分为3组,通过NaOH和HNO3调节至不同pH(1.7、6.8和11.0)。然后将100 mL(1.84 mmol/L)L-组氨酸溶液加入上述溶液中,110 ℃搅拌12 h。12 500 r/min离心10 min去除较大粒径的副产物后,收集含有AuNCs@His的透明上清液,4 ℃保存。其次,AuNCs@His 1、2和3通过紫外-可见吸收光谱、动态激光散射(DLS)、透射电子显微镜(TEM)和X射线光电子能谱(XPS)进行了充分的表征。
1.2.2 多类型ROS的制备
市售的H2O2和NaClO直接稀释,可分别制备H2O2和ClO-的工作液。FeCl2与H2O2在酸性条件下通过芬顿反应得到·OH。NaNO2与H2O2以1∶5的物质的量比反应得到ONOO-。NaClO与H2O2混合搅拌得到1O2。将KO2溶解于DMSO中制备超氧自由基![]()
1.2.3 ROS响应的传感器阵列构建
在96孔板(3×7阵列)中加入等量的各种活性氧:(A1~A3):0.01 mol/L磷酸盐缓冲液;(B1~B3):含50 μL(0.5 mmol/L)ClO-的0.01 mol/L磷酸盐缓冲溶液;(C1~C3):含50 μL(0.5 mmol/L)ONOO-的0.01 mol/L磷酸盐缓冲液溶液;(D1~D3):含50 μL(0.5 mmol/L)·OH的0.01 mol/L磷酸盐缓冲液溶液;(E1~E3):含50 μL(0.5 mmol/L)H2O2的0.01 mol/L磷酸盐缓冲溶液;(F1~F3):含50 μL(0.5 mmol/L)1O2的0.01 mol/L磷酸盐缓冲液溶液;(G1~G3):含50 μL(0.5 mmol/L)![]() 的0.01 mol/L磷酸盐缓冲溶液。再加入200 μL(20 μg/mL)AuNCs@His 1、2和3溶液室温孵育5 min。通过酶标仪分析AuNCs@His 1、2和3的荧光信号,计算荧光猝灭效率,以形成的“指纹图谱”进行主成分分析。
的0.01 mol/L磷酸盐缓冲溶液。再加入200 μL(20 μg/mL)AuNCs@His 1、2和3溶液室温孵育5 min。通过酶标仪分析AuNCs@His 1、2和3的荧光信号,计算荧光猝灭效率,以形成的“指纹图谱”进行主成分分析。
1.2.4 细胞培养
所有细胞系在含10%胎牛血清的DMEM培养,并添加100 U/mL青霉素和100 μg/mL链霉素。所有细胞系在37 ℃含5% CO2的无菌环境中生长,并在达到80%以上的密度后传代[23-25]。
1.2.5 体外细胞毒性试验
采用MTT法检测AuNCs@His 1、2和3的体外细胞毒性。简单地说,将MDA-MB-231细胞接种于96孔微孔板中,培养24 h进行附着。之后,将含有3种不同浓度AuNCs@His的培养基分别与MDA-MB-231细胞孵育24 h。然后,将20 μL(5 mg/mL)MTT试剂加入上述细胞中,再孵育 4 h,然后用100 μL DMSO替换培养基,室温振荡10 min。最后,用酶标仪测定490 nm处甲瓒晶体的吸光度。细胞相对活力计算公式为:细胞相对活力(%)=Abs(探针)/Abs(对照)×100%,其中Abs(探针)和Abs(对照)分别为有探针和无探针时的吸光度[26]。
1.2.6 肿瘤细胞类型及增殖状态鉴别
11株不同细胞在含10%胎牛血清的DMEM培养基中培养2~3 d(5% CO2,37 ℃)。将细胞与20 μg/mL AuNCs@His 1、2、3共孵育2 h。以ROS猝灭剂预处理的细胞为对照。细胞经胰蛋白酶消化、再分散后,通过流式细胞仪分析荧光信号,计算金纳米团簇的荧光猝灭效率,再进行PCA分析。为了鉴别肿瘤组织增殖状态,将肿瘤组织经消化后,再用DMEM培养基稀释至5×105个/mL细胞后,其他操作流程与上述一致[27]。
1.2.7 患者队列
本文分析了安徽医科大学第一附属医院12例浸润性乳腺癌标本。患者年龄40~65岁。本研究按照安徽医科大学生物医学伦理委员会规程(编号:83220390)进行。
使用透射电子显微镜(TEM)和X射线光电子能谱(XPS)表征合成的金纳米团簇。TEM图像显示,AuNCs@His 1、2和3均为单分散球形,平均直径分别为(2.3±0.7)、(2.0±0.6)和(1.7±0.5)nm(图1a~1f)。同时,XPS显示,制备的金纳米团簇有Au 4f、C 1s、N 1s和O 1s这4个共同峰(图1g),表明成功制备了组氨酸修饰的AuNCs[28]。另外,AuNCs@His 1、2和3的荧光激发和发射光谱存在显著差异,其荧光寿命分别为4.93、7.62、5.26 ns,可作为荧光传感器阵列元件(图1h~1i)。
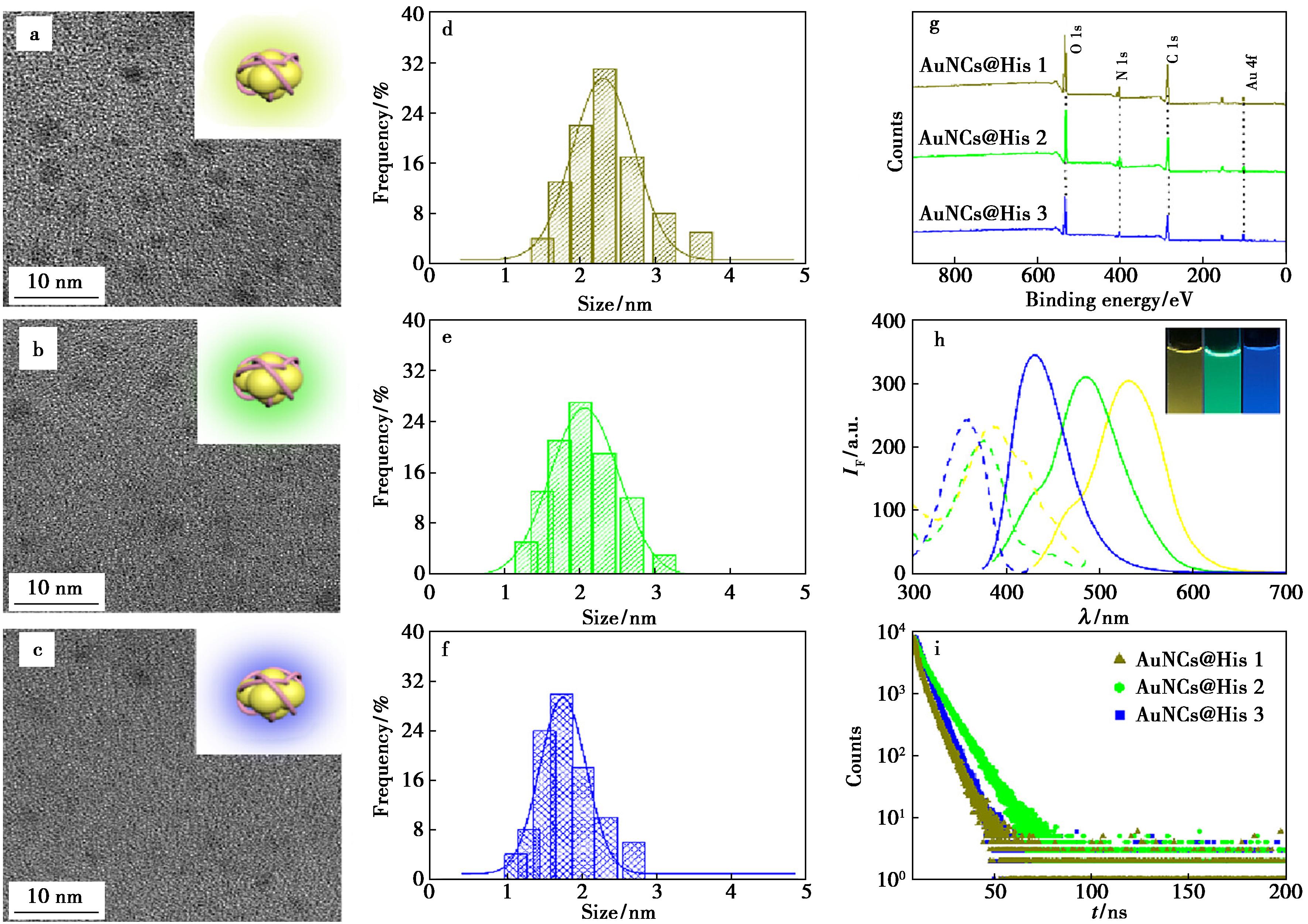
a~c.AuNCs@His 1、2和3的TEM图像;d~f.相应金纳米团簇粒径的高斯分布;g.AuNCs@His 1、2和3的XPS光谱;h.AuNCs@His 1、2和3的荧光激发(虚线)和发射谱图(实线);i.AuNCs@His 1、2和3的荧光寿命
图1 3种金纳米团簇的表征
Fig.1 Characterization of three types of gold nanoclusters
接下来,以荧光猝灭效率为指标评估AuNCs@His 1、2和3对6种浓度相同的ROS(ClO-、ONOO-、·OH、H2O2、1O2和![]() 的荧光响应。如图2a所示,对应于不同的ROS,可以观察到一种独特的荧光响应模式。每个ROS的光学“指纹”可以通过具有颜色差异的热图直观地反映出来(图2b)。接下来,通过PCA对荧光响应模式进一步分类。如图2c所示,ROS的响应模式被很好地聚类成6个独立的组,没有重叠,表明荧光传感阵列可鉴别不同的ROS。定量传感函数是传感器阵列性能的另一个重要参数。以ClO-定量为例,如图2d所示,AuNCs@His 1、2和3的荧光猝灭效率随着ClO-浓度的增加而增加,分别在0~200、0~600和0~100 μmol/L浓度范围内呈良好的线性关系。此外,热图清晰地显示了AuNCs@His 1、2和3对不同浓度ClO-的不同荧光响应(图2e)。在PCA图中,不同浓度的ClO-(1~120 μmol/L)可以被清晰区分,没有重叠(图2f),证实了所提传感器阵列的浓度区分能力。
的荧光响应。如图2a所示,对应于不同的ROS,可以观察到一种独特的荧光响应模式。每个ROS的光学“指纹”可以通过具有颜色差异的热图直观地反映出来(图2b)。接下来,通过PCA对荧光响应模式进一步分类。如图2c所示,ROS的响应模式被很好地聚类成6个独立的组,没有重叠,表明荧光传感阵列可鉴别不同的ROS。定量传感函数是传感器阵列性能的另一个重要参数。以ClO-定量为例,如图2d所示,AuNCs@His 1、2和3的荧光猝灭效率随着ClO-浓度的增加而增加,分别在0~200、0~600和0~100 μmol/L浓度范围内呈良好的线性关系。此外,热图清晰地显示了AuNCs@His 1、2和3对不同浓度ClO-的不同荧光响应(图2e)。在PCA图中,不同浓度的ClO-(1~120 μmol/L)可以被清晰区分,没有重叠(图2f),证实了所提传感器阵列的浓度区分能力。
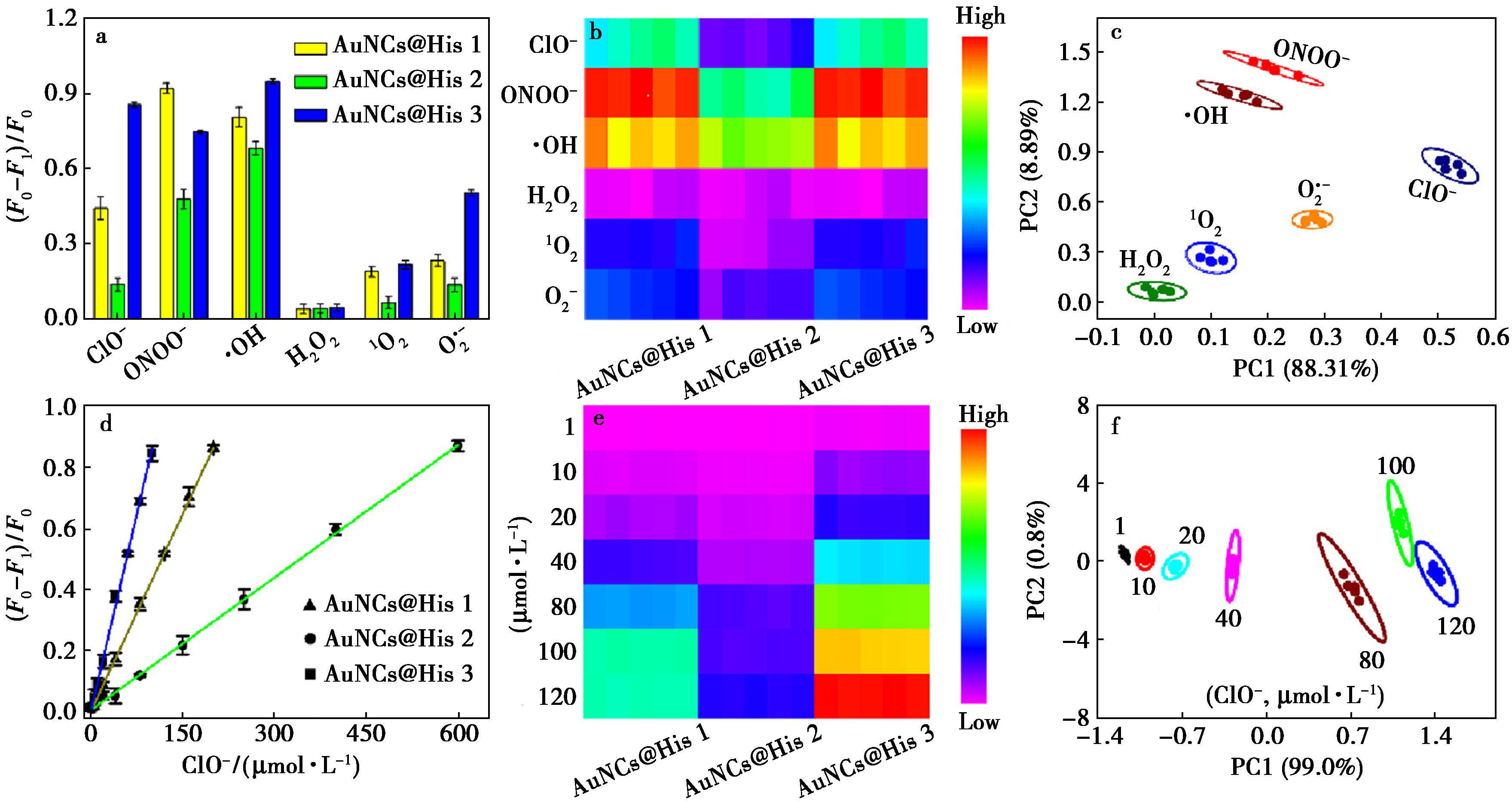
a.AuNCs@His 1、2和3对6种ROS的荧光响应;b.AuNCs@His 1、2和3对6种ROS的热图;c.AuNCs@His 1、2和3对6种ROS的PCA分析图;d.AuNCs@His 1、2和3对ClO-的荧光响应线性图;e.AuNCs@His 1、2和3对ClO-的热图;f.AuNCs@His 1、2和3对ClO-的PCA分析图;误差棒代表标准偏差(n=3)
图2 ROS响应型传感器阵列的构建
Fig.2 Construction of the ROS-responsive sensor array
为了探究ROS响应型荧光传感器阵列的传感机理,采用XPS对AuNCs@His 3与ClO-反应前后进行表征。如图3a所示,AuNCs@His 3的XPS分析确定了Au 4f 7/2和Au 4f 5/2峰,结合能分别为84.4和88.2 eV,是对应于Au(0)和Au(I)两种不同组分的典型结合能。该结果清楚地说明了AuNCs@His 3中Au(0)和Au(I)的共存,这可能有助于维持AuNCs@His 3的荧光稳定性[29]。计算得到AuNCs@His 3的Au(0)/Au(I)比率为1.24。然而,与ClO-反应后,Au(0)/Au(I)比值降低至0.39,表明Au(0)可以被ClO-有效地氧化为Au(I)(图3b)。同时,也探究了ClO-对表面配体的氧化作用。与未处理的AuNCs@His 3相比,ClO-处理的AuNCs@His 3的O—C![]() O含量显著增加,而C
O含量显著增加,而C![]() N含量显著降低,这可能是由于L-组氨酸的咪唑环通过开环反应(图3c、3d)被氧化所致。
N含量显著降低,这可能是由于L-组氨酸的咪唑环通过开环反应(图3c、3d)被氧化所致。
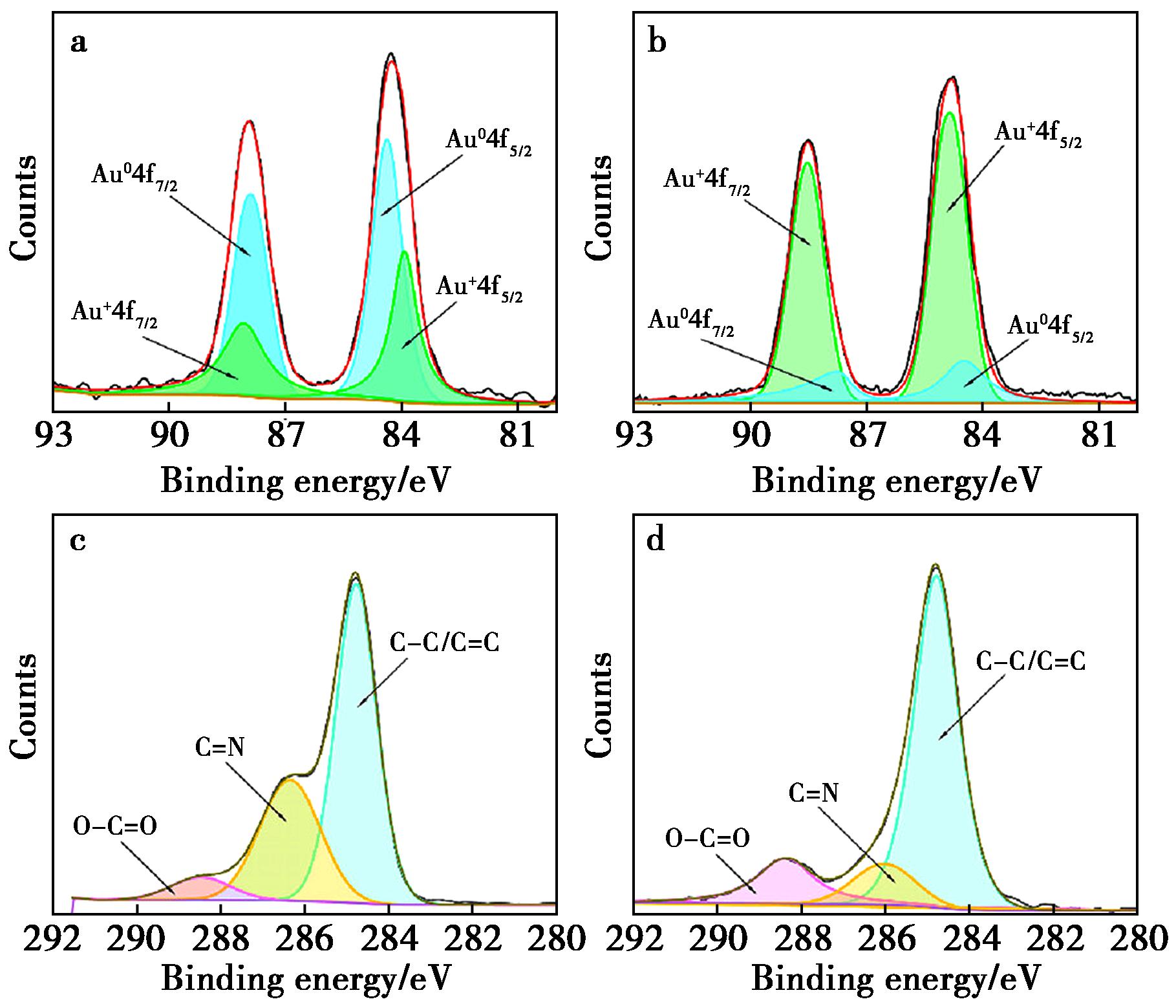
a.AuNCs@His 3与ClO-反应前的Au 4f XPS图谱;b.AuNCs@His 3与ClO-反应后的Au 4f XPS图谱;c.ClO-处理前AuNCs@His 3的C1 XPS图谱;d.ClO-处理后AuNCs@His 3的C1 XPS图谱
图3 传感机制的探究
Fig.3 Investigation of the sensing mechanism
考虑到荧光探针的生物应用,使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴盐(MTT)法评估AuNCs@His 1、2和3的细胞毒性。如图4a所示,MDA-MB231细胞分别与不同浓度的AuNCs@His 1、2和3孵育24 h后,观察到可忽略的细胞毒性,表明它们具有良好的生物相容性。由于AuNCs@His的有效细胞摄取是区分多种癌细胞的必要前提,因此通过FCM考察了AuNCs@His 1、2和3的内吞作用。在FCM分析之前,首先测定AuNCs@His 1、2和3的Zeta电位。图4b表明AuNCs@His 1、2和3均带正电荷,因此通过AuNCs@His与带负电荷的细胞膜之间的静电相互作用有效地促进了它们内化到细胞中[30]。此外,在MDA-MB-231细胞中,AuNCs@His 1、2和3的内吞指数相似(~9.0%),这可能是由于AuNCs@His表面具有相同的配体(图4c)。接下来,评估了AuNCs@His 1、2和3对细胞内ROS的荧光响应,分别用脂多糖(LPSs)/基丙烯酰胺(PMA)和N-乙酰半胱氨酸(NAC)/2,2,6,6-四甲基哌啶氧化物(TEMPO)预处理MDA-MB-231细胞以诱导和清除细胞内ROS。如图4d所示,与对照组相比,在NAC/TEMPO处理的MDA-MB-231细胞中观察到强烈的荧光信号,而在LPS/PMA处理的MDA-MB-231细胞中观察到较少的荧光信号,表明AuNCs@His的荧光猝灭是由细胞内ROS引起的。
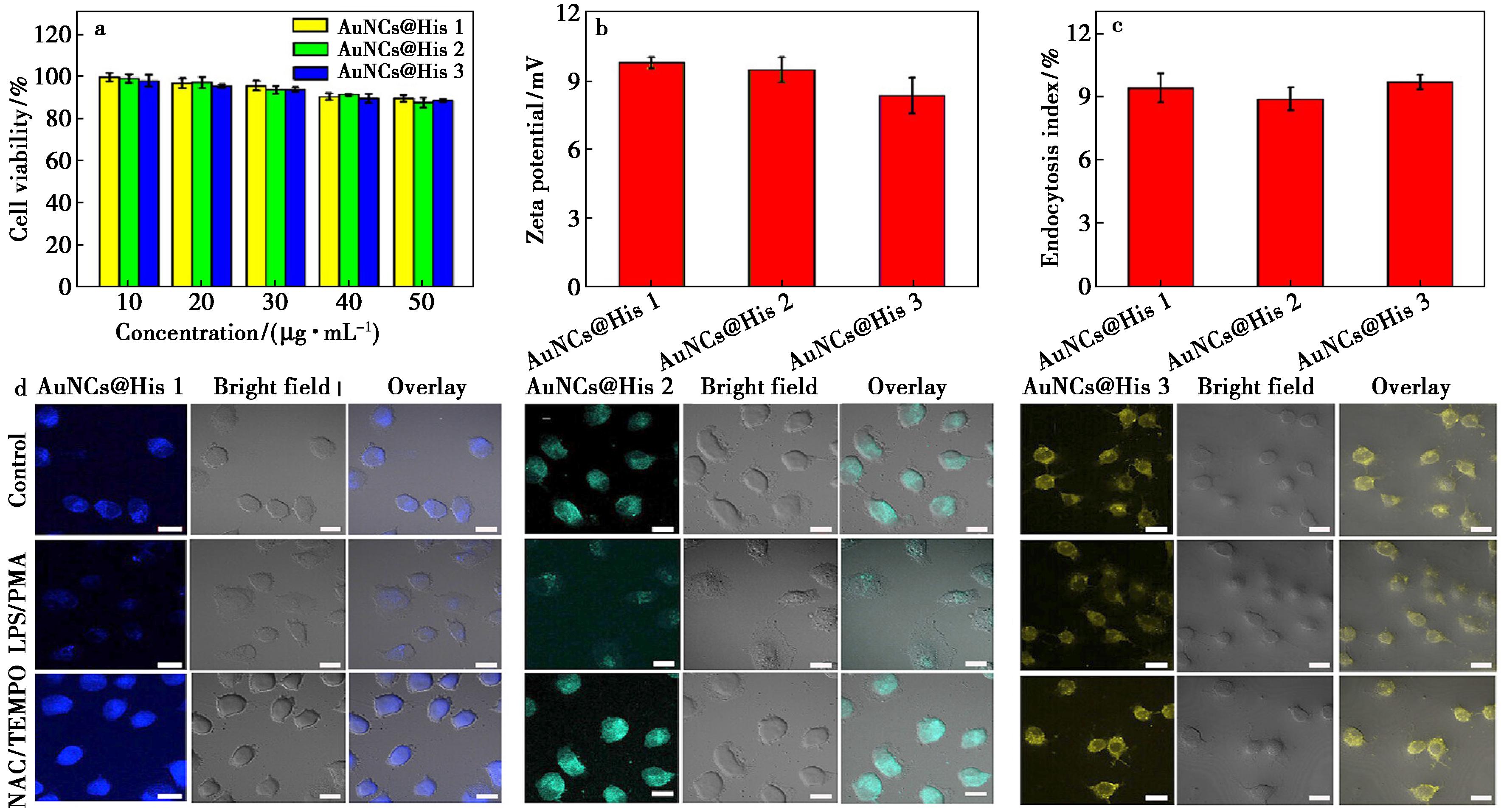
a.不同浓度AuNCs@His 1、2、3分别孵育MDA-MB-231细胞24 h后的细胞存活率;b.AuNCs@His 1、2、3的Zeta电位;c.AuNCs@His 1、2、3的细胞内吞指数,误差棒代表标准偏差(n=4);d.AuNCs@His 1、2、3、LPS/PMA+AuNCs@His 1、2、3和NAC/TEMPO+AuNCs@His 1、2、3分别处理MDA-MB-231细胞的CLSM图像,标尺=20 μm
图4 荧光探针的细胞摄取
Fig.4 Cellular uptake of fluorescent probes
受此启发,进一步评估荧光传感器阵列是否能够区分不同的细胞系。选择6株肿瘤细胞(MGC-803、A549、HepG2、SKOV-3、MDA-MB-231、HeLa)和5株正常细胞(Het-1A、L02、HCAEC、hOMF、HK-2)作为模型。通过流式细胞仪分析AuNCs@His 1、2和3与细胞共孵育后的荧光信号。以NAC/TEMPO预处理的细胞作为对照。如图5a所示,由于ROS的种类和水平不同,不同细胞的荧光响应存在明显差异。从图5b中可以看出,所有细胞系均位于簇中,且彼此明显分开,表明这些细胞被正确地区分。同时,使用层次聚类分析(HCA)分析不同细胞系的相似性。在HCA图中(图5c),正常细胞和癌细胞以100%的准确率被分为两个簇,证明了传感器阵列具有出色的细胞识别能力。接下来,进一步研究了传感器阵列是否能够区分癌细胞的增殖状态。利用该传感器阵列对安徽医科大学第一附属医院收集的12例乳腺癌临床组织样本进行了检测。AuNCs@His 1、2、3对乳腺癌组织中ROS的荧光响应如图5d所示,形成独特的光学“指纹”。所有乳腺癌样本在PCA得分图中正确聚类,以95%置信区间(图5e、5f)将其进一步划分为低、中、高增殖状态对应的3个区域。综上,构建的荧光传感阵列具备有效鉴别癌细胞类型及其增殖状态的能力。
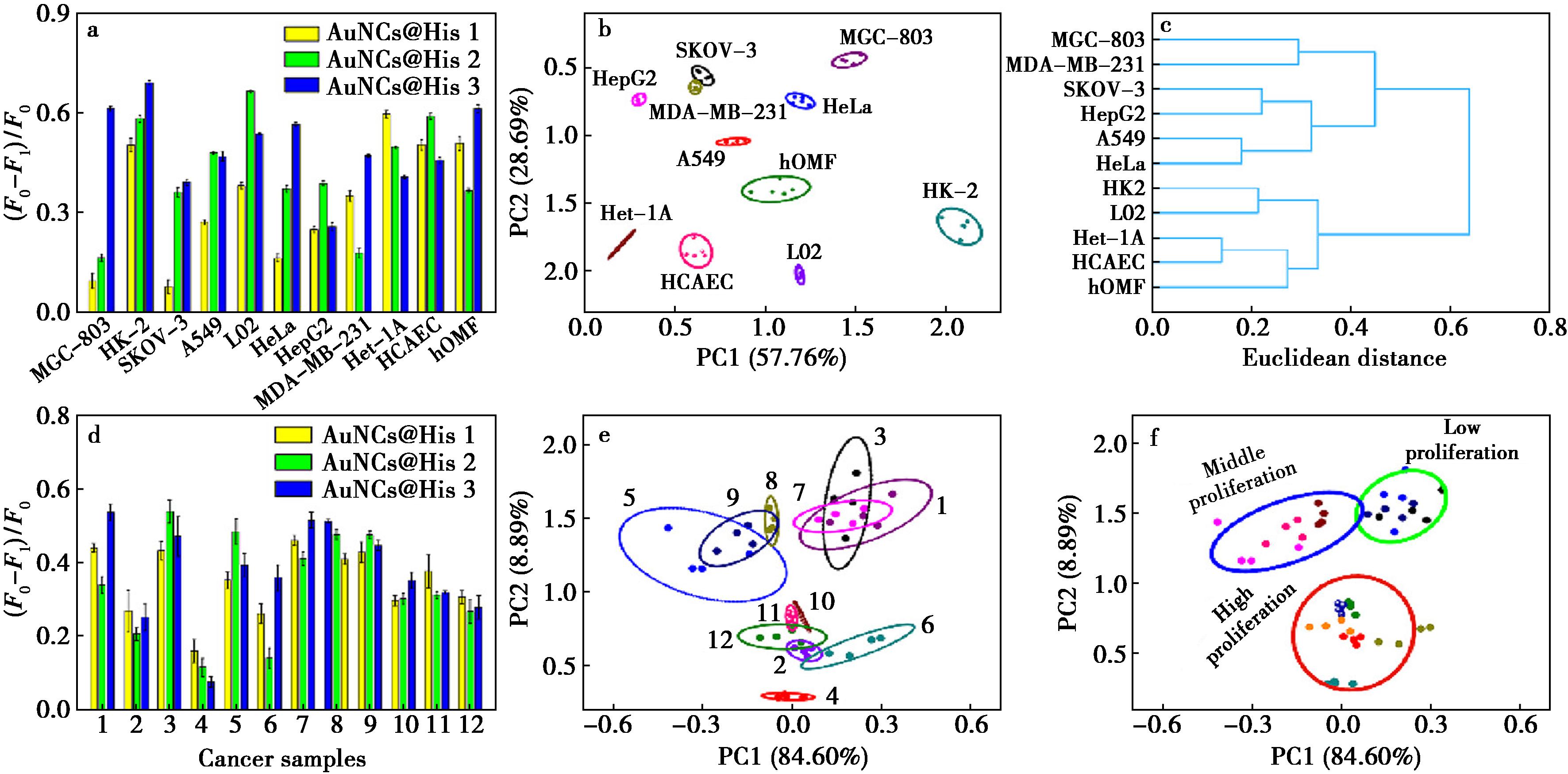
a.荧光阵列传感器分析11株不同细胞的“指纹图谱”(n=5);b.不同细胞的PCA图;c.不同细胞的HCA图;d.荧光阵列传感器分析12例乳腺癌临床样本的“指纹图谱”(n=5);e.12例乳腺癌临床样本的PCA分析;f.PCA分析划分的低、中、高增殖状态
图5 肿瘤细胞的模式识别
Fig.5 Pattern recognition of cancer cells
本文制备了pH可控的多色AuNCs@His 1、2和3,并成功构建了ROS响应的荧光传感器阵列用于癌症的精准诊断。构建的荧光传感器阵列响应6种类型的ROS,从而形成独特的光学“指纹”,通过PCA可以很好地将其聚集成几个独立的组,而不会重叠。基于ROS响应模式,传感器阵列不仅区分了不同的癌细胞,而且区分了它们的增殖状态。与先前报道的方法相比,本文的传感器阵列具有以下突出的优点。首先,具有不同荧光轮廓的单配体修饰的AuNCs具有相似的表面性质,保证了相似的内吞效率。其次,通过使用ROS响应的荧光传感器阵列和PCA,可以快速准确地识别各种癌细胞和癌症增殖状态,从而提高诊断效率。第三,传感器阵列的配置非常简单,没有复杂的合成和昂贵的仪器。总的来说,ROS响应的荧光传感器阵列在癌症的精确诊断方面具有巨大的应用潜力。然而,所提出的传感器阵列不便于癌症的早期诊断。进一步的研究需要开发用于血清ROS模式识别的智能传感器阵列。
[1]Guerra C E,Sharma P V,Castillo B S.Annu.Rev.Med.,2024,75(1):67-81.
[2]Lawrence R,Watters M,Davies C R,Pantel K,Lu Y J.Nat.Rev.Clin.Oncol.,2023,20(7):487-500.
[3]Pan Y W,Wang Y J,Chen X X,Zhang X M,Huo C H.Anal.Lab.,2023,42(10):1 395-1 405.
潘艺文,王钰结,陈晓雯,张晓敏,霍朝晖.分析试验室,2023,42(10):1 395-1 405.
[4]Sasmal R,Das S N,Pahwa M,Rao S,Joshi D,Inamdar M S,Sheeba V,Sgasti S S.Anal.Chem.,2018,90(19):11 305-11 314.
[5]Shi F F,Jiang Y T,Gong G A,Qin J Y,Mei Y.Phys.Test.Chem.Anal.,Part B,2024,60(1):495-501.
史峰峰,蒋裕婷,龚国傲,覃江阳,梅勇.理化检验-化学分册,2024,60(5):495-501.
[6]Sun W,Nan J,Che Y,Shan H,Sun Y,Xu W,Yang B.Biosens.Bioelectron.,2024,261:116 469.
[7]Ecker D M,Jones S D,Levine H L.mAbs,2015,7(1):9-14.
[8]Askim J R,Mahmoudi M,Suslick K S.Chem.Soc.Rev.,2013,42(22):8 649-8 682.
[9]Anzenbacher J P,Lubal P,Bu ek P,Palacios M A,Kozelkova M E.Chem.Soc.Rev.,2010,39(10):3 954-3 979.
ek P,Palacios M A,Kozelkova M E.Chem.Soc.Rev.,2010,39(10):3 954-3 979.
[10]Yang B,Chen Y,Shi J.Chem.Rev.,2019,119(8):4 881-4 985.
[11]Tong L,Chuang C C,Wu S,Zuo L.Cancer lett.,2015,367(1):18-25.
[12]Zhou Z,Song J,Nie L,Chen X.Chem.Soc.Rev.,2016,45(23):6 597-6 626.
[13]Aggarwal V,Tuli H S,Varol A,Thakral F,Yerer M B,Sak K,Sethi G.Biomolecules,2019,9(11):735.
[14]Murphy M P,Holmgren A,Larsson N G,Halliwell B,Chang C J,Kalyanaraman B,Winterbourn C C.Cell Metab.,2011,13(4):361-366.
[15]Zhao S,Zang G,Zhang Y,Liu H,Wang N,Cai S,Wang G.Biosens.Bioelectron.,2021,179:113 052.
[16]Cheung E C,Vousden K H.Nat.Rev.Cancer,2022,22(5):280-297.
[17]Zheng Y,Wei M,Wu H.J.Nanobiotechnol.,2022,20(1):328.
[18]Hong L,Dong W N,Wu Z N,Wang L.Chin.J.Appl.Chem.,2024,41(9):1 238-1 247.
洪乐,董伟男,武振楠,王林.应用化学,2024,41(9):1 238-1 247.
[19]Pei Y,Wang P,Ma Z,Xiong L.Acc.Chem.Res.,2018,52(1):23-33.
[20]Wang Y J,Hu Y X,Sun Y C,Gong T,Guo R.Chem.Reagents,2024,46(8):10-18.
王艺洁,胡怡萱,孙毓琛,弓韬,郭睿.化学试剂,2024,46(8):10-18.
[21]Noreldeen H A A,Huang K Y,Wu G W,Peng H P,Deng H H,Chen W.Anal.Chem.,2022,94(26):9 287-9 296.
[22]Xu S,Lu X,Yao C,Huang F,Jiang H,Hua W,Ouyang J.Anal.Chem.,2014,86(23):11 634-11 639.
[23]Zhao F,Yu H,Liang L,Wang C,Shi D,Zhang X,Ying Y,Cai W,Li W,Li J,Zheng J,Qiao L,Che S,Yu J.Adv.Healthcare Mater.,2023,12(29):2 301 346.
[24]Li S L,Hou H Y,Chu X,Zhu Y Y,Zhang Y J,Duan M D,Liu J,Liu Y.ACS Nano,2024,18(11):7 769-7 795.
[25]Song P,Han X,Li X,Cong Y,Wu Y,Yan J,Wang Y,Wang X,Mu Z,Wang L,Li X,Zhang H.Mater.Horiz.,2023,10(8):2 927-2 935.
[26]Naghaviyan A,Hashemi-moghaddam H,Zavareh S,Ebrahimi V M.Mol.Pharmaceutics,2023,20(1):101-117.
[27]Lu H,Lu Q,Sun H,Wang Z,Shi X,Ding Y,Ran X,Pei J,Pan Y,Zhang Q.ACS Appl.Mater.Interf.,2023,15(32):38 381-38 390.
[28]Xiao F,Chen Y,Qi J,Yao Q,Xie J,Jiang X.Adv.Mater,2023,35(20):221 0412.
[29]Young A J,Sauer M,Rubio G M,Sato A,Foelske A,Serpell C J M,Reithofer M R.Nanoscale,2019,11(17):8 327-8 333.
[30]Chang Y,Chen J Y,Yang J,Lin T,Zeng L,Xu J F,Hu J L,Zhang X.ACS Appl.Mater.Interf.,2019,11(42):38 497-38 502.