SOD纳米类酶的分类及其疾病治疗应用
张思嘉,刘鑫欣,崔岱宗*
(东北林业大学 生命科学学院 黑龙江省酶与类酶工程重点实验室,黑龙江 哈尔滨 150040)
摘要:超氧化物歧化酶(SOD)作为机体内酶抗氧化系统的组分,在消除多余的活性氧(ROS),应对氧化应激,维持氧化还原平衡,使机体处于健康稳定状态发挥重要作用,同时,SOD在疾病治疗、食品、化妆品等方面有着广泛的应用。然而天然SOD存在提取困难、成本高、易失活,以及分子量大,细胞透过性弱等缺点严重限制了其应用。因此近年来,具有替代天然SOD发挥作用的潜力的SOD纳米类酶的研究较为活跃。综述了SOD纳米类酶优势、分类、活性调控,论述了SOD纳米类酶在疾病治疗上应用,总结了SOD纳米类酶面临的挑战和未来的发展方向。SOD纳米类酶在疾病治疗上具有较大的前景,但其发挥作用的机理日趋复杂,需要更深一步的研究。
关键词:超氧化物歧化酶;SOD;纳米类酶;疾病治疗;活性调控
中图分类号:O69
文献标识码:A
文章编号:0258-3283(2025)06-0035-07
DOI:10.13822/j.cnki.hxsj.2024.0301
Classification and Therapeutic Applications of SOD Nanoenzymes
ZHANG Si-jia,LIU Xin-xin,CUI Dai-zong*
(Key Laboratory of Enzyme and Enzyme Engineering of Heilongjiang Province,College of Life Sciences,Northeast Forestry University,Harbin 150040,China)
Abstract:Superoxide dismutase (SOD),as a component of the body′s antioxidant enzyme system,plays an important role in eliminating excess reactive oxygen species (ROS),combating oxidative stress,and maintaining redox balance to keep the body in a healthy and stable state.Additionally,SOD enzymes have been widely applied in disease treatment,food,cosmetics,and other fields.However,natural SOD faces limitations such as difficult extraction,high cost,easy inactivation,large molecular weight,and weak cell permeability,which severely restrict its application.Therefore,in recent years,research on SOD nanoenzymes,which have the potential to replace natural SOD and perform similar functions,has been active.The advantages,classification,activity regulation,and application of SOD nanoenzymes in disease treatment were summarized,and the challenges and future development directions of SOD nanoenzymes were hightlighted.SOD nanoenzymes have great prospects in disease treatment,but their mechanisms of action are becoming increasingly complex and require further research.
Key words:superoxide dismutase;SOD;nanoenzymes;therapeutic applications;activity regulation
收稿日期:2024-08-19;修回日期:2025-03-25
基金项目:黑龙江省大学生创新创业训练计划项目(20231022625142);黑龙江省重点研发计划(创新基地)项目(JD2023SJ14)。
作者简介:张思嘉(2002-),女,辽宁朝阳人,本科生,主要研究方向为生物材料纳米合成及其类酶活性。
通讯作者:崔岱宗,E-mail:siyu19831114@163.com。
超氧化物歧化物酶(SOD)通过催化超氧阴离子自由基的歧化反应,将其转化为氧气和过氧化氢,从而防止超氧阴离子自由基对细胞的损伤。在氧化应激的条件下,过量的ROS能够将细胞内的蛋白质、脂质、DNA等氧化,失去稳态,造成细胞生理紊乱以及损伤,甚至会干扰一系列氧化应激敏感信号通路,引发各种疾病生理问题。保持机体平衡,清除多余的ROS对于细胞维持正常生理代谢功能至关重要。超氧阴离子自由基作为一种前导ROS,是第一个产生的ROS,而且能够转换为其他ROS,发挥着核心作用[1]。因此清除超氧阴离子自由基可以在一定程度上缓解氧化应激状态。SOD无疑是应对氧化应激对细胞造成的损伤的有效武器,在生物体内起着重要的保护作用。
目前,世界各国已经陆续对SOD在疾病治疗功效得到认定,并注册专利号。同时SOD药品已经应用在临床上[2],取得了良好的效果。尽管如此,但是SOD并未在医药领域得到广泛使用。这是因为SOD的自身存在的缺陷[3],如半衰期短、分子量大、不易透过细胞膜、稳定性差、成本高[4]等缺陷限制了其在医药领域大放光彩。因此迫切需要克服了SOD缺陷的模拟物代替SOD在医药领域上大展拳脚。纳米酶的问世为研究SOD模拟物的科学家们带来了希望。纳米酶因其本身材料性质和具有的类酶活性而得名,其本身的理化性质决定了其具有稳定性高、分子量小、半衰期长、成本低等优点。研究具有SOD活性的SOD纳米类酶不仅可以作为克服天然SOD的缺陷的模拟物在医药领域上更上一层楼,也可以代替天然SOD在农业、工业等其他行业发挥作用,促进经济增长。
1 纳米酶优势
自从1969年SOD被首次发现以来[5],研究发现SOD在医药、农业、食品加工等领域[2]具有广泛的应用前景,然而天然酶存在的缺陷限制了其应用[3]。因此,科学家们迫切研究SOD模拟物以替代天然SOD。1970年到2007年期间,科学家大多将目光投入在传统模拟酶研究和改进上,然而,传统模拟酶也存在着一系列问题[6],如:催化效率低,合成复杂,活性位点单一,分离回收困难等。直到2007年Gao等[7]的发现,将无机纳米材料与酶结合起来,揭开了“纳米酶”的序幕。纳米酶其本身的优良特性为模拟酶研究的科学家们带去了希望。
纳米酶是一类既具有纳米材料本身的理化性质(光电磁热力等),又能在较为极端条件下(高低温、酸碱等)发挥类酶催化作用的新型纳米功能材料[8]。与天然酶相比,纳米酶弥补了天然酶的缺陷,使得其能够代替天然酶继续发光发热(表1)。
表1 纳米酶与天然酶优缺点对比
Tab.1 Comparison of nanoenzymes and natural enzymes
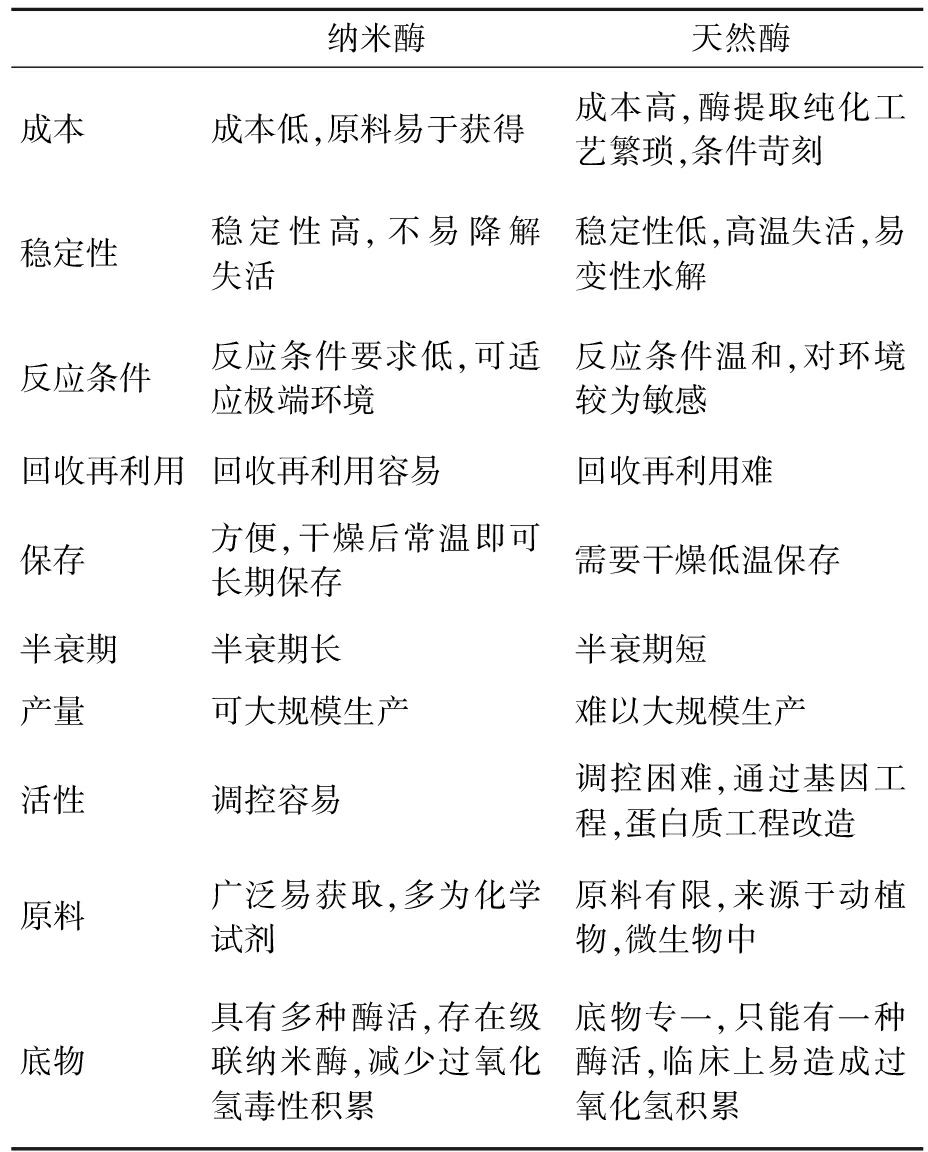
纳米酶天然酶成本 成本低,原料易于获得成本高,酶提取纯化工艺繁琐,条件苛刻稳定性 稳定性高,不易降解失活稳定性低,高温失活,易变性水解反应条件 反应条件要求低,可适应极端环境反应条件温和,对环境较为敏感回收再利用回收再利用容易回收再利用难保存 方便,干燥后常温即可长期保存需要干燥低温保存半衰期 半衰期长半衰期短产量 可大规模生产难以大规模生产活性 调控容易调控困难,通过基因工程,蛋白质工程改造原料 广泛易获取,多为化学试剂原料有限,来源于动植物,微生物中底物 具有多种酶活,存在级联纳米酶,减少过氧化氢毒性积累底物专一,只能有一种酶活,临床上易造成过氧化氢积累
虽然,SOD纳米类酶与天然酶相比有很多优势,但其本身仍存在一些潜在危险及局限性,比如SOD纳米类酶在体内的代谢过程尚不完全清楚,长期使用是否会导致潜在的风险显现,以及SOD纳米类酶除了发挥类酶作用,是否与其他蛋白质相互作用等。
2 SOD纳米类酶分类
自从2007年至今,纳米酶得到了较为全面的研究,不同材料和结构的纳米酶被先后陆续报道。具有SOD活性的纳米酶按照其组成成分分为贵金属SOD纳米类酶、金属氧化物SOD纳米类酶、碳基SOD纳米类酶、复合SOD纳米类酶(表2)[9]。
表2 SOD纳米类酶的应用
Tab.2 Application of SOD nanomimetic enzymes
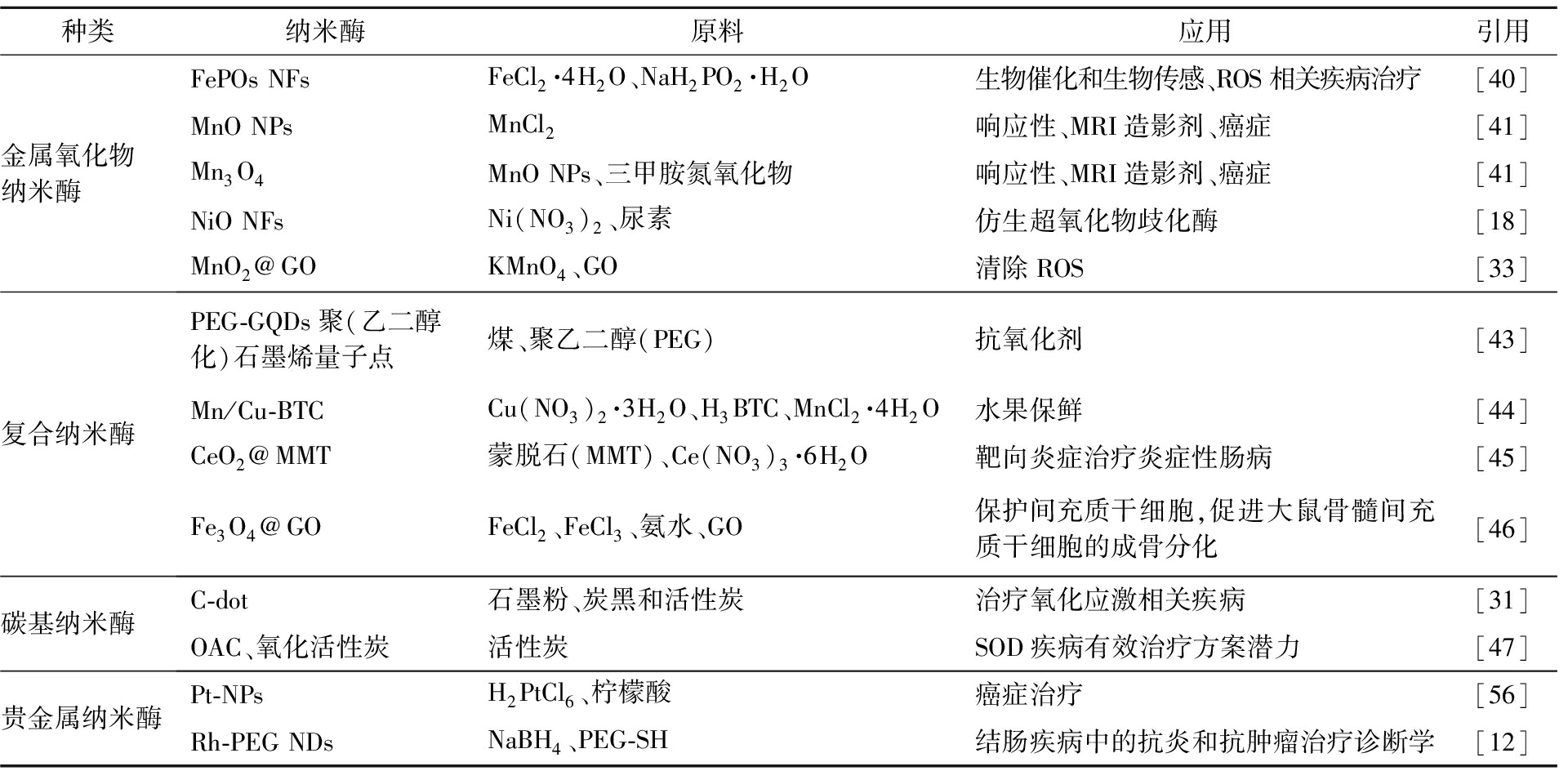
种类纳米酶原料应用引用金属氧化物纳米酶FePOsNFsFeCl2·4H2O、NaH2PO2·H2O生物催化和生物传感、ROS相关疾病治疗[40]MnONPsMnCl2响应性、MRI造影剂、癌症[41]Mn3O4MnONPs、三甲胺氮氧化物响应性、MRI造影剂、癌症[41]NiONFsNi(NO3)2、尿素仿生超氧化物歧化酶[18]MnO2@GOKMnO4、GO清除ROS[33]复合纳米酶PEG-GQDs聚(乙二醇化)石墨烯量子点煤、聚乙二醇(PEG)抗氧化剂[43]Mn/Cu-BTCCu(NO3)2·3H2O、H3BTC、MnCl2·4H2O水果保鲜[44]CeO2@MMT蒙脱石(MMT)、Ce(NO3)3·6H2O靶向炎症治疗炎症性肠病[45]Fe3O4@GOFeCl2、FeCl3、氨水、GO保护间充质干细胞,促进大鼠骨髓间充质干细胞的成骨分化[46]碳基纳米酶C-dot石墨粉、炭黑和活性炭治疗氧化应激相关疾病[31]OAC、氧化活性炭活性炭SOD疾病有效治疗方案潜力[47]贵金属纳米酶Pt-NPsH2PtCl6、柠檬酸癌症治疗[56]Rh-PEGNDsNaBH4、PEG-SH结肠疾病中的抗炎和抗肿瘤治疗诊断学[12]
2.1 贵金属SOD纳米类酶
研究发现,一些贵金属如Pt[10]、Au[11]、Rh[12]等合成的纳米材料也具有类SOD活性。Yin等[11]合成了Au NPs,并发现Au NPs具有SOD活性。Zheng等[10]发现Pt NPs显示出优异的超氧化物歧化酶(SOD)样功能。目前,以Pt为代表的贵金属SOD纳米类酶有望在疾病治疗中得到应用[10]。
2.2 金属氧化物SOD纳米类酶
自从2007年首次发现四氧化三铁具有氧化物酶活性后[7],其他一系列金属氧化物酶(如MnOx NPs、(Co3O4)n、CeO2等)也陆续发现具有类SOD活性。Guo等[13]将密度泛函理论计算与微动力学模型相结合,以证明(Fe3O4)n(n=1~2)表现出模仿SOD的内在活性。2018年,梁敏敏[14]利用水热法合成了Mn3O4纳米酶,通过荧光法、电子顺磁共振、紫外吸收法等分析证明该纳米酶具有SOD活性,酶活性为常用CeO2的2.4倍。Patel等[15]通过电子自旋共振(ESR)光谱分析发现MnOx NPs(MnO2、Mn2O3和Mn3O4 NPs)都具有类SOD活性。同时,文献[16]发现(Co3O4)n纳米颗粒具有SOD活性。目前,对低生物毒性和高生物相容性的CeO2纳米酶的研究较为全面。CeO2也是具有SOD活性的多功能纳米酶。Self等[17]对细胞色素c进行了竞争性分析发现纳米CeO2具有SOD模拟活性。同时通过电子顺磁共振(EPR)测量,也证实了超氧阴离子消除能力。动力学研究表明,尺寸为3~5 nm的CeO2表现出优于天然Zn/Cu SOD的活性。此外,2016年,Mu等[18]首次通过溶剂热法合成了NiO NFs,并发现了具有SOD活性。目前,金属氧化物SOD纳米类酶已经参与到缓解炎症和癌症治疗方面的研究中[14,19]。
2.3 碳基SOD纳米类酶
在碳基SOD纳米类酶中,富勒烯及其衍生物、石墨烯及其衍生物氧化石墨烯(GO)、碳点等碳基纳米材料的酶活性一直备受关注。已经有相关报道证明了它们模拟SOD的催化活性的优越能力。
富勒烯是一类由12个五元环和若干六元环组成的中控笼状分子,自20世纪80年代中期被发现以来就以其独特的结构和新奇的性质而成为科学界研究的热点[20]。1991年,Krusic等[21]初步发现富勒烯能够吸收多个自由基,推测可以充当自由基清除剂发挥作用。Dugan等[22]研究发现水溶性羟基富勒烯,具有清除超氧阴离子自由基和H2O2作用。直到2004年,Ali等[23]提出羟基富勒烯(C60-C3)具有SOD模拟酶的性质。此后,富勒烯及其衍生物的类SOD活性被广泛研究,目前已经有研究报道了富勒烯及其衍生物在调节氧化应激,疾病治疗和维持机体健康的重要作用[24]。
石墨烯(Graphene)是由处于蜂窝状晶体点阵上的碳原子以sp2杂化链接形成的单原子层二维晶体[25]。自从2004年,首次发现以来[26],因其特性,被广泛研究。Chen等[27]通过使用表面等离子共振显微镜(SPRM)观察石墨烯在负电位下的析氧反应,发现石墨烯具有SOD活性。自从2010年以来,Qu等[28]首次发现氧化石墨烯具有类过氧化物酶活性后,其SOD活性也被陆续发现。目前,石墨烯类材料已经在医药领域崭露头角[25]。
碳点(CD)作为新型的碳纳米材料,自2004年被发现以来[29],受到了广泛关注,并陆续发现具有SOD活性[30]。20年来,科学家们致力于研究能够和天然酶活性相媲美的纳米酶,但未得到实质性进展。直到2023年,Gao等[31]报道了一种由活性炭制备的碳点SOD纳米类酶,其催化活性超过10 000 U/mg,与天然酶相当。这可能由于活性炭制备的碳点含有的较高C C含量(71%),提供了较大的π-电子系统,可以促进电子转移。此外,模拟SOD的碳点目前已经被认作为细胞保护剂和几种氧化应激相关疾病的可能治疗方法,包括心脏病、阿尔茨海默病和帕金森病等[32]。由此,以碳点为代表的碳基SOD纳米类酶将有广阔的前景。
C含量(71%),提供了较大的π-电子系统,可以促进电子转移。此外,模拟SOD的碳点目前已经被认作为细胞保护剂和几种氧化应激相关疾病的可能治疗方法,包括心脏病、阿尔茨海默病和帕金森病等[32]。由此,以碳点为代表的碳基SOD纳米类酶将有广阔的前景。
2.4 复合SOD纳米类酶
近年来,研究者在研究开发SOD模拟物时,多将目光投向单一成分的SOD纳米类酶,如一系列贵金属SOD纳米类酶、金属氧化物SOD纳米类酶和碳基SOD纳米类酶等。一方面,单一成分纳米酶活性远不如天然酶,另一方面,即使多功能的单一成分的纳米酶在一定条件下倾向于表达一种酶活,这限制了其临床应用。为了开发出酶活性不逊于天然酶的新型纳米酶,研究者们基于纳米酶的活性受到纳米酶的掺杂,包裹修饰等的调控等原理,开发出来一系列复合纳米酶。Liang等[33]通过改良的Hummers法合成(氧化石墨烯)GO,并将合成的GO与KMnO4共同搅拌加热,孵育后形成MnO2@GO。采用WST-8试剂盒法和TMB法,测定SOD和过氧化物酶活性,发现相同浓度下,MnO2@GO(I.R.=95.5%)的酶活性强于MnO2(I.R.=5.6%)和GO(I.R.=29.6%),同时对超氧阴离子自由基有较高特异性。2023年,Liu等[34]通过Pt4+的原位化学分解将Pt NPs沉积在CNDs(碳量子点)表面,生成新型Pt@CNDs复合纳米酶,该SOD纳米类酶的活性高于单个Pt NPs和CNDs的酶活性,此外,该复合纳米酶实现整合Pt NPs的过氧化氢酶活和CNDs的超氧化物歧化酶活性,实现级联反应,将SOD纳米类酶反应的产物过氧化氢进一步降解,使机体免受积累的过氧化氢毒害,有效缓解活性氧诱导的活体小鼠炎症。目前,复合SOD纳米类酶有望在医药等方面得到应用[33,34]。
3 SOD纳米类酶活性调控
纳米酶的活性并非是一成不变的,其活性可以通过改变理化性质来调控,比如尺寸大小、形态、包裹修饰以及环境因素等[9]。
3.1 尺寸与形貌
SOD纳米类酶的活性受到相对比表面积的影响,而相对比表面积与纳米材料的尺寸和形貌有关。这可能是因为,相对比表面积大的纳米材料,能够提供更多的活性位点,促进反应的进行[9]。Beret等[35]通过研究尺寸分别为4.5、7.8、23和28 nm CeO2颗粒的酶活性,分析发现,在控制铈浓度不变情况下,尺寸为4.5 nm的CeO2颗粒的酶活性最大。严格的密度泛函理论和微动力学建模相结合技术分析发现Co3O4的催化活性很大程度上取决于它们的大小和结构[36]。研究发现[37],在相同的条件下,CeO2纳米棒比CeO2纳米立方体具有更高的催化活性。研究者通过BET法计算发现,纳米棒的比表面积要比纳米立方体的大,同时XPS和Raman分析发现,纳米棒表面有更多的Ce3+,高浓度的Ce3+增强了二氧化铈的还原性。据此可以根据Ce3+与Ce4+含量比值来调节其酶活性[38]。
3.2 包裹修饰掺杂
纳米酶的酶活性除了受到尺寸外貌影响外,还受到包裹修饰的影响。例如,San等[39]分别用PepA、DegP和ClpP蛋白来包裹Pt NPs,分析发现不同的蛋白包裹的Pt NPs的SOD活性不同,其中PepA-PtNPs最高,ClpP-PtNPs次之,而 DegP-PtNPs则要低得多。Barkam等[42]研究不同阴离子(乙酸盐、硝酸盐、氯化物、硫酸盐)修饰的铈纳米颗粒(CNPs)的SOD活性,分析发现,由硝酸铈(Ⅲ)和氯化铈(Ⅲ)合成的CNPs表现出更高程度的SOD模拟活性。Liang等[33]将MnO2和GO结合起来形成MnO2@GO,分析发现,MnO2@GO的酶活性优于单独的MnO2和GO。此外,纳米酶本身的掺杂成分及其比例也对酶活性有影响。陈晨[44]通过溶剂热法制得的Cu为中心、均苯三甲酸(H3BTC)为配体的金属有机框架(MOF)材料,同时以此材料(Cu-BTC)为前驱体,利用锰(Ⅱ)部分交换了Cu-BTC中的铜(Ⅱ),制得了一系列不同Mn掺杂的双金属MOFs材料(Mn/Cu-BTC)。研究发现,当添加的锰(Ⅱ)浓度为0.4 mol/L时,Mn/Cu-BTC材料的类SOD活性最好(记为Mn/Cu-BTC-0.4)。Liu等[48]合成3种Pt含量不同的纳米酶(Pt@PCN222-Mn-1、Pt@PCN222-Mn-3和Pt@PCN222-Mn-5),分析发现,3种纳米酶显现不同的SOD活性。
3.3 环境因素
同时,SOD纳米类酶反应的条件也对酶活性产生影响。例如,Nie等[49]研究发现Pt NPs在中性条件下发挥SOD活性,但在酸性条件下则不然。Pt NPs[50]、Ag NPs在酸性条件下发挥过氧化物酶活性,而在中性和碱性环境中表现出类过氧化氢酶样活性,Pt和Au NPs在中性条件下表现出模拟SOD能力。
4 SOD纳米类酶在疾病治疗上的应用
天然SOD拥有的半衰期短、靶向效果差、分子量大、膜透性差等缺点限制临床应用。目前,迫切需要有效的模拟物来代替天然SOD继续发挥作用。然而,SOD纳米类酶解决了半衰期短,靶向差,血脑屏障渗透性低的问题,有望进一步促进纳米药物在临床治疗中的应用。SOD纳米类酶在疾病治疗上具有广泛的应用潜力,特别是与氧化应激和炎症有关的疾病(表2)。
4.1 心血管疾病
SOD纳米类酶可通过清除超氧阴离子自由基,减轻氧化应激,减少血管损伤,从而对心血管疾病如缺血再灌注损伤和动脉粥样硬化等具有保护作用。
近日,Ding等[51]发现在高同型半胱氨酸血症大鼠心脏IRI模型中静脉注射具有类SOD活性的钒酸铈纳米棒(CVNRs)可以有效的缓解氧化应激,减少了心肌微循环功能障碍和心肌梗死面积,同时具有优异的生物相容性和安全性,在治疗高同型半胱氨酸血症大鼠(HHcyR)心肌微血管缺血-再灌注损伤中展现出比其他具有类SOD活性的化合物更大的潜力,为缺血再灌注损伤的治疗提供了另一种可能。Zheng等[10]合成了Pt-AMP-NP,显示出最优异的抗氧化性能,表明其作为治疗血管疾病如动脉粥样硬化的新药的潜力。
4.2 神经系统疾病
氧化应激是多种神经系统疾病的常见病理生理因素[52]。SOD纳米类酶,由于其能够缓解氧化应激并克服天然SOD的缺陷,在治疗神经系统疾病中显示出巨大潜力,如缺血性中风、帕金森病和神经炎症疾病等。
Gao等[31]团队设计了具有超高类SOD活性的碳点纳米酶(活性>10 000 U/mg),研究发现C-dot SOD纳米类酶表现出对氧化损伤细胞的内在靶向能力,并有效保护缺血性中风雄性小鼠模型中的神经元细胞。Xu等[53]开发了一种三元素纳米酶(PtCuSe纳米酶),它具有理想的CAT和SOD活性,可用于级联清除活性氧(ROS),减轻神经细胞损伤,减轻帕金森病动物模型的行为和病理症状。因此,这种巧妙的三元素纳米酶可能在治疗帕金森病和其他神经退行性疾病方面具有潜力。近日,Ye等[54]开发了一种新型的具有章鱼型不对称结构仿生自驱动纳米马达,表现出较高的CAT和SOD活性,用于中枢神经系统炎症疾病的级联靶向抗炎治疗,为未来中枢神经系统相关疾病的治疗干预提供了一种范式。
4.3 炎症性疾病
SOD纳米类酶也显示出对一些炎症性疾病的治疗潜力,如炎症性肝病、炎症性肠病(IBD)和角膜炎等。它可以通过清除活性氧(ROS)来减轻炎症反应和细胞损伤,改善这些疾病的病理过程。
Liu等[48]开发了一种集成级联纳米酶(Pt@PCN222-Mn),研究发现用级联纳米酶治疗可以有效缓解两种形式的炎症性肠病(IBD;即溃疡性结肠炎和克罗恩病)。Kong等[30]采用水热法制备了一类具有多酶活性(包括SOD活性)的CDs,可用于靶向治疗炎症性肝病。最近,Guo等[55]开发了一种创新的接触镜涂层——接触镜碳化钒涂层(将具有包括超氧化物歧化酶(SOD)样活性的V2CMXene纳米片修饰于角膜接触镜表面),研究发现该接触镜涂层能够有效降低人角膜上皮细胞(HCECs)中的活性氧(ROS)水平,以及显著降低脂多糖(LPS)诱导的RAW264.7细胞的炎症反应。这一创新方法为预防和治疗角膜炎开辟了新思路。
5 SOD纳米类酶缺陷与展望
SOD纳米类酶是一种具有SOD活性的纳米材料,具有清除体内活性氧自由基、抗氧化和抗炎作用。尽管SOD纳米类酶在抗氧化、神经保护等方面具备潜在优势,但也存在一些缺陷和挑战。其缺陷可能包括以下几种:组织特异性,SOD纳米类酶在不同组织和细胞内的渗透性和作用效果可能存在差异,需要针对不同疾病和治疗对象进行优化。目前,口服SOD纳米类酶药物大多应用于治疗肠、胃、口腔等部位的疾病,需要深入研究开发出能够透过肠道屏障进入血液循环的药物。另外,SOD纳米类酶尚未广泛应用于临床,大多处于在模式动物小鼠等研究水平,这可能与其潜在的毒性有关,如纳米酶治疗后的去路尚未得到完全清楚研究,需要进一步研究,以期望早日应用于临床上,为患者带来福音。
SOD纳米类酶的展望:基于以上缺陷需要更深入研究SOD纳米类酶的药代和药动力学以及生物安全性,为未来进一步投入临床中应用提供保障。需要进一步通过纳米技术等手段,实现SOD纳米类酶的靶向传递和释放,提高在特定组织和细胞内的作用效果,降低副作用和毒性。另外,SOD纳米类酶需要进一步深入研究,以期望能够作为口服药送入人体内靶向目标位置。尽管SOD纳米类酶在治疗慢性疾病、神经退行性疾病等方面具有广阔的应用前景,但在面临的挑战中仍需不断进行深入研究和改进。期待未来,SOD纳米类酶在抗氧化治疗和神经保护领域取得更多突破。
参考文献:
[1]Valko M,Rhodes C J,Moncol J,Lzakovic M,Mazur M.Chem.Biol.Interact.,2006,160(1):1-40.
[2]Dong L,He Y Z,Wang Y L,Dong Z Y.J.Agric.Sci.Technol.,2013,15(5):53-58.
董亮,何永志,王远亮,董志扬.中国农业科技导报,2013,15(5):53-58.
[3]Zhang Y L,Xie Y,Wang H J,Hou X P,Liu Y.Acta Pharm.Sin.,2005,(2):173-177.
张云龙,谢英,王会娟,侯新朴,刘艳.药学学报,2005,(2):173-177.
[4]Wu K.Ind.Microbiol.,2023,53(6):84-87.
吴坤.工业微生物,2023,53(6):84-87.
[5]Mccord J M,Fridovich I.J.Biol.Chem.,1969,244(22):6 049-6 055.
[6]Luo S J,Wang Y Y,Rao H B,Wang X X.Chem.Bull.,2017,80(7):642-650.
罗莎杰,王妍媖,饶含兵,王显祥.化学通报,2017,80(7):642-650.
[7]Gao L Z,Zhuang J,Nie L,Yan X Y.Nat.Nanotechnol.,2007,2(9):577-583.
[8]Fan K L,Gao L Z,Wei H,Jiang B,Wang D J,Zhang R F,He J Y,Meng X Q,Wang Z R,Fan H Z,Wen T,Duan D M,Chen L,Jiang W,Lu Y,Jiang B,Wei Y H,Li W,Yuan Y,Dong H J,Zhang L,Hong C Y,Zhang Z X,Cheng M M,Geng X,Hou T Y,Hou Y X,Li J R,Tang G H,Zhao Y,Zhao H Q,Zhang S,Xie J Y,Zhou Z J,Ren J S,Huang X L,Gao X F,Liang M M,Zhang Y,Xu H Y,Qu X G,Yan X Y.Prog.Chem.,2023,35(1):1-87.
范克龙,高利增,魏辉,江冰,王大吉,张若飞,贺久洋,孟祥芹,王卓然,樊慧真,温涛,段德民,陈雷,姜伟,芦宇,蒋冰,魏咏华,李唯,袁野,董海姣,张鹭,洪超仪,张紫霞,程苗苗,耿欣,侯桐阳,侯亚欣,李建茹,汤国恒,赵越,赵菡卿,张帅,谢佳颖,周子君,任劲松,黄兴禄,高兴发,梁敏敏,张宇,许海燕,曲晓刚,阎锡蕴.化学进展,2023,35(1):1-87.
[9]Zhao H Q,Zhang R F,Yan X Y,Fan K L.J.Mat.Chem.B,2021,9(35):6 939-6 957.
[10]Zheng W,Jiang B,Hao Y.Biofabrication,2014,6(4):45 004.
[11]He W W,Zhou Y T,Wayne G W,Hu X N,Wu X C,Zheng Z,Boudreau M D,Yin J J.Biomaterials,2013,34(3):765-773.
[12]Miao Z H,Jiang S S,Ding M L,Sun S Y,Ma Y,Younis M R,He G,Wang J G,Lin J,Cao Z,Huang P,Zha Z B.Nano Lett.,2020,20(5):3 079-3 089.
[13]Guo S,Guo L.J.Phys.Chem.C,2019,123(50):30 318-30 334.
[14]Liang M M.Chin.Sc.Life Sci.,2018,48(6):705-706.
梁敏敏.Chin.Sc.Life Sci.,2018,48(6):705-706.
[15]Jiang X,Gray P,Patel M.J.Mater.Chem.B,2020,8(6):1 191-1 201.
[16]Guo S,Han Y,Guo L.Catal.Surv.Asia.,2020,24:70-85.
[17]Korsvik C,Patil S,Seal S,Self W T.Chem.Commun.,2007,(10):1 056-1 058.
[18]Mu J S,Zhao X,Li J,Yang E C,Zhao X J.J.Mater.Chem.B,2016,4(31):5 217-5 221.
[19]Liu Q W,Zhang A,Wang R H,Zhang Q,Cui D X.Nanomicro.Lett.,2021,13:1-53.
[20]Deng S L,Xie S Y.Prog.Chem.,2011,23(1):53-64.
邓顺柳,谢素原.化学进展,2011,23(1):53-64.
[21]Krusic P J,Wasserman E,Keizer P N.Science,1991,254(5 035):1 183-1 185.
[22]Dugan L L,Lovett E G,Quick K L.Parkinsonism.Relat.Disord.,2001,7(3):243-246.
[23]Ali S S,Hardt J I,Quick K L,Kimhan J S,Erlanger B F,Huang T T,Epstein C J,Dugan L L.Free Radic.Biol.Med.,2004,37(8):1 191-1 202.
[24]Ma H L,Liang X J.Sci.Chi.Chem.,2010,53:2 233-2 240.
[25]Zhang J,Xu S B,Chen J,Liu Q F,Zhang Z R,Geng Z J.Mater.Rev.,2015,29(3):148-151.
张锦,许少波,陈军,刘群峰,张泽荣,耿志杰.材料导报,2015,29(3):148-151.
[26]Novoselov K S,Geim A K,Morozov S V,Jing D,Zhang Y,Dubonos S V,Grigorieva I V,Firsov A A.Science,2004,306(5 696):666-669.
[27]Chen S,Yin C,Huang Z.Int.J.Spons.Am.Carb.Soc.,2022,(1):191.
[28]Song Y J,Qu K G,Zhao C,Ren J S,Qu X G.Adv.Mater.,2010,22(19):2 206-2 210.
[29]Xu X Y,Ray R,Gu Y L,Ploehn H J,Gearheart L,Raker K,Scrivens W A.J.Am.Chem.Soc.,2004,126(40):12 736-12 737.
[30]Kong B,Yang T,Cheng F,Qian Y,Li C,Zhan L,Li Y,Zou H,Huang C.J.Colloid.Interf.Sci.,2022,12:107.
[31]Gao W H,He J Y,Chen L,Meng X Q,Ma Y N,Cheng L L,Tu K S,Gao X F,Liu C,Zhang M Z,Fan K L,Pang D W,Yan X Y.Nat.Commun.,2023,14(1):160.
[32]Sun H J,Zhou Y,Ren J S,Qu X G.Angew.Chem.Int.Ed.,2018,12:469.
[33]Yu Y,Zhang Y N,Wang Y,Chen W X,Guo Z J,Song N N,Liang M M.Nano Res.,2023,16(8):10 763-10 769.
[34]Zhang Y J,Gao W H,Ma Y N,Cheng L L,Zhang L,Liu Q G,Chen J Y,Zhao Y R,Tu K S,Zhang M Z,Liu C.Nano Today,2023,49:101 768.
[35]Baldim V,Bedioui F,Mignet N,Margaill I,Beret J F.Nanoscale,2018,10(15):6 971-6 980.
[36]Guo S,Han Y,Guo L.Catal.Surv.Asia.,2020,24:70-85.
[37]Wei X,Li X,Feng Y.RSC Adv.,2018,8(21):11 764-11 770.
[38]Guo J J,Gao Y F,Zhang X.Chem.Reagents,2022,44(9):1 249-1 256.
郭佳靖,高艳芳,张欣.化学试剂,2022,44(9):1 249-1 256.
[39]San B H,Moh S H,Kim K K.J.Mater.Chem.,2012,5:1 774-1 796.
[40]Wang W,Jiang X,Chen K.Chem.Commun(Camb).,2012,48(58):7 289-7 291.
[41]Ragg R,Schilmann A M,Korschelt K,Wieseotte C,Kluenker M,Viel M,Prei S,Herzberger J,Frey H,Hernze K,Blvmler P,Tahir M N,Natalio F,Tremel W.J.Mater.Chem.B.,2016,4(46):7 423-7 428.
[42]Barkam S,Ortiz J,Sarafs E N,Mccormack R,Das S,Gupta A,Neal C,Petrovici A,Hanson C,Sevilla M D,Adhilary A,Seal S.J.Phys.Chem.C Nanomater.Interf.,2017,121(36):20 039-20 050.
[43]Nilewski L,Mendoza K,Jalilov A S,Berka V,Wu G,Sikkema W,Metzger A,Ye R,Zhang R,Luong D X.ACS Appl.Mater.Interf.,2019,11(18):16 815-16 821.
[44]Chen C.Construction of Mn/Cu Bimetallic Organic Framework Derivatives Nanozymes and Application of Superoxide Dismutase-Like Activity.Zhenjing:Jiangsu University,2023.
陈晨.Mn/Cu双金属有机框架衍生物纳米酶构建及类超氧化物歧化酶性能应用研究[D].镇江:江苏大学,2023.
[45]Zhao S,Li Y X,Liu Q Y,Li S R,Cheng Y.Adv.Funct.Mater.,2020,30(45):2 004 692.
[46]Zhang H,Li S R,Liu Y F,Yu Y J,Lin S C,Wang Q,Miao L Y,Wei H,Sun W B.Biomater.Sci.,2020,8(21):5 984-5 993.
[47]Wu G,Mchugh E A,Berka V.ACS Appl.Nano Mater.,2020,3(7):6 962-6 971.
[48]Liu Y F,Cheng Y,Zhang H,Zhou M,Yu Y J,Liu S C,Jiang B,Zhao X Z,Miao L Y,Wei C W,Liu Q Y,Lin Y W,Du Y,Butch C J,Wei H.Sci.Adv.,2020,6(29):eabb2 695.
[49]Liu Y,Wu H H,Li M,Yin J J,Nie Z H.Nanoscale,2014,6(20):11 904-11 910.
[50]Liu Q W,Zhang A,Wang R H,Zhang Q,Cui D X.Nanomicro.Lett.,2021,13:1-53.
[51]Ding L,Zhang S,Li Y.Chem.Eng.J.,2024,486:1 385-8 947.
[52]Cheng F Y,Kotha S,Fu M,Yang Q,Wang H,He W W,Mao X B.Nano Today,2024,54:102 142.
[53]Xu H,Ding X,Li L.Front.Bioeng.Biotech.,2023,11:1 208 693.
[54]Ye J,Fan Y,She Y.Adv Sci.,2024,1:2 310 211.
[55]Guo H,Chu X,Guo Y.Sci.Adv.,2024,10(15):3 262.
[56]Jawaid P,Rehman M U,Hassan M A,Zhao Q L,Li P,Miyamoto Y,Misawa M,Ogawa R,Shimizu T,Kondo T.Ultrason.Sonochem.,2016,31:206-215.

