人血清淀粉样蛋白A纯品含量的同位素稀释质谱方法研究
朱天翼,李兰英,孟娇然,王乐乐*,李杰,刘刚
(上海市计量测试技术研究院 国家市场监管重点实验室(生物分析计量溯源),上海 201203)
摘要:建立了人血清淀粉样蛋白A(SAA)纯品的液相色谱-同位素稀释串联质谱检测方法。首先采用凝胶电泳和液相色谱法对SAA的纯度进行了表征,然后采用飞行时间质谱对SAA的相对分子量和肽图进行了测定,最后利用氨基酸水解-同位素稀释串联质谱方法对SAA含量进行了准确测定。结果表明,SAA样品纯度为99.39%,实测相对分子质量为 11 678.73 Da,与理论分子量11 682.7 Da高度一致,氨基酸序列覆盖率99.04%,氨基酸水解-同位素稀释串联质谱法的定量结果为80.9 μg/g,扩展不确定度为2.0 μg/g (k=2)。该方法具有较高的精密度和准确度,测量结果可溯源至SI单位,为SAA蛋白标准物质的研制奠定了基础。
关键词:血清淀粉样蛋白A;同位素稀释质谱法;氨基酸;标准物质;不确定度
中图分类号:O655
文献标识码:A
文章编号:0258-3283(2025)06-0021-07
DOI:10.13822/j.cnki.hxsj.2024.0498
Analysis of Content of Human Serum Amyloid A by Isotope Dilution Mass Spectrometry Method
ZHU Tian-yi,LI Lan-ying,MENG Jiao-ran,WANG Le-le*,LI Jie,LIU Gang
(Key Laboratory of Bioanalysis and Metrology for State Market Regulation,Shanghai Institute of Measurement and Testing Technology,Shanghai 201203,China)
Abstract:A liquid chromatography-tandem mass spectrometry (LC-MS/MS) method for the detection of pure human serum amyloid A (SAA) was established.The purity of SAA was initially characterized using sodium dodecyl sulfate polyacrylamide gel electrophoresis and liquid chromatography.Subsequently,the relative molecular weight and peptide map of SAA were determined using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry.The SAA content was then accurately quantified using an amino acid hydrolysis-isotope dilution LC-MS/MS method.The results demonstrated that the purity of the SAA sample was 99.39%,and the measured relative molecular weight was 11 678.73 Da,which was consistent with the theoretical value of 11 682.7 Da.Furthermore,the amino acid sequence coverage rate was found to be 99.04%.The quantitative result of the amino acid hydrolysis-isotope dilution LC-MS/MS method was 80.9 μg/g,with an uncertainty of 2.0 μg/g (k=2).This method exhibits high precision and accuracy,with measurement results traceable to the International System of Units (SI units),laying a solid foundation for the development of SAA protein reference materials.
Key words:serum amyloid A;isotope dilution mass spectrometry;amino acid;certified reference materials;uncertainty
收稿日期:2024-12-27;修回日期:2025-01-20
基金项目:国家市场监督管理总局科技计划项目(2023MK027);上海市计量测试技术研究院青年科技创新项目(H00RY2403)。
作者简介:朱天翼(1997-),男,上海人,硕士,助理工程师,主要研究方向为化学分析测试及标准物质研制。
通讯作者:王乐乐,E-mail:wangll@simt.com.cn。
血清淀粉样蛋白A(Serum amyloid A,SAA)是机体急性期反应过程中产生的特定反应蛋白。当人体受到细菌、病毒等病原体刺激后,SAA蛋白浓度会迅速增加至正常水平的约1 000倍[1,2]。因此,SAA常被用于急性感染性疾病的早期诊断、炎症反应的监测以及病情发展的标志物[3-5]。目前,临床上常用的SAA的检测方法包括酶联免疫吸附法、胶体金免疫层析法、化学发光免疫分析法等[1,6],这些方法具有简单、快速的特点。然而,缺乏SAA标准物质使得临床实验室和诊断试剂厂家难以对试剂产品进行校准,导致测量结果的可比性不足。为了实现对SAA的标准化检测,需要建立一个高准确度、可溯源至国际单位制(SI)[7-9]的定值方法,并研制相关的标准物质。
同位素稀释质谱法(Isotope dilution mass spectrometry,IDMS)具有高准确度、高灵敏度、检测范围广和良好的重复性等优势,已成为国内外计量机构用于蛋白质定量和相关标准物质研制的首选方法[10-12]。蛋白质定量的同位素稀释质谱法根据加入同位素内标的差异可分为氨基酸水平、多肽水平和蛋白质水平的同位素稀释质谱法[13-15]。其中,氨基酸水平同位素稀释质谱法将蛋白质完全水解成氨基酸,再加入已知质量的同位素标记氨基酸作为内标,能够最大限度地消除系统误差与随机误差,保持氨基酸及其同位素标记氨基酸比例不变,从而获得高准确度的蛋白质含量分析结果,特别适用于高纯度蛋白的检测[16-18]。
本研究首先采用凝胶电泳和液相色谱法对SAA的纯度进行了表征,应用基质辅助激光解吸离子化-飞行时间质谱(MALDI-TOF MS)对蛋白相对分子量和质量指纹图谱图进行测定。最后,建立基于氨基酸水解同位素稀释质谱法的SAA样品绝对定量分析方法,并对方法的不确定度进行评估。方法的定量结果可溯源至SI单位,为SAA纯度标准物质的研制以及参考测量方法的建立奠定了基础。
1 实验部分
1.1 主要仪器与试剂
1260 Infinity Ⅱ型高效液相色谱仪(美国 Agilent公司);Acquity I-Class/XEVO TQ-S型液质联用仪(LC MS/MS,美国Waters公司);Autoflex Max型飞行时间质谱仪(德国Bruker公司);XPR205型电子天平(瑞士Mettler Toledo公司);N-EVAP 112型氮吹仪(美国Organomation公司);5810型高速离心机(德国Eppendorf公司);Mini-PROTEAN® Tetra型电泳槽、PowerPacTM型基础电泳仪(美国Bio-Rad公司)。
脯氨酸纯度标准物质(Pro,GBW(E)100084,99.0%)、苯丙氨酸纯度标准物质(Phe,GBW(E)100061,99.9%)、异亮氨酸纯度标准物质(Ile,GBW(E)100057,99.7%)、牛血清白蛋白含量标准物质(BSA,GBW09815)(中国计量科学研究院);13C5-脯氨酸(Pro*)、13C9-苯丙氨酸(Phe*)、13C6-异亮氨酸(Ile*)(99%,美国剑桥同位素实验室);重组人血清淀粉样蛋白A(重组人SAA,上海甄融生物科技有限公司);盐酸(优级纯,37wt%,国药集团化学试剂有限公司);苯酚(99.9%,上海阿达玛斯试剂有限公司);甲酸(质谱纯,美国Fisher公司);其余试剂均为色谱纯,实验用水为超纯水。
1.2 仪器分析条件
1.2.1 色谱条件
Waters Hss T3色谱柱(150 mm×2.1 mm,1.7 μm);进样量:2 μL;流速:0.2 mL/min;流动相:A相为0.1%甲酸水溶液,B相为0.1%甲酸乙腈溶液;梯度条件:0~10 min,2% B;10~11 min,2%~95% B;11~14 min,95% B;14~14.1 min,95%~2% B;14.1~18 min,2% B。
1.2.2 质谱条件
电离方式:电喷雾正离子模式(ESI+);监测模式:多反应监测模式(MRM);喷雾电压:1.0 kV;离子源温度:150 ℃;脱溶剂气温度:500 ℃;脱溶剂气流速:900 L/h;锥孔气路流速:150 L/h。各氨基酸的定量离子对、锥孔电压、碰撞能量信息见表1。
表1 质谱监测氨基酸信息
Tab.1 Amino acid information of mass spectrometry monitoring
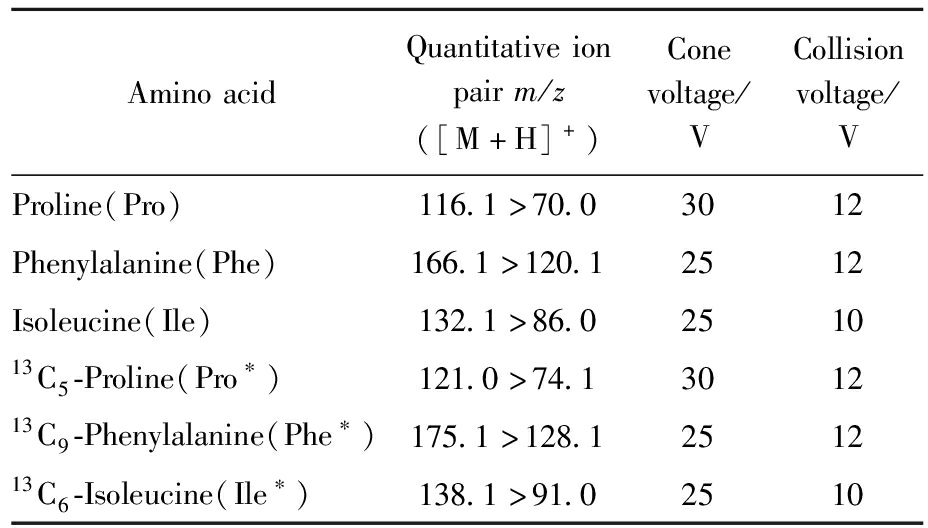
AminoacidQuantitativeionpairm/z([M+H]+)Conevoltage/VCollisionvoltage/VProline(Pro)116.1>70.03012Phenylalanine(Phe)166.1>120.12512Isoleucine(Ile)132.1>86.0251013C5-Proline(Pro∗)121.0>74.1301213C9-Phenylalanine(Phe∗)175.1>128.1251213C6-Isoleucine(Ile∗)138.1>91.02510
1.3 标准溶液配制
氨基酸及氨基酸同位素内标母液的配制:采用重量法配制3种氨基酸及3种同位素内标母液,用电子天平精密称取氨基酸和氨基酸同位素内标固体粉末,分别用体积分数为0.1 mol/L盐酸溶液溶解,分别得到0.2 mg/g 3种氨基酸母液和3种氨基酸同位素内标母液,置于4 ℃冰箱避光保存待用。
氨基酸混合标准溶液的配制:采用重量法精密称取一定量的3种氨基酸母液,加入0.1 mol/L盐酸稀释得到氨基酸混合标准溶液。
氨基酸同位素内标混合标准溶液的配制:采用重量法精密称取一定量的3种氨基酸同位素内标母液,加入0.1 mol/L盐酸稀释得到氨基酸同位素内标混合标准溶液。
低浓度、高浓度混合溶液的配制:按照SAA蛋白质完全水解产物氨基酸含量比例的0.9和1.1倍,分别用电子天平精密称取氨基酸混合标准溶液(低浓度90 μL、高浓度110 μL)和100 μL氨基酸同位素内标混合标准溶液,补加超纯水至1 mL,混合配制得到低浓度、高浓度混合溶液,其中氨基酸与氨基酸同位素内标的浓度比分别为0.9(低浓度)和1.1(高浓度)。
1.4 蛋白质样品的水解
将重组人SAA冻干粉溶于超纯水中,用电子天平精密称量,配制成浓度约为100 μg/g的蛋白溶液,置于-80 ℃低温保存。
水解前将重组人SAA蛋白溶液从-80 ℃冰箱取出,平衡至室温。用电子天平精密称取 50 μL待测蛋白样品和100 μL氨基酸同位素内标混合标准溶液至水解管中,使得氨基酸同位素内标浓度与蛋白质完全水解后氨基酸的理论浓度相一致。氮气吹干后,加入400 μL(6 mol/L)含有0.5%苯酚的盐酸溶液,涡旋混匀并氮吹除氧 2 min后,置于110 ℃恒温水解40 h。水解完成后,将水解管取出并用氮气吹干,加入1 mL 0.1%甲酸水溶液,涡旋混匀并经过0.22 μm滤膜过滤后,待进行LC MS/MS分析。
1.5 蛋白质含量计算
采用括号法对蛋白质的含量进行定量测定,根据式(1)、(2)计算得到重组人SAA蛋白水解后Pro、Phe、Ile 3种氨基酸的浓度,再根据式(3)分别以每种氨基酸浓度计算蛋白浓度。
IR=[RSAA(I2-I1)-(I1R2-I2R1)]/(R2-R1)
(1)
式中,IR是蛋白样品中氨基酸质量比(非标记/标记);RSAA是样品中氨基酸色谱峰面积比(非标记/标记);I1和I2分别是低浓度和高浓度混合溶液中氨基酸质量比(非标记/标记);R1和R2分别是低浓度和高浓度混合溶液中氨基酸色谱峰面积比(非标记/标记)。
cAA=(mIScISIR)/mSAA
(2)
式中,cAA是蛋白样品中Pro、Phe、Ile的浓度,μg/g;mIS是蛋白样品中加入氨基酸同位素内标溶液的质量,mg;cIS是氨基酸同位素内标混合标准溶液的浓度,μg/g;mSAA是重组人SAA蛋白样品的质量,mg。
cSAA=(cAAMSAA)/(MAAn)
(3)
式中,cSAA是重组人SAA蛋白样品的浓度,μg/g;MSAA和MAA分别是重组人SAA蛋白和氨基酸的分子量,Da;n是蛋白样品中氨基酸个数。
由3种氨基酸含量计算得到的蛋白质浓度结果,取平均值作为重组人SAA蛋白的含量定量结果。
2 结果与讨论
2.1 蛋白质样品纯度分析
采用4%~20%的SDS-PAGE预制胶在100 V电泳电压下进行分离,电泳时间60 min。测定结果如图1所示,重组人SAA蛋白条带位于12 kDa左右,与理论11 682.7 Da分子量相吻合,泳道无杂带,说明蛋白纯度较高。
应用HPLC进一步验证重组人SAA蛋白的纯度。将重组人SAA冻干粉溶于超纯水中配制成浓度约为1 mg/mL的溶液,分别进行凝胶排阻色谱(SEC-HPLC)和反相色谱(RP-HPLC)分析。
(1)SEC-HPLC色谱分析
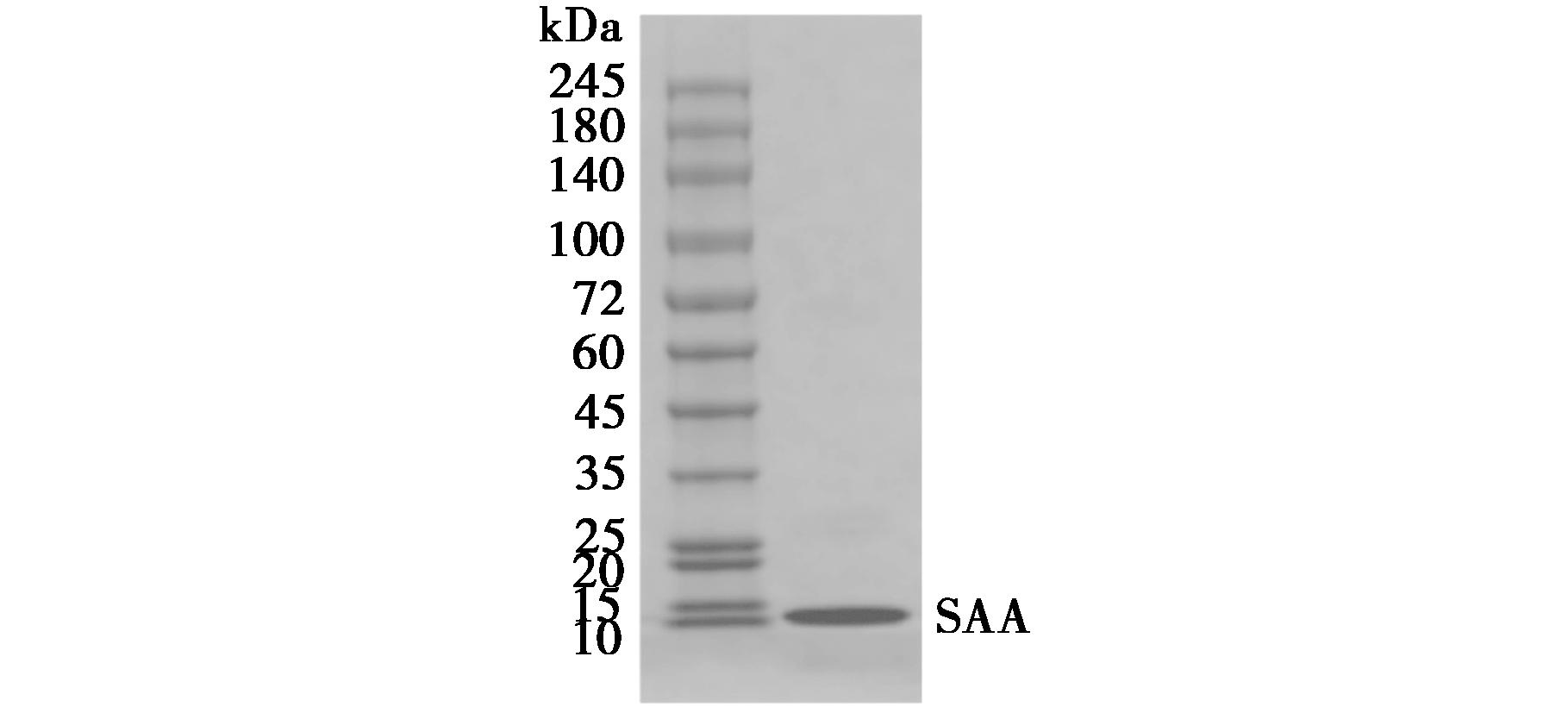
色谱条件:Yarra SEC-4000色谱柱(300 mm×7.8 mm,3 μm);进样量:10 μL;流速:0.5 mL/min;流动相:含有0.3 mol/L NaCl的50 mmol/L磷酸盐缓冲液(pH 6.8);等度洗脱。SEC-HPLC纯度分析结果如图2a所示,二极管阵列检测器(DAD)监测样品在220 nm处的响应值,对样品进行峰面积归一化计算,得到样品中SAA纯度为99.39%。
(2)RP-HPLC色谱分析
色谱条件:Syncronis C18色谱柱(150 mm×4.6 mm);进样量:25 μL;流速:0.6 mL/min;流动相:A:0.1%三氟乙酸-水溶液,B:0.1%三氟乙酸-乙腈溶液;梯度条件:0~18 min,95% A~30% A;18~18.1 min,30% A~5% A;18.1~20 min,5% A;20~20.1 min,5% A~95% A;20.1~25 min,95% A;检测波长:214 nm。RP-HPLC纯度分析结果如图2b所示,样品中未发现除SAA以外的杂质。
2.2 MALDI-TOF MS分子量测定
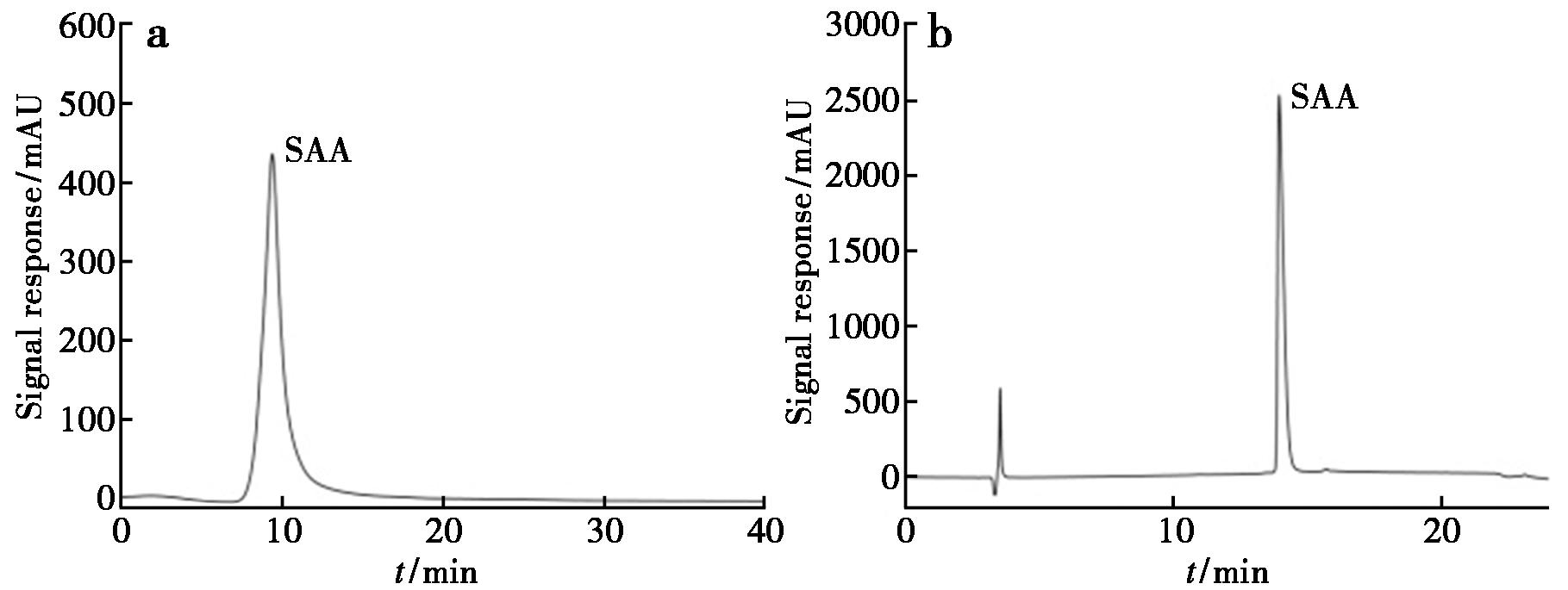
重组人SAA蛋白经过MALDI-TOF MS分析测定其分子量,得到11 678.73 Da单电荷母离子峰和5 841.43 Da双电荷离子峰,结果如图3所示,与理论11 682.7 Da分子量吻合。
2.3 质量指纹图谱分析
重组人SAA蛋白经过胰蛋白酶酶切后,进行MALDI-TOF MS检测,结果通过Mascot蛋白鉴定软件进行分析,检索结果如图4所示,与重组人SAA蛋白的序列覆盖率为99.04%[19],氨基酸序列的高度匹配说明重组人SAA蛋白的序列与理论一致。
2.4 蛋白水解条件优化
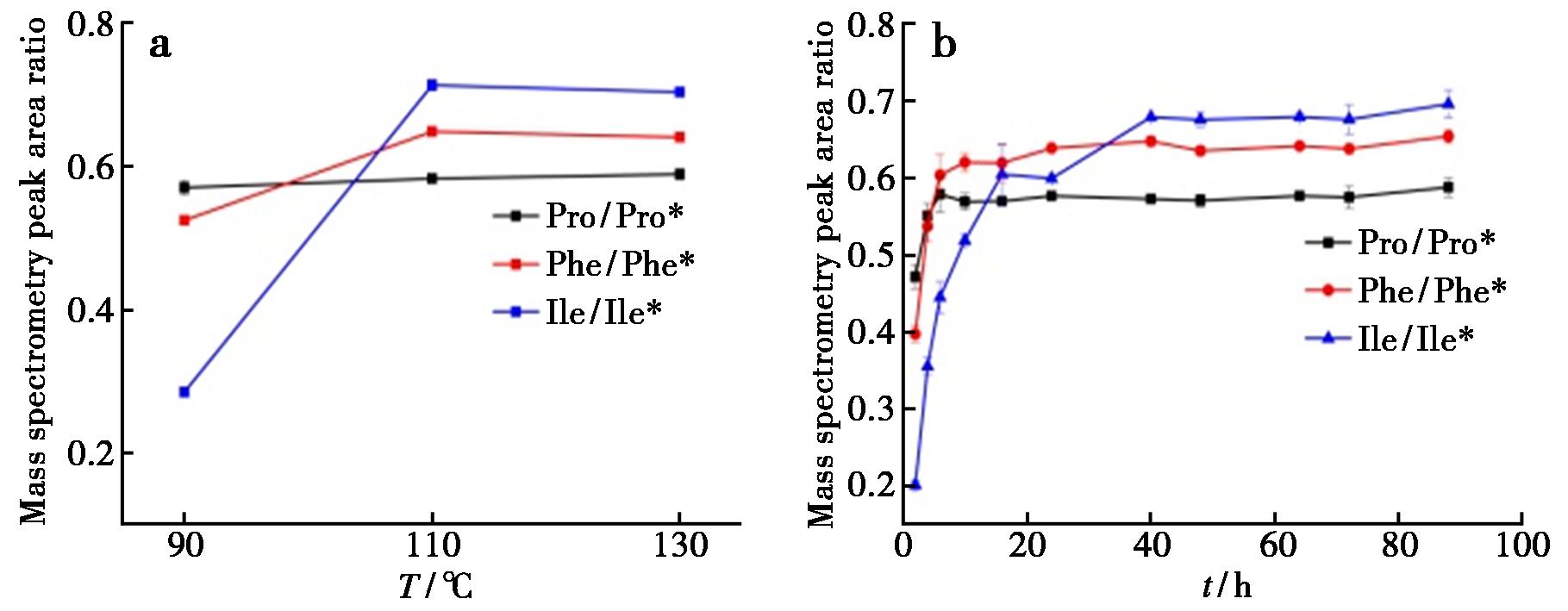
为确保蛋白质能完全酸水解成游离氨基酸,保证定量的准确性和重复性,对影响蛋白质水解效率的水解温度、水解时间、盐酸浓度、水解试剂用量等多种因素进行优化。选择较为稳定的Pro、Phe、Ile 3种氨基酸作为SAA蛋白定量分析对象,并对水解条件进行优化。为避免氮吹过程不能完全将水解体系中氧气除尽,在水解试剂中添加0.5%苯酚作为化学除氧剂,保证氨基酸不会在水解过程中氧化分解[20]。
分别考察水解温度90、110和130 ℃,水解时间2~88 h时,水解后3种氨基酸及其对应同位素内标的质谱峰峰面积比变化趋势,如图5所示。水解温度超过110 ℃,水解时间达到40 h后,氨基酸及其内标的含量没有明显变化,说明SAA水解反应到达平台期,选择110 ℃和40 h作为最优水解条件。
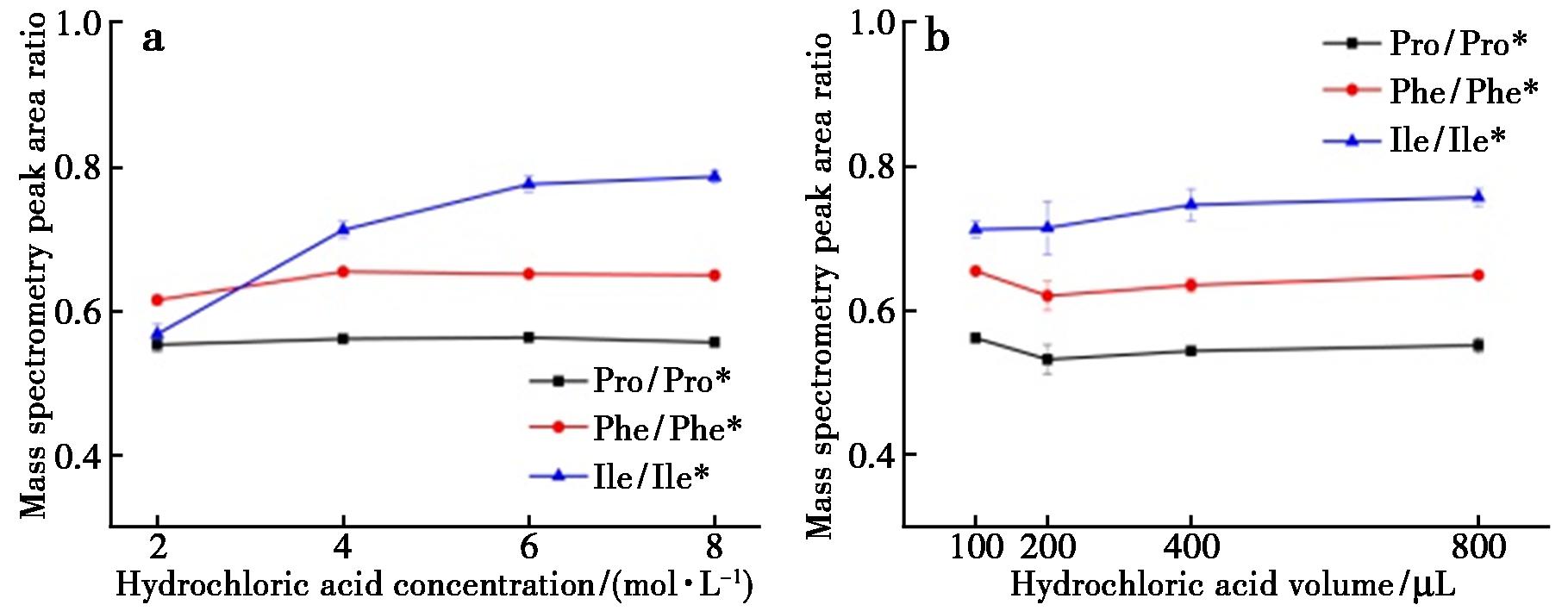
蛋白质酸水解常用盐酸作为水解试剂,在液相水解体系中盐酸浓度和用量与蛋白是否能完全水解密切相关,通过对不同浓度盐酸(2、4、6和 8 mol/L)和盐酸用量(100、200、400和800 μL)的考察表明,当盐酸浓度>6 mol/L、盐酸用量>400 μL时蛋白质水解后氨基酸含量趋于一致,水解体系中过低的酸浓度和体积都会影响水解进程和效率,因此选择400 μL(6 mol/L)盐酸作为蛋白水解试剂。
2.5 线性范围、检出限和定量限
分别移取2、5、10、20、50、100、200、500 μL氨基酸混合标准溶液和100 μL氨基酸同位素内标混合标准溶液,混合配制得到8个不同浓度的标准系列工作液,其中氨基酸及其对应同位素内标的浓度比分别为0.02∶1、0.05∶1、0.1∶1、0.2∶1、0.5∶1、1∶1、2∶1、5∶1,进行LC MS/MS分析。以氨基酸及其对应同位素内标的浓度比为横坐标,质谱峰面积比为纵坐标,作线性回归得到线性方程和相关系数,分别以3倍和10倍信噪比计算方法的检出限和定量限,结果见表2。
表2 氨基酸的线性方程、相关系数、检出限、定量限
Tab.2 Linear equations,correlation coefficients,detection limits,and quantification limits for amino acids
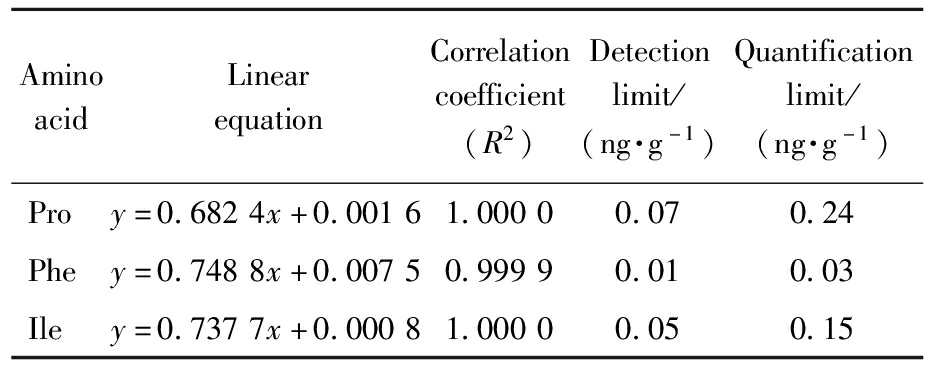
AminoacidLinearequationCorrelationcoefficient(R2)Detectionlimit/(ng·g-1)Quantificationlimit/(ng·g-1)Proy=0.6824x+0.00161.00000.070.24Phey=0.7488x+0.00750.99990.010.03Iley=0.7377x+0.00081.00000.050.15
2.6 方法正确度验证
为了进一步验证本方法的准确可靠,选择GBW09815牛血清白蛋白含量标准物质进行测试。采用1.4中建立的测试方法,将该标准物质平行处理3份,每份重复检测3次,根据Pro、Phe、Ile 3种氨基酸测得值分别计算蛋白浓度,取平均值得到BSA蛋白浓度为0.893 g/g,测定结果在标准物质证书所示标准物质(0.903±0.038) g/g参考值范围内,进一步证明所建立方法具有良好的正确度。
2.7 定量分析重组人SAA蛋白
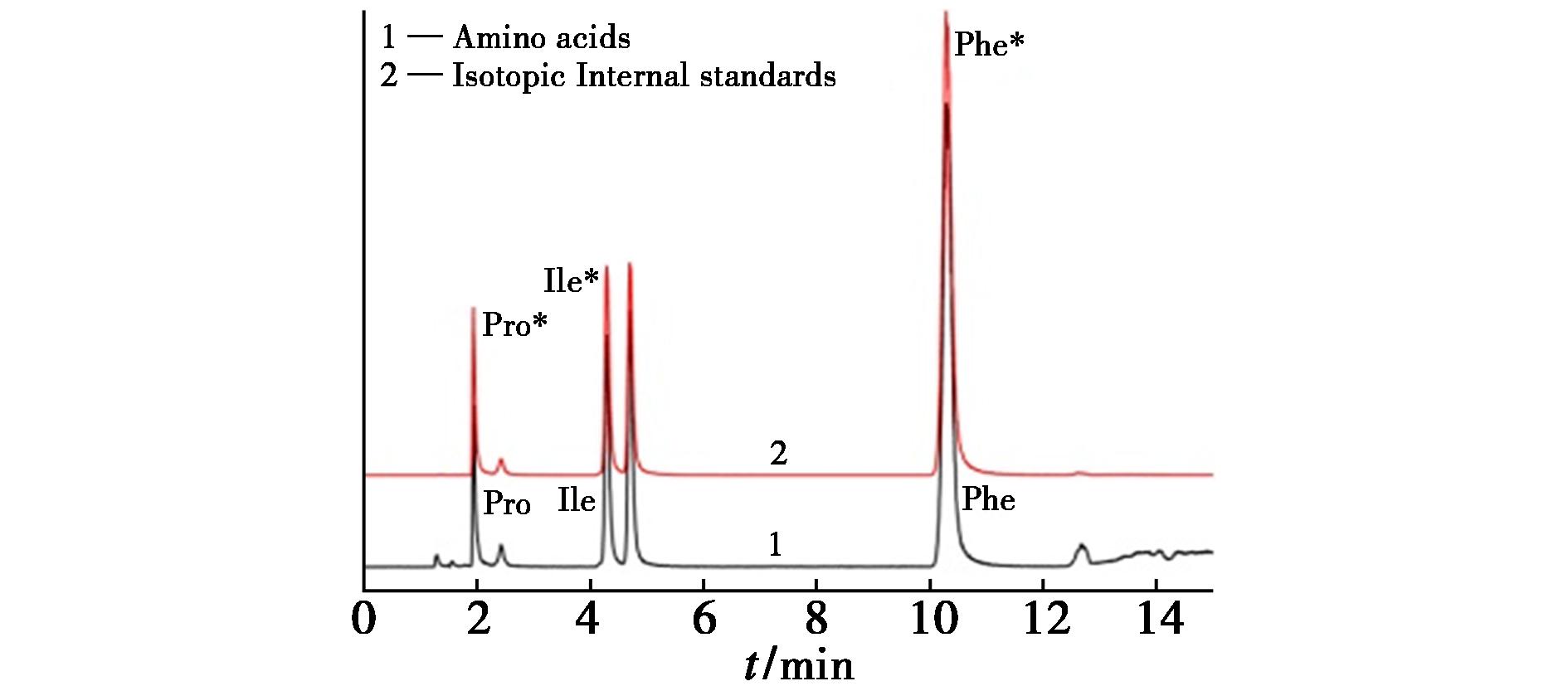
采用建立的方法,测定重组人SAA蛋白水解产物中3种氨基酸及3种同位素内标的质谱峰面积,总离子流图见图7。取6个平行样品,每份重复检测3次,结果见表3。测量得到重组人SAA蛋白含量为80.87 μg/g,测定结果的相对标准偏差为1.79%,表明该方法测定重组人SAA蛋白样品浓度具有良好的重复性。
表3 重组人SAA蛋白定量分析结果
Tab.3 Quantitative analysis results of recombinant human SAA protein
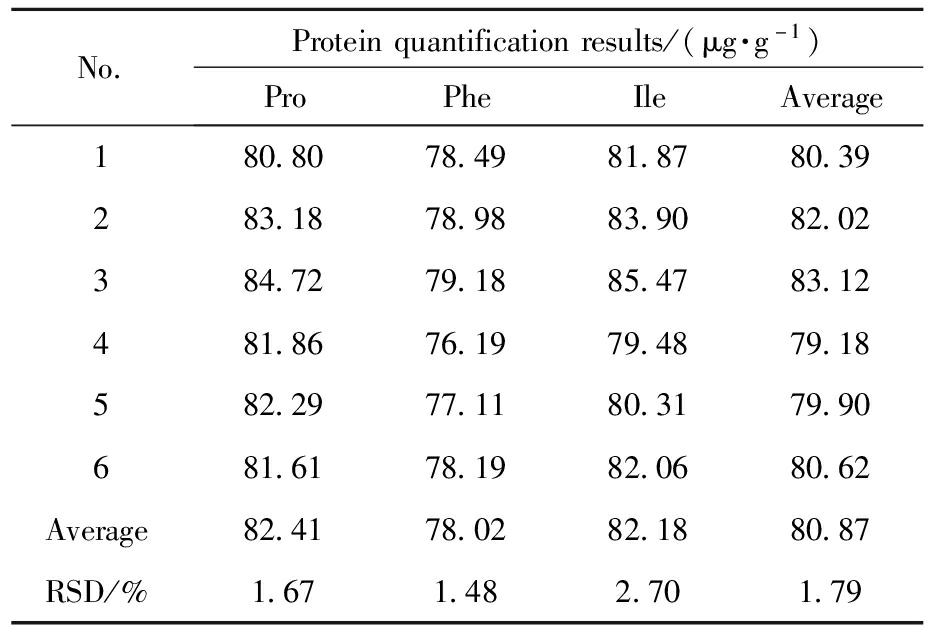
No.Proteinquantificationresults/(μg·g-1)ProPheIleAverage180.8078.4981.8780.39283.1878.9883.9082.02384.7279.1885.4783.12481.8676.1979.4879.18582.2977.1180.3179.90681.6178.1982.0680.62Average82.4178.0282.1880.87RSD/%1.671.482.701.79
3 测量结果的不确定度评定
根据1.5中式(1)、(2)、(3),分别计算每一种氨基酸定量SAA的不确定度主要来源于:蛋白样品中氨基酸质量比(非标记/标记)、SAA样品的质量、样品中加入氨基酸同位素内标的质量、方法测量的重复性、水解效率引入的不确定度。
3.1 蛋白样品中氨基酸质量比(非标记/标记)引入的不确定度
根据括号法得到蛋白样品中氨基酸质量比(非标记/标记)引入的不确定度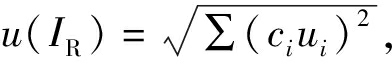 其中ci为各分量的灵敏系数,ui为各分量的不确定度。其不确定度由低浓度(高浓度)混合溶液中氨基酸质量比(非标记/标记)、低浓度(高浓度)混合溶液中氨基酸色谱峰面积比(非标记/标记)、样品中氨基酸色谱峰面积比(非标记/标记)5个分量引入的不确定度分量合并得到,各分量的灵敏系数和不确定度分量见表4。
其中ci为各分量的灵敏系数,ui为各分量的不确定度。其不确定度由低浓度(高浓度)混合溶液中氨基酸质量比(非标记/标记)、低浓度(高浓度)混合溶液中氨基酸色谱峰面积比(非标记/标记)、样品中氨基酸色谱峰面积比(非标记/标记)5个分量引入的不确定度分量合并得到,各分量的灵敏系数和不确定度分量见表4。
表4 蛋白样品中氨基酸质量比(非标记/标记)引入的不确定度
Tab.4 Uncertainty introduced by the mass ratio of amino acids (unlabeled/labeled) in protein samples
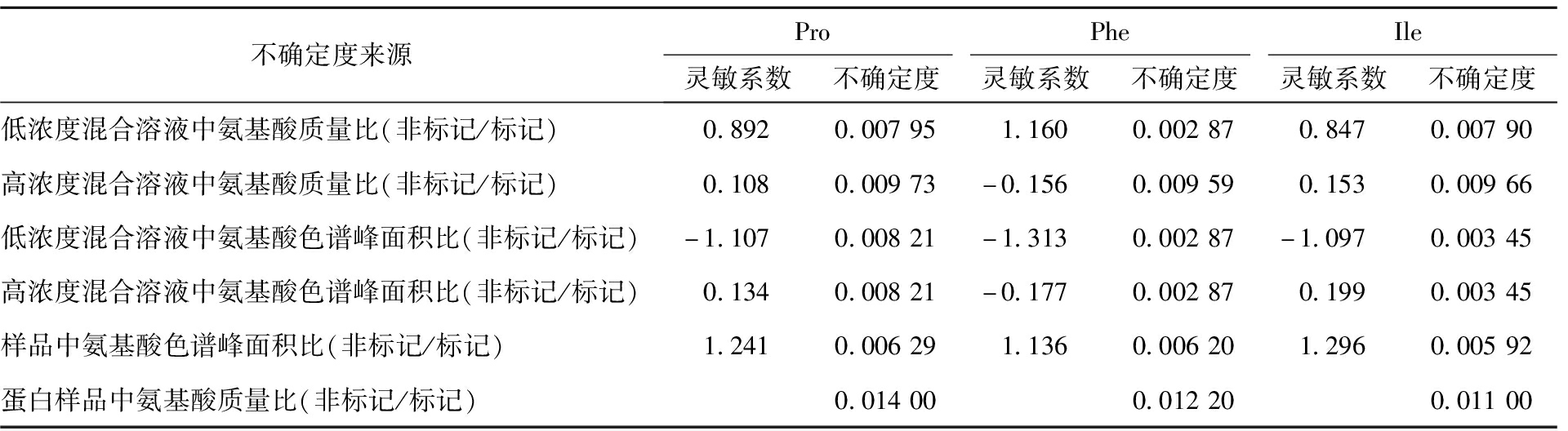
不确定度来源ProPheIle灵敏系数不确定度灵敏系数不确定度灵敏系数不确定度低浓度混合溶液中氨基酸质量比(非标记/标记)0.8920.007951.1600.002870.8470.00790高浓度混合溶液中氨基酸质量比(非标记/标记)0.1080.00973-0.1560.009590.1530.00966低浓度混合溶液中氨基酸色谱峰面积比(非标记/标记)-1.1070.00821-1.3130.00287-1.0970.00345高浓度混合溶液中氨基酸色谱峰面积比(非标记/标记)0.1340.00821-0.1770.002870.1990.00345样品中氨基酸色谱峰面积比(非标记/标记)1.2410.006291.1360.006201.2960.00592蛋白样品中氨基酸质量比(非标记/标记) 0.01400 0.01220 0.01100
表5 SAA定量分析结果的不确定度汇总
Tab.5 Summary of uncertainty from SAA quantitative analysis result
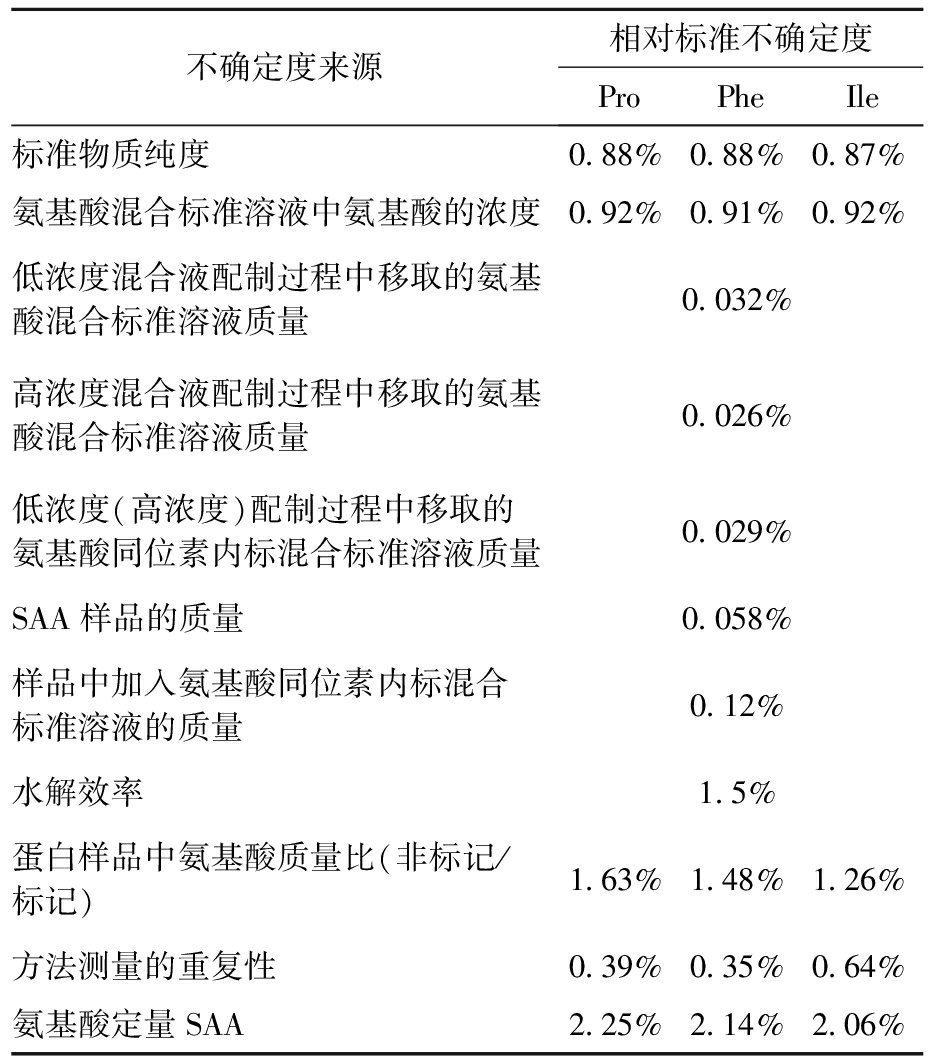
不确定度来源相对标准不确定度ProPheIle标准物质纯度0.88%0.88%0.87%氨基酸混合标准溶液中氨基酸的浓度0.92%0.91%0.92%低浓度混合液配制过程中移取的氨基酸混合标准溶液质量0.032%高浓度混合液配制过程中移取的氨基酸混合标准溶液质量0.026%低浓度(高浓度)配制过程中移取的氨基酸同位素内标混合标准溶液质量0.029%SAA样品的质量0.058%样品中加入氨基酸同位素内标混合标准溶液的质量0.12%水解效率1.5%蛋白样品中氨基酸质量比(非标记/标记)1.63%1.48%1.26%方法测量的重复性0.39%0.35%0.64%氨基酸定量SAA2.25%2.14%2.06%
3.1.1 低浓度(高浓度)混合溶液中氨基酸质量比(非标记/标记)引入的不确定度
混合溶液中氨基酸与同位素内标的质量比 I=(mAAcAA)/(mIScIS),其中mAA、mIS分别为移取的氨基酸混合标准溶液和氨基酸同位素内标混合标准溶液的质量,cAA、cIS分别为移取的氨基酸混合标准溶液和氨基酸同位素内标混合标准溶液的浓度。由于测量结果与同位素内标混合标准溶液的浓度无关,在计算过程中会抵消,因此氨基酸混合标准溶液中氨基酸与同位素内标的质量比引入的不确定度仅与另外3个分量相关。
(1)氨基酸混合标准溶液的浓度引入的不确定度:氨基酸混合标准溶液由0.2 mg/g氨基酸母液按重量法配制得到,其不确定度由氨基酸母液配制过程、移取氨基酸母液的质量、氨基酸混合标准溶液总质量3个不确定度分量组成,其中氨基酸母液配制过程引入的不确定度由氨基酸标准物质的纯度、氨基酸标准物质的质量和氨基酸母液总质量组成。
在称量氨基酸混合标准溶液总质量、氨基酸母液总质量时,天平在该量程的最大允许误差为±0.5 mg。而在称量移取氨基酸母液的质量、氨基酸标准物质的质量时,天平在该量程的最大允许误差为±0.05 mg。分别计算得到相对标准不确定度,合成得到氨基酸混合标准溶液的浓度引入的相对标准不确定度。
(2)移取的氨基酸混合标准溶液和氨基酸同位素内标混合标准溶液的质量引入的不确定度:天平在该量程的最大允许误差为±0.05 mg,计算得到称量引入的相对标准不确定度。
采用方和根合成分别得到低浓度(高浓度)混合溶液中氨基酸质量比(非标记/标记)引入的不确定度,计算结果见表4。
3.1.2 低浓度(高浓度)混合溶液中氨基酸色谱峰面积比(非标记/标记)引入的不确定度
仪器测量过程中氨基酸色谱峰面积比(非标记/标记)引入的不确定度主要由仪器的重复性引入[21]。用仪器重复测量低浓度混合溶液9次,得到9组峰面积比并计算标准偏差SD1实际定值过程中混合溶液重复测量3次取平均值,则低浓度混合溶液中氨基酸色谱峰面积比(非标记/标记)引入的标准不确定度为: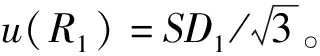 由于低浓度和高浓度混合溶液的进样浓度较为接近,两者引入的标准不确定度相同。
由于低浓度和高浓度混合溶液的进样浓度较为接近,两者引入的标准不确定度相同。
3.1.3 样品中氨基酸色谱峰面积比(非标记/标记)引入的不确定度
与3.1.2中不确定度评定方法类似,用仪器重复测量样品溶液9次,得到9组峰面积比并计算标准偏差SDSAA,引入的标准不确定度为: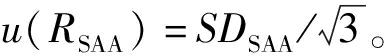
3.2 SAA样品的质量、样品中加入氨基酸同位素内标的质量引入的不确定度
天平在该量程的最大允许误差为±0.05 mg,分别计算得到SAA样品的质量和样品中加入氨基酸同位素内标混合标准溶液的质量引入的相对标准不确定度。
3.3 方法测量的重复性引入的不确定度
根据A类不确定度评估方法,由样品重复测定结果的相对标准偏差计算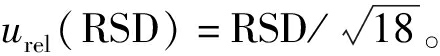
3.4 水解效率引入的不确定度
根据文献和前期定值经验[22,23],水解效率引入不确定度估计为1.5%。
分别计算得到3种氨基酸定量SAA的标准不确定度,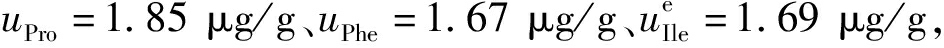 合成得到血清淀粉样蛋白A定量方法的标准不确定度
合成得到血清淀粉样蛋白A定量方法的标准不确定度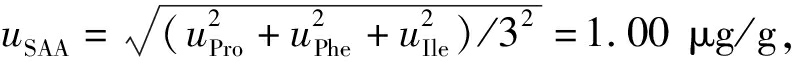 结果的扩展不确定U=2.0 μg/g(k=2),重组人SAA蛋白含量的检测结果为(80.9±2.0) μg/g。
结果的扩展不确定U=2.0 μg/g(k=2),重组人SAA蛋白含量的检测结果为(80.9±2.0) μg/g。
4 结论
本研究采用氨基酸同位素标记物作为内标,在经过优化蛋白质样品酸水解过程中各影响因素的基础上,建立了基于氨基酸水解同位素稀释质谱法的血清淀粉样蛋白A定量分析方法。通过对蛋白质水解产物中Pro、Phe、Ile 3种氨基酸的定量和不确定度评定,得到样品中SAA蛋白含量为(80.9±2.0) μg/g。经验证,该方法的测定结果准确可靠,具有较高的精密度和准确度,测量结果可溯源至SI单位,为SAA纯度标准物质的研制以及参考测量方法的建立奠定了基础。
参考文献:
[1]Zhou Q Y,Huang J R,Chen X,Wang C X.J.Biol.,2019,36(4):85-88.
周齐洋,黄建荣,陈祥,王春新.生物学杂志,2019,36(4):85-88.
[2]Frühbeck G,Catal n V,Rodríguez A,Ramírez B,Becerril S,Salvador J,Portincasa P,Colina I,Gómez-ambrosi J.Sci.Rep.,2017,7(1):6 619.
n V,Rodríguez A,Ramírez B,Becerril S,Salvador J,Portincasa P,Colina I,Gómez-ambrosi J.Sci.Rep.,2017,7(1):6 619.
[3]Schweizer J,Bustamante A,Lapierre-fétaud V,Faura J,Scherrer N,Azurmendi G L,Fluri F,Schütz V,Luft A,Boned S,Sanchez J C,Montaner J,Katan M.Stroke,2020,51(12):3 523-3 530.
[4]Lannergård A,Larsson A,Friman G,Ewald U.Acta Paediatr.,2008,97(8):1 061-1 065.
[5]Carvallo A,Veleiro B,Sabaté-brescó M,Baeza M L,Guilarte M,Herrera-lasso V,Rodríguez-garijo N,Diaz donado C,Labrador-horrillo M,Ferrer M.J.Allergy Clin.Immun.,2024,12(1):195-200.
[6]Liu S Y,Li K W,Wang X H,Li Z H,Wang Z F,Zhu Z G.Anal.Lab.,2023,42(1):1 552-1 562.
刘淑媛,李凯文,王星皓,李崭虹,王子峰,朱志刚.分析试验室,2023,42(1):1 552-1 562.
[7]Milton M J T,Wielgosz R I.Metrologia,2000,37(3):199.
[8]Poole S,Walker D,Gaines D R E,Gallimore J R,Pepys M B.J.Immunol.Methods,1998,214(1):1-10.
[9]Lu X H,Bo M,Wu X,Lu L,Wang B.Chem.Reagents,2022,44(10):1 403-1 410.
卢晓华,薄梦,吴雪,陆琳,汪斌.化学试剂,2022,44(10):1 403-1 410.
[10]Yan R,Lin J,Chen X S,Han N.Chin.Metrol.,2023,(11):96-102.
燕茹,林婧,陈心硕,韩宁.中国计量,2023,(11):96-102.
[11]Chen X,Shi L H,Wu L Q,Jin Y X.Chin.Meas.Test,2023,49(11):166-175.
赵旭,石莲花,武利庆,金有训.中国测试,2023,49(11):166-175.
[12]Tran T T H,Kim J,Rosli N,Mok I,Oh K H,Lee H,Hong S P,Jin Y X,Wu L,Wang J,Sakaguchi Y,Kinumi T,Takatsu A,Kim S K,Jeong J S.J.Chromatogr.B,2019,1 126/1 127:121 732.
[13]Zhang C L,Song D W,Sun W,Liu Y,Xiao P,Li H M.Life Sci.Instrum.,2016,14(Z1):47-50.
张春鹂,宋德伟,孙巍,刘钰,肖鹏,李红梅.生命科学仪器,2016,14(Z1):47-50.
[14]Ji H,Wang J,Ju S,Cong H,Wang X,Su J,Wang H.J.Chromatogr.B,2017,1 059:49-55.
[15]Liu J Y,Zhang J P,Bo M,Song D W.Meas.Tech.,2020,(7):8-12.
刘健仪,张金萍,薄梦,宋德伟.计量技术,2020,(7):8-12.
[16]Wang X X,Wu L Q,Yang B,Zhang N,Su P,Yang Y.Curr.Biotechnol.,2020,10(6):597-606.
王仙霞,武利庆,杨彬,张宁,苏萍,杨屹.生物技术进展,2020,10(6):597-606.
[17]Bi J,Wu L,Yang B,Yang Y,Wang J.Anal.Bioanal.Chem.,2012,403(2):549-554.
[18]Zhu W,Ni X R,Xu S.Metrol.Meas.Tech.,2022,49(7):12-14.
朱文,倪鑫茹,徐昇.计量与测试技术,2022,49(7):12-14.
[19]Sack G H.Mol.Med.,2018,24(1):46.
[20]Mu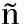 oz A,Kral R,Schimmel H.Anal.Biochem.,2011,408(1):124-131.
oz A,Kral R,Schimmel H.Anal.Biochem.,2011,408(1):124-131.
[21]Wang H F,Ying J N.Chem.Reagents,2020,42(11):1 327-1 330.
万浩芳,应佳妮.化学试剂,2020,42(11):1 327-1 330.
[22]Liu Y,Song D W,Zhang F Y,Li H M,Xu B,Dai X H,Sun H Y,Chen B R.J.Chin.Mass Spectrom.Soc.,2017,38(6):640-646.
刘钰,宋德伟,张方彦,李红梅,徐蓓,戴新华,孙慧颖,陈宝荣.质谱学报,2017,38(6):640-646.
[23]Wu L,Yang B,Bi J,Wang J.Anal.Bioanal.Chem.,2011,400(10):3 443-3 449.





 n V,Rodríguez A,Ramírez B,Becerril S,Salvador J,Portincasa P,Colina I,Gómez-ambrosi J.
n V,Rodríguez A,Ramírez B,Becerril S,Salvador J,Portincasa P,Colina I,Gómez-ambrosi J. oz A,Kral R,Schimmel H.
oz A,Kral R,Schimmel H.