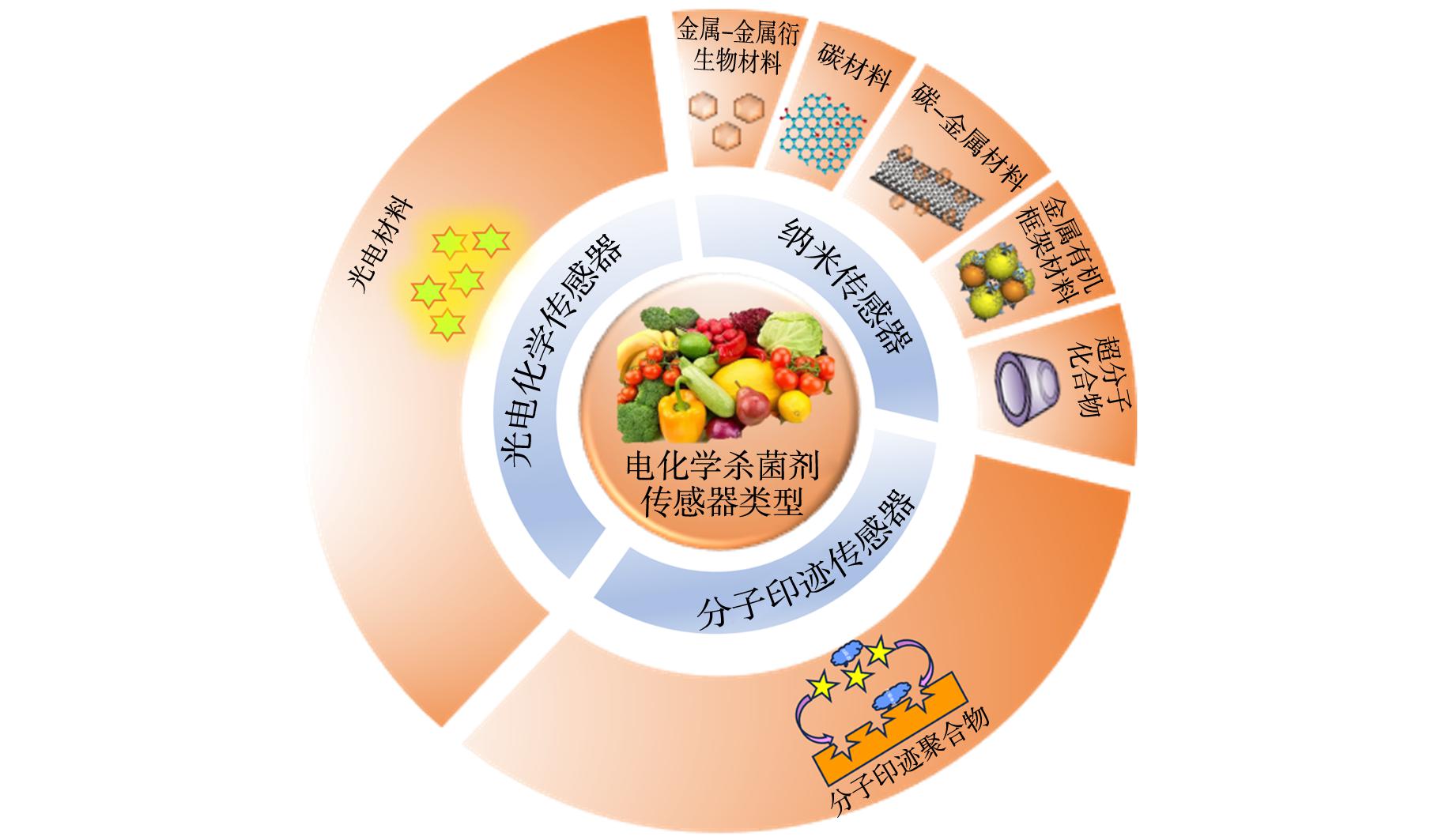
图1 不同类型的电化学杀菌剂传感器
Fig.1 Different types of electrochemical fungicide sensors
电化学和新能源
农用杀菌剂是指能够有效防治和杀死病原微生物而又不妨碍农作物生长的一类化学药剂[1],主要用于提高农作物的防御能力。其杀菌机理主要是通过影响病原微生物的细胞结构和功能(细胞壁和质膜生物合成)、细胞能量生成(抑制腺苷三磷酸(ATP)的合成)、细胞代谢物质合成及其功能(核酸、蛋白质、酶)、诱导植物自身调节等[2]。按传导特性分为保护性杀菌剂和内吸性杀菌剂[3],保护性杀菌剂是在作物体外或体表直接杀死、抑制病菌,防止进入而侵害作物,包括硫、无机硫化合物,铜制剂和有机硫化合物等。内吸性杀菌剂通过作物吸收后在体内杀灭侵入组织的病菌,主要有苯并咪唑类、二甲酰亚胺类、苯基酰胺类等[4]。农用杀菌剂因其高效、广谱、低毒而大面积用于果蔬的栽培。滥用不仅造成环境污染严重、毒害授粉类昆虫[5]、影响生态系统结构和功能[6],而且会产生抗药性问题[7],长期食用杀菌剂超标的果蔬也会引起慢性中毒以及食源性疾病[8,9]。随着农用杀菌剂使用数量、种类、范围的不断增加,果蔬的食用安全性引起了消费者的普遍重视和担忧。为此,实现果蔬中痕量杀菌剂的检测对保障食品安全意义重大。
目前,农用杀菌剂的快速检测方法有色谱-质谱联用技术[10-12]、胶体金免疫层析法[13]、表面增强拉曼光谱(SERS)[14,15]、酶联免疫吸附法[16],定量检测方法有Real-time PCR法[17,18]、液相色谱法[19,20]等。虽然这些分析方法精确度和准确度高,但存在流程繁琐、耗时、要求技术高,并不适用于现场检测。与上述方法相比,电化学法能够实现快速定量检测的需求。近年来,由于电化学传感器具有仪器微型化,操作简便、灵敏度高、成本低廉等优点,逐渐用于实际样品中的杀菌剂检测。电极材料对提高电化学活性和响应起着至关重要的作用,而基于纳米材料的电化学传感器具有高灵敏度和特异性。因此,本文综述了用于检测杀菌剂的电化学传感器的最新研究进展,主要包括基于不同电极材料的各种电化学传感器(图1),着重阐述了纳米材料的特性以及在构建电化学传感器中的关键性作用。这对于今后研究电化学传感器检测杀菌剂具有借鉴意义和提供了理论依据。

图1 不同类型的电化学杀菌剂传感器
Fig.1 Different types of electrochemical fungicide sensors
大多数杀菌剂是多环或杂化大分子有机物,具有高分子量、电子转移困难、电化学活性响应低等特点,导致直接检测存在困难。为了达到痕量检测的目的,常通过修饰功能化纳米材料对电极进行增敏或提高其电催化活性,实现电信号的放大,利用多种纳米材料形成纳米复合材料,对电极表面进行改性,从而提高传感能力。然而,电极的修饰材料是传感器检测的核心部分。一方面,通过人为设计改性电极的亲水/疏水环境,增加了药物的富集效果。另一方面,通过自组装、滴涂、电沉积、电聚合等方法,在电极表面修饰和构建功能化纳米材料,利用其独特的表面效应、催化活性、尺寸效应,增加电极的电导率,加速电极界面电子的转移速率,促进电化学行为。基于以上两点的有效结合而发挥协同效应,能够显著提高电化学响应,从而提高检测灵敏度。
纳米材料主要包括贵金属、过渡金属以及稀土金属各种纳米结构。因其具有独特的光电特性和化学性质、以及易于表面功能化等优良特性,被广泛用于传感器的改性剂,在许多技术应用中受到了广泛的关注。
硒(Se)容易与包裹的分子相互作用,其氧化还原性可以为捕获电子提供更多的活性中心[21]。基于此,Nataraj等[22]先利用三聚氰胺热聚合成石墨氮化碳(GCN),通过探针超声辅助剥离使其二维GCN层分离,然后,将硒粉与剥离的GCN再次热聚合,并将硒嵌入了GCN的框架中,成功构建了Se-GCN修饰的一次性丝网印刷碳电极(SPCE)用于检测多菌灵(CBD)。检出限(LOD)为6.0×10-9 mol/L,线性范围为0.99×10-7~3.469×10-4 mol/L,该电极用于检测橙汁和蔬菜提取物样品中CBD的回收率良好。Yamuna等[23]通过简便的超声水解法合成铁锑氧体(FeSbO4)纳米颗粒,用于CBD的微量电化学传感,FeSbO4/GCE电极的检出限是5.4×10-9 mol/L,线性范围是1.0×10-8~6.43×10-7 mol/L。二氧化钛(TiO2)作为一种无害、低价的纳米材料,具有独特的光学和生物特性,基于二氧化钛修饰的电化学传感器制造策略,能够提高电极的灵敏度,是用于检测具有电活性分子的理想电催化剂。Killedar等[24]将TiO2修饰在碳糊电极上(CPE)痕量检测CBD。与裸的CPE相比,修饰后的二氧化钛有效地增加了CBD的氧化峰电流。该传感器的线性范围是1.0×10-7~4.2×10-4 mol/L,检出限为1.71×10-8 mol/L。然而,限制金属纳米材料在传感器中应用的主要缺点是其热力学不稳定和聚集倾向,导致传感器稳定性差,表面自由能高,灵敏度低。
过渡金属硫化物(TMS)具有良好的夹层结构,如WS2、MoS2、SnS2、CoS2,因其优异的催化性能在电催化中被广泛青睐,它们的高导电性在电化学催化应用中是一种极好的电极材料[25],具有广泛的应用价值,是当前研究的热点材料之一。单层二硫化钨(WS2)具有二维层状结构,同时兼具n型和p型电运输特性。项园等[26]制备了二硫化钨-碳纳米管/玻碳电极复合传感器对猕猴桃中CBD的超高灵敏检测。该传感器在1.0×10-7~4.2×10-5 mol/L浓度范围内呈线性关系,LOD为1.1×10-8 mol/L。尹文青等[27]将金纳米颗粒电沉积到MoS2修饰的石墨电极表面,构建了CBD电化学传感器,LOD为8.5×10-7 mol/L,线性范围是2.0×10-7~4.0×10-4 mol/L。
MXenes是一种新型的二维过渡金属-碳/氮化物,化学成分一般式为Mn+1XnTx(n=1~3)[28],其中M代表过渡金属,X是C和/或N,Tx指表面官能团,其结构类似于石墨烯[29]。MXene通常是用浓氢氟酸选择性蚀刻其前驱体MAX相中的A元素而制备,经过MAX相中蚀刻A原子层后,M原子层重新排列,导致MXene纳米片材料具有金属电导率。MXene的表面在刻蚀过程中可以形成了大量的官能团,如—OH、—F和![]() O,通过改变表面官能团,MXene材料可以在导体和半导体之间切换。使其具有独特的结构、优良的导电性、良好的化学稳定性、高表面积,易于表面功能化等特点,赋予它们在分析化学广阔的应用前景。MXene作为一种具有丰富表面化学性质的电导性二维纳米材料,是构建电化学传感器的理想载体。其中,层状形貌的Ti3C2是MXene材料中研究最多的二维材料。Mxene材料比石墨烯材料具有更丰富的元素组成和复杂的混合键[30]。因此,MXene材料在特定应用中具有更大的改性潜力。为了提高MXene材料的性能,将其他纳米材料与MXene结合,通过协同效应改善其原有性能,从而大大提高了基于MXene的电化学传感器的选择性和灵敏度。
O,通过改变表面官能团,MXene材料可以在导体和半导体之间切换。使其具有独特的结构、优良的导电性、良好的化学稳定性、高表面积,易于表面功能化等特点,赋予它们在分析化学广阔的应用前景。MXene作为一种具有丰富表面化学性质的电导性二维纳米材料,是构建电化学传感器的理想载体。其中,层状形貌的Ti3C2是MXene材料中研究最多的二维材料。Mxene材料比石墨烯材料具有更丰富的元素组成和复杂的混合键[30]。因此,MXene材料在特定应用中具有更大的改性潜力。为了提高MXene材料的性能,将其他纳米材料与MXene结合,通过协同效应改善其原有性能,从而大大提高了基于MXene的电化学传感器的选择性和灵敏度。
同时,MXenes的主要缺点之一是在阳极室窗口不稳定。为了提高它的稳定性,通常采用纳米颗粒(NPs)如铂和钯纳米颗粒对Ti3C2Tx进行修饰。例如,Zhong等[31]利用MXene@Ag纳米团簇和氨基功能化多壁碳纳米管(MXene@AgNCs/NH2-MWCNTs),构建了一种新型的CBD检测比率电化学传感器。MXene中嵌入的Ag纳米团簇(AgNCs)不仅可以抑制MXene薄片的聚集,提高其电催化能力,而且可以作为比率电化学检测的内参探针。Zhong等[32]制备了CuxO修饰的MWCNTs-COOH/MXene复合材料,用于水果样品中电化学传感器,其合成路线和应用详见图2。由于复合材料中组分的协同效应,所制备传感器的检测线性范围为1.0×10-8~1.0×10-5 mol/L,检测下限为3.0×10-9 mol/L。MXene外层的表面基团提供了许多通过共价或非共价键进行功能化的机会,然而,官能团的实验定量控制仍然是一项具有挑战性的任务。
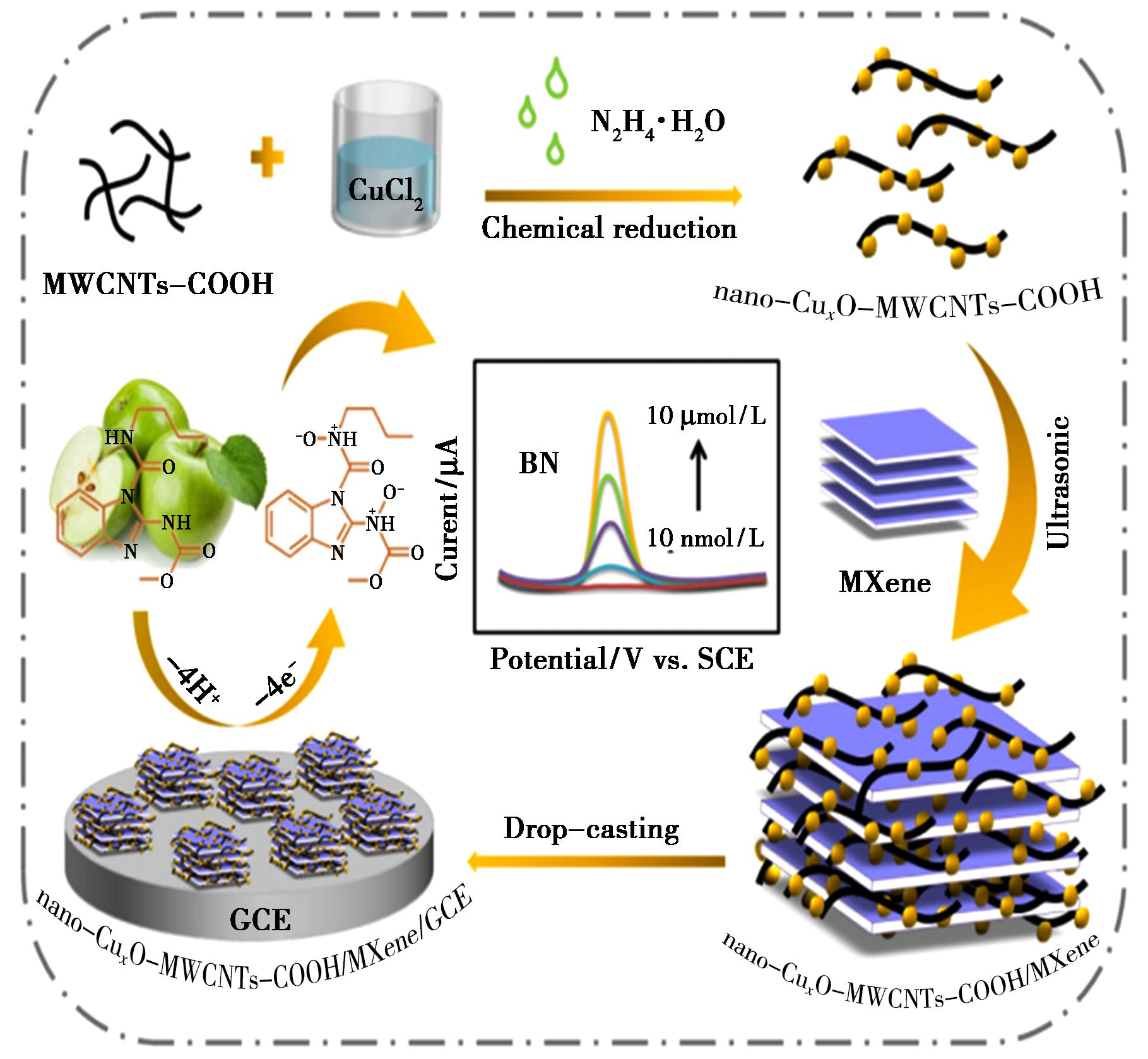
图2 纳米CuxO-MWCNTs-COOH/MXene/GCE的合成路线及其在BN检测中的电化学应用
Fig.2 Synthetic route of nano-CuxO-MWCNTs-COOH/MXene/GCE and its electrochemical application for the detection of BN
碳纳米材料,如碳纳米管、石墨烯、碳点,具有孔隙率高、导电性能好、化学性质稳定、电子传输快以及优异的传感能力而广泛应用于各种化合物电化学传感中。碳支撑纳米材料的独特性可归因于其基本结构,即一层sp2键碳原子,导致高的电导率在暴露于电子供体基团时形成良好的电荷转移能力[33]。碳基纳米材料可作为放大电化学测定目标物时的转导信号,各种材料的组合可以调整纳米复合材料的特性以满足需求。
Ilager等[34]设计了一种基于二维氧化石墨烯(GO)的玻碳电极(GCE)电化学传感器,并将其作为CBD检测的传感材料。利用方波伏安法(SWV)实现了对CBD的痕量检测。该GO/GCE传感器的线性范围为1.0×10-7~2.5×10-4 mol/L,检测限为1.38×10-8 mol/L。Tasaltin等[35]采用绿色超声微波辅助方法制备了还原氧化石墨烯,并研究该电化学传感器检测合成杀菌剂霜霉威(PM)。研究结果表明传感检测PM的LOD为6.0×10-7 mol/L,线性范围为1.0×10-6~5.0×10-6 mol/L。
近年来,基于碳基-金属基纳米材料的传感器逐渐成为主流方向。高比表面积的碳基材料不仅能够避免金属纳米颗粒的团聚,提高金属纳米颗粒的电催化能力,而且金属与碳基质的结合能够提供更多的电催化活性位点,增加了电化学活性。Priya等[36]以硝酸钐和氢氧化钠为起始原料,通过水热法合成了氧化钐(Sm2O3),随后,利用超声将制备的Sm2O3和还原氧化石墨烯(rGO)分散复合后滴涂在玻碳电极表面,构建了一种基于Sm2O3/rGO纳米复合材料的电化学传感器,用于快速检测CBD,线性范围为1.9×10-8~1.98×10-7 mol/L和2.9×10-7~4.213×10-4 mol/L,LOD为3.0×10-9 mol/L。该传感器成功地应用于食品和环境水样的CBD检测,回收率良好。Sm2O3/rGO纳米复合材料可以作为食品和环境污染物的有效电化学传感。Dong等[37]合成了一种新型铁酸锌/单壁碳纳米管(ZnFe2O4/SWCNTs)复合纳米材料,并应用于CBD和噻菌灵(TBZ)的同时定量测定。研究表明修饰电极的电活性面积是裸电极的5.5倍。该电化学传感器成功应用于实际样品中CBD和TBZ的测定。与单金属催化剂相比,核壳双金属催化剂往往具有较好的催化活性。核壳结构暴露了更多的活性位点,提供了更高的电活性和比表面积。Li等[38]制备了一种由Au@Pt壳核纳米结构包裹的碳纳米角和还原氧化石墨烯修饰的玻碳电极(Au@Pt/CNHs@rGO/GCE)电化学传感器,用于CBD检测。CNHs@rGO提高了电子转移能力和电化学活性表面积,而Au@Pt纳米颗粒的涂层进一步提高了传感器的灵敏度。该传感器的线性范围是5.0×10-8~5.0×10-5 mol/L,LOD是1.64×10-9 mol/L。
超分子材料通常是指由相同单体形成的聚集体化合物,目前在电化学传感器方面应用比较多的有环糊精、壳聚糖、柱芳烃、冠醚等。利用超分子材料制备农用杀菌剂的传感器报道的比较少,可能是由于超分子材料存在比表面积低、电导率差等缺点,导致电化学响应差。因此,有必要引入一个合适的衬底来放大电化学检测信号。
环糊精(CD)是天然衍生的多糖,通常有α-CD、β-CD和γ-CD。CD具有内腔疏水、外腔亲水的环形形式,可以选择性地与目标分子结合到内腔中,形成稳定的主客包合体。CD具有良好的主客体超分子识别特性,有助于制备高性能的电化学传感器。Liu等[39]首次利用β-环糊精(β-CD)功能化碳纳米片@碳纳米管(CNS@CNT)制备了一种新型的电化学传感器,用于CBD的测定。CNS@CNT结合了CNS较大的表面积和CNT优良的电导率,显著提高了电催化性能。此外,β-CD具有良好的宿主超分子识别能力,可以提高CBD的选择性识别和富集能力。该传感器的检测线性范围为3.0×10-8~3.0×10-5 mol/L,LOD为9.4×10-9 mol/L。Garrido等[40]首先用清洗后的GCE电极在苯胺溶液中进行电聚合,随后将β-CD和fMWCNT的分散体滴涂到GCE表面上,成功制备了一种应用于苹果中杀菌剂嘧霉胺(PMT)灵敏检测的电化学传感器。其LOD为1.04×10-6 mol/L,线性范围是1.0×10-5~8×10-5 mol/L。壳聚糖(CTS)是一种线性多糖生物聚合物,具有显著的成膜性能、良好的分散性和亲水性、优异的附着力,它被认为是一种很好的生物基材料,可以在电极表面形成稳定的膜。Liu等[41]将通过热解绿豆制备的衍生碳(MBC)和壳聚糖超声分散成MBC@CTS悬液,采用滴涂法制备了MBC@CTS/GCE传感器。MBC@CTS/GCE传感器对CBD表现出良好的电化学检测性能。在优化条件下,MBC@CTS/GCE传感器的线性浓度范围为1.0×10-7~2.0×10-5 mol/L,LOD为2.0×10-8 mol/L。此外,所制备的传感器成功应用于苹果和番茄果汁的CBD检测。
有机框架以金属/共价有机框架(MOF/COF)多孔材料的研究和应用最为普遍。金属/共价有机框架(MOF/COF)材料具有超薄的厚度、大的表面积、低电阻、高通量以及能提供高活性位点等特点,被广泛应用于传感、催化、药物传递、气体捕获等领域。由于COFs和MOFs具有的超微量孔隙度、活性功能位点和精细的结构等特点,因此有机框架材料非常适用于电化学传感检测药物残留。
Tu等[42]利用Mxene/碳纳米角/β-环糊精-金属有机框架(MXene/CNHs/β-CD-MOFs)构建CBD农药测定的电化学传感平台。β-CD-MOFs结合了β-CD的主客体识别特性和MOFs的多孔结构、高孔隙率和孔隙体积,使CBD具有较高的吸附能力。MXene/CNHs具有较大的比表面积、大量的活性位点、较高的导电率,提供了更多的传质通道,提高了CBD的传质能力和催化作用。该传感器的LOD为1.0×10-9 mol/L,线性范围为3.0×10-9~1.0×10-5 mol/L。二维叶状框架(ZIF-L)的大表面积不仅可以将分析物进行富集,响应的浓度提高到较高水平,而且,叶状形态可以缩短离子扩散和电子转移距离,从而提高电化学性能。因此,Shi等[43]以硝酸锌为金属源,2-甲基咪唑为配体,合成一种二维叶状框架(ZIF-L)嵌入还原氧化石墨烯(rGO@ZIF-L)的纳米材料用于苯菌灵(BM)敏感检测的电化学传感。BM传感的线性范围为9.0×10-9~1.0×10-5 mol/L,LOD为3.0×10-9 mol/L。该传感器具有良好的稳定性、重复性和重现性,以及良好的抗干扰能力。
虽然COFs和MOFs多孔材料在药物残留检测方面取得了许多进展,但仍然存在挑战。其中一个重要的问题是MOF/COF的稳定性,为了在实际电化学检测中的应用,COFs和MOFs的电化学稳定性仍有待探索和改进,由于具有可调节的配体和金属中心,COFs和MOFs的结构和孔隙很容易进行调整。第二个挑战是COFs和MOFs的制备需要特定的条件,以及其结晶过程和控制聚合的方法仍然难以保证。此外,还需更多地关注于设计快速和实时的检测分析,药物残留的检测必须克服弱协同作用,以提高检测效果。
其他具有优异导电性的材料也可作为电极修饰剂,可以提高电化学性能。如离子液体具有离子导电性和较宽的电化学电位窗,能促进界面电子转移,增强改性电极的电化学活性,可作为一种优良的导电粘合剂。
Yang等[44]以1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6])为离子液体,制备了MWCNTs-IL改性玻碳电极用于PMT的电化学传感检测。在最佳条件下,该电化学传感器对PMT的线性浓度范围为1.0×10-7~1.0×10-4 mol/L,检测限为1.6×10-8 mol/L。Neto等[45]用支链聚乙烯亚胺功能化的四氧化三铁(Fe3O4@BPEI)修饰玻璃碳电极(GCE),实现了CBD的检测。该电化学传感器对CBD的线性浓度范围为3.98×10-8~7.94×10-8和7.94×10-8~1.57×10-7 mol/L,检测限为1.0×10-8 mol/L。 ekuljica等[46]采用以四丁基氯化铵(TBACl)离子液体为碳糊电极改性剂的电化学传感器测定CBD。Yang等[47]采用一步水热法和煅烧法将合成的三维花样NiCo2O4和氧化石墨烯原位复合,再与离子液体1-辛基-3-甲基咪唑六氟磷酸超声复合,构建了基于NiCo2O4/rGO/IL的PMT电化学传感器。在最佳条件下,电化学传感器对PMT的两个线性范围分别为1.0×10-4~1.0×10-2和2.0×10-2~1.4×10-1 mol/L,LOD为1.1×10-8 mol/L。
ekuljica等[46]采用以四丁基氯化铵(TBACl)离子液体为碳糊电极改性剂的电化学传感器测定CBD。Yang等[47]采用一步水热法和煅烧法将合成的三维花样NiCo2O4和氧化石墨烯原位复合,再与离子液体1-辛基-3-甲基咪唑六氟磷酸超声复合,构建了基于NiCo2O4/rGO/IL的PMT电化学传感器。在最佳条件下,电化学传感器对PMT的两个线性范围分别为1.0×10-4~1.0×10-2和2.0×10-2~1.4×10-1 mol/L,LOD为1.1×10-8 mol/L。
分子印迹技术也叫分子模板技术,是制备对特定目标分子具有特异预定选择性的高分子化合物-分子印迹聚合物(Molecularly imprinted polymer,MIP)的技术[48]。分子印迹聚合物(MIPs)是模仿钥匙的原理,人工合成的高分子聚合材料,具备人工生成的识别位点。
Qi等[49]先将硫醇石墨烯引入到金纳米颗粒修饰的玻璃碳电极上,随后将普鲁士蓝与金纳米粒子共沉积在修饰后的电极上,作为固定化探针,然后将分子印迹聚合物膜进行电聚合作为识别元件。制备了基于MIP/Au-PB/SH-G/Au NPs电化学检测戊唑醇的传感器,其LOD为1.25×10-8 mol/L,线性范围为5.0×10-8~4.0×10-4 mol/L。Feng等[50]采用一锅法合成了氮、硫掺杂的碳化钼(N、S-Mo2C)。以多菌灵为模板分子,邻苯二胺为功能单体,利用电聚合在N、S-Mo2C表面原位合成了MIP膜。制备了一种基于氮硫掺杂空心Mo2C/C球的新型CBD分子印迹电化学传感器。该传感器在1.0×10-12~8.0×10-9 mol/L范围内具有良好得线性,检测限为6.7×10-13 mol/L。Yola[51]制备了一种基于CdMoO4/g-C3N4纳米复合材料的分子印迹电化学传感器,用于果汁样品中的CBD测定。定量限(LOQ)和LOD值分别计算为0.1×10-10、2.5×10-12 mol/L,具有良好的选择性、稳定性、重现性和可重复性。Duan等[52]构建了一种基于NiCo2O4@ZnO/ZnCo2O4的新型分子印迹电化学传感器,用于五氯硝基苯(PCNB)的灵敏度和高选择性检测。在最佳条件下,PCNB的还原峰值电流在浓度为5.0×10-8~5.5×10-6 mol/L的范围内呈线性相关,检测限为8.33×10-9 mol/L。
MIPs特异性强,能够实现快速检测,但同时也存在模板分子不易去除,重现性比较差等问题,这直接导致了检测灵敏度降低。将MIPs结合成复合材料,能提升MIPs传感器的电化学性能。
在电化学传感器中,光电化学传感器作为一种蓬勃发展的分析方法,结合了电化学分析和光学分析的优点,受到越来越多的研究关注。与传统的电化学技术相比,由于激发源(光)和检测信号(电流)的完全分离,光电化学传感器的背景信号大大降低,其灵敏度较高。因此,基于不同光电材料、电压设计和研发的各种类型的光电化学传感器,成为一种很有潜力的分析工具,可用于快速和灵敏地监测农业生产中的有害污染物。
Fereja等[53]首次研究了甲酸乙酯的电化学发光(ECL)性质。基于![]() 作为发光团而表现出强烈的ECL反应,提出了一种快速、灵敏的甲酸乙酯检测方法,在优化的实验条件下,ECL强度与甲酸乙酯浓度在3.0×10-6~1.0×10-3 mol/L内呈线性关系,检测甲酸乙酯的LOD为0.7×10-6 mol/L。Zhang等[54]以苯并咪唑、硝酸锌和三联吡啶氯化钌为起始原料合成了
作为发光团而表现出强烈的ECL反应,提出了一种快速、灵敏的甲酸乙酯检测方法,在优化的实验条件下,ECL强度与甲酸乙酯浓度在3.0×10-6~1.0×10-3 mol/L内呈线性关系,检测甲酸乙酯的LOD为0.7×10-6 mol/L。Zhang等[54]以苯并咪唑、硝酸锌和三联吡啶氯化钌为起始原料合成了![]() 随后将
随后将![]() 分散体滴涂在GCE表面,以Nafion作为结合剂,然后,将改性电极插入含有速克灵(PCM)聚合物液的吡咯溶液中进行电聚合。最后,修饰后的电极用NaOH洗脱去除PCM。获得了具有三维空腔的
分散体滴涂在GCE表面,以Nafion作为结合剂,然后,将改性电极插入含有速克灵(PCM)聚合物液的吡咯溶液中进行电聚合。最后,修饰后的电极用NaOH洗脱去除PCM。获得了具有三维空腔的![]() 改性电极,制备流程详见图3。
改性电极,制备流程详见图3。
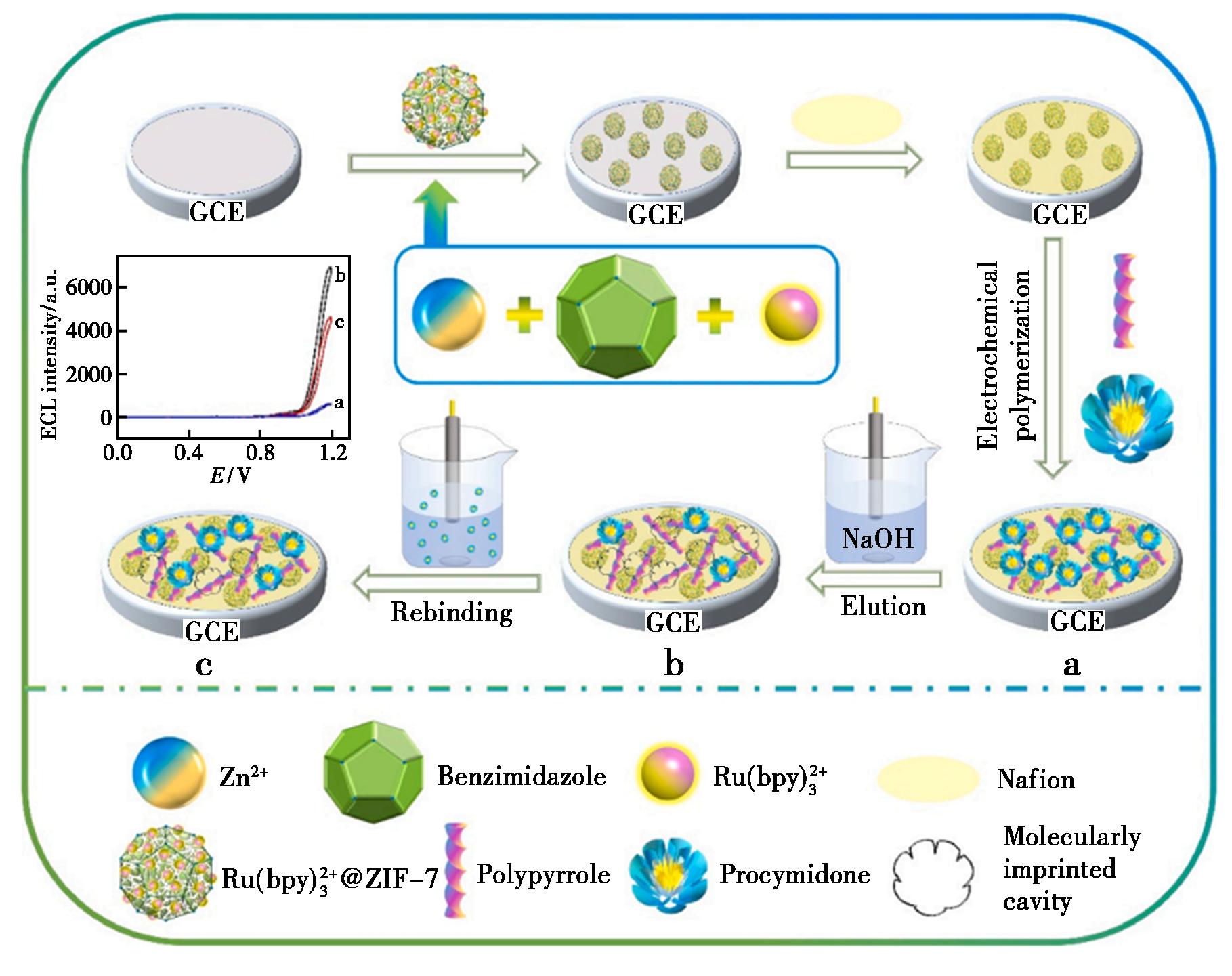
图3 ![]() 的制备流程图
的制备流程图
Fig.3 Schematic illustration of the fabrication process ![]()
其ECL强度的变化值与PCM浓度的对数成正比,线性范围和检测限分别为1.0×10-10~1.0×10-6、2.0×10-11 mol/L。目前,利用光电化学传感器检测果蔬中农用杀菌剂的研究鲜有报道。光电化学分析法虽取得了一定的进展,但仍存在分析试剂价格昂贵、分析成本高、回收不方便、发光效率低等缺点,未来光电化学分析法将朝着电极材料不易剥离、稳定性好、光电转化效率高等方向发展。表1为电化学传感器检测农药杀菌剂的应用。
表1 电化学传感器检测农药杀菌剂注
Tab.1 Detection of agricultural fungicides by electrochemical sensors
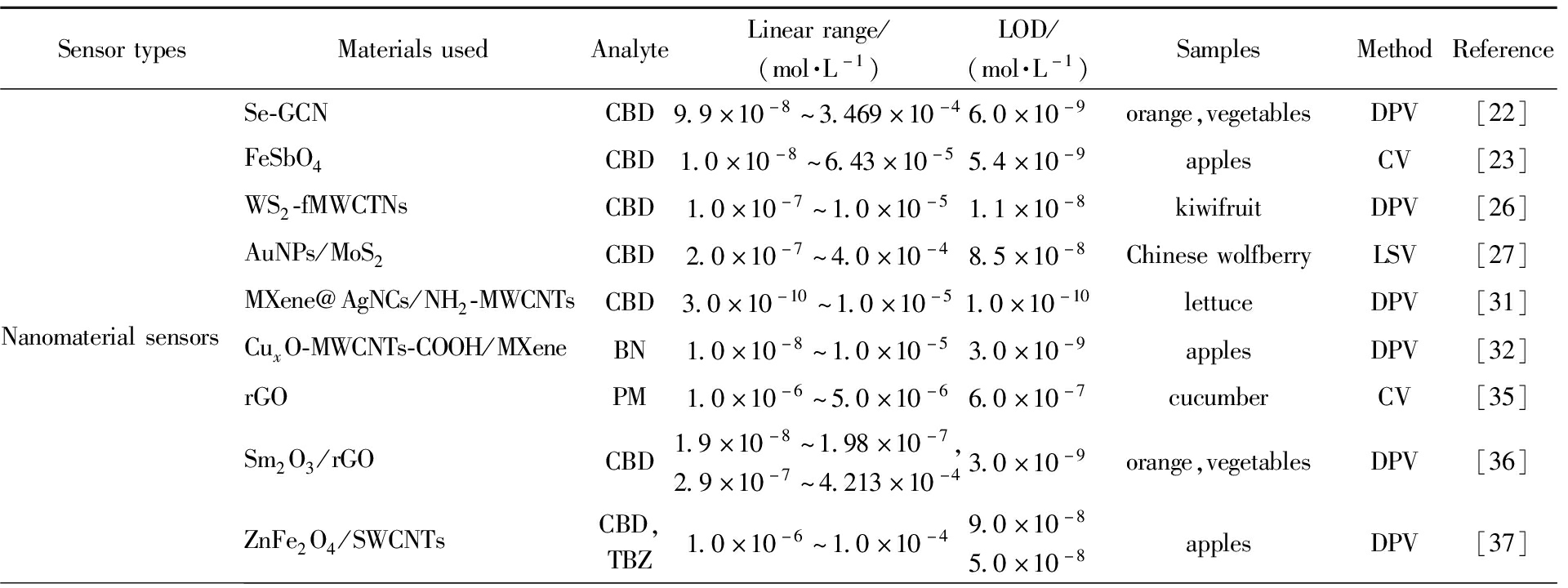
SensortypesMaterialsusedAnalyteLinearrange/(mol·L-1)LOD/(mol·L-1)SamplesMethodReferenceNanomaterialsensorsSe-GCNCBD9.9×10-8~3.469×10-46.0×10-9orange,vegetablesDPV[22]FeSbO4CBD1.0×10-8~6.43×10-55.4×10-9applesCV[23]WS2-fMWCTNsCBD1.0×10-7~1.0×10-51.1×10-8kiwifruitDPV[26]AuNPs/MoS2CBD2.0×10-7~4.0×10-48.5×10-8ChinesewolfberryLSV[27]MXene@AgNCs/NH2-MWCNTsCBD3.0×10-10~1.0×10-51.0×10-10lettuceDPV[31]CuxO-MWCNTs-COOH/MXeneBN1.0×10-8~1.0×10-53.0×10-9applesDPV[32]rGOPM1.0×10-6~5.0×10-66.0×10-7cucumberCV[35]Sm2O3/rGOCBD1.9×10-8~1.98×10-7,2.9×10-7~4.213×10-43.0×10-9orange,vegetablesDPV[36]ZnFe2O4/SWCNTsCBD,TBZ1.0×10-6~1.0×10-49.0×10-85.0×10-8applesDPV[37]
续表
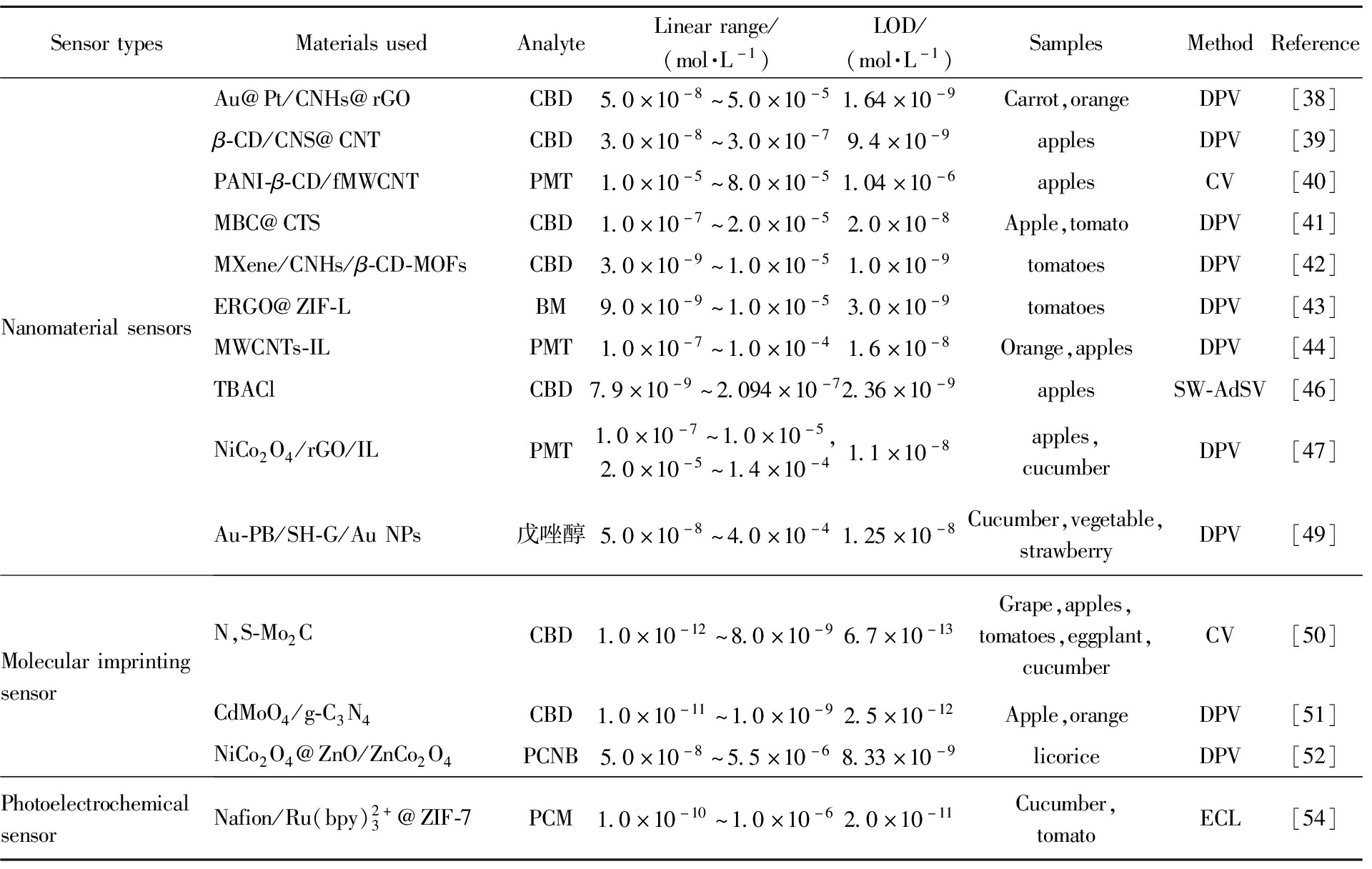
SensortypesMaterialsusedAnalyteLinearrange/(mol·L-1)LOD/(mol·L-1)SamplesMethodReferenceNanomaterialsensorsAu@Pt/CNHs@rGOCBD5.0×10-8~5.0×10-51.64×10-9Carrot,orangeDPV[38]β-CD/CNS@CNTCBD3.0×10-8~3.0×10-79.4×10-9applesDPV[39]PANI-β-CD/fMWCNTPMT1.0×10-5~8.0×10-51.04×10-6applesCV[40]MBC@CTSCBD1.0×10-7~2.0×10-52.0×10-8Apple,tomatoDPV[41]MXene/CNHs/β-CD-MOFsCBD3.0×10-9~1.0×10-51.0×10-9tomatoesDPV[42]ERGO@ZIF-LBM9.0×10-9~1.0×10-53.0×10-9tomatoesDPV[43]MWCNTs-ILPMT1.0×10-7~1.0×10-41.6×10-8Orange,applesDPV[44]TBAClCBD7.9×10-9~2.094×10-72.36×10-9applesSW-AdSV[46]NiCo2O4/rGO/ILPMT1.0×10-7~1.0×10-5,2.0×10-5~1.4×10-41.1×10-8apples,cucumberDPV[47]Au-PB/SH-G/AuNPs戊唑醇5.0×10-8~4.0×10-41.25×10-8Cucumber,vegetable,strawberryDPV[49]MolecularimprintingsensorN,S-Mo2CCBD1.0×10-12~8.0×10-96.7×10-13Grape,apples,tomatoes,eggplant,cucumberCV[50]CdMoO4/g-C3N4CBD1.0×10-11~1.0×10-92.5×10-12Apple,orangeDPV[51]NiCo2O4@ZnO/ZnCo2O4PCNB5.0×10-8~5.5×10-68.33×10-9licoriceDPV[52]PhotoelectrochemicalsensorNafion/Ru(bpy)2+3@ZIF-7PCM1.0×10-10~1.0×10-62.0×10-11Cucumber,tomatoECL[54]
注:CBD:多菌灵;BN:苯菌灵;PM:霜霉威;TBZ:噻菌灵;PMT:嘧霉胺;PCNB:五氯硝基苯;PCM:速克灵;CV:Cyclic Voltammetry;LSV:Linear Sweep Voltammetry;DPV:Differential Pulse Voltammetry;SW-AdSV:Square-wave Adsorptive Stripping Voltammetry;ECL:Electrochemiluminescence。
归纳总结了电化学传感器检测农药杀菌剂的最新进展,并对电化学杀菌剂传感器种类进行了分类,重点突出不同纳米材料的独特电化学性能。基于各种纳米材料的传感元件均能实现对农用杀菌剂的高灵敏检测。纳米材料提高了电化学传感器的稳定性、选择性以及灵敏度,并提供了巨大的表面积、良好的表面选择性、电荷转移速率和电导率,从而提高了传感器的效率。然而,使用基于不同纳米材料的电化学传感的稳定性和可重复性仍需进一步提高。
未来电化学传感器的发展核心:(1)传感材料:在先进的纳米改性材料的帮助下,通过精确的纳米结构,有望大大提高电化学传感器的性能。纳米材料是在电极和生物活性物质之间起桥梁作用以产生和传输信号的物质。需要进一步研究来控制纳米材料的形态,以增强纳米材料和电极之间的反应信号。(2)设备开发:为了满足现场检测,应考虑电化学传感器的稳定性和可靠性,更加重视便携式设备的发展,基于纳米材料的电化学传感器平台的进步将成为新技术的强大驱动力。
[1]Arzani F A,Santos J H Z D.Soft Matter.,2022,18:5 340-5 358.
[2]Liu R Y,Li Z Z,Liu S F,Zheng J,Zhu P P,Cheng B,Yu R,Geng H.J.Agric.Food Chem.,2023,71(18):6 803-6 817.
[3]Bingham I J,Young C,Bounds P,Gravouil C,Paveley N D.J.Field Crops Res.,2021,261:1 080 011.
[4]Zhai Y N,Wang S W,Zhang B R,Tang Y B,Wang H,Ling J J,Hu Z Y,Wang Y Y,Li H T,Ge R S.J.Toxicol.Lett.,2023,379:76-86.
[5]Syadi A M,Faisal M,Harraz F A,Jalalah M,Alsaiari M.J.Sci.Rep.,2021,11(1):9 174.
[6]Chen Y,Liu H M,Tian Y R,Du Y Y,Ma Y,Zeng S W,Gu C J,Jiang T,Zhou J.J.ACS Appl.Mater.Interf.,2020,12(12):14 386-14 399.
[7]Yang Y,Dong G R,Wang M,Xian X W,Wang J,Liang X Y.J.Crop.Prot.,2021,145:105 611.
[8]Sanchez C L,Souders C L,Pena-delgado C J,Nguyen K T,Kroyter N,Ahmadie N E,Aristizabal-henao J J,Bowden J A,Martyniuk C J.J.Neurotoxicology,2020,80:76-86.
[9]Narenderan S T,Meyyanathan S N,Babu B.J.Food Res.Int.,2020,133:109 141.
[10]Yang F,Tang G L,Ye C W,Wang Y,Fan M J,Deng H M,Liu S S,Bian Z Y,Ji Y.Microchem.J.,2021,171:106 849.
[11]Xiong W,Jing H,Guo D M.J.Chromatographia,2021,84:729-740.
[12]Wu J X,Zhi S W,Jia C H,Li X H,Zhu X D,Zhao E C.J.Sep.Sci.,2019,42(24):3 688-3 696.
[13]Li N L,Xu X X,Song S S,Liu L Q,Kuang H,Wang Z Y,Xu C L.New J.Chem.,2021,45:9 002-9 009.
[14]Wang K Q,Sun D W,Pu H B,Wei Q Y.J.Food Chem.,2020,310:125 923.
[15]Saini R K,Sharma A K,Agarwal A,Prajesh R.J.Mater Chem.Phys.,2023,295:127 088.
[16]Esteve-turrillas F A,Mercader J V,Agulló C,Abad-somovilla A,Abad-fuentes A.J.Analyst,2017,142:3 975-3 985.
[17]Chen G J,Zhang Z F,Jiang L Y,Xu F S,Ma Z H,Li H Y.Acta Phytopathol.Sin.,2008,(6):561-569.
陈广进,张志芳,姜丽英,徐发三,马忠华,李红叶.植物病理学报,2008,(6):561-569.
[18]Chu B Y,Gong K Y,Gu Y L,Wang C C,Pan Y,Luo Y,Ma Z H.Acta Phytopathol.Sin.,2017,47(4):532-540.
初炳瑶,龚凯悦,谷医林,王翠翠,潘阳,骆勇,马占鸿.植物病理学报,2017,47(4):532-540.
[19]You X W,Chen X C,Liu F M,Hou F,Li Y Q.J.Food Chem.,2018,239:354-359.
[20]Wang M,Zhao L Y,Niu Y,Qin S,Zhang L X,Jia L Y,Jing X.J.Food Chem.,2023,18:100 711.
[21]Li H J,Cao H G,Chen T,Zhang X,Shi Y C.J.Mol.Catal.,2020,483:110 715.
[22]Nataraj N,Chen T W,Akilarasan M,Chen S M,Al-ghamdi A A,Elshikh M S.J.Chemosphere,2020,302:134 765.
[23]Yamuna A,Chen T W,Chen S M.J.Food Chem.,2022,373:131 569.
[24]Killedar L,Ilager D,Malode S J,Shetti N P.J.Mater.Chem.Phys.,2022,285:126 131.
[25]Maheshwaran S,Balaji R,Chen S M,Chang Y S,Tamilalagan E,Chandrasekar N,Ethiraj S,Samuel M S,Kumar M.J.Environ.Res.,2022,205:112 515.
[26]Xiang Y,Xiong W M,Liao X N,Chen J Y.Acta Agric.Univ.Jiangxiensis,2017,39(6):1 147-1 153.
项园,熊万明,廖晓宁,陈金印.江西农业大学学报,2017,39(6):1 147-1 153.
[27]Yin W Q,Yan Y,Peng J,Gao Z N.Anal.Lab.,2018,12(37):1 402-1 406.
尹文青,闫玥,彭娟,高作宁.分析试验室,2018,12(37):1 402-1 406.
[28]Rhouati A,Berkani M,Vasseghian Y,Golazadeh N.J.Chemosphere,2022,291:132 921.
[29]Wu X Z,Ma P Y,Sun Y,Du F X,Song D Q,Xu G B.J.Electroanaly,2021,33(8):1 827-1 851.
[30]Li T,Shang D W,Gao S W,Wang B,Kong H,Yang G Z,Shu W D,Xu P L,Wei G.J.Biosensors,2022,12:314.
[31]Zhong W,Gao F,Zou J,Liu S W,Li M F,Gao Y S,Yu Y F,Wang X Q,Lu L M.J.Food Chem.,2021,306:130 006.
[32]Zhong W,Zou J,Xie Y Y,Yang J,Li M F,Liu S W,Gaoi Y S,Wang X Q,Lu L M.J.Electroanal.Chem.,2022,920:116 586.
[33]Maleh H K,Beitollahi H,Kumar P S,Tajil S,Jahani P M,Karimi F,Karaman C,Vasseghian Y,Baghayeri M,Rouhi J,Show P L,Rajendran S,Fu L,Zare N.J.Food Chem.Toxicol.,2022,164:112 961.
[34]Ilager D,Malode S J,Shetti N P.J.Chemosphere,2022,303:134 919.
[35]Tasaltin N,Karakus S,Tasaltin C,Baytemir G.J.Food Chem.,2022,372:131 267.
[36]Priya T S,Nataraj N,Chen T W,Chen S M,Kokulnathan T.J.Chemosphere,2022,307:135 711.
[37]Dong Y Y,Yang L J,Zhang L.J.Agric Food Chem.,2017,65(4):727-736.
[38]Li W Z,Wang P X,Chu B B,Chen X G,Peng Z C,Chu J Y,Lin R,Gu Q H,Lu J,Wu D H.J.Food Chem.,2023,402:134 197.
[39]Liu R Q,Li B,Li F,Dubovyk V,Chang Y Q,Li D D,Ding K J,Ran Q W,Wang G F,Zhao H Y.J.Food Chem.,2022,384:132 573.
[40]Garrido J M P J,Rahemi V,Borges F,Brett C M A,Garrido E M P J.J.Food Control.,2016,60:7-11.
[41]Liu R Q,Chang Y Q,Li F,Dubovyk V,Li D D,Ran Q W,Zhao H Y.J.Food Chem.,2022,392:133 301.
[42]Tu X L,Gao F,Ma X,Zou J,Yu Y F,Li M F,Qu F L,Huang X G,Lu L M.J.Hazard.Mater.,2020,396:122 776.
[43]Shi M,Peng G W,Xue S Y,Xu J K,Gao Y S,Liu S W,Duan X M,Lu L M.J.Molecules,2022,27:6 857.
[44]Yang J C,Wang Q,Zhang M H,Zhang S M,Zhang L.J.Food Chem.,2015,187:1-6.
[45]Neto D M A,Costa L S D,Sousa C P,Becker H,Casciano P N S,Nascimento H O,Neto J R B,Limaneto P D,Nascimento R F,Guedes J A C,Oliveira R C,Zampieri D,Correia A N,Fechinep B A.J.Electrochim.Acta,2022,432:141 193.
[46] ekuljica S,Guzsva
ekuljica S,Guzsva ny V,Kalcher K,Anoj
ny V,Kalcher K,Anoj i
i J.J.Electrochem.Soc.,2020,167:137 504.
J.J.Electrochem.Soc.,2020,167:137 504.
[47]Yang L J,Hu Y D,Wang Q,Dong Y Y,Zhang L.J.Anal.Chim.Acta,2016,935:104-112.
[48]Ratautaite V,Samukaite B U,Plausinaitis D,Boguzaite R,Balciunas D,Ramanaviciene A,Neunert G,Ramanavicius A.Int.J.Mol.Sci.,2021,22(9):5 032.
[49]Qi P P,Wang J,Wang Z W,Wang X,Wang X Y,Xu X H,Xu H,Di S S,Zhang H,Wang Q,Wang X Q.J.Electrochim.Acta,2018,274:406-414.
[50]Feng S X,Li Y G,Zhang R Y,Li Y C.J.Biosens Bioelectron,2019,142:11 1491.
[51]Yola M L.J.Chemosphere,2022,301:134 766.
[52]Duan D,Ye J P,Li K.J.Sens.Actuat.B.Chem.,2021,344:130 222.
[53]Fereja T H,Kitte S A,Snizhko D,Qi L M,Nsabimana A,Liu Z Y,Xu G B.J.Anal.Bioanal.Chem.,2018,410:6 779-6 785.
[54]Zhang X,Tian L,Sun Z,Wu Q,Shan X Y,Zhao Y J,Chen R Z,Lu J.J.Food Chem.,2022,391:133 235.