生物体内的活性分子,如活性氧(ROS)、活性氮(RNS)以及还原态谷胱甘肽(GSH)等,是维持细胞正常生理功能的关键因素。这些分子的浓度和分布受到严格调控,以保障细胞内的稳态平衡。然而,当外界环境因素如受到污染、辐射或化学物质介入时,这种精细的平衡可能被打破,导致活性分子的异常积累或耗竭,从而引发一系列病理变化。研究表明,活性分子的失衡与多种疾病的发生发展密切相关,包括糖尿病及其并发症、代谢性疾病如肥胖、神经退行性疾病、癌症以及衰老等[1-5]。因此,深入理解活性分子在生物体内的行为,探索能够及时检测细胞以及细胞器内各种活性分子的分析方法,不仅对于揭示疾病机制至关重要,也在疾病的诊断方面提供了新的视角和策略[6-9]。
碳水化合物、脂质、蛋白质、酶辅助因子和各种其他生物分子都在满足细胞能量需求方面发挥作用。氧化能力的最终来源通常是分子氧,在这个过程中,分子氧被还原为水。分子氧的还原可以从多个角度进行分析,主要包括以下几种,如图1所示,包括单电子还原、2电子还原、3电子还原、4电子还原。在这些过程中,分子氧可以通过不同的电子转移路径实现。如果电子的加成没有以适当的方式发生,就会产生部分还原的氧基物种。这类物种以及由他们衍生或与之相关的其他物种,通常被描述为“活性氧物种”(ROS)。ROS在人体中具有双重作用,既可以通过少量的产生促进人体健康,也可能因过量而引发多种病理损伤,其可能会对细胞内蛋白质、脂质和DNA造成损害而引发疾病。这种由过量活性氧引起的损害状态被称为“氧化应激”。细胞内的大部分氧化作用发生在线粒体内。线粒体是细胞的“能量工厂”,其通过氧化磷酸化过程为细胞活动提供能量。除此之外线粒体还参与代谢调控,钙离子调节,细胞凋亡调控等过程,而且也是细胞内ROS的主要来源之一。细胞内ROS,如过氧化氢(H2O2)、超氧阴离子![]() 单线态氧(1O2)、次氯酸(HClO)、一氧化氮(NO)和过氧亚硝基阴离子(ONOO-)等作为细胞内的正常代谢产物,在生命活动的多种生理、病理过程中发挥着重要作用,ROS的类型和浓度也决定了其对细胞的正面或负面影响。ROS水平异常是多种疾病的早期信号(如氧化应激标志物),通过检测特定ROS(如H2O2、ONOO-等)的浓度变化,辅助诊断某些疾病,因此ROS在疾病诊断和早期预警中发挥了重要作用。除此之外,对ROS的大量研究使得人类更进一步揭示疾病的发生机制,例如揭示ROS如何通过氧化损伤(如DNA断裂、脂质过氧化)或调控信号通路(如NF-κB、MAPK)参与疾病的发生。ROS的积累可导致DNA损伤和基因突变从而引起癌症的发生。此外,ROS还通过氧化低密度脂蛋白(LDL)和损伤血管内皮细胞,促进心血管疾病的发生。因此对ROS进行高精度追踪检测,不仅能深化对疾病机制的理解,还为临床诊断、治疗及预防提供了重要依据,是连接基础研究与转化医学的关键桥梁。
单线态氧(1O2)、次氯酸(HClO)、一氧化氮(NO)和过氧亚硝基阴离子(ONOO-)等作为细胞内的正常代谢产物,在生命活动的多种生理、病理过程中发挥着重要作用,ROS的类型和浓度也决定了其对细胞的正面或负面影响。ROS水平异常是多种疾病的早期信号(如氧化应激标志物),通过检测特定ROS(如H2O2、ONOO-等)的浓度变化,辅助诊断某些疾病,因此ROS在疾病诊断和早期预警中发挥了重要作用。除此之外,对ROS的大量研究使得人类更进一步揭示疾病的发生机制,例如揭示ROS如何通过氧化损伤(如DNA断裂、脂质过氧化)或调控信号通路(如NF-κB、MAPK)参与疾病的发生。ROS的积累可导致DNA损伤和基因突变从而引起癌症的发生。此外,ROS还通过氧化低密度脂蛋白(LDL)和损伤血管内皮细胞,促进心血管疾病的发生。因此对ROS进行高精度追踪检测,不仅能深化对疾病机制的理解,还为临床诊断、治疗及预防提供了重要依据,是连接基础研究与转化医学的关键桥梁。
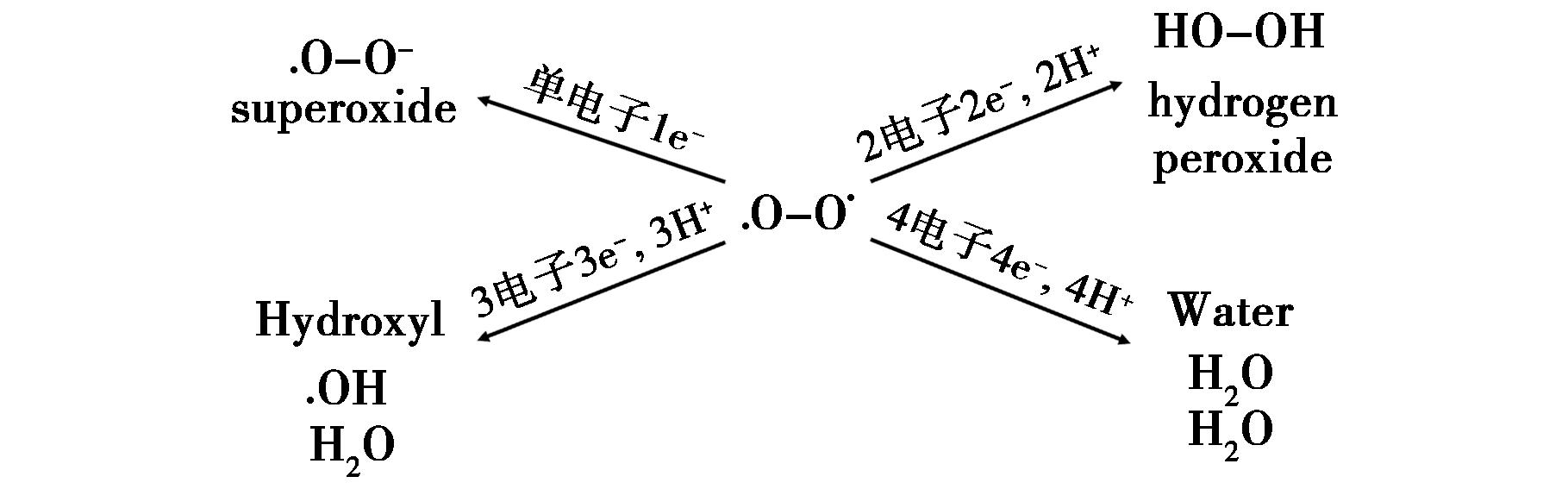
图1 分子氧的还原
Fig.1 Reduction of molecular oxygen
生物成像和生物传感是目前分子诊疗方面的新兴领域,对于深入了解细胞功能以及为疾病的准确诊断和治疗提供广泛的诊断参数具有重要意义。近红外(NIR),通常指650~1 700 nm,尤其是700~900 nm的第1近红外窗口和1 000~1 700 nm的第2窗口[10]。近红外荧光成像(NIR Fluorescence Imaging)是一种基于近红外光(通常为650~1 700 nm)激发荧光探针,通过检测其发射信号实现生物组织成像的技术[11]。与发射波长更短的传统荧光成像工具相比,NIR荧光成像具有一系列优点:1)组织穿透深度更强。生物组织对NIR光的散射和吸收,尤其是血红蛋白、水、脂质等主要成分显著低于可见光,因此,NIR光可穿透数厘米的组织,而可见光通常仅限表面(<1 mm);2)更低的自体荧光背景。生物组织自发荧光弱:许多生物分子如胶原、黄素、NADH等在可见光激发下会产生强自体荧光,导致信噪比(SNR)下降。NIR区自体荧光极少,背景噪声低,成像对比度更高;3)减少光毒性,使得生物样品不易受到破坏。NIR光子能量低于可见光,对细胞和组织的光损伤更小,适合长期活体成像。除此之外,还具有高分辨率,实时动态成像等特点,这使其成为生物医学领域的新兴成像技术之一[12-18]。光学成像的蓬勃发展大大得益于生物相容性荧光团的设计和作为信号传感器的靶向和可激活的“智能”成像探针的开发,包括有机小分子、聚合物、无机和无机有机杂化纳米材料[19,20]。分子探针研究领域中发展出了针对机体或细胞内多种离子或分子的特异性探针,如用于监测体内铁离子[21]、汞离子[22]等重金属离子的阳离子探针,用于监测体内硫化物[23]、柠檬酸盐[24]、氧/氮/硫等[25]的阴离子探针,以及监测如氨基酸[26]、肿瘤标记物[27]等在内的特殊有机标记物的特殊探针等。
本文重点介绍了近5年近红外ROS荧光探针的研究现状,并基于各类探针的分类进行了更为深度的综述与思考,对其突破现有技术瓶颈,加速从基础研究到临床应用的转化等方面的发展趋势进行了展望,以期为相关领域的研究提供新的方法和思考。此外,提出了人工智能技术与分子设计和靶点预测相结合的观点,有望大幅提升探针开发效率,为实现ROS的高效检测和精准调控提供新的技术手段,最终为疾病诊断和治疗开辟新的途径。
过氧化氢(H2O2)作为生物体内含量最高的活性氧(ROS)之一,是一种关键的信号转导分子,主要产生于细胞线粒体的有氧呼吸电子传递链。适量的H2O2对维持生物体正常的生理过程至关重要,例如参与细胞信号传导、免疫反应和代谢调控等。然而,细胞内H2O2的过量积累会引发氧化应激,导致代谢紊乱,进而导致多种疾病的发生。因此,开发能够实时、准确地检测线粒体内H2O2含量变化的新技术,对于疾病的早期诊断、预防和治疗具有重要的临床应用价值。
由于芳香族硼酸盐容易被引入荧光团中,因此Chen等[28]使用芳香族硼酸盐作为H2O2的识别碱基来构建荧光探针,基于乙酰基上亲核加成H2O2的反应,开发了一种可用于过氧化氢分子内快速识别的高效的H2O2探针BHA-B,其结构式及其检测原理如图2所示。他们选择激发态分子内质子转移荧光团BHA-OH作为初始研究对象,由于该荧光团具有巨大的Stokes位移,良好的抗光漂白性,以及多个可修饰的反应位点,因此以BHA-OH为荧光团设计出的BHA-B具有灵敏度高(检测限7×10-8 mol/L甚至更低)、响应快(3 min以内)、Stokes位移大(225 nm)等优点,不仅可以监测细胞内外源性和内源性H2O2,还能成功实现斑马鱼体内药物性器官损伤引起的内源性H2O2水平变化。该探针实现了对药物刺激下生物体内H2O2过量生成的精准示踪,验证了其在生命科学研究中的应用价值。作为首个基于此类设计策略的小分子有机荧光H2O2探针,其创新性的分子构建思路为后续相关研究提供了重要参考。
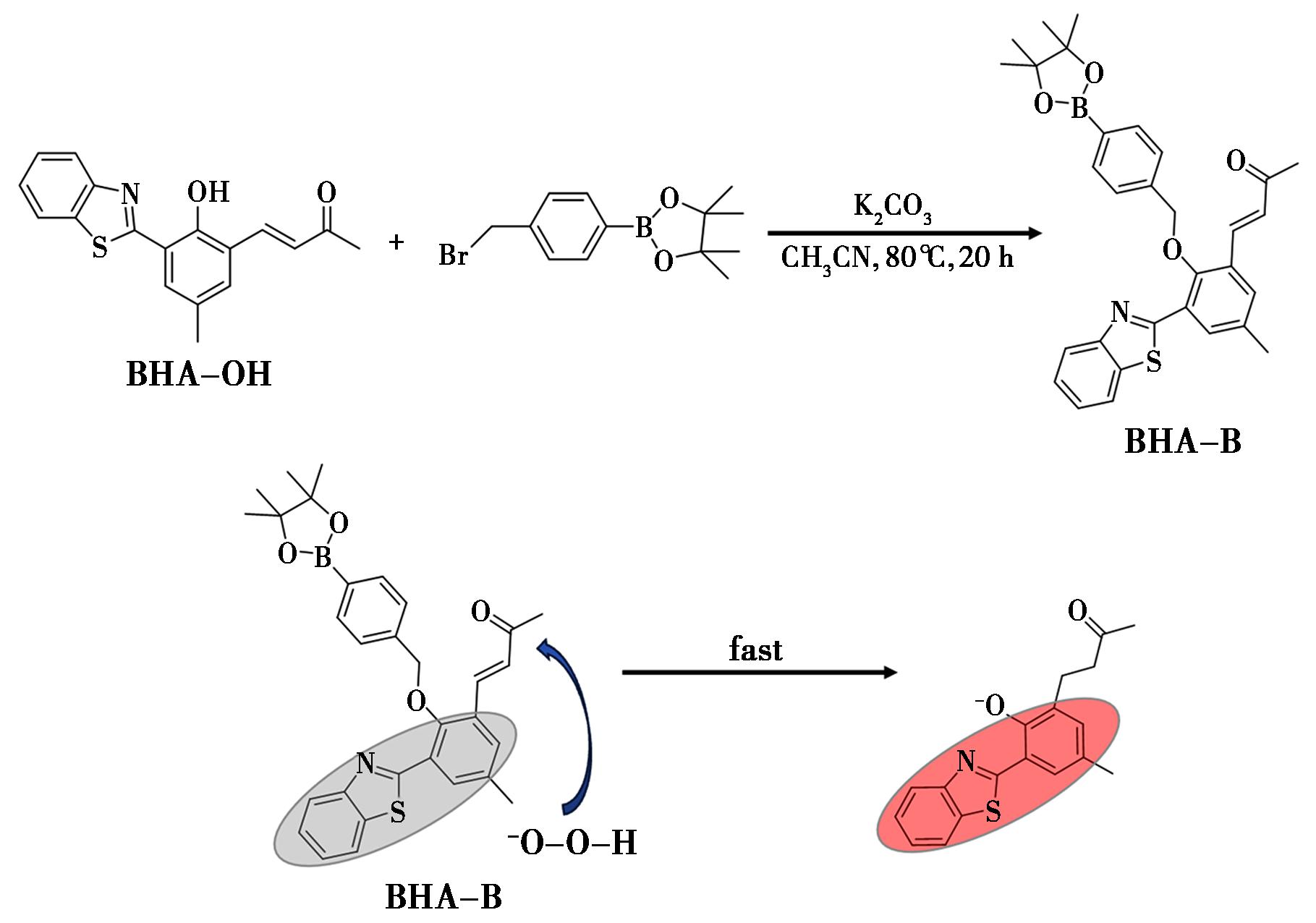
图2 BHA-B的设计以及其检测H2O2的机理
Fig.2 Design of BHA-B and its mechanism for detecting H2O2
HClO(次氯酸)和ClO-(次氯酸盐)是生物体内重要的ROS,作为一种强氧化剂,在免疫防御、细胞信号传导和抗病毒等多种生理过程中发挥关键作用。然而,当他们的水平超过正常范围时,会产生严重的氧化应激,导致组织和细胞的损伤,导致免疫系统紊乱,甚至引发疾病。因此,检测人体内的HClO和ClO-含量对于疾病的早期诊断、治疗监测和预防具有重要意义。次氯酸荧光探针主要是将次氯酸识别基团连接到不同的荧光团上,结合不同的反应机制,从而释放荧光信号[29]。HClO和ClO-的检测机制主要依赖于荧光探针的设计和特定化学反应的触发。这些探针通过分子结构的变化(如环化、开环、氧化还原反应等)实现对目标物种的高选择性和灵敏度检测,并广泛应用于生物医学、环境监测和工业领域,本文只列举部分类型的NIR荧光探针加以介绍。
Li等[30]基于由吸电子和供电子基团组成的HDCX-OH作为荧光团,设计了一种具有近红外荧光检测能力的近红外探针HDCX-HClO,荧光团及探针结构如图3所示,N,N-二甲基硫代氨基甲酸酯的引入使HDCX-HClO无荧光,在HClO存在下,荧光团HDCX-OH被释放,继而显示出显著的近红外荧光发射,荧光强度集中在750 nm处。
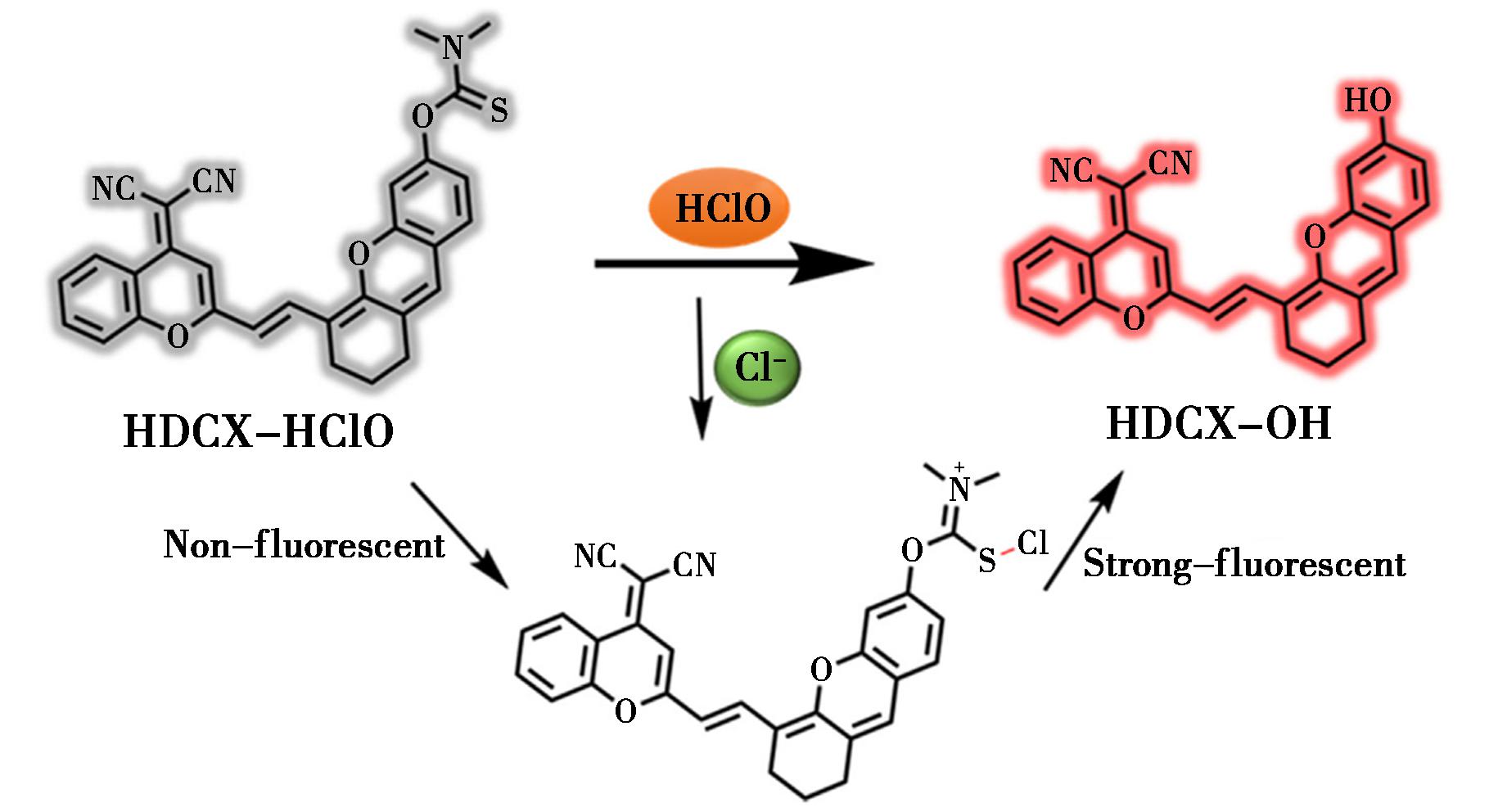
图3 HDCX-HClO对HClO的敏感机制[30]
Fig.3 Sensing mechanism of HDCX-HClO to HClO[30]
Zhang等[31]基于次氯酸盐特异性识别基团N,N-二甲基硫代甲酰基与近红外染料尼罗蓝(NB)的连接而设计了一个特定的荧光探针Pro-NBS(图4)来研究瘢痕疙瘩中ClO-的水平。在液体溶液中,由ClO-衍生出的Cl-离子,开始对碳-硫双键的攻击,导致硫代氨基甲酸酯链段分离。随后,自燃接头通过分子内1,6-消除释放,伴随着二氧化碳(CO2)和4-亚甲醌的生成。这些错综复杂的连续反应构建了分子内推拉电子(D-π-A)系统,从而产生了显著的荧光,其在675 nm处增加约70倍。与其他刺激的比较,探针Pro-NBS在ClO-中表现出独特的灵敏度和出色的选择性检测。这些特征表明探针Pro-NBS有望对生命系统中的瘢痕疙瘩进行实时和原位诊断。
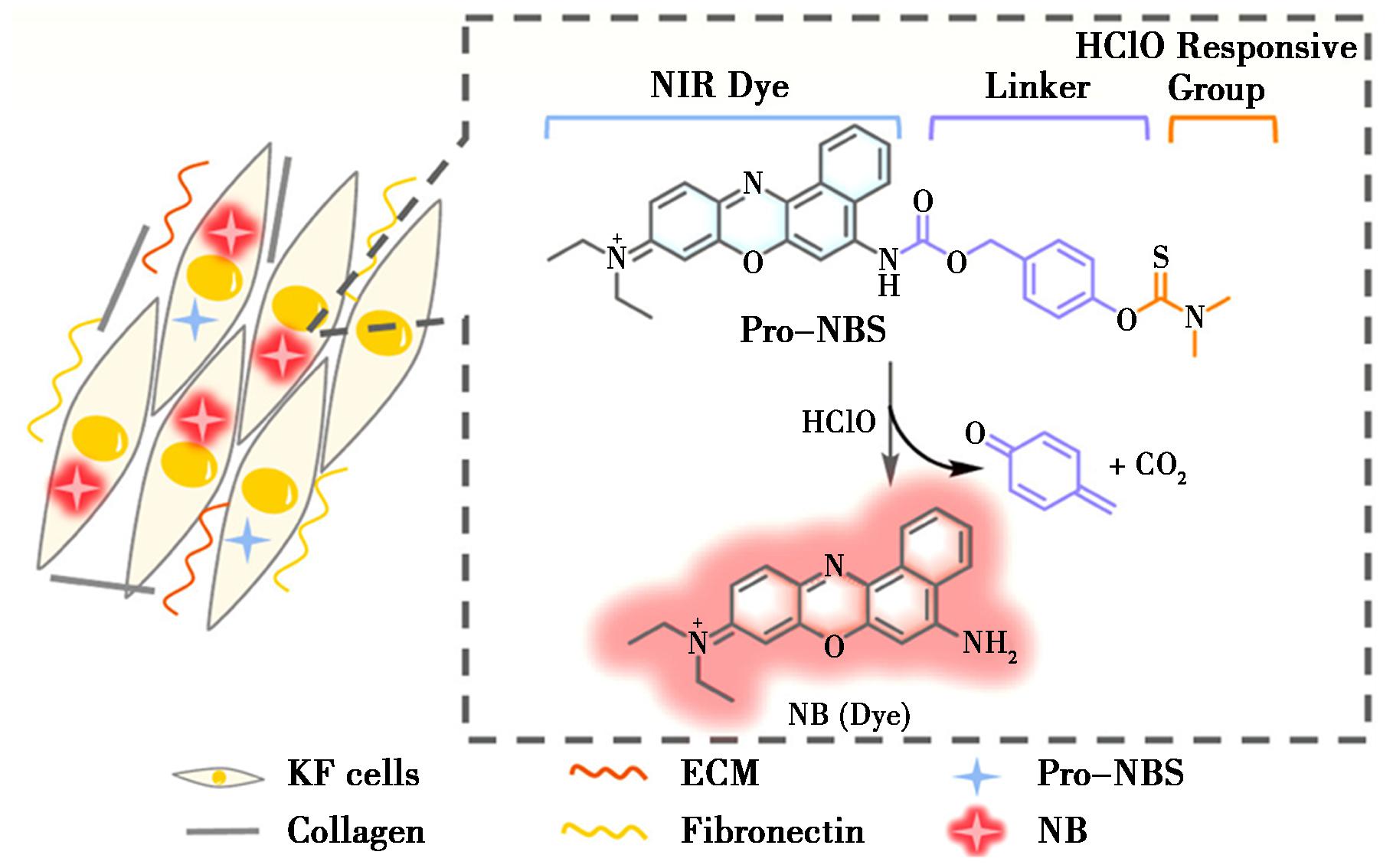
图4 探针Pro-NBS对ClO-的检测机制[31]
Fig.4 Reaction mechanism of probe Pro-NBS for ClO-[31]
Li等[32]基于亚甲蓝(MB)的近红外激发波长开发了一种以MB为荧光核心,N,N-二甲基硫代氨基甲酸酯作为HClO响应部分的NIR荧光探针MB-HPD(图5),其在681 nm处的荧光信号表现出快速增强。N,N-二甲基硫代氨基甲酸酯基团在HClO的持续攻击下发生水解和断开,最终导致荧光团MB的释放,并在激发下获得了明显的红色荧光信号。与其他分析物相比,探针MB-HPD具有快速的荧光响应(20 s)、显著的选择性和对HClO的高灵敏度(14.3 nmol/L)。探针MB-HPD已成功用于各种环境中的HClO成像,包括细胞、斑马鱼、真实水样,以及APAP诱导的关节炎和肝损伤的小鼠模型。探针MB-HPD的广泛适用性为HClO的体内和体外成像提供了一种有前途的工具,这对进一步了解HClO在相关疾病中的作用具有重要意义。
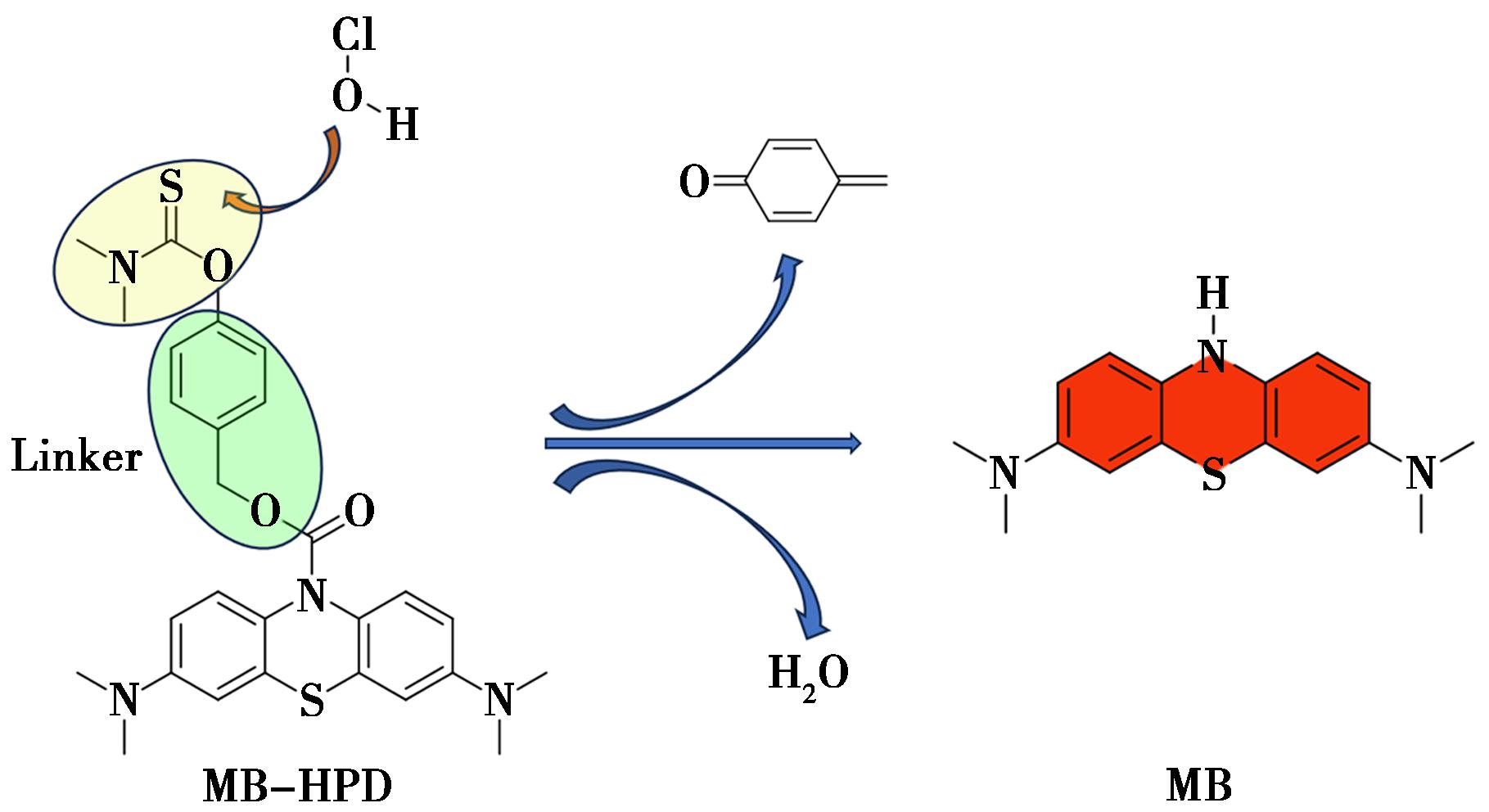
图5 探针MB-HPD对HClO的设计策略
Fig.5 Design strategy of probe MB-HPD towards HClO
Liu等[33]以二氨基马来腈基团为识别位点,设计合成了一种新型NIR荧光探针(SWJT-9),用于检测ClO-。SWJT-9具有较大的斯托克斯位移(237 nm),在可见光下对ClO-表现出优异的NIR荧光响应,颜色发生变化。它显示ClO-的检测限低(24.7 nmol/L)、高选择性和快速检测(2 min内)。此外,该探针还成功用于检测HeLa细胞中的ClO-。
基于此,发现近红外荧光探针在HClO/ClO-检测领域取得了显著进展,通过特异性识别基团(如N,N-二甲基硫代氨基甲酸酯)和多种响应机制(如氧化还原、1,6-消除等)实现了高选择性、快速响应(秒级)和高灵敏度(nmol/L级)检测,并成功应用于细胞、斑马鱼和小鼠疾病模型研究。然而,该领域仍面临选择性不足、响应速度待提升和临床转化困难等挑战。未来研究需聚焦于开发新型识别基团以提高选择性、设计亚秒级响应探针用于动态监测、推动临床术中导航应用,同时结合NIR-Ⅱ/Ⅲ区探针和AI辅助设计等新技术,以深化对HClO/ClO-在疾病中作用机制的理解,并促进其在精准医疗中的实际应用。通过跨学科合作与技术创新,近红外荧光探针有望为氧化应激相关疾病的早期诊断和治疗监测提供更有效的工具。
超氧阴离子![]() 作为ROS家族中的关键成员,在维持细胞代谢和应对环境压力中发挥重要作用,但其过量积累则可能导致严重的生物分子损伤和多种疾病的发生。例如,由
作为ROS家族中的关键成员,在维持细胞代谢和应对环境压力中发挥重要作用,但其过量积累则可能导致严重的生物分子损伤和多种疾病的发生。例如,由![]() 自由基引发的氧化应激和线粒体功能障碍会导致癫痫发作引起的脑损伤。因此,实时、在线地对细胞内的
自由基引发的氧化应激和线粒体功能障碍会导致癫痫发作引起的脑损伤。因此,实时、在线地对细胞内的![]() 进行原位可视化成像检测具有重要的科学意义,还为开发针对氧化应激相关疾病的诊断和治疗策略提供重要依据[34]。
进行原位可视化成像检测具有重要的科学意义,还为开发针对氧化应激相关疾病的诊断和治疗策略提供重要依据[34]。
Ying等[35]开发了一种基于亚甲蓝(MB)的新型NIR荧光探针MB-SO,用于检测![]() 如图6所示,该探针通过氨基甲酸酯键连接还原型MB,其本身没有荧光,在
如图6所示,该探针通过氨基甲酸酯键连接还原型MB,其本身没有荧光,在![]() 作用下发生特异性裂解释放荧光团,实现对
作用下发生特异性裂解释放荧光团,实现对![]() 的高灵敏度、高选择性检测。MB-SO成功应用于活细胞和小鼠模型中
的高灵敏度、高选择性检测。MB-SO成功应用于活细胞和小鼠模型中![]() 的成像监测,特别是在戊烯曲唑(PTZ)诱导的癫痫模型中直接观测到脑内
的成像监测,特别是在戊烯曲唑(PTZ)诱导的癫痫模型中直接观测到脑内![]() 水平的变化。
水平的变化。
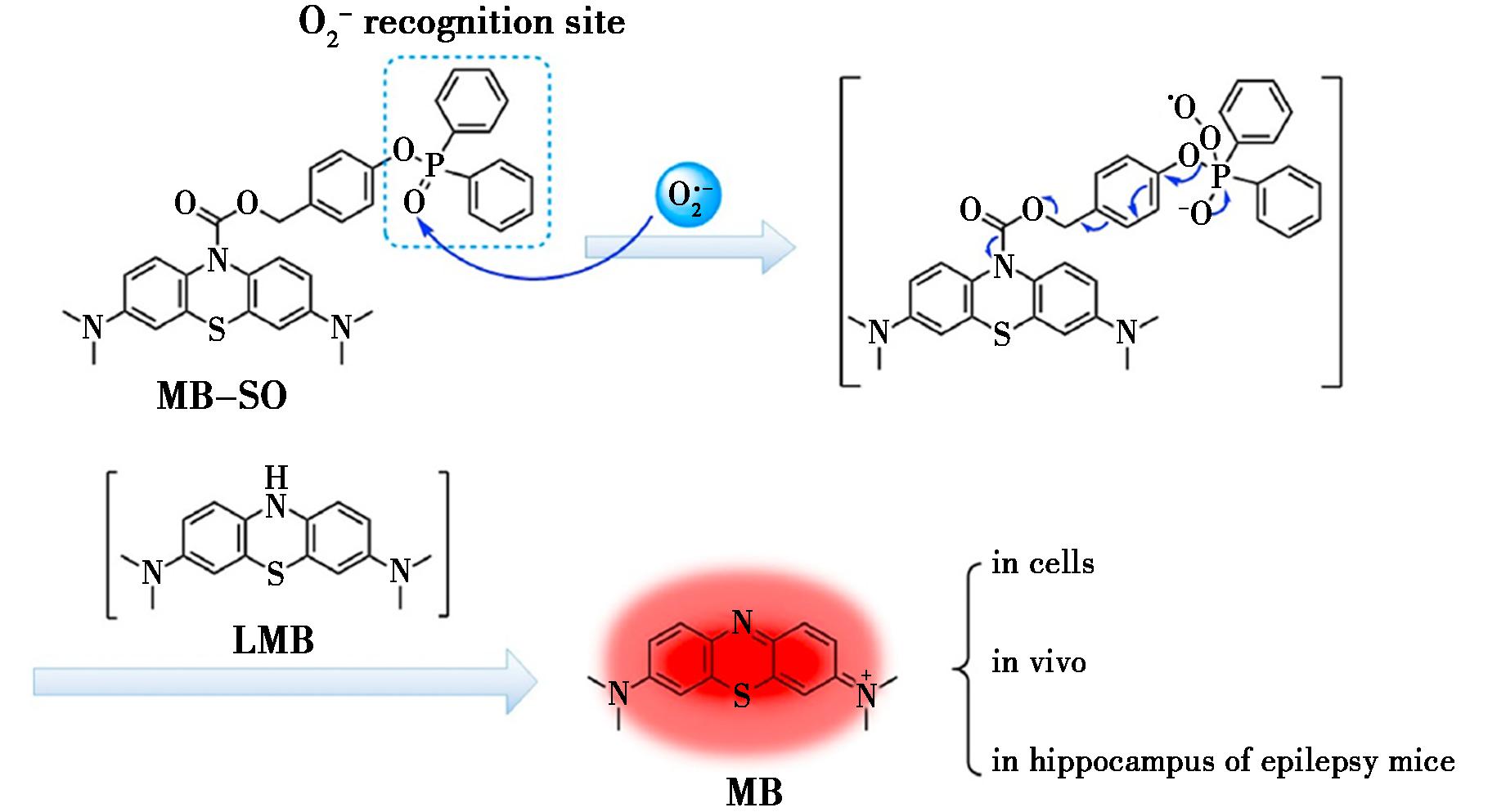
图6 探针MB-SO对![]() 的反应机制[35]
的反应机制[35]
Fig.6 Response mechanism of probe MB-SO for ![]() [35]
[35]
Ma等[36]设计合成了一种新型细胞膜靶向近红外荧光探针SHX-O,用于![]() 的特异性检测。如图7所示,该探针采用半菁骨架作为荧光团,通过引入磺化双吲哚结构和二苯基膦酰识别基团构建而成。探针初始状态下由于羟基取代导致荧光微弱,但在与
的特异性检测。如图7所示,该探针采用半菁骨架作为荧光团,通过引入磺化双吲哚结构和二苯基膦酰识别基团构建而成。探针初始状态下由于羟基取代导致荧光微弱,但在与![]() 特异性反应后,可在790 nm处产生显著的近红外荧光增强。值得注意的是,SHX-O不仅表现出优异的选择性,还因其两亲性结构特性实现了对细胞膜的特异性定位。除此之外,该探针能有效监测黄嘌呤氧化酶/黄嘌呤体系诱导产生的细胞膜
特异性反应后,可在790 nm处产生显著的近红外荧光增强。值得注意的是,SHX-O不仅表现出优异的选择性,还因其两亲性结构特性实现了对细胞膜的特异性定位。除此之外,该探针能有效监测黄嘌呤氧化酶/黄嘌呤体系诱导产生的细胞膜![]() 动态变化,为研究细胞膜相关氧化应激过程提供了有力的分子工具。
动态变化,为研究细胞膜相关氧化应激过程提供了有力的分子工具。
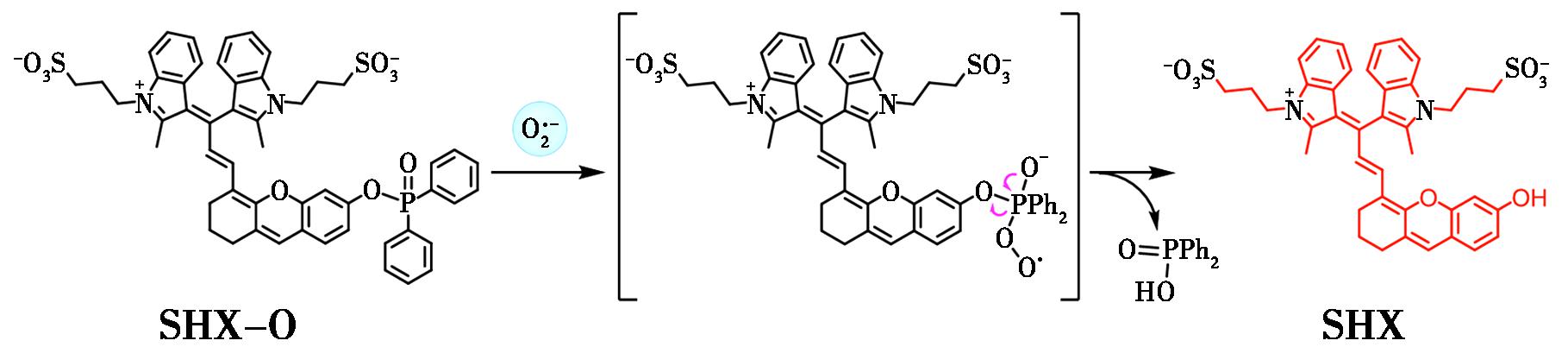
图7 探针SHX-O对![]() 的响应机制[36]
的响应机制[36]
Fig.7 Response mechanism of probe SHX-O to ![]() [36]
[36]
近红外荧光探针技术为![]() 检测提供了强有力的研究工具。基于以上研究,近红外荧光探针大多通过特异性识别基团与
检测提供了强有力的研究工具。基于以上研究,近红外荧光探针大多通过特异性识别基团与![]() 发生氧化还原反应,触发荧光团(如亚甲蓝、半菁等)的释放或构象变化,从而实现对
发生氧化还原反应,触发荧光团(如亚甲蓝、半菁等)的释放或构象变化,从而实现对![]() 的高选择性检测。这些探针利用分子内电荷转移(ICT)、光诱导电子转移(PET)等光物理机制调控荧光信号,并通过结构优化(如磺化修饰)实现细胞膜靶向等特定功能定位。未来研究可从以下几个方向深入探索:1)开发新一代NIR-Ⅱ区(1 000~1 700 nm)探针,提升活体成像的穿透深度和分辨率;2)设计多功能探针系统,实现
的高选择性检测。这些探针利用分子内电荷转移(ICT)、光诱导电子转移(PET)等光物理机制调控荧光信号,并通过结构优化(如磺化修饰)实现细胞膜靶向等特定功能定位。未来研究可从以下几个方向深入探索:1)开发新一代NIR-Ⅱ区(1 000~1 700 nm)探针,提升活体成像的穿透深度和分辨率;2)设计多功能探针系统,实现![]() 与其他生物标志物的同步检测;3)优化探针的药代动力学特性,推动其向临床应用转化;4)结合人工智能辅助的探针设计方法,加速高性能探针的开发,并拓展在神经退行性疾病、心血管疾病等重大疾病研究中的应用。未来需进一步优化探针的稳定性、生物相容性及动态响应范围,以推动其在临床前研究中的应用。
与其他生物标志物的同步检测;3)优化探针的药代动力学特性,推动其向临床应用转化;4)结合人工智能辅助的探针设计方法,加速高性能探针的开发,并拓展在神经退行性疾病、心血管疾病等重大疾病研究中的应用。未来需进一步优化探针的稳定性、生物相容性及动态响应范围,以推动其在临床前研究中的应用。
单线态氧(1O2)具有高反应性和短寿命的特点,是一种性质极其活泼的ROS之一,在细胞信号传导、基因表达调控、细胞分裂、癌症的光动力治疗等方面发挥着重要作用。但由于 1O2的高反应性与短寿命,实时定量地检测线粒体内的 1O2生成具有极大的挑战性,因此,开发一种实时、定量检测线粒体内的 1O2的探针对于在分子水平上理解其在生理和病理过程中的作用至关重要,从而为疾病治疗提供新思路和方法。
Zhao等[37]设计并合成了一种双响应荧光探针DBCC,其结构式如图8所示,荧光量子产率为31.79%。DBCC可以同时检测 1O2和ClO-取决于不同的氧化程度。探针本身几乎没有荧光,同时发出强烈的蓝色(λEm=443 nm)和绿色(λEm=497 nm)荧光 1O2和ClO-,分别实现了 1O2和ClO-。同时,共聚焦显微镜成像表明DBCC能够靶向脂滴(LDs),并成功用于监测外源性和内源性 1O2和ClO-,为后续研究人员提供了检测LDs中的 1O2和ClO-含量的可靠工具。
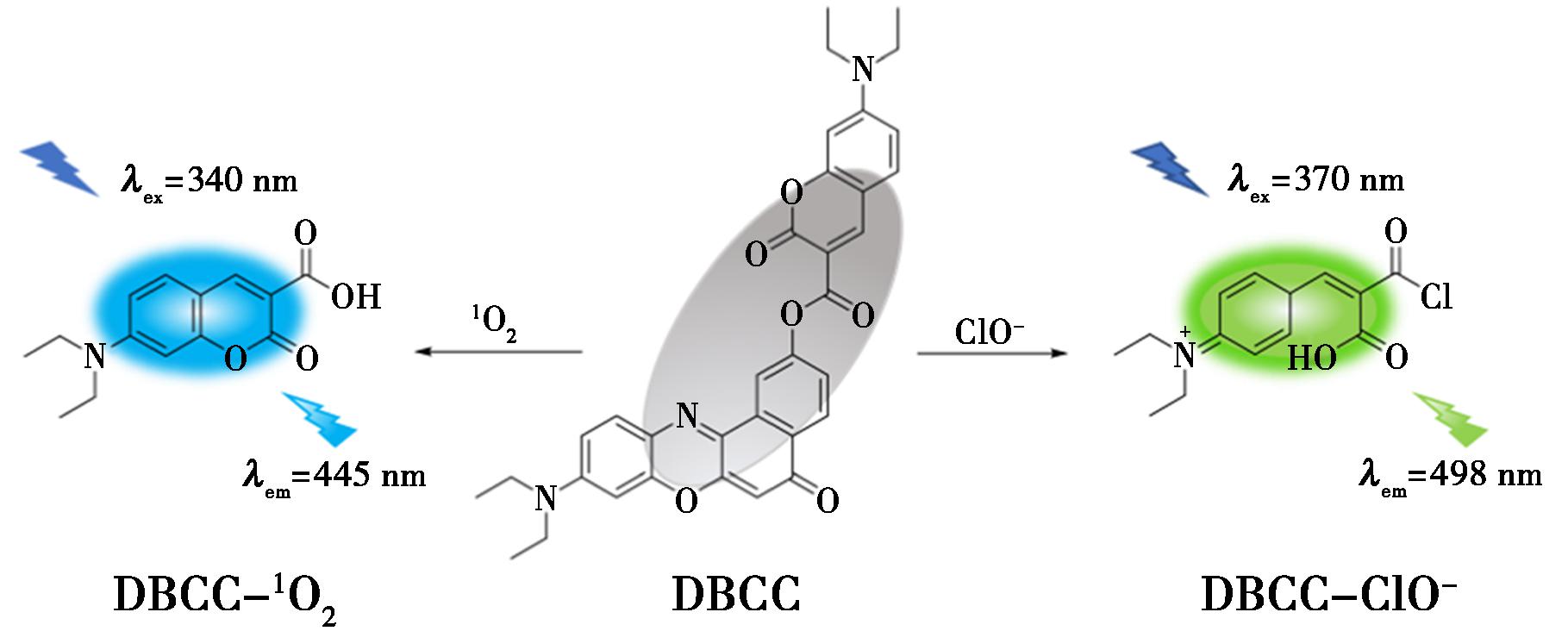
图8 探针DBCC的结构及响应机制[37]
Fig.8 Structure and response mechanism of probe DBCC[37]
实现多功能光疗,同时结合多诊断成像和协同治疗的功能,确实是一个极具吸引力和挑战性的任务。这一目标的核心在于优化利用光敏剂在光激发后的能量耗散途径(包括辐射和非辐射途径),以实现诊断、治疗和监测的多重功能。Tang等[38]巧妙地设计和构建了一种基于聚集诱导发射(AIE)活性荧光团的简单、高效的一体式光热效应传感器(One-for-All-One-One-All-One-to-All),如图9所示。利用AIE活性分子丰富的分子内旋转子和振子、扭曲构象和高的D-A强度,AIE分子基纳米粒子可以巧妙地实现辐射和非辐射激发态能量耗散之间的平衡,表现出显著的NIR-Ⅱ荧光信号,极高的 1O2产生,在单次660 nm激光照射下,光热转换效率高达46%。与传统的One-in-One策略相比,基于AIEgen的One-for-All协议在实现多通道功能和最大化光疗效果方面更加直观。
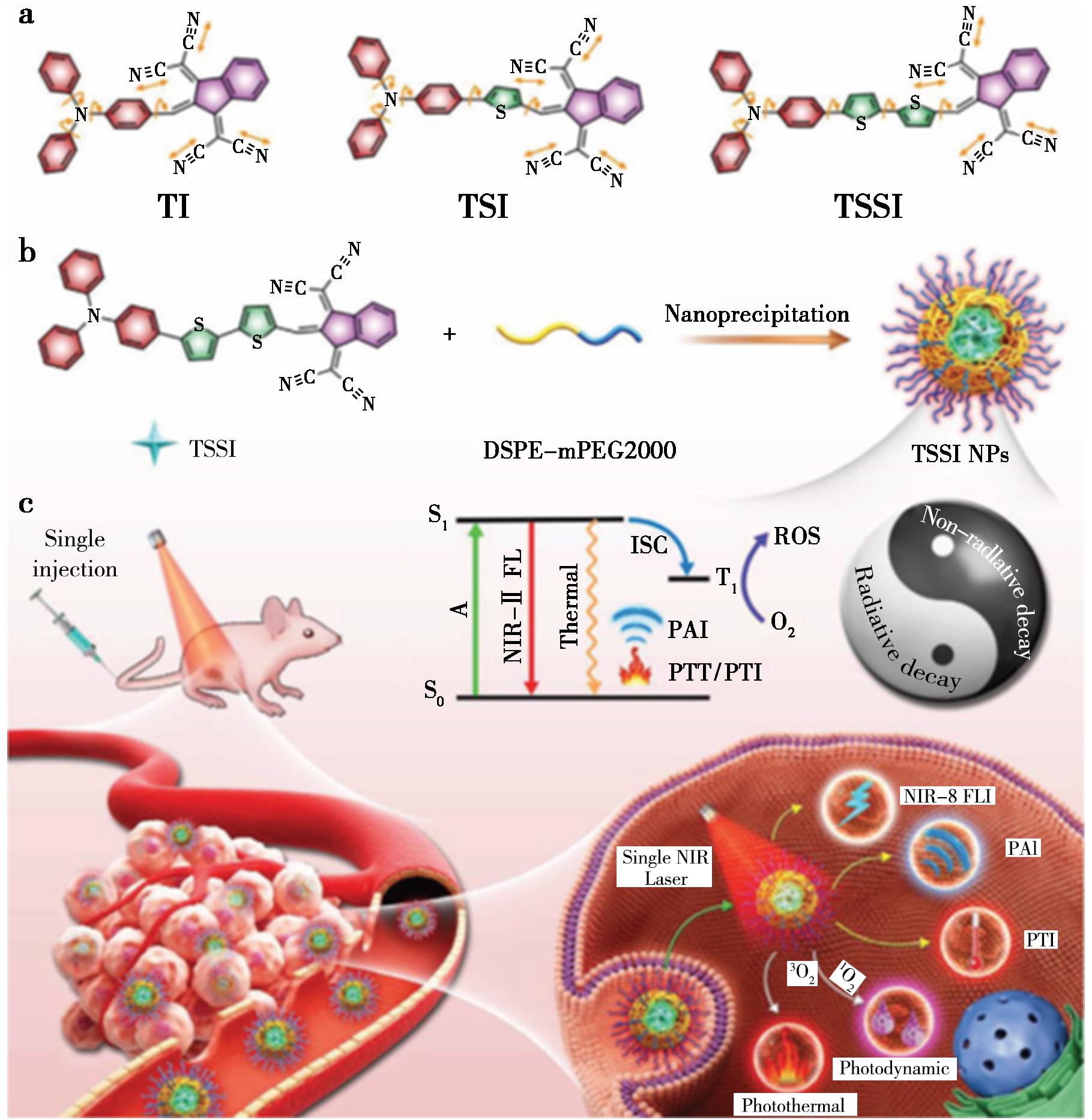
图9 分子结构(a)、纳米制造(b)和多功能光热应用(c)示意图[38]
Fig.9 Schematic illustration of molecular structures (a),nanofabrication (b) and versatile phototheranostic application (c)[38]
基于此,我们发现单线态氧 1O2荧光探针的响应检测机制大多是基于 1O2特异性氧化反应触发荧光信号变化,一些探针如DBCC具备多分析物( 1O2/ClO-)区分能力。当前 1O2探针已从单一检测转向多功能集成,DBCC的双分析物检测与AIEgen的“诊疗一体化”设计代表了前沿方向。未来需重点突破活体实时定量与临床转化壁垒,为光动力治疗等应用提供精准工具。
NO是自由基性质的气体分子,作为细胞中重要的信使分子和效应分子,在人体生理和病理过程中也起着重要作用,与心脑血管、基体炎症、糖尿病、肿瘤、肥胖等多种疾病密切相关。因此,对生物体内NO的检测具有重要的生物学意义。
Lin等[39]开发了用于实时检测炎症性肠病(IBD)中一氧化氮(NO)的近红外荧光探针LS-NO。该探针使用寡乙二醇吗啉官能化噻吩作为强电子供体,使用二氨基苯(1,2,5-噻二唑)作为弱电子受体和NO捕获基团。它可以检测活细胞溶酶体中的外源性和内源性NO,具有很高的灵敏度和特异性。通过密度泛函理论详细分析了模型分子DAD-NO和DAD-TZ内激发和发射过程中的电子转移,结果表明,从作为弱电子受体的二氨基苯(1,2,5-噻二唑)转变为作为强电子受体的三唑并-(1,2,5-噻二唑)使LS-NO成为一种有效的“关-开”近红外NO荧光探针。
Han等[40]基于ICT效应,构建了线粒体靶向NIR荧光探针NFL-NH2,如图10所示,该探针实现了活细胞和类风湿性关节炎(RA)小鼠模型中NO监测的比例计量荧光成像。在NO存在的情况下,探针NFL-NH可与NO反应,探针溶液由绿色变为蓝色。此外,NFL-NH2具有低细胞毒性和出色的线粒体靶向性,可以实时监测炎症刺激下小鼠单核/巨噬细胞(RAW 264.7)中外源性和内源性NO含量。该探针在RA的早期诊断和评估中具有很大的应用潜力。
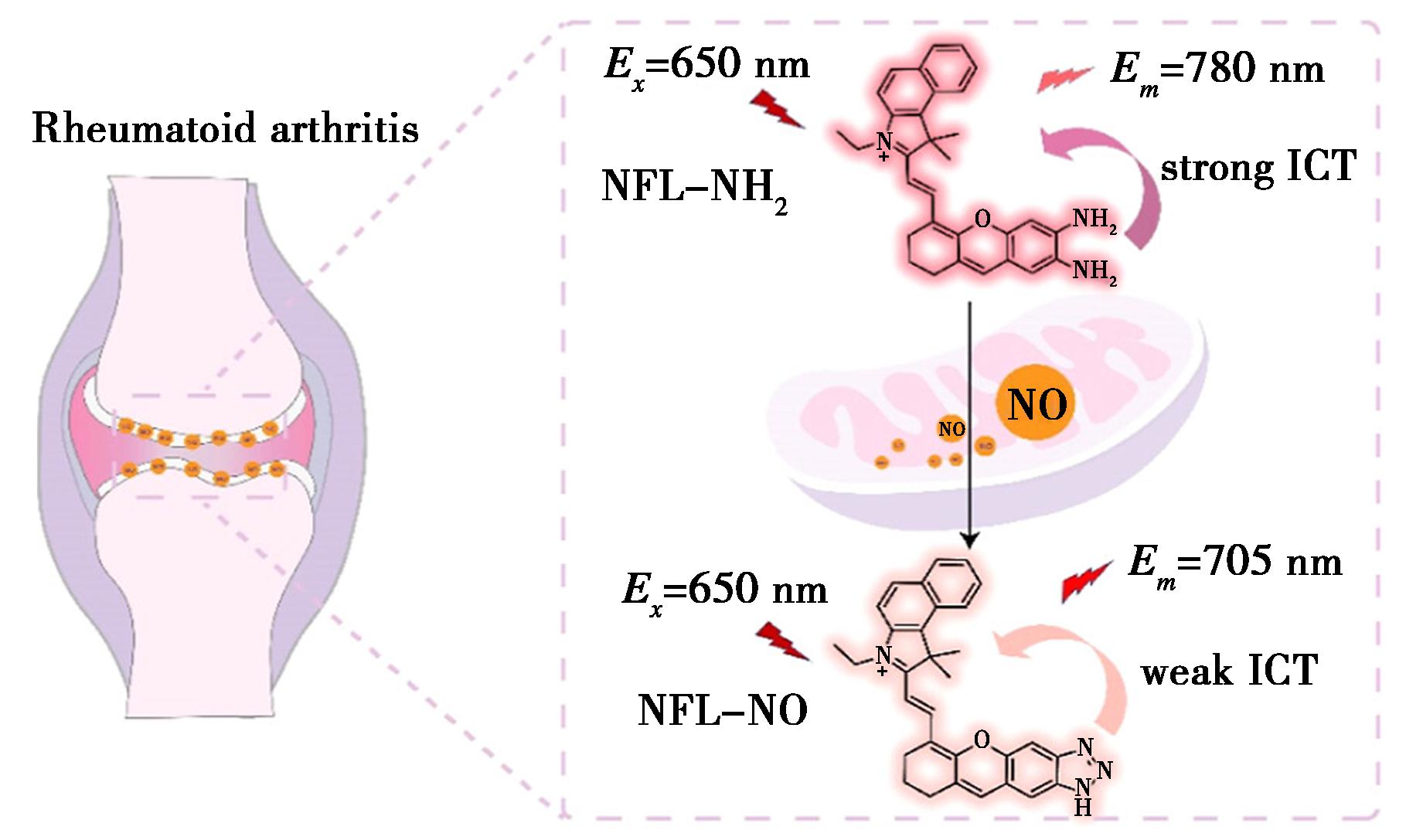
图10 探针NFL-NH2的响应机制[40]
Fig.10 Response mechanisms of probes NFL-NH2[40]
基于以上研究,目前一氧化氮(NO)近红外荧光探针通过特异性识别基团(如二氨基苯噻二唑)与NO发生环化反应,触发分子内电荷转移(ICT)效应增强,实现"关-开"型荧光响应。虽然当前NO探针的很多策略已经实现了高灵敏检测,且为疾病机制研究提供了新工具,但未来还需开发多参数响应探针以同步检测NO与相关生物分子的相互作用网络,并进一步优化探针的药代动力学特性以提升活体成像信噪比,结合NIR-Ⅱ窗口(1 000~1 700 nm)探针技术实现更深组织穿透成像。
过氧亚硝酸盐(ONOO-)是由一氧化氮(·NO)和超氧阴离子![]() 之间的扩散控制反应产生的一种反应性化合物,作为一种信号分子和一系列病理过程的贡献者而受到越来越多的关注。硝酸盐的高活性异构体,其特殊的结构赋予了它很强的氧化能力,能够氧化蛋白质、脂质和核酸。体内过氧亚硝酸盐反应的产物3-硝基酪氨酸具有很强的氧化能力。目前的观点是认为,过氧亚硝酸盐是一种关键的动脉粥样硬化前氧化剂,可以改变斑块中的脂质和蛋白质,促进其进展。除了动脉粥样硬化,研究还表明,过氧亚硝酸盐与其他主要疾病(如再灌注损伤和癌症)存在不良关系。因此开发专一性检测ONOO-的荧光探针对心脑血管等疾病的诊断具有重大意义。
之间的扩散控制反应产生的一种反应性化合物,作为一种信号分子和一系列病理过程的贡献者而受到越来越多的关注。硝酸盐的高活性异构体,其特殊的结构赋予了它很强的氧化能力,能够氧化蛋白质、脂质和核酸。体内过氧亚硝酸盐反应的产物3-硝基酪氨酸具有很强的氧化能力。目前的观点是认为,过氧亚硝酸盐是一种关键的动脉粥样硬化前氧化剂,可以改变斑块中的脂质和蛋白质,促进其进展。除了动脉粥样硬化,研究还表明,过氧亚硝酸盐与其他主要疾病(如再灌注损伤和癌症)存在不良关系。因此开发专一性检测ONOO-的荧光探针对心脑血管等疾病的诊断具有重大意义。
Zhang等[41]设计了一种新型NIR荧光探针DCI-ONOO,该探针采用二氰基异佛尔酮为荧光团,二苯基膦为识别基团,通过ICT机制实现ONOO-特异性检测(LOD=39.8 nmol/L)。该探针具有大斯托克斯位移(208 nm)和pH稳定性,能对活细胞及药物性肝肾损伤模型中的ONOO-进行动态成像,揭示了器官损伤过程中ONOO-的生成模式。
Zhou等[42]通过对苯并吡喃衍生物进行分子骨架优化,开发出具有改良光谱特性的近红外荧光团DCM-Cl-OH,并以此为基础构建了高性能ONOO-荧光探针DCM-Cl-P。如图11所示,该探针对ONOO-表现出优异的选择性和快速响应特性,成功实现了活细胞和斑马鱼模型中ONOO-的可视化检测。该研究不仅为ONOO-检测提供了高效工具,更为深入理解AD病理机制提供了重要实验依据。
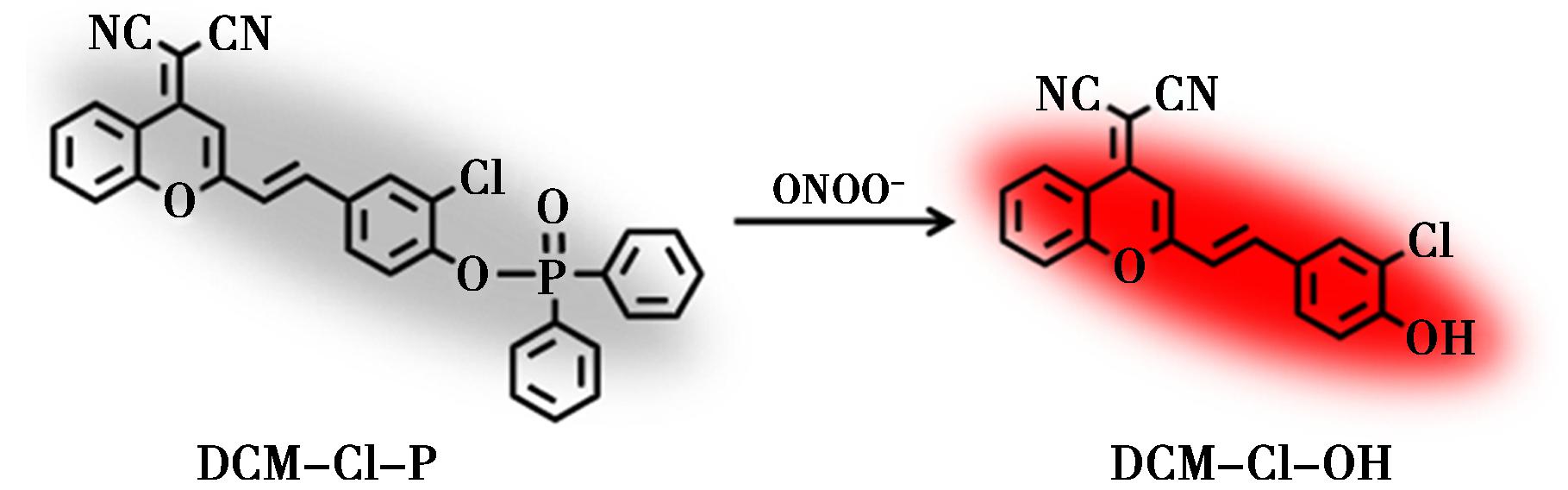
图11 探针DCM-Cl-P的响应机制[42]
Fig.11 Response mechanisms of probes DCM-Cl-P[42]
癫痫是一种严重威胁人类健康的慢性神经退行性疾病。研究表明,癫痫的病理进展与过氧亚硝酸盐(ONOO-)密切相关。然而,由于缺乏强大的成像探针来确定癫痫脑内ONOO-的水平,因此了解ONOO-在癫痫中的生理作用仍是一项具有挑战性的工作。Yu等[43]提出了一种近红外双光子荧光探针二氰基甲基-4H-吡喃(DCM)-ONO(图12a),用于示踪活细胞和红藻氨酸(KA)诱导的大鼠癫痫模型中的ONOO-,具有良好的灵敏度和选择性。该探针由NIR、TP、DCM荧光团和识别部分二苯基膦酰胺组成。探针与ONOO-反应 10 min后,磷酸酰胺键被打断,释放出的氨基由于分子内电荷转移过程的恢复而发出强烈的荧光。结果表明,该探针能有效地检测活细胞和癫痫大鼠脑内内源性ONOO-的变化。
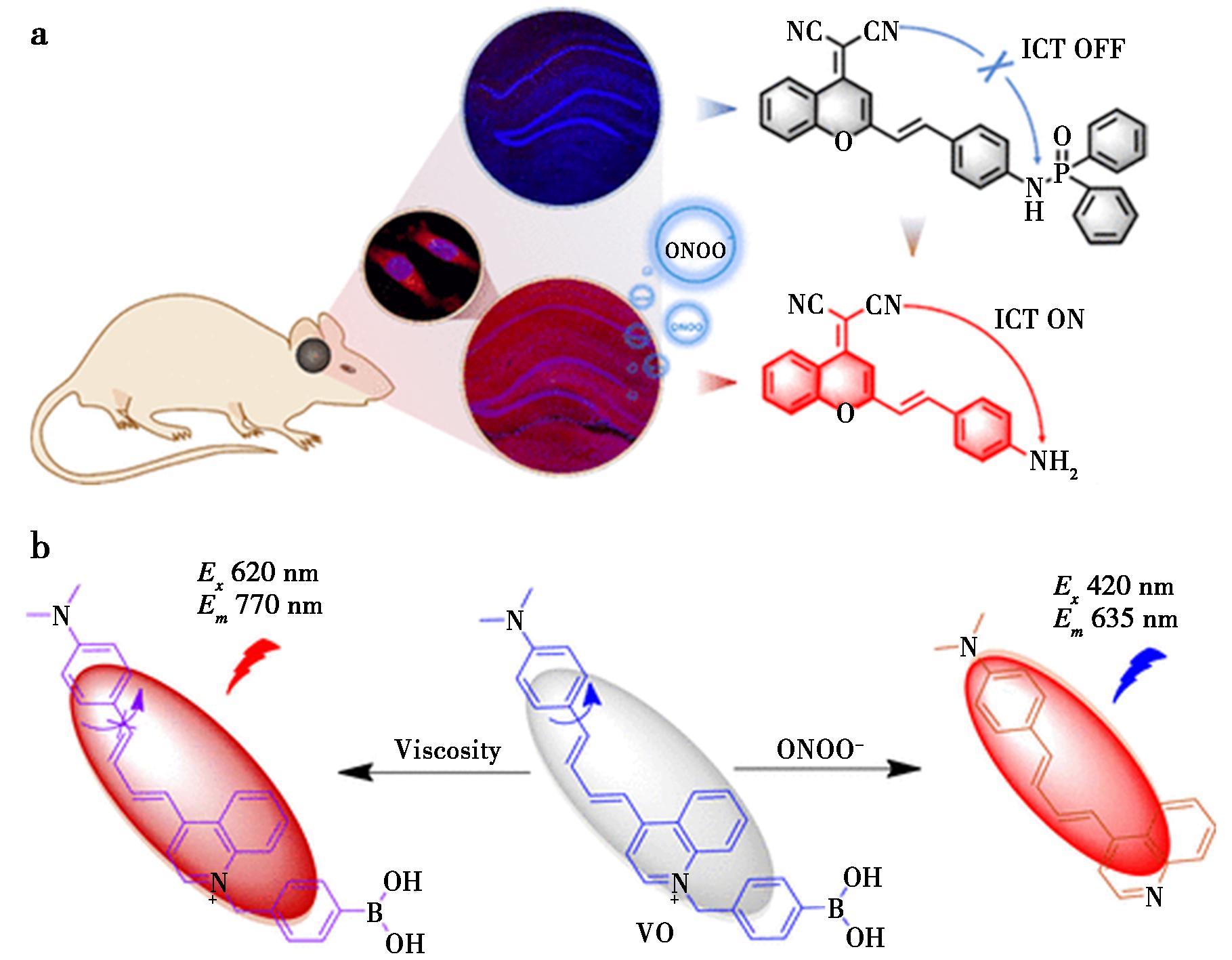
图12 探针(DCM)-ONO(a)和探针VO(b)的响应机制[43,44]
Fig.12 Response mechanisms of probes(DCM)-ONO (a)and probe VO(b)[43,44]
细胞内黏度和ONOO-含量影响正常细胞代谢和生理功能,与很多疾病过程密切相关。Feng等[44]研制了一种多通道成像粘度/ONOO-荧光探针VO(图12b)。实验结果表明,VO对黏度和ONOO-均有较好的检测性能,并基于其细胞毒性和pH稳定性较低的优点,成功地将VO用于活体细胞和动物黏度和ONOO-的成像。该探针通过成像对乙酰氨基酚诱导的粘度和ONOO-变化,成功地显示了药物所致的肝毒性,结果表明VO在检测粘度和ONOO-以及检测药物性肝毒性方面具有很大的潜力。
基于以上研究,近红外荧光探针通过特异性识别基团(如二苯基膦、磷酸酰胺等)与ONOO-发生氧化反应,触发分子内电荷转移(ICT)效应恢复或荧光团释放(如DCM、二氰基异佛尔酮等),实现对ONOO-的高选择性检测(检测限达nmol/L级)。这些探针通过大斯托克斯位移(如208 nm)、双光子吸收(如DCM-ONO)等设计优化,已成功应用于多种疾病模型研究。未来研究应聚焦于1)开发多参数响应探针同步检测ONOO-及其关联分子(如![]() 设计血脑屏障穿透性探针用于中枢神经系统疾病研究;3)结合NIR-Ⅱ成像提升活体检测深度;4)探索ONOO-在疾病中的分子调控网络。这些突破将推动氧化应激相关疾病的机制研究和早期诊断。
设计血脑屏障穿透性探针用于中枢神经系统疾病研究;3)结合NIR-Ⅱ成像提升活体检测深度;4)探索ONOO-在疾病中的分子调控网络。这些突破将推动氧化应激相关疾病的机制研究和早期诊断。
本文以过氧化氢(H2O2)、超氧阴离子![]() 单线态氧(1O2)、次氯酸(HClO)、一氧化氮(NO)和过氧亚硝基阴离子(ONOO-)6种ROS检测探针为基本分类,系统梳理了近5年来基于不同识别机制的近红外ROS响应型荧光探针的研究进展,重点对每一类荧光探针的检测机制进行了综述,旨在为开发具有更高选择性、更低毒性、更好生物相容性的新型近红外荧光探针,满足基础研究和临床应用的多样化需求提供帮助。
单线态氧(1O2)、次氯酸(HClO)、一氧化氮(NO)和过氧亚硝基阴离子(ONOO-)6种ROS检测探针为基本分类,系统梳理了近5年来基于不同识别机制的近红外ROS响应型荧光探针的研究进展,重点对每一类荧光探针的检测机制进行了综述,旨在为开发具有更高选择性、更低毒性、更好生物相容性的新型近红外荧光探针,满足基础研究和临床应用的多样化需求提供帮助。
近年来,小分子荧光探针在ROS检测领域取得了突破性进展,但仍面临诸多关键挑战:1)探针光学性能的优化仍是当前研究的重点方向。开发具有大斯托克斯位移、高荧光量子产率和快速响应特性的新型探针,将显著提升检测灵敏度和成像质量;2)探针的生物相容性和组织穿透性亟待改善,未来的发展方向应致力于材料与结构的优化,设计近红外探针来提升组织穿透深度;3)比率型荧光探针凭借其自校准特性,能够有效消除检测过程中的系统误差,将成为未来发展的重点方向。以上3点均为ROS荧光探针的开发提供了新的思路。
此外,ROS与衰老、心血管疾病、糖尿病及癌症以及很多的并发症有密切的联系,但目前能够实时跟踪细胞内ROS并精确量化的探针较少,基于此,未来的研究应更多的集中于突破ROS荧光探针对临床应用的转化。值得关注的是,随着人工智能技术的快速发展,以DeepSeek为代表的先进AI系统正在为荧光探针研究带来革命性的变革,有望大幅提升探针开发效率,为实现ROS的高效检测和精准调控提供新的技术手段,最终为疾病诊断和治疗开辟新的途径。
[1]Wiseman H,Halliwell B.Biochem.J.,1996,313:17-29.
[2]Mccord J M.Science,1974,185(4 150):529-531.
[3]Chen Z X,Miao Z Q,Wang H P,Rao X B,Liu F L,Lu D P,Lu H F,Zhang Q L.Sens.Actuators,B,2025,424:136 911.
[4]Balaban R S,Nemoto S,Finkel T.Cell,2005,120(4):483-495.
[5]Sensi S L,Yin H Z,Weiss J H.Eur.J.Neurosci.,2000,12(10):3 813-3 818.
[6]Thews O,Riemann A.Cancer Metastasis Rev.,2019,38(1/2):113-129.
[7]Wang Y N,Hu L M,Sun G H,Hao Z M,Yang J,Mo S Y.Chem.Reagents,2023,45 (9):83-89.
王筱楠,胡利明,孙国辉,郝振铭,杨静,莫善雁.化学试剂,2023,45(9):83-89.
[8]Doni A,Musso T,Morone D.J.Exp.Med.,2015,212(6):905-925.
[9]Yang J,Guo Y,Marco P,Yan J.Dyes Pigm.,2021,193:109 466.
[10]Ning Y,Jin G Q,Wang M X,Gao S,Zhang J L.Curr.Opin.Chem.Biol.,2021,66:102 097.
[11]Altynay K,Nathan R,Rory P,Jürgen K,Mark G,Víctor M,Muhammad M,Atif S,Liao H G,Mani S,Swapnil S,Michael S,Zhang X L,Boon S,Mark H,Lloyd W,Jin X J,Gong X,Flavio Q,Adylkhan T,Assel T,Carlos M.Nat.Biotechnol.,2023,41:1 208-1 220.
[12]Choquet D,Sainlos M,Sibarita J B.Nat.Rev.Neurosci.,2021,22(4):237-255.
[13]Anusha B,Peeyush Y,Le Z,Ramesh N B,Ming X,Timothy E G.Angew.Chem.Int.Ed.,2024,63:e20 240 640.
[14]Lu Z,Wei P,Peng H,Jiang L,Wu P,Yi T.Theranostics,2024,14(10):3 900-3 908.
[15]Han Q,Shang Z Y,Zhang T W,Meng Q T,Guo H,Wang K H.J.Mol.Struct.,2024,1 318(1):139 361.
[16]Niu H Y,Liu J W,Helen M,Connor O,Thorfinnur G,Tony D J,Zhang H.Chem.Soc.Rev.,2023,52:2 322-2 357.
[17]Jia D L,Li Z,Ma H Y,Ji H Y,Qi H L,Zhang C X.Anal.Chem.,2024,96:6 030-6 036.
[18]Xu Z Y,Zheng Q F,Li N,Deng W H,Qin T Y,Lv T Y Z,Wang L,Li M L,Chen X Q,Zhang W X,Liu B,Peng X J.J.Hazard.Mater.,2024,477(15):135 364.
[19]Cai W J,Xin T,Sun L L,Fan C B,Liao G M,Tu Y Y,Liu G,Pu S Z.Spectrochim.Acta,Part A,2024,316(5):124 341.
[20]Zhang Y Y,Wei H C,Li Y,Shang Z Y,Zhang R,Zhang Z Q,Meng Q T.Anal.Chim.Acta,2025,1 351(15):343 882.
[21]Han H H,Tian H,Zang Y,Sedgwick A C,Li J,Sessler J L,He X P,James T D.Chem.Soc.Rev.,2021,50(17):9 391-9 429.
[22]Wang L,Ma Y Y,Lin W Y.J.Hazard.Mater.,2024,461(5):132 604.
[23]Wang F,Sun X L,Zan J N,Li M S,Liu Y F,Chen J Y.Spectrochim.Acta,Part A,2020,265:118 230.
[24]Stephen M,Maria H,Stuart N,Tan J,Laurence M,Katrina A.Org.Biomol.Chem.,2023,21:8 548-8 553.
[25]Chang Y,Fu J,Yao K.Dyes Pigm.,2019,161:331-340.
[26]Jiao X,Li Y,Niu J,Xie X,Wang X,Tang B.Anal.Chem.,2018,90(1):533-555.
[27]Fan C Y,Gao X,Wang H L,Xiong Y,Zou X T,Liu S Y.Dyes Pigm.,2023,219:111 606.
[28]Chen S J,Fan W K,Sun Z,Zheng E,Wang L,Wu Y Y,Hou S C,Ma X D.Spectrochim.Acta,Part A,2022,276:121 162.
[29]Liu X L,Liu Z Q,Li Y J,Wang Y L,Zhang W Z.Org.Biomol.Chem.,2025,23:1 708-1 713.
[30]Li L L,Wan X F,Huang J Z,Ma K D,Tan X Y.Front.Chem.,2022,10:1 009 186.
[31]Yuan F,Zhang S Y,Wang Y,Gao X,Zhao Y H,Ning L L,Wang Y W,Guo Y,Zhang J J.Anal.Chem.,2024,96(42):16 964-16 970.
[32]Li Q,Qi P F,Wang L,Wang Y Y,He C,Fu S,Chen S,Zhang H G,Hou P.Spectrochim.Acta,Part A,2024,320:124 613.
[33]Liu C X,Xiao S Y,Gong X L,Zhu X,Wang Y W,Peng Y.Molecules,2023,28:402.
[34]Jie Z,Liu J,Shu M,Ying Y,Yang H.Talanta,2022,236:122 892.
[35]Ying W W,Dong F X,Shi Y F,Zhan Z Y,Wang S W,Lv L,Liu H Z,Liu L,Zheng Y G,Zhang L.Dyes Pigm.,2023,213:111 155.
[36]Ma B K,Chai Z Y,Liu Y,He Z X,Chen X Q,Qian C,Chen Y J,Wang W Z,Meng Z H.Spectrochim.Acta,Part A,2025,327:125 431.
[37]Zhao W Q,Zhang S T,Yan J L,Xu P Y,Li B,Zhang Y M,Li J L,Wu S P.Sens.Actuators,B,2024,412:135 813.
[38]Zhang Z,Xu W,Kang M,Wen H,Guo H,Zhang P,Xi L,Li K,Wang L,Wang D,Tang B Z.Adv.Mater.,2020,32(36):e2 003 210.
[39]Lin X Y,Sun S H,Liu Y T,Shi Q Q,Lv J J,Peng Y J.Front.Chem.,2023,10:990 979.
[40]Han T T,Sun Y,Zhao C,Wang H Y,Yu H,Liu Y.J.Med.Chem.,2024,67(5):4 026-4 035.
[41]Zhang Z F,Zhang Y,Wang H Y,Ge C P.Anal.Methods,2025,doi:10.1039/d5ay00486a.
[42]Zhou Z L,Fang C,Shen Y M,Zhang X Y,Li H T,Zhang Y Y.Sens.Actuators,B,2024,415(15):135 971.
[43]Luo X,Cheng Z,Wang R,Yu F.Anal.Chem.,2021,93(4):2 490-2 499.
[44]Deng Y,Feng G.Anal.Chem.,2020,92(21):14 667-14 675.