随着“碳达峰”、“碳中和”等目标的提出,锂离子电池(LIB)作为可持续的清洁能源进入了快速发展的时期[1],同时也引发一系列的潜在问题。一方面有价金属的大量消耗使得锂离子电池制造面临资源枯竭的困境[2,3]。另一方面,废旧锂离子电池大量堆积也会对生态系统造成潜在的污染[4],尤其是其中的重金属、电解质、溶剂及各类有机物辅料,如果不经合理处置而废弃,将对生态系统和人类健康等造成巨大危害[5,6]。因此,对废旧锂离子电池进行回收再利用具有重要意义。目前报道较多的回收方法是火法回收和湿法回收。然而,传统的火法回收工艺面临能耗高、废气排放、锂损失等问题[7,8],湿法工艺是目前回收锂离子电池最主要的方法,但是大量使用强酸、氧化剂、沉淀剂等,同样具有腐蚀性强、后处理流程长且复杂、释放有害气体等风险[9,10]。寻求一种绿色、无毒、选择性好的溶剂成为研究热点问题之一。
传统离子液体因其卓越的金属氧化物溶解能力而备受关注,其毒性和价格却是制约发展的主要瓶颈。作为近年来快速发展的绿色溶剂,低共熔溶剂(Deep eutectic solvents,DESs)能够有效地促进金属的选择性浸取、分离及回收,这为金属资源循环利用带来了新的解决方案。它是由氢键受体(Hydrogen bonding acceptor,HBA)和氢键供体(Hydrogen bonding donor,HBD)以一定的化学计量比组合而成的低共熔混合物,其凝固点显著低于各组成成分的熔点,具有原料价廉易得、制备简单、物理化学性质稳定、结构性质可调、导电性好、饱和蒸气压低、不易燃、可生物降解、对金属氧化物具有较好溶解性等优点[11-13],在化学反应[14,15]、电化学[16]、分离[17]等领域得到广泛的应用。
2019年,Tran等[18]首次利用无毒且可生物降解的氯化胆碱(ChCl)-乙二醇(EG)DESs浸出钴酸锂,钴的浸出率高达94.1%。氯化胆碱-尿素在180 ℃下溶解钴酸锂12 h,Li和Co的浸出率分别为95%、98%[19]。Lu等[20]基于草酸(OA)的弱酸性和还原性设计了氯化胆碱-草酸(n(氯化胆碱)∶n(草酸)=1∶1)DESs,在120 ℃下将钴酸锂中钴和锂的浸出率分别提高至96.3%、96.1%。Chen等[21]采用聚乙二醇-硫脲(n(聚乙二醇)∶n(硫脲)=1∶2)DESs改善了LiCoO2的溶解效果,在80 ℃下反应24 h后,Co在其中的溶解度为2121.14 mg/L,分别是Co在PTSA-H2O-ChCl和ChCl-EG的2倍和35倍。曾静[22]针对剥离铝箔后的钴酸锂-铜复合材料,设计了一种以聚乙二醇和柠檬酸组成的新型DESs,锂和钴的浸出效率达96%、71%,同时能选择性分离铜。低共熔溶剂在推动废旧锂离子电池于温和环境中实现绿色环保与经济效益的双重目标上,展现出独特的优势,然而DESs会将所有目标金属元素全部浸出,需要添加沉淀剂或调节pH实现元素间的相互分离[23]。其次,大部分低共熔溶剂的黏度较大,需要较高温度或额外加入稀释剂才能提高浸出效率[24]。开发和设计新型双功能DESs以实现高效、高选择性一步提取有价金属仍然是一项挑战。
提高溶剂酸性、调控氢键供体类型及DESs类型可实现在温和条件下高效浸出的目的[25-27]。研究表明,组分的配位和还原能力以及DESs的黏度和质子活性是选择性浸出LiCoO2的重要因素。氯化胆碱型DESs浸出钴酸锂时,氯化胆碱提供氯离子与Co、Li结合形成配合物,乙二醇、尿素、丙二酸、草酸等氢键供体起到还原剂的作用,可将高价金属还原为低价金属,此外,活性质子作为氧受体,吸收钴酸锂中的氧,破坏金属氧化物的共价键,促进钴酸锂的溶解[28]。但是浸出后钴以配离子形式连同锂离子一起进入到浸出液中,需要后续复杂的分离过程。因此,选择能与Co2+形成不溶性配合物的组分制备DESs是原位选择性浸出的前提。此外,LiCoO2为金属氧化物,在浸出时加入一定量的酸使H+与正极材料中的氧结合破坏晶体结构,可提高浸出效果。
在众多氢键供体中,草酸为二元中强酸,具有较强的还原能力和配位能力,其价格较低,在废旧电池正极材料的浸出中应用广泛。但是以氯化胆碱-草酸浸出LiCoO2时,溶液中存在![]() 两种竞争配体,在配体化学序列中分裂能大小为
两种竞争配体,在配体化学序列中分裂能大小为![]() 优先与分裂能较低的Cl-形成[CoCl4]2-配离子而不是固体CoC2O4·2H2O,因此,无法实现Li和Co的原位分离。此外,氯化胆碱-草酸的黏度较高,影响浸出过程中离子的传质效果,增加浸出后过滤难度。在氯化胆碱-乙二醇DESs中乙二醇既是氢键供体,又是稀释剂,大幅降低氯化胆碱的黏度,且乙二醇能与水、丙酮互溶,还具有较高的沸点,配制形成溶液时不容易固化。
优先与分裂能较低的Cl-形成[CoCl4]2-配离子而不是固体CoC2O4·2H2O,因此,无法实现Li和Co的原位分离。此外,氯化胆碱-草酸的黏度较高,影响浸出过程中离子的传质效果,增加浸出后过滤难度。在氯化胆碱-乙二醇DESs中乙二醇既是氢键供体,又是稀释剂,大幅降低氯化胆碱的黏度,且乙二醇能与水、丙酮互溶,还具有较高的沸点,配制形成溶液时不容易固化。
本文提出了一种基于低共熔溶剂中常用的试剂乙二醇和草酸组合的新型DESs,用于从废旧锂离子电池的正极活性材料(LiCoO2)中一步选择性提取和分离Li和Co。在温和条件下就能实现高效浸出,得到草酸盐二水合物(CoC2O4·2H2O)和草酸锂(Li2C2O4)。详细探讨了所制备的DESs(n(EG)∶n(OA))的特性,包括DESs的热稳定性、结构特征。深入研究了浸出条件对Li和Co选择性浸出效率的影响。此外,还具体讨论了 LiCoO2中选择性浸出Li和Co的机理。
1 实验部分
1.1 主要仪器与试剂
STA 449F3型同步热分析仪(德国耐驰仪器制造有限公司);Avio 200型电感耦合等离子体发射光谱仪(珀金埃尔默仪器(上海)有限公司);Ultima Ⅳ型X-射线衍射仪(日本理学株式会社);Apreo 2C型场发射扫描电子显微镜(美国赛默飞世尔科技公司);UV 3900H型紫外可见分光光度计(日本株式会社岛津制作所);VERTEX70型傅里叶红外光谱仪(德国布鲁克光谱仪器公司);TDL-60B型离心机(青岛明博环保科技有限公司);FA1004N型电子天平(上海精密科学仪器有限公司);DHG-9030A型电热恒温干燥箱(上海高致精密仪器有限公司);ZNCL-GS型智能恒温磁力搅拌器(巩义市予华仪器有限责任公司)。
钴酸锂(LiCoO2)、草酸(H2C2O4·2H2O)、乙二醇(C2H6O2)(分析纯,上海阿拉丁生化科技股份有限公司)。废旧LiCoO2电池黑粉由天津某废旧锂离子电池回收厂提供,用王水溶解并通过ICP进行化学成分分析,其中Li的质量分数为5.60%,Co的质量分数为59.25%。所有试剂在使用时均未进行二次处理。
1.2 实验方法
1.2.1 低共熔溶剂的制备
称取一定量的乙二醇(EG)和草酸(OA)置于带磨口塞的试剂瓶中,在60 ℃条件下加热磁力搅拌,直至得到澄清透明的液体,将制备好的溶剂放入恒温干燥箱中备用。
1.2.2 浸出钴酸锂
准确称取一定量的钴酸锂粉末和DESs加入到带塞的玻璃瓶中,在400 r/min转速下进行浸出,考察液料比(10~100 g/g)、温度(60~100 ℃)、浸出时间对钴和锂浸出率的影响,浸出结束后采用高速离心机将混合物离心分离,可原位获得固体CoC2O4·2H2O;采用蒸馏方式处理上清液,加热温度为160 ℃,随着蒸馏的进行圆底烧瓶中的液体由无色澄清逐渐变为白色浑浊然后变为淡黄色浑浊液,直至形成黄色浑浊液且无馏液时停止加热,将圆底烧瓶中的浑浊液进行过滤,依次用蒸馏水、无水乙醇进行洗涤,将固体产物放于恒温干燥箱中在100 ℃下干燥12 h,得到白色固体Li2C2O4。
1.2.3 表征/测试方法
使用同步热分析仪在氮气气氛下测定DESs的热稳定性,测试温度范围为30~800 ℃,升温速率为10 ℃/min。采用紫外-可见分光光度计和傅里叶红外光谱仪测试了的结构特征。采用扫描电子显微镜(SEM)和X射线衍射仪(XRD)分别测试分离纯化后固体化合物的形貌和物相。
按式(1)计算LiCoO2中金属离子的浸出率(ηi),并用电感耦合等离子体发射光谱仪对浸出混合物中的Li和Co进行定量测试。
ηi=[(nimi)/(msωi)]×100%
(1)
式中,ni为浸出液中测定金属离子的质量浓度,g/g;mi为浸出液的初始质量,g;ms为钴酸锂粉末的质量,g;ωi为钴酸锂中金属元素的占比,wt%。
2 结果与讨论
2.1 低共熔溶剂的性质及结构
利用DESs浸出废旧锂离子电池时,温度是重要的影响因素,不仅影响有价金属的浸出,同时如果其浸出温度高于DESs的分解温度将导致DESs分解因而破坏DESs的结构,因此,了解DESs的热稳定性是选择溶剂的先决条件。同步热分析仪(TG-DSC)在研究材料的热稳定性、相转变温度、物质的变化情况等方面具有快速、准确、精度高等优点,应用范围非常广泛。浸出前采用同步热分析仪测试了5种n(EG)∶n(OA)的热稳定性,结果见图1。
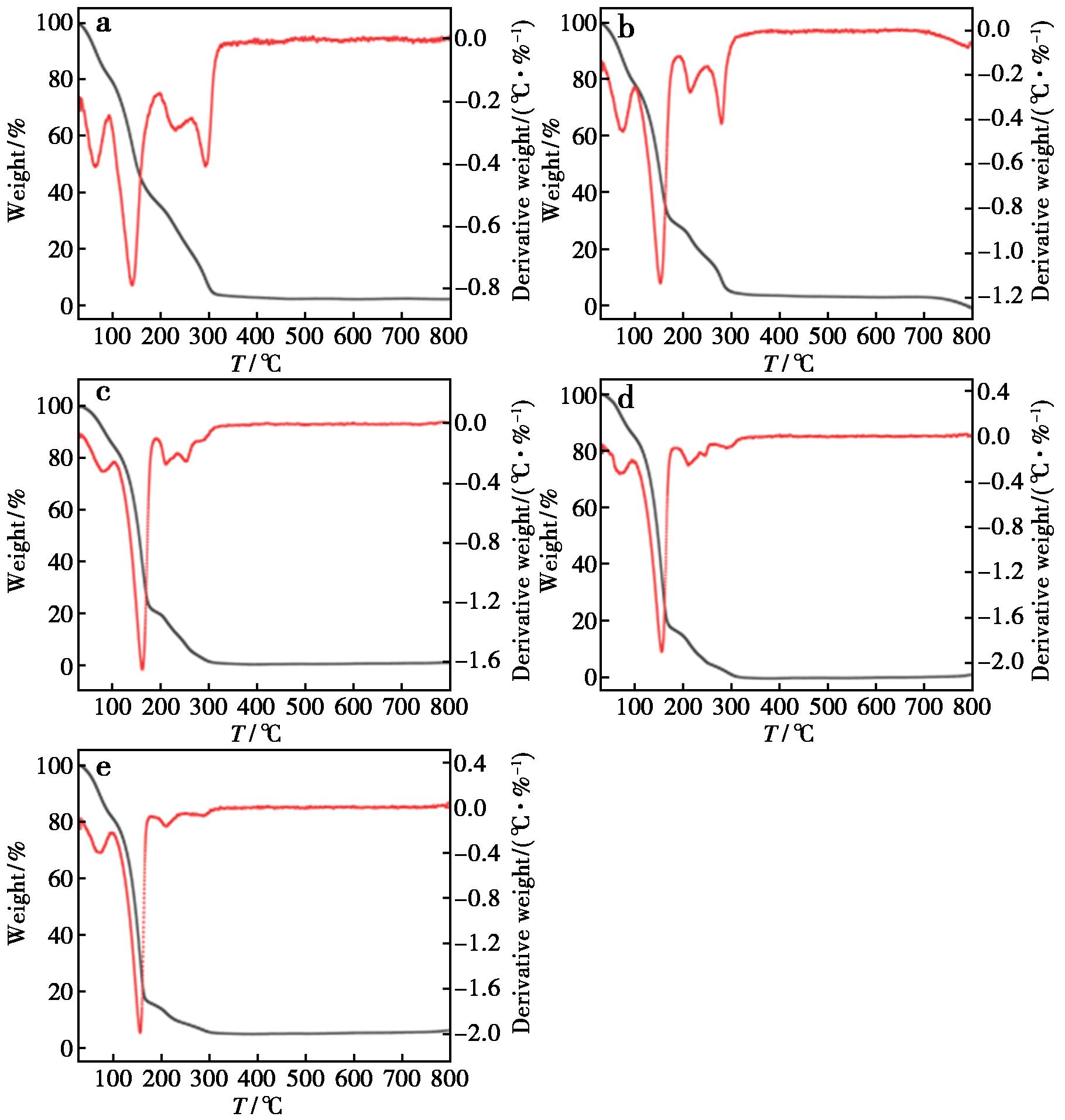
a~e中n(EG)∶n(OA)分别为2∶1、4∶1、6∶1、8∶1、10∶1
图1 不同n(EG)∶n(OA)的同步热分析测试结果
Fig.1 Simultaneous thermal analysis test results with different n(EG)∶n(OA)
由图1可知,不同n(EG)∶n(OA)的DESs热重分析图呈现一致性,随着温度升高,热重曲线中出现两个明显的失重平台。30~100 ℃为第1个失重区域,这是由于草酸脱去结晶水造成的,且n(EG)∶n(OA)为2∶1和4∶1的DESs在此区域较其它比例DESs失重更明显,说明DESs组成中草酸的占比越高,失重越明显。100~150 ℃为第2个失重区域,5个DESs均出现较尖的放热峰,这是DESs分解造成的。因此,利用EG-OA DESs浸出废旧锂离子电池时需严格控制浸出温度低于DESs的分解温度150 ℃以下。
为了探究EG和OA之间的协同作用,采用FT-IR对制备的DESs进行表征,结果如图2所示,谱图解析数据见表1。
表1 红外光谱图解析
Tab.1 Analysis of infrared spectra

Vibration type of functional groupsWave number/cm-1Vibration type of functional groupsWave number/cm-1νO—H3 380δO—H1 329νas C—H2 947νC—H1 203νs C—H2 881νC—O1 090,1 044νC O1 753δC—H882δH—O—H1 650
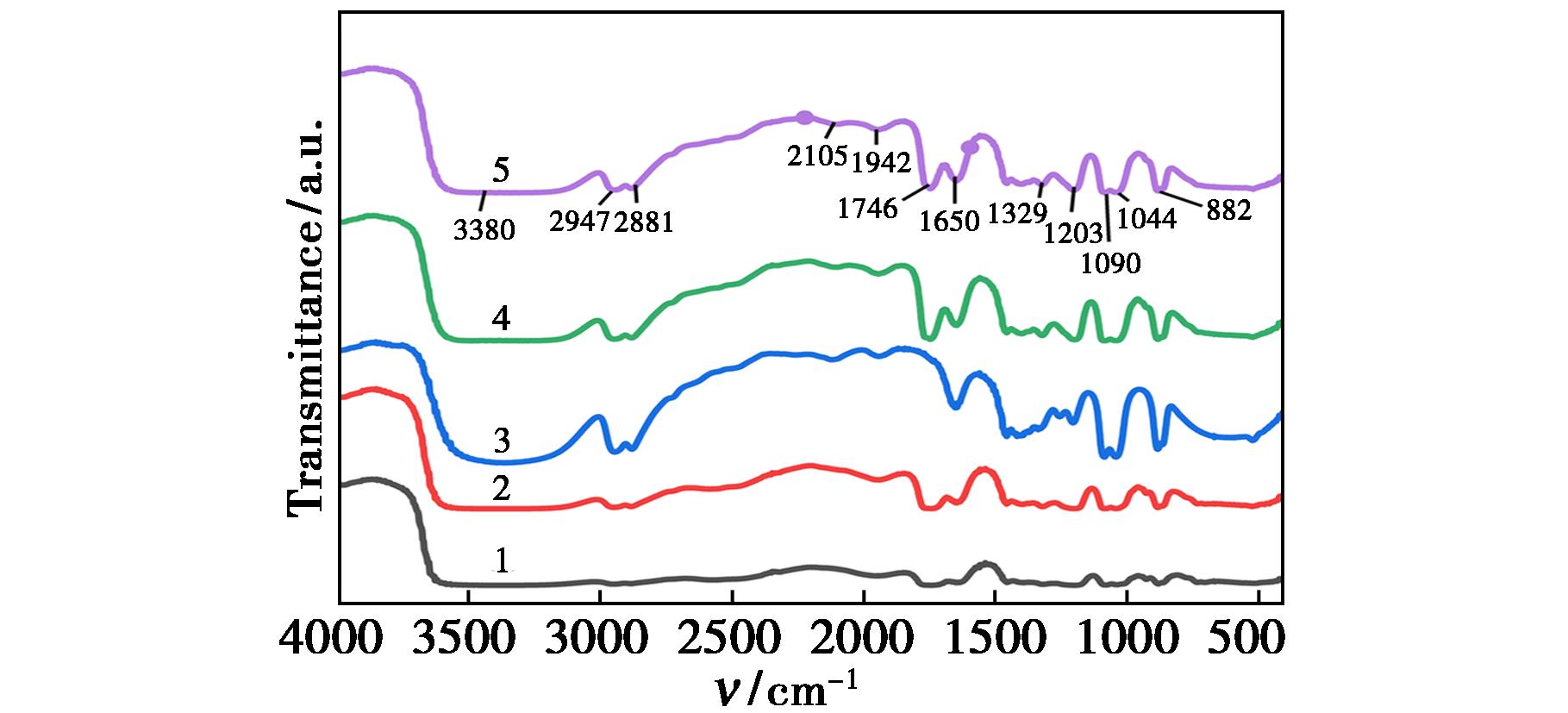
曲线1~5中n(EG)∶n(OA)分别为2∶1、4∶1、6∶1、8∶1、10∶1
图2 不同n(EG)∶n(OA)的红外光谱图
Fig.2 Infrared spectra with different n(EG)∶n(OA)
由图2可知,不同n(EG)∶n(OA)的DESs的红外光谱图呈现一致性,各吸收峰的位置基本相同,只是吸收峰的强度存在差异,说明改变物质的量比混合物的基本结构不变。在3 100~3 500 cm-1范围内出现一个较宽的吸收峰,归属于O—H的伸缩振动峰,在气态或低浓度的非极性溶剂溶液中,醇以游离态存在时,νO—H在3 650~3 590 cm-1处出现一个尖峰,当形成氢键缔合时νO—H向低波数位移,在3 550~3 200 cm-1处出现强的吸收峰且峰形变宽[29]。草酸分子中νO—H在3 000 cm-1附近,其羰基氧具有较强的电负性,会吸引乙二醇中羟基氢原子形成稳定的氢键,氢键的存在使得氯化胆碱的晶格能有所降低,这对低共熔溶剂的形成起到重要作用[30]。
为进一步验证红外光谱图中分子间氢键的形成,以蒸馏水为参比液,测试了不同n(EG)∶n(OA)的紫外-可见吸收光谱,结果如图3所示。
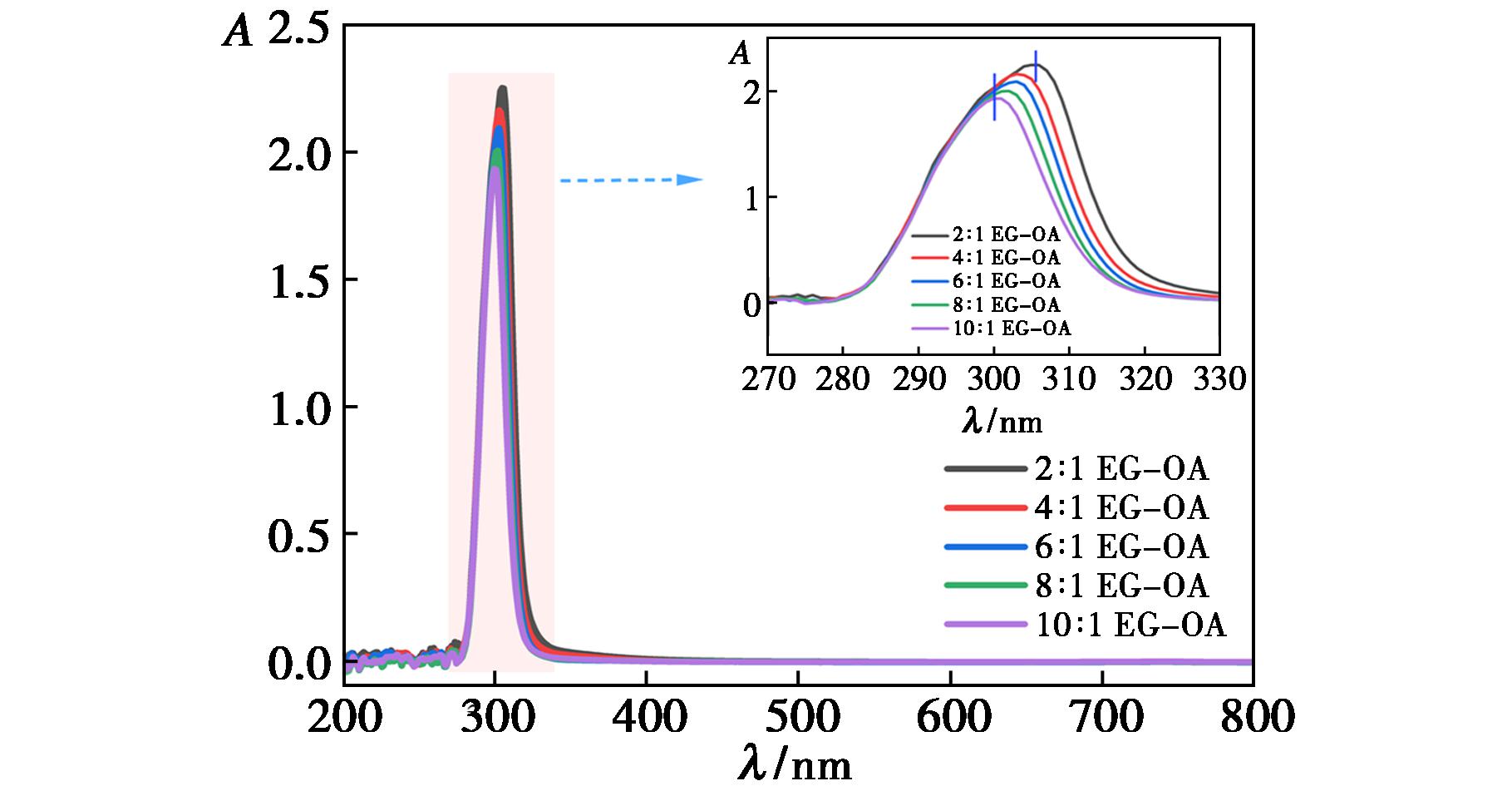
图3 不同n(EG)∶n(OA)的紫外-可见吸收光谱图(插图为标识区域放大图)
Fig.3 UV-visible absorption spectra with different n(EG)∶n(OA) (the illustration is an enlarged view of the marked area)
从图3可知,在300 nm处出现最大吸收峰,改变n(EG)∶n(OA),其最大吸收峰的位置基本不变,进一步说明物质的量比变化对DESs混合物的结构影响较小。300 nm处的吸收峰为草酸分子中—C![]() O吸收峰,从插图中可看到增加OA的含量,混合物的最大吸收波长从300 nm红移至305 nm,增加了5 nm。羧酸中—C
O吸收峰,从插图中可看到增加OA的含量,混合物的最大吸收波长从300 nm红移至305 nm,增加了5 nm。羧酸中—C![]() O与乙二醇中羟基氢形成分子间氢键,增加OA的含量,草酸和乙二醇之间形成了更多的氢键,使 —C
O与乙二醇中羟基氢形成分子间氢键,增加OA的含量,草酸和乙二醇之间形成了更多的氢键,使 —C![]() O周围的电子云密度降低,最大吸收波长向长波方向移动。
O周围的电子云密度降低,最大吸收波长向长波方向移动。
2.2 DESs浸出工艺条件优化
在钴酸锂的浸出过程中温度、DESs的物质的量比、浸出时间、液料比是决定浸出效果的重要因素,采取单因素实验依次对上述条件进行优化。
2.2.1 温度对浸出率的影响
固定n(EG)∶n(OA)为4∶1,液料比为50 g/g,浸出时间为12 h,磁力搅拌器的转速为400 r/min,考察温度对浸出率的影响,结果见图4。
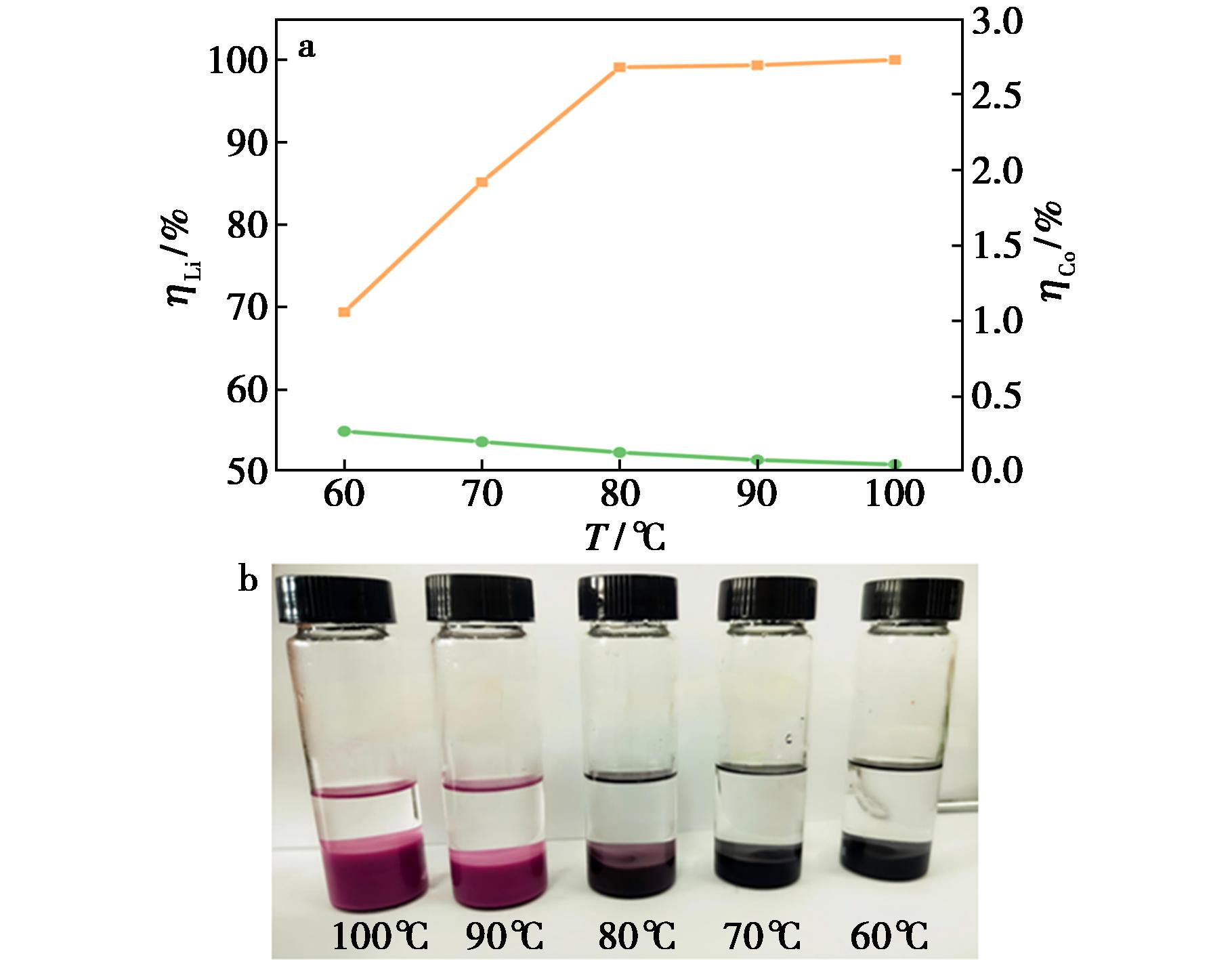
a.浸出率变化;b.浸出液颜色变化
图4 温度对锂和钴浸出率的影响
Fig.4 Effect of temperature on lithium and cobalt leaching rates
由图4可以看出,锂的浸出率在60 ℃时为69.41%,当温度升高至80 ℃时快速增至99.10%,高于80 ℃后,浸出率逐渐趋于平缓,100 ℃时锂的浸出率达100%。DESs的黏度受温度影响较大,升高温度可明显降低其黏度,加快反应物和浸出产物的扩散速率,同时增加活化分子有效碰撞的概率,加快浸出反应的速率。温度从60 ℃升高至100 ℃时,钴的浸出率呈现下降趋势,从0.27%逐渐降低至0.05%。在浸出过程中还观察到随着温度的升高,浸出液的颜色由最初的黑灰色逐渐变紫,温度越高紫色越明显。温度高于90 ℃,体系呈现紫红色,将浸出液进行高速离心,离心管上端为无色液体,下端为紫色固体。说明随着温度的升高,锂浸出后留在上层清液中,钴离子与低共熔溶剂中的草酸结合形成沉淀,升高温度加快了沉淀反应的速率,使上层清液中钴的含量逐渐降低。结合TG-DSC数据,当温度升高至100 ℃,DESs会出现首次失重现象,因此,后续实验选择90 ℃为浸出温度。
2.2.2 n(EG)∶n(OA)对浸出率的影响
金属氧化物的溶解度与构成低共熔溶剂组分之间的物质的量比直接相关。设定温度为90 ℃,液料比为50 g/g,浸出时间为12 h,磁力搅拌器的转速为400 r/min,考察n(EG)∶n(OA)对浸出率的影响,结果见图5。
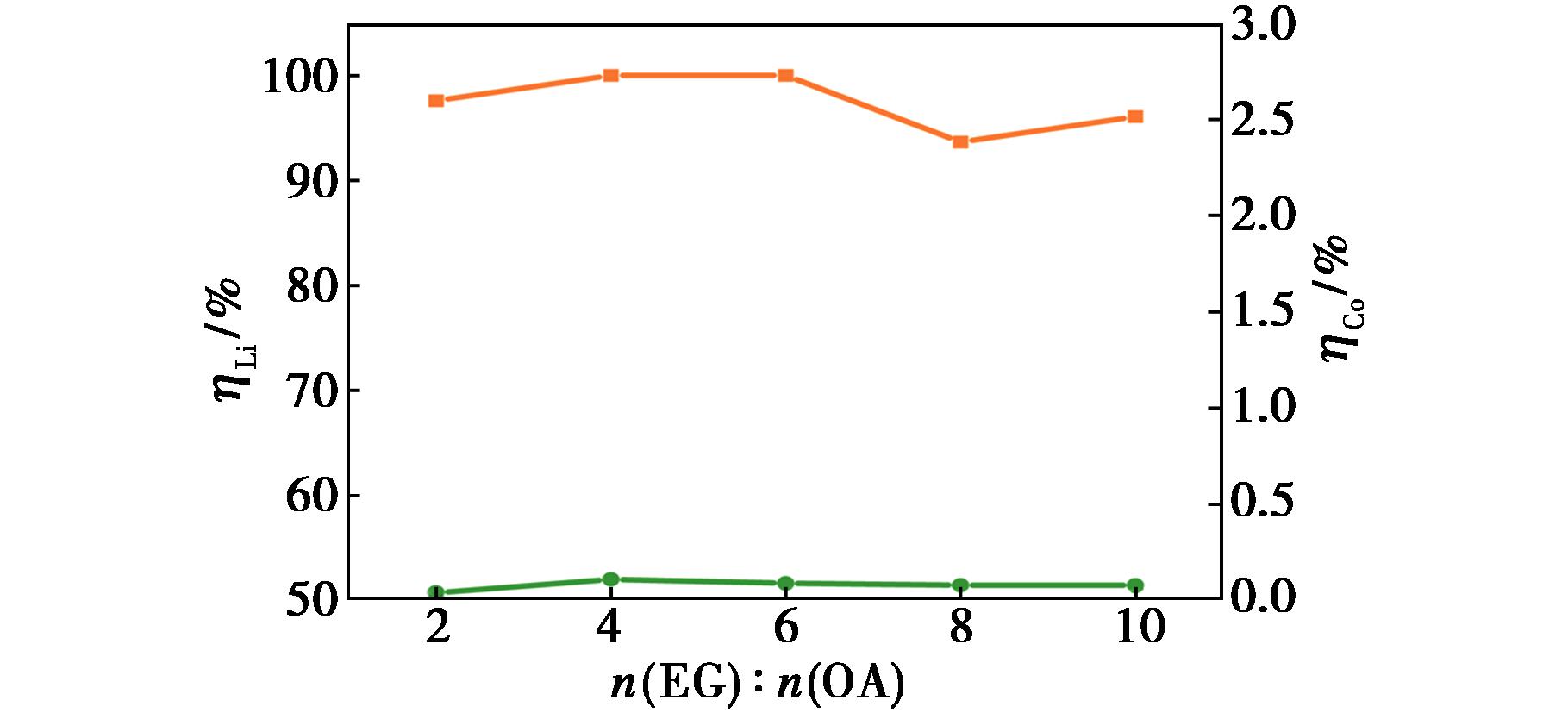
图5 n(EG)∶n(OA)对浸出率的影响
Fig.5 Effect of n(EG)∶n(OA) on the leaching rate
由图5可知,当n(EG)∶n(OA)从2∶1增加至6∶1时,锂的浸出率从97.59%升高至100%,当 n(EG)∶n(OA)为8∶1时又降低至93.65%。当 n(EG)∶n(OA)从2∶1增加至4∶1时钴的浸出率从0.04%升高至0.11%,n(EG)∶n(OA)为6∶1时又降低至0.09%,并趋于稳定。在实验中配制了 n(EG)∶n(OA)为1∶1的DESs,在温度低于50 ℃时形成白色晶体,改变n(EG)∶n(OA)为2∶1时,即使在室温下均呈现无色均匀液体,说明增加乙二醇的量会快速降低DESs的黏度,促进固液之间的传质,增加锂和钴的浸出率,但是随着浸出过程中钴沉淀化合物的不断析出,在LiCoO2粉末的表面形成固体产物层,降低锂的浸出效果,这也是锂先升高后降低的原因。n(EG)∶n(OA)为10∶1时,体系的黏度进一步降低,增加了H+的传质速率,锂的浸出率较8∶1时有所提升,但仍然低于 6∶1。因此,为保证锂的最大浸出,并且钴尽可能形成沉淀物,选择n(EG)∶n(OA)为6∶1。
2.2.3 时间对浸出率的影响
设定温度为90 ℃,n(EG)∶n(OA)为 6∶1,液料比为50 g/g,磁力搅拌器的转速为400 r/min,考察了浸出时间对浸出率的影响,结果如图6所示。
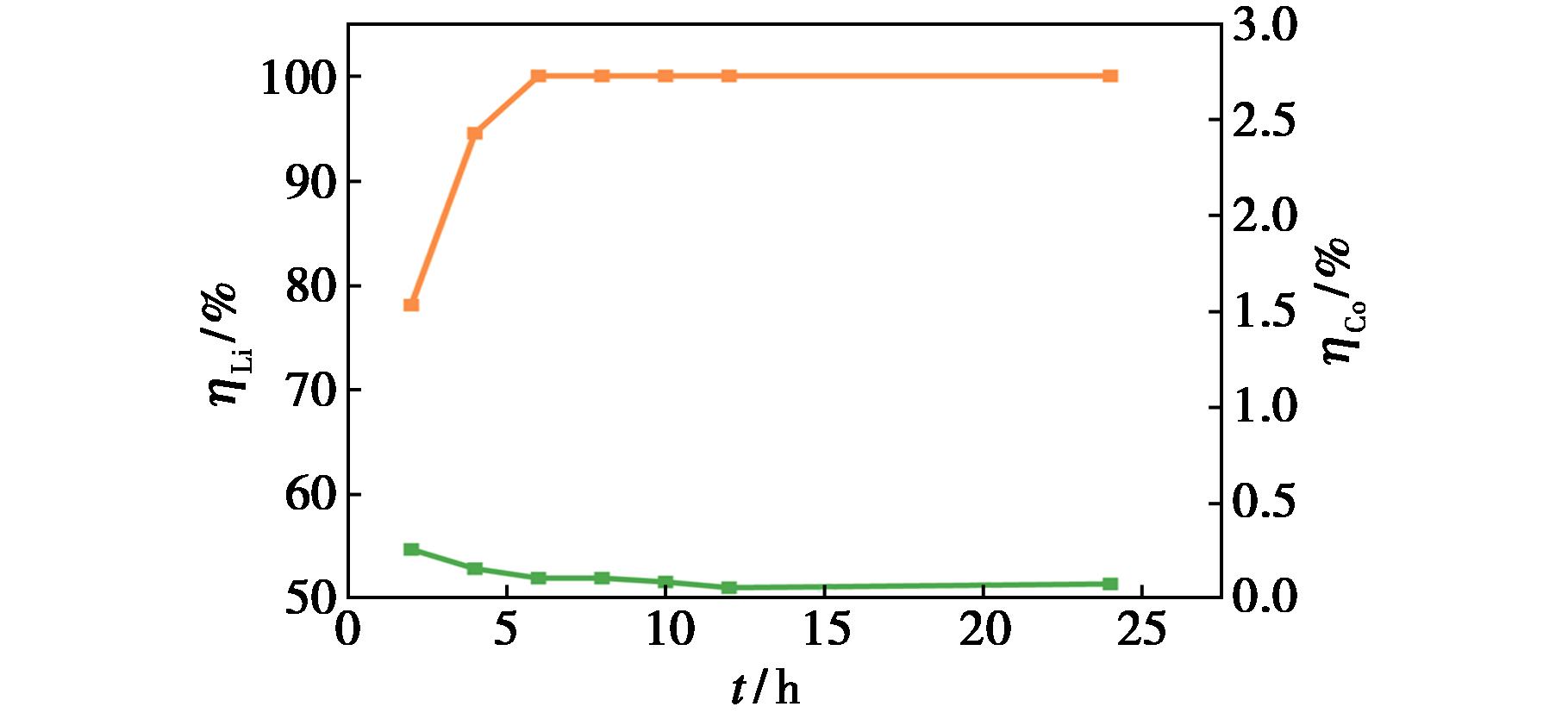
图6 时间对浸出率的影响
Fig.6 Effect of time on the leaching rate
由图6可知,浸出时间为2 h时锂的浸出率达78.1%,继续增加至6 h,锂的浸出率升高至100%,继续延长时间,锂的浸出率保持100%不变。钴的浸出率呈现逐渐下降趋势,2 h时钴的浸出率为0.26%,12 h时下降至0.06%,当时间增加至24 h时,钴的浸出率升高至0.08%,比 12 h时升高了0.02%,说明在12 h时浸出反应达到平衡,因此选择12 h为浸出时间。
2.2.4 液料比对浸出率的影响
设定温度为90 ℃,n(EG)∶n(OA)为 6∶1,浸出时间为12 h,磁力搅拌器的转速为400 r/min,考察了液料比对浸出率的影响,结果如图7所示。
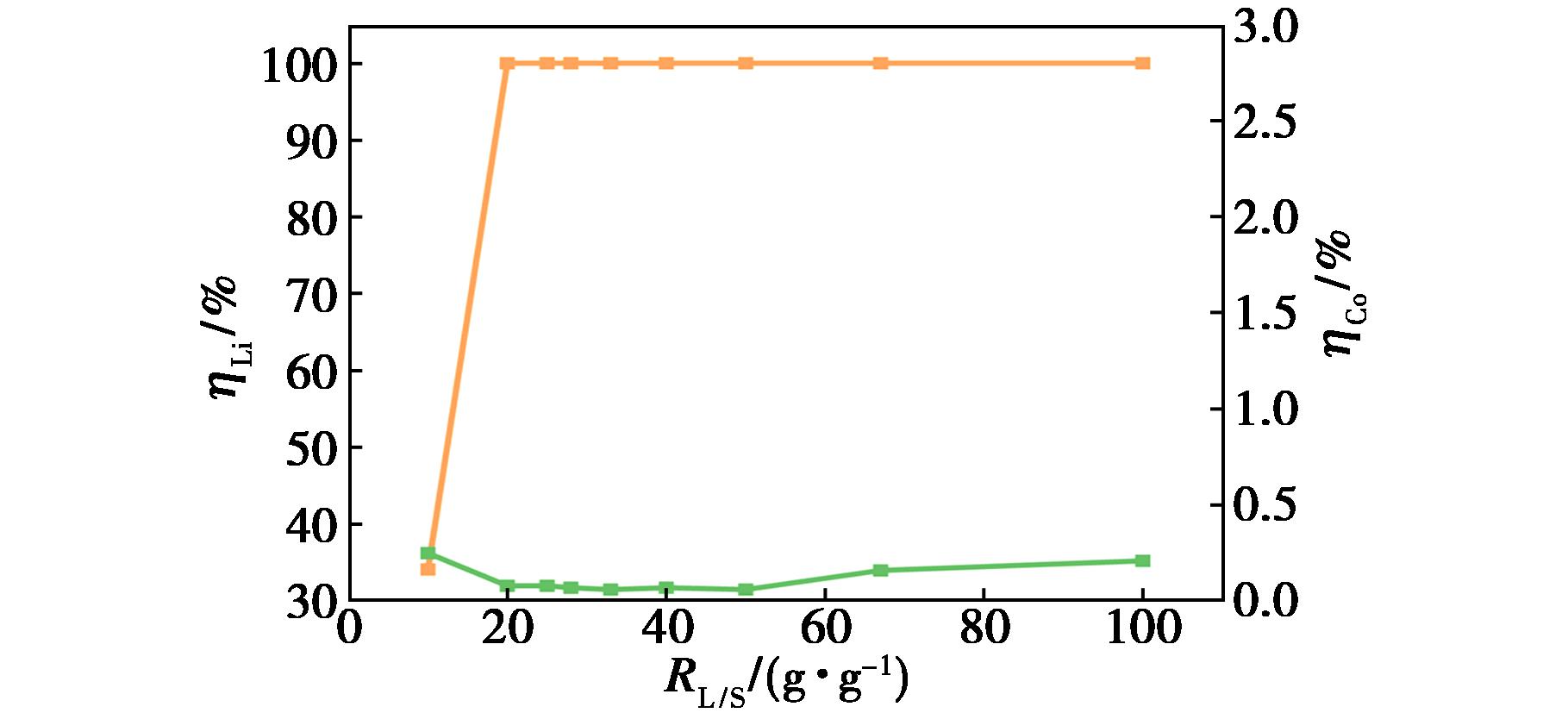
图7 液料比对浸出率的影响
Fig.7 Effect of liquid-solid ratio on leaching rate
由图7可以看出,增加液料比,锂的浸出率快速增加随后逐渐趋于稳定,当液料比为20 g/g时锂的浸出率达100%,该体系对锂具有较高的浸出率,可能是因为在该体系中具有较高的草酸浓度,促进锂与草酸结合。钴的浸出率先缓慢下降后逐渐升高,液料比为50 g/g时达最低(0.06%),综合考虑锂的最大浸出、钴的最小浸出,选择50 g/g为最佳液料比。
通过以上单因素实验获得了最佳的浸出条件:温度90 ℃、n(EG)∶n(OA)为6∶1、浸出时间12 h、液料比50 g/g、磁力搅拌器的转速400 r/min。在此条件下锂的浸出率为100%,钴则以CoC2O4·2H2O固体形式形成存在于沉淀物中,实现了LiCoO2中锂的高效选择性浸出和钴的原位分离。
为验证工艺条件的有效性并提升其应用价值,采用拆解处理后的废旧LiCoO2作为原料,在预设条件下进行浸出。结果显示,锂的浸出率高达100%,而钴的浸出率仅为0.07%,与纯LiCoO2的浸出效果相吻合。由此证实,该工艺条件对废旧LiCoO2的浸出具有良好的适用性与可行性,具备进一步推广应用的潜力。
2.3 有价金属的选择性回收
浸出、离心后,在下层固体中加水沉降、过滤、洗涤得到粉红色固体产物,利用SEM、XRD对其进行表征,结果见图8。由图8可知,浸出后粉色固体的XRD衍射峰与CoC2O4·2H2O的标准衍射峰(PDF#25-0250)一致,未出现明显的杂质峰,表明LiCoO2完全分解并转化为CoC2O4·2H2O。SEM图像表明,所得CoC2O4·2H2O为纳米棒状结构。
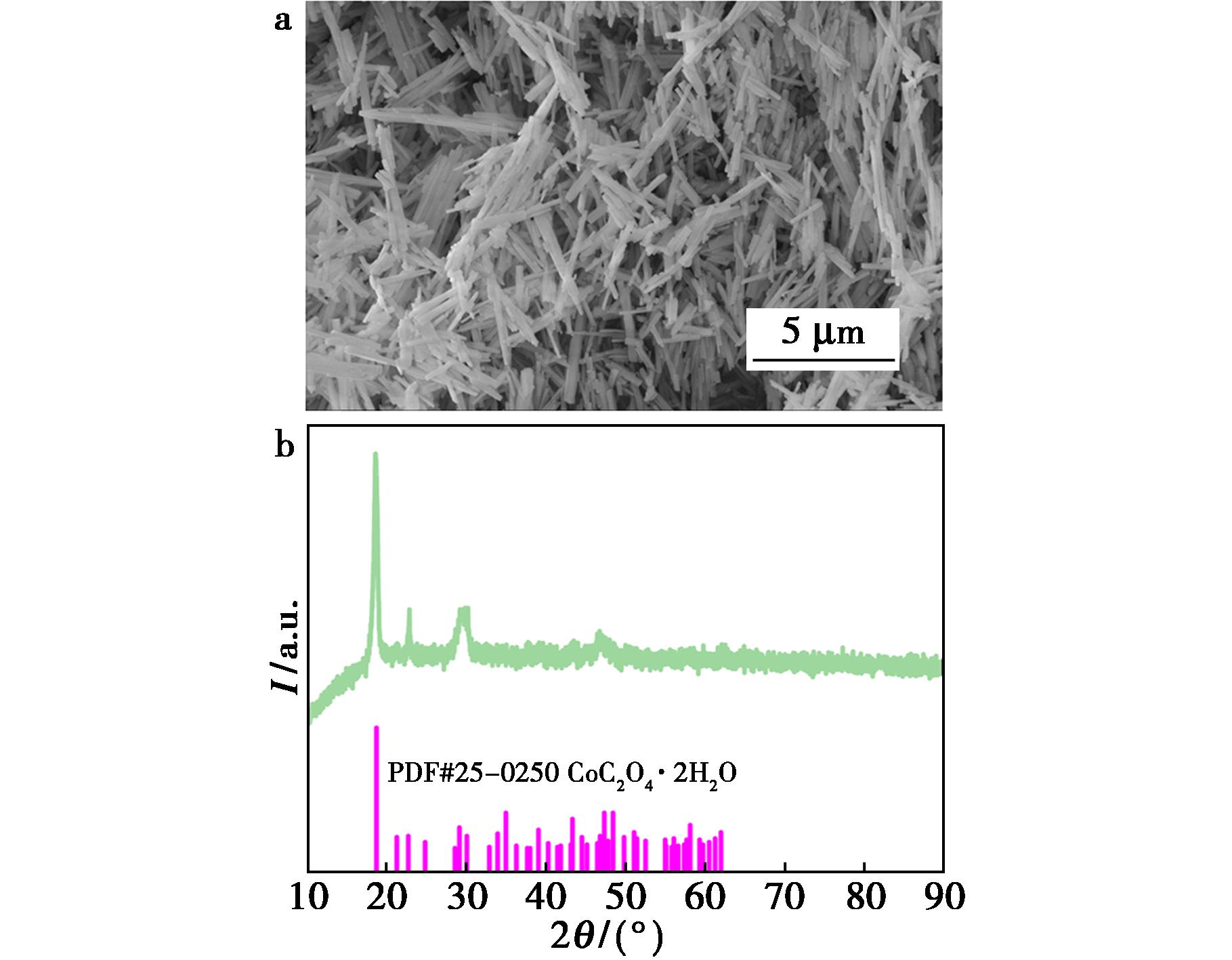
图8 草酸钴的SEM(a)和XRD(b)图
Fig.8 SEM (a) and XRD (b) images of cobalt oxalate
由于锂的草酸盐对水和氢离子比较敏感,而LiC2O4在乙二醇中具有较低的溶解度,鉴于草酸的分解温度为157 ℃,而乙二醇的分解温度为197.3 ℃,将浸出液在160 ℃下进行蒸馏,在此温度下,草酸发生分解,经蒸馏所收集的馏出液为乙二醇。此时体系中析出大量白色固体沉淀,利用SEM、XRD对其进行表征,结果见图9。由图9可知,白色固体沉淀的XRD衍射峰与Li2C2O4(PDF#24-0646)标准衍射峰一致,且没有杂质峰,说明在160 ℃下蒸馏富含Li+的浸出液所获得的固体产物为较高纯度的Li2C2O4。其形貌为块状聚集体,是因为Li2C2O4白色粉末颗粒较细腻容易粘附在一起。
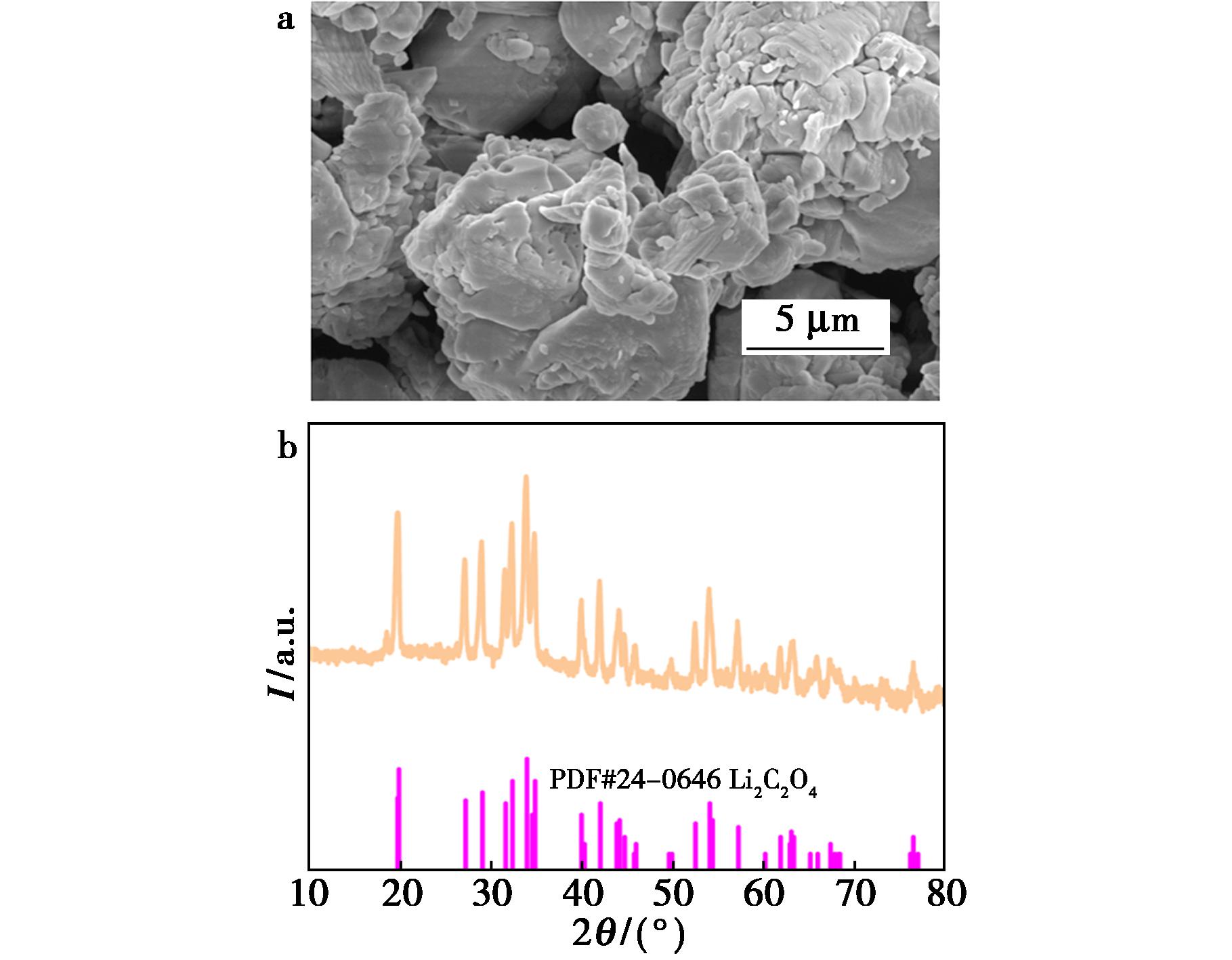
图9 草酸锂的SEM(a)和XRD(b)图
Fig.9 SEM (a) and XRD (b) images of lithium oxalate
2.4 浸出和分离机制
选用的钴酸锂为稳定的层状结构,Li+位于八面体的间隙位置,而DESs中存在大量的H+,浸出起始阶段,H+进入到LiCoO2晶格中将Li+释放到溶剂中,实现Li+的浸出,同时形成H-CoⅢO2固相中间产物[31],草酸和乙二醇中的质子与H-CoⅢO2中的氧反应,破坏H-CoⅢO2中的Co—O共价键[32],使Co(Ⅲ)裸露在固体表面,进一步发生反应。因此,初始阶段Li在Co之前浸出,且浸出更容易,使得Li具有较高的浸出效率。草酸和乙二醇均有还原性,Co3+具有强氧化性且在浸出液中不稳定,易被乙二醇和草酸还原为Co2+,之后Co2+与![]() 形成CoC2O4·2H2O沉淀。由于浸出液中钴浓度保持在较低水平,说明钴的浸出、还原和沉淀过程是同时且快速进行的。
形成CoC2O4·2H2O沉淀。由于浸出液中钴浓度保持在较低水平,说明钴的浸出、还原和沉淀过程是同时且快速进行的。
综上所述,利用DESs组成成分的酸性、还原性和![]() 的沉淀3种作用协同浸出LiCoO2中金属元素,具体反应过程如下:
的沉淀3种作用协同浸出LiCoO2中金属元素,具体反应过程如下:
LiCoⅢO2+H+![]() H-CoⅢO2+Li+
H-CoⅢO2+Li+
(2)
(3)
2H-CoⅢO2+2H++HO(CH2)2OH![]()
2Co2++O![]() (CH)2
(CH)2![]() O+4H2O
O+4H2O
(4)
(5)
(6)
2.5 低共熔溶剂的循环浸出
传统湿法冶金回收工艺中通常加入沉淀剂回收分离有价金属,导致溶剂的回收困难,在本研究中实现了钴和锂的一步原位浸出,而且不需要额外添加沉淀剂,为低共熔溶剂的再生创造良好条件。将上一循环浸出液离心分离CoC2O4·2H2O沉淀后的上清液作为下一循环的溶剂,加入 LiCoO2在相同的条件下进行循环浸出,结果如图10所示。由图10可知,3次浸出时,锂的浸出率均为100%,钴的浸出率保持在0.1%以下,最终浸出液中锂的浓度达4 679 mg/L,钴的浓度为26.1 mg/L,进一步证实该DESs具有较好的循环浸出性能。
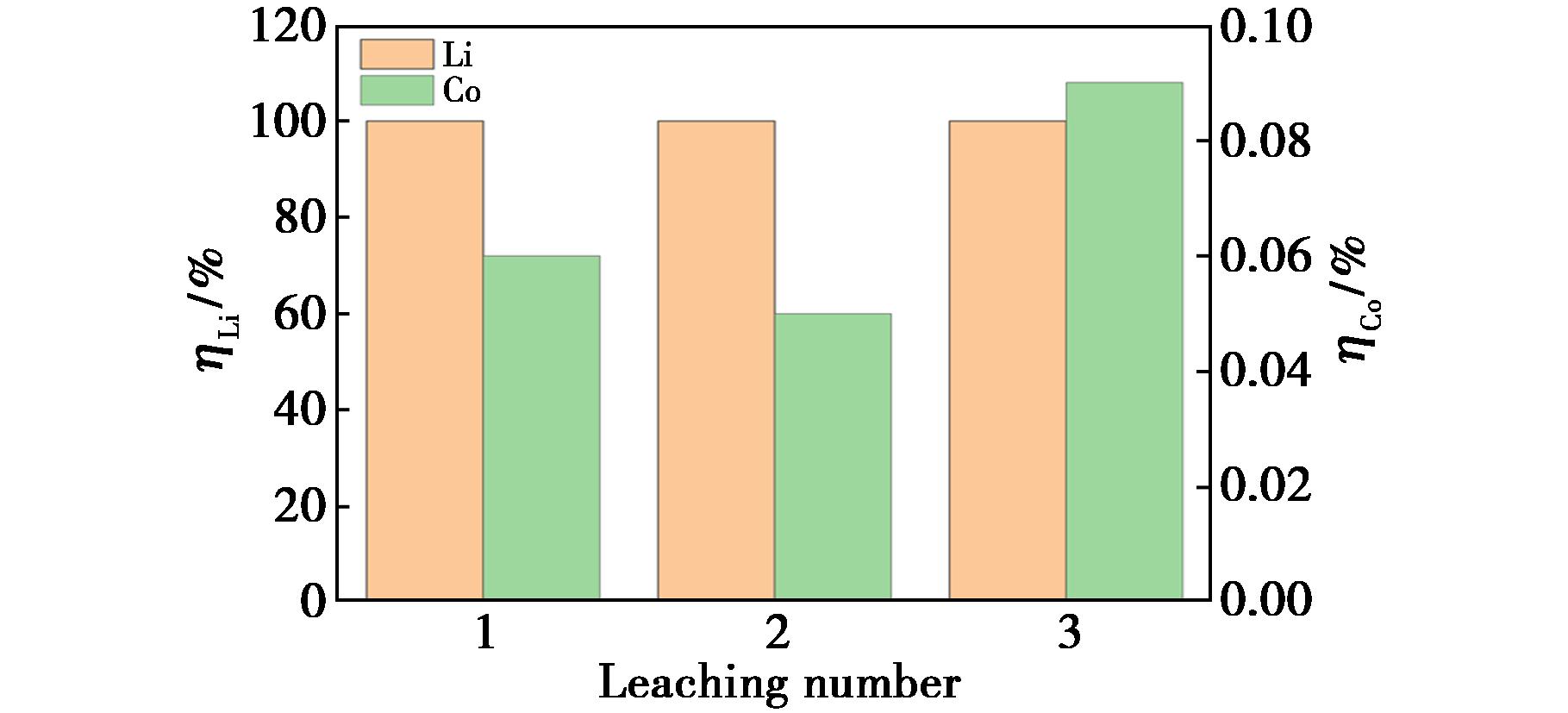
图10 不同浸出次数下钴和锂的浸出率
Fig.10 Leaching rates of cobalt and lithium at different leaching times
为简化循环过程并提高效率,无需从DESs中移除锂,通过允许锂在循环中富集并随后进行回收,可显著减少工作量。值得注意的是,在浸出过程中CoC2O4·2H2O及Li2C2O4的形成使DESs的物质的量比发生变化,再次循环时需要额外补充H2C2O4·2H2O以维持DESs组成的恒定。
3 结论
本文制备了一种基于乙二醇和草酸的新型低共熔溶剂,并实现了从废旧锂离子电池正极活性材料(LiCoO2)中一步高选择性浸出分离有价金属(Li、Co),使钴以沉淀形式析出而锂浸出在溶液中,避免了后续额外繁杂的分离过程。在最佳条件下(温度90 ℃、n(EG)∶n(OA)为6∶1、浸出时间12 h、液料比50 g/g、搅速400 r/min),Li的浸出率为100%,只有0.06%的Co从溶剂中浸出,同时,原位分离了固体产物CoC2O4·2H2O,并且滤液中的Li通过蒸馏以Li2C2O4的形式回收,该过程基于乙二醇、草酸的还原性以及沉淀反应实现了锂和钴的高效浸出,依据Li2C2O4和CoC2O4·2H2O在酸性环境中溶解性的差异实现了锂和钴的原位分离。这项工作对从废锂离子电池正极活性材料中有效选择性回收有价值金属提供了一条可持续的途径。
[1]Baudino L,Santos C,Pirri C F,Mantia F,Lamberti A.Adv.Sci.,2022,9(27):2 201 380.
[2]Kim S,Bang J,Yoo J,Shin Y,Bae J,Jeong J,Kim K,Dong P,Kwon K.J.Cleaner Prod.,2021,294:126 329.
[3]Zheng H S.Study on Separation and Recovery of Lithium from Spent Lithium-ion Battery Cathode Materials.Beijing:University of Chinese Academy of Sciences,2021.郑鸿帅.废旧锂离子电池正极材料分离回收锂的研究.北京:中国科学院大学,2021.
[4]Zhang W,Xu C,He W,Li G,Huang J.Waste Manage.Res.,2018,36(2):99-112.
[5]Zheng Z,Chen M,Wang Q,Zhang Y,Ma X,Shen C,Xu D,Liu J,Liu Y,Gionet P.ACS Sustainable Chem.Eng.,2018,6(11):13 977-13 982.
[6]Yun L,Sandoval J,Zhang J,Gao L,Garg A,Wang C T.J.Electrochem.Energy Convers.Storage,2019,16(2):21 011.
[7]Fan E,Li L,Wang Z,Lin J,Huang Y,Yao Y,Chen R,Wu F.Chem.Rev.,2020,120(14):7 020-7 063.
[8]Roy J J,Rarotra S,Krikstolaityte V,Zhuoran K W,Cindy Y D I,Tan X Y,Carboni M,Meyer D,Yan Q,Srinivasan M.Adv.Mater.,2022,34(25):2 103 346.
[9]Chitre A,Freake D,Lander L,Edge J,Titirici M M.Batteries Supercaps,2020,3(11):1 126-1 136.
[10]Porvali A,Aaltonen M,Ojanen S,Velazquez-martinez O,Eronen E,Liu F,Wilson B P,Serna-guerrero R,Lundström M.Resour.,Conserv.Recycl.,2019,142:257-266.
[11]Abbott A P,Boothby D,Capper G,Davies D L,Rasheed R K.J.Am.Chem.Soc.,2004,126(29):9 142-9 147.
[12]Abbott A P,Al-barzinjy A A,Abbott P D,Harris R C,Hartley J,Ryder K S.Phys.Chem.Chem.Phys.,2014,16(19):9 047-9 055.
[13]Kianfar E,Mafi S.Fine Chem.Eng.,2021,2(1):22-31.
[14]Alonso D A,Baeza A,Chinchilla R,Guillena G,Pastor I M,Ramón D J.Eur.J.Org.Chem.,2016,2 016(4):612-632.
[15]Cai T P,Qiu H D.TrAC,Trends Anal.Chem.,2019,120:1-9.
[16]Brett C M A.Curr.Opin.Electrochem.,2018,10:143-148.
[17]Li L N,Liu Y M,Wang Z T,Yang L,Liu H W.J.Sep.Sci.,2021,44(6):1 098-1 121.
[18]Tran M K,Rodrigues M T F,Kato K,Babu G,Ajayan P M.Nat.Energy,2019,4(4):339-345.
[19]Wang S,Zhang Z,Lu Z,Xu Z.Green Chem.,2020,22(14):4 473-4 482.
[20]Lu Q,Chen L,Li X,Chao Y,Sun J,Ji H,Zhu W.ACS Sustainable Chem.Eng.,2021,9(41):13 851-13 861.
[21]Chen Y,Lu Y,Liu Z,Zhou L,Li Z,Jiang J,Wei L,Ren P,Mu T.ACS Sustainable Chem.Eng.,2020,8(31):11 713-11 720.
[22]Zeng J.Study on the Recycling and Resynthesis of Cathode Materials of Lithium Cobalt Oxide Batteries by Deep Eutectic Solvents.Hangzhou:Zhejiang University,2022.曾静.低共熔溶剂用于废弃钴酸锂电池中金属成分的回收和再生研究.杭州:浙江大学,2022.
[23]Morina R,Callegari D,Merli D,Alberti G,Mustarelli P,Quartarone E.ChemSusChem,2022,15(2):e202 102 080.
[24]Chen Y,Liu C,Qiu Y H,Ben Z X,Mu T C.Chem.Ind.Eng.Prog.,2022,41(S1):485-496.陈钰,刘冲,邱于荟,贲梓欣,牟天成.化工进展,2022,41(S1):485-496.
[25]Gong S S,Wu T,Wang G G,Huang Q.Chem.J.Chinese U.,2021,41(10):3 151-3 159.巩珊珊,吴彤,王官格,黄擎.高等学校化学学报,2021,41(10):3 151-3 159.
[26]Du P X,Li Y H,Rao Z H,Liu C H.J.Eng.Thermophys.,2022,43(1):152-157.杜沛星,李宇浩,饶中浩,刘昌会.工程热物理学报,2022,43(1):152-157.
[27]Rold n-ruiz M S,Ferrer M L,Gutiérrez M N,Monte F D.ACS Sustainable Chem.Eng.,2020,8(14):5 437-5 445.
n-ruiz M S,Ferrer M L,Gutiérrez M N,Monte F D.ACS Sustainable Chem.Eng.,2020,8(14):5 437-5 445.
[28]Lu B,Du R,Wang G,Wang Y,Dong S,Zhou D,Wang S,Li C.Environ.Res.,2022,212:113 286.
[29]Liu Z G,Zhang H,Li Y M.Instrumental Analysis.Dalian:Dalian University of Technology Press,2007.刘志广,张华,李亚明.仪器分析.大连:大连理工大学出版社,2007.
[30]Wang H,Cao X Z,Xue X X.J.Electrochem.,2021,28(4):2 103 071.王昊,曹晓舟,薛向欣.电化学,2021,28(4):2 103 071.
[31]Chen L,Chao Y,Li X,Zhou G,Lu Q,Hua M,Li H,Ni X,Wu P,Zhu W.Green Chem.,2021,23(5):2 177-2 184.
[32]Alhashim S H,Bhattacharyya S,Tromer R,Kabbani A,Babu G,Oliveira E F,Galvao D S,Ajayan P M.ACS Sustainable Chem.Eng.,2023,11(18):6 914-6 922.