当归(Angelica sinensis),别名干归、岷归、秦哪、文无、当归曲等,性温,味甘、辛,是伞形科多年生草本植物,在我国分布广泛,尤以甘肃东南部的岷县产量颇丰,品质较优。迄今,当归药材因具有抗凝抗炎、抗氧化、活血补血、镇痛等药理活性,所以其在心脑血管、抗肿瘤、妇科疾病等临床疾病中具有广泛应用[1]。当归是传统的药食同源植物[2],蕴含多种生物活性成分。随着现代中医药学的不断发展,当归药材中很多新的生物活性成分及其药理作用逐渐被发现,为临床应用提供理论指导。本文对当归药材中生物活性成分及其提取方法、药理作用的研究展开综述,期待对该中药材的进一步开发应用奠定理论基础。
1 当归不同药用部位的成分及功效
当归药材中主要含有挥发油类、有机酸类、多糖类、黄酮类、微量元素等多种成分,当归不同药用部位的化学成分也存在一定差异,现有文献表明:当归头、身、尾的总挥发油含量以归尾最高,归身次之,归头最低[3]。当归尾呈现出有机酸含量显著高于其他部位的特征[4,5]。然而,关于归头与归身中阿魏酸含量的比较情况,现阶段在学术领域尚存在较大争议,仍有待进一步深入探究与精准界定。关于当归不同药用部位多糖的研究相对较少,有学者认为当归身所含当归多糖的量要明显高于当归头等部位[6]。经学者深入探究当归不同药用部位的多糖含量后发现,其含量呈现出显著差异,当归身所含多糖量最高,当归尾则相对较少[7]。王桂艳等[8]运用原子吸收分光光度计,针对归头、归身、归尾中的主要微量元素,即Ca、Na、Mg、Fe、Cu、Zn、Ba展开了精确测定。测定结果显示:在归尾之中,Fe的含量较高;归身则对Cu有着较高的富集度;归头里Zn的含量较为突出;而Ba在归身中的含量亦处于较高水平。
当归入药蕴含着古人对其药性细致入微的洞察与总结。《脾胃论》曾描述:“当归头止血上行,当归身补血中守,当归尾破血下流,全当归补血活血。”古代学者将当归分为全归、归头、归身、归尾部分,且各部分功效各有侧重。
全归则涵盖了当归各个部分的综合特性;归头专注于止血之效,在探究人体止血机制在应对各类出血症状时可能发挥关键作用;归身侧重于养血功能,可以为身体的血液生成与滋养提供有力支持,对于血虚体弱等状况有着潜在的调养之功;归尾则以活血见长,可促进血液的流通与循环,有助于消散瘀血、改善局部血液瘀滞的状态。这种功效各有侧重的划分,不仅反映了当归不同部位在药性上的差异,更为中医临床精准用药、根据患者具体病症灵活调配当归的不同部位提供了理论依据与实践指导,是中医用药智慧中极具特色与价值的重要组成部分。
2 当归中生物活性成分及其提取方法
当归中涵盖挥发油类、有机酸类、多糖类以及黄酮类等生物活性成分。常见的当归生物活性成分测定可采用紫外-可见分光光度法(UV-VIS)、原子吸收分光光度法(AAS)、高效液相色谱法(HPLC)以及气相色谱质谱联用法(GC-MS)等方式。
2.1 挥发油类
当归里的挥发油主要是由苯酞类、萜烯类、酚类等化合物所构成,其主要成分为苯酞类,其中最常见的藁本内酯就属于此类,其他还包括洋川芎内酯、正丁酰内酯、邻羧基苯正戊酮、当归酮、月桂烯等30余种,当归挥发油中部分苯酞类化合物结构见图1。
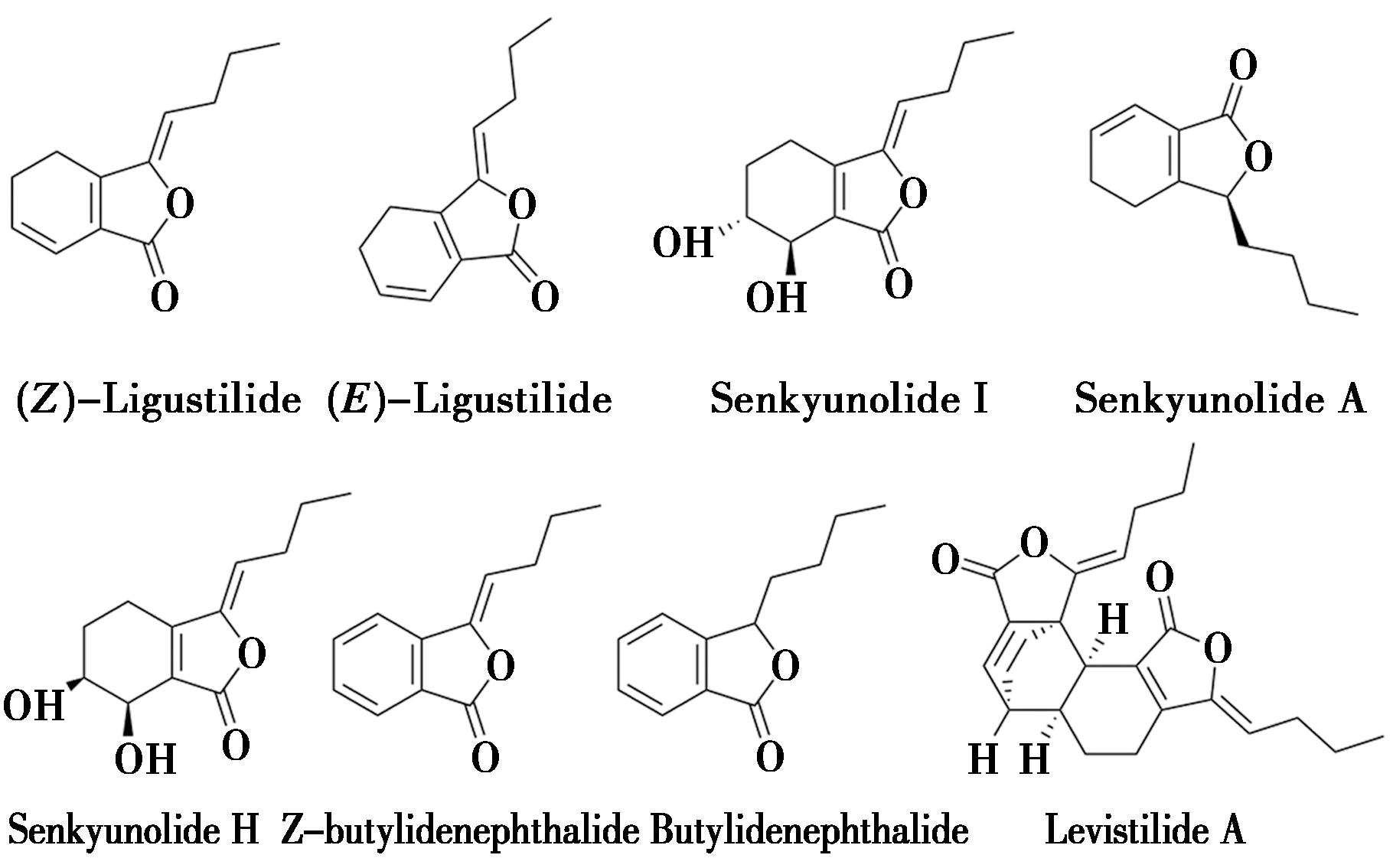
图1 当归中苯酞类部分化合物结构
Fig.1 Structure of phthalein compounds in angelica sinensis
藁本内酯是挥发油中的主要成分之一,其提取方式包括水提取、醇提取、超声提取、微波提取、机械压榨以及超临界流体萃取法等。藁本内酯属于热不稳定物质,具有不饱和的苯酞结构,在高温下能够发生异构化,对湿、热、光具有较高的敏感性[9,10]。Wan等[11]采用水蒸气蒸馏法提取当归挥发油,设计单因素试验对浸泡时间、蒸馏时间和液料比3个参数进行了考察,发现挥发油得率随蒸馏时间的延长而增加,随浸泡时间和料液比的增加呈先增高后降低的趋势,得出浸泡时间、蒸馏时间和液固比均是影响其得率的关键工艺参数,采用Box-Behnken设计实验及概率分析法确定当归挥发油提取工艺的设计空间,最终得出在蒸馏时间为8.41 h,浸泡时间为3.20 h,液固比为9.3∶1(mL/g)的条件下,当归挥发油的得率为0.711%。相较于传统药典方法,挥发油得率提升了70%~80%。Fan等[12]运用NADES(天然深层共晶溶剂)辅助微波加氢蒸馏法(NADES-A-MHD)提取当归挥发油,在对多种NADES予以比较后,确定NADES-1(氯化胆碱-柠檬酸)可作提取剂,精油得率最高。NADES-4(氯化胆碱-甘油)和NADES-1(氯化胆碱-苹果酸)也有较高的得率,可作为参考。因其考虑到挥发油的得率和成本,最终选择NADES-1(氯化胆碱-柠檬酸)进行后续实验,通过单因素实验筛选出物质的量比、微波功率和NADES含水率3个重要参数进行响应面实验优化,得出最佳工艺条件为物质的量比1∶3,微波功率600 W,含水量40%,在此工艺条件下,挥发油平均得率为1.39%,大幅提高了挥发油得率。相较于传统的提取方法,此提取方法有得率高、绿色、环保、低能耗等优点。为后期中药材绿色提取有实际的指导意义。
2.2 有机酸类
当归所含的有机酸中,包括阿魏酸、丁二酸、壬二酸、绿原酸、香草酸、茴香酸等。其中阿魏酸是现行中国药典中用于当归质量控制的指标性成分,且在医学、食品工业、化妆品行业[13]具有广泛应用而深受广泛关注。当归中部分有机酸化合物结构见图2。
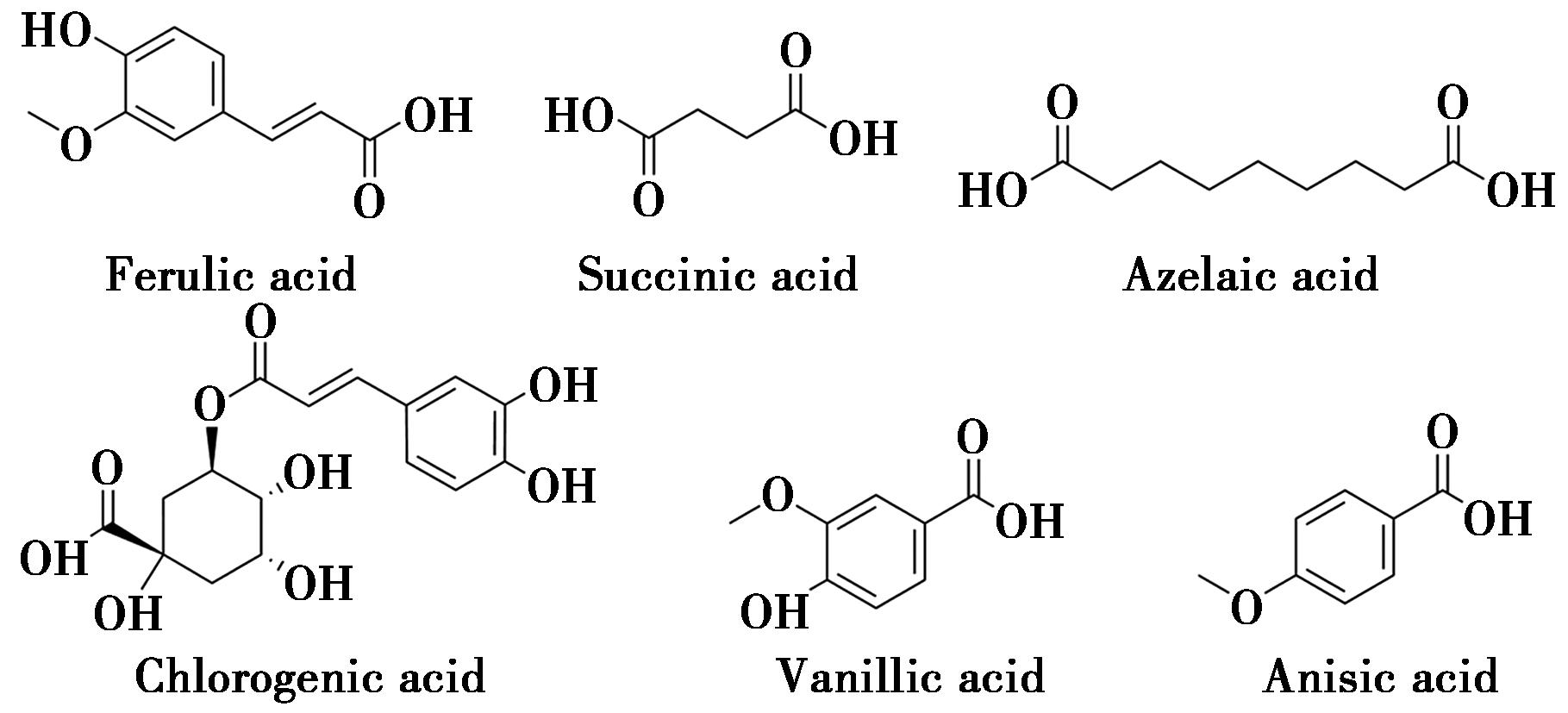
图2 当归中有机酸部分化合物结构
Fig.2 Structure of organic acids in angelica sinensis
阿魏酸属于热不稳定性,其对环境光、热、氧气和pH以及酶比较敏感。近年来,有关阿魏酸的提取研究主要聚焦于提升其稳定性以及提取后的纯度。传统的提取手段,像水煎煮提取、加热回流提取以及有机溶剂提取法之类,均存在耗费时间长、操作复杂繁琐、提取效率低下等缺陷。宁娜等[14]采用超声协同酶法,提取当归中的阿魏酸,选用酶解时间、酶用量、酶解温度和酶解pH 4个因素进行单因素试验,单因素最优条件分别为酶解时间50 min、酶用量0.3%、酶解温度45 ℃、酶解pH 4.5。其通过响应面试验发现酶解时间同酶解温度之间的交互效应、酶解时间与酶解pH的交互作用,对于当归中阿魏酸的得率所产生的影响极为显著。通过分析与验证得出最优提取工艺为酶解时间50 min、酶用量0.3%、酶解温度 45 ℃、酶解pH 4.4。在此工艺条件下,阿魏酸得率为0.673 mg/g。该研究结果为当归提取工艺深入开发提供了一定参考。刘珂等[15]曾经为简化生产工艺,降低生产成本,采用红外辐射结合表面活性剂提取当归中阿魏酸,选用绿色表活剂APG1214代替传统的低沸有毒溶剂作为提取剂,选用红外线灯作为热源替代传统的回流加热;又采用Box-Behnken响应面试验优化提取工艺,最终APG1214体积分数3.7%、液固比60.85∶1(mL/g)、提取时间23.66 min、红外功率241.69 W,所得的阿魏酸实际得率为0.805 4(mL/g),优于传统提取方法。此提取工艺缩短了提取时间,提高了提取效率,为当归阿魏酸的未来应用奠定了基础。
2.3 多糖类
多糖,是一种高分子碳水化合物,广泛存在于许多中草药中。从当归中分离出多糖组分经红外线吸收光谱鉴定主要包括葡萄糖、半乳糖、甘露糖、木糖等单糖和多糖[16]。其多糖类成分在当归中的含量约占16%。当归多糖类化合物部分单糖组分结构见图3。
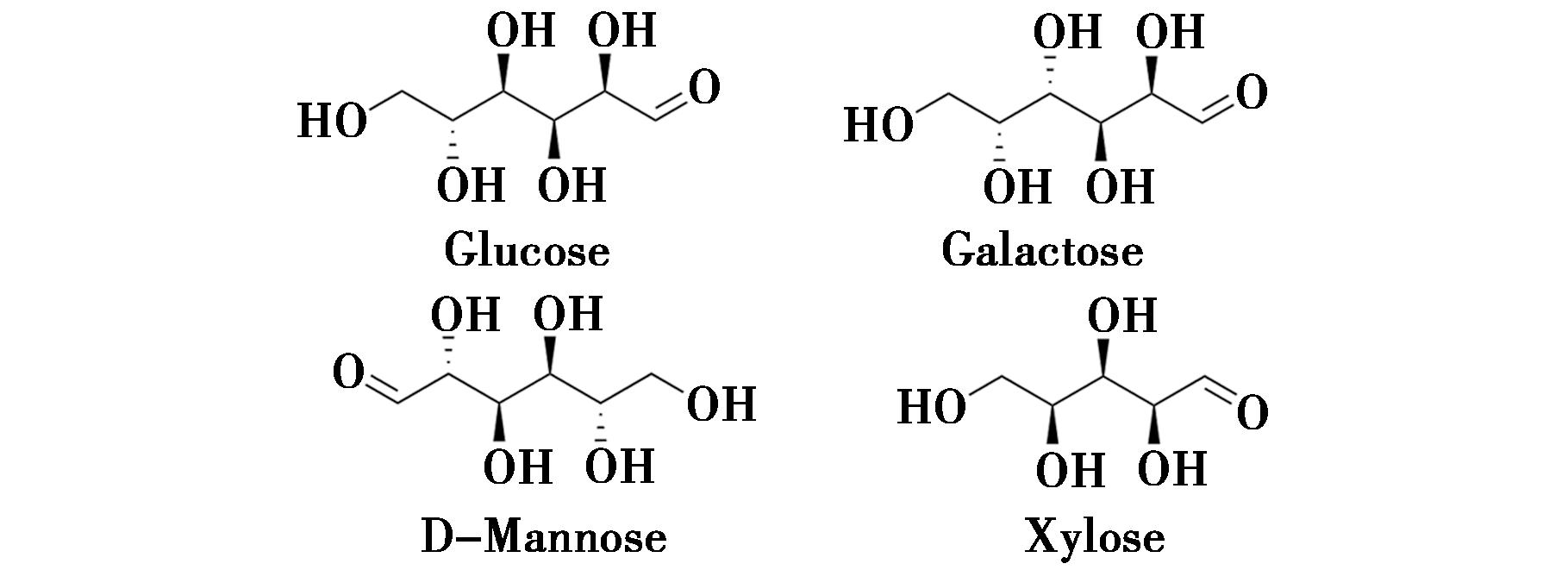
图3 当归中多糖类化合物部分单糖组分结构
Fig.3 Structure of partial monosaccharide components of polysaccharide compounds in angelica sinensis
多糖类物质属于水溶性成分,不易溶于有机溶剂,传统的多糖提取方法有水提醇沉法、热水浸提法、酶辅助提取法等。有耗时长、难以工业化、产量低等缺点。因此,传统的多糖提取方法需要被改进,新型的提取技术主要有半仿生萃取法、超临界流体萃取技术、超滤膜技术等。研究表明,超声辅助提取是一种适合多糖的提取技术,超声波频率和功率对多糖的得率和纯度均有影响。Wang等[17]经超声辅助提取多糖的研究发现,多糖得率受料液比、超声波功率、超声时间、温度影响,其结论得出超声功率一般选择在350~550 W左右为最佳,超声处理时间越长,得率越低,不宜超过120 min,温度为80~100 ℃。Tian等[18]运用单因素试验与响应面法来优化当归内多糖的提取工艺,选取水料比、超声时间和超声功率为考察因素进行响应面分析优化,得到最佳提取条件为:水料比43.31(mL/g),超声时间28.06 min,功率396.83 W,在此工艺条件下,多糖得率为(21.89±0.21)%,相较于传统的提取方法,可操作性更强,多糖得率高,进一步为当归中提取多糖工艺提供了参考价值。
2.4 黄酮类
黄酮类化合物是当归中另一类重要的生物活性成分,包含黄酮及其衍生物黄酮醇、二氢黄酮等 7 000多种衍生物。当归中黄酮、黄酮醇结构见图4。
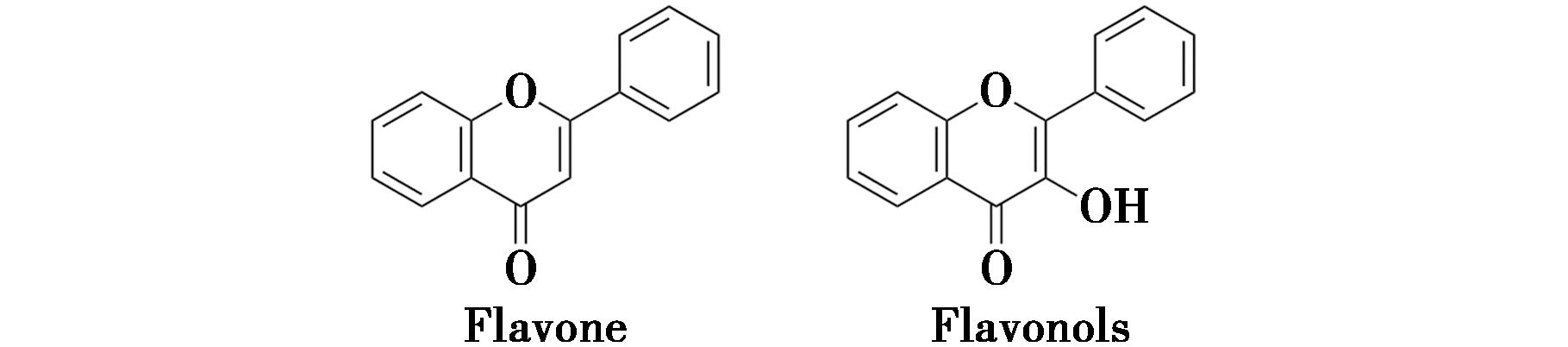
图4 当归中黄酮、黄酮醇结构式
Fig.4 Structural formula of flavonoids and flavonols in angelica sinensis
黄酮的提取过程中,温度是一个重要的影响因素,随着超声温度的升高,分子运动速度、扩散速度、渗透和溶解速度迅速上升,有助于黄酮含量的提高。温度过高会引起黄酮的稳定性变差且杂质溶出过多会影响提取效率,Zhang等[19]选用超声辅助法提取当归中黄酮类化合物,其通过单因素实验对超声温度、超声时间、乙醇浓度、液固比等参数进行考察,设计响应面试验优化,最终得出最佳工艺参数:超声温度80 ℃,超声时间4 min,乙醇浓度78%,液固比35(mg/g)。Yu等[20]开发了微波和超声辅助提取(SC-MUAE)方法的顺序组合,随后通过Box-Behnken设计响应面方法(BBD-RSM)对其进行了优化,最终确定其最佳工艺参数为:乙醇浓度48.15%,微波提取时间 6.43 min,超声提取时间10.09 min和超声功率 370.9 W。在此条件下,黄酮类化合物的得率为7.86 mg/g。此实验结果为中草药中黄酮类化合物的高效提取提供了参考依据。
2.5 其他成分
当归中含有近23种微量元素,包括铜、铁、锰、锌、钙、钠、钾、镁等,同时还涵盖维生素A、维生素B12以及青霉菌属生成的代谢产物等成分[21]。这些成分通常采用原子吸收光谱法(AAS)、电感耦合等离子体发射光谱法(ICP-OES)、电感耦合等离子体质谱法(ICP-MS)来对其进行表征分析。其中,最为常用的ICP-MS测定法具有较高精密度、良好的重复性以及出色的稳定性,这为中草药的质量管控以及药效基础物质的深入探究提供了精准且便捷的技术支撑手段,有力地推动了相关领域的研究进展与实践应用。
3 药理作用
研究表明,当归及其提取物具有很强的生物活性,在临床应用领域具有极高的药用价值,发现其对血液及造血系统、阿尔兹海默症(AD)[22]防治起到调节作用,同时还具有抗肿瘤、抗辐射、抗氧化、保肝护肾等诸多功效[23]。
3.1 抗血小板聚集
血栓形成会导致血液循环不畅,从而可能导致心脑血管疾病。抗血小板聚集和抗高脂血症是改善血液循环的关键过程。Jin等[24]通过研究当归提取物对富血小板血浆中胶原蛋白诱导的血小板聚集的影响,并测定了其抗血小板聚集活性。在血栓栓塞小鼠模型中研究了当归的作用,采用高脂饮食喂养小鼠模型研究其抗高脂血症作用,并采用Western blotting法阐明其作用机制。观察到当归提取物明显抑制人富血小板血浆中的血小板聚集。此外,当归提取物在通过给药诱导的血栓栓塞小鼠模型中显示出保护作用。结果表明当归等植物混合提取物可通过抗血小板聚集和抗高脂血症改善血液循环。
阿魏酸钠(SF)可选择性地对TXA2合成酶活性予以抑制,提升前列环素PGI2/TXA2的比率,能极为显著地抑制血小板的聚集,还可对羟色胺(5-HT)、血栓素(TXA2)样物质的释放起到抑制作用[25]。
阿魏酸的半衰期短,溶解度、生物利用度和细胞吸收率低,较差的水溶性和药代动力学特征会限制其临床应用。Guo等[26]为克服这些障碍并增强血小板活化和血栓形成的抑制作用,合成了具有窄尺寸分布的阿魏酸钠功能化银纳米金字塔(SF-pAgNPs)。细胞毒性和溶血测定表明其制备的纳米金字塔具有良好的生物相容性模式。体外研究表明,SF-pAgNPs可以通过SF和纳米银的协同抗血栓能力有效抑制血小板活化、聚集和粘附。此外,SF-pAgNPs表现出强大的抗血栓活性和延长的抑制作用,在小鼠模型中比PEG-Ag和游离SF好得多。凭借增强的抗血栓形成作用和良好的生物相容性模式,相信阿魏酸钠功能化的银纳米金字塔可具有成为预防和治疗血栓形成的潜力。
3.2 造血补血功能
当归的补血作用与促进造血功能有关。而当归多糖(ASP)是当归能够用于补血的一类关键成分[27]。Zhang等[28]制备了ASP/羟基磷灰石(HAp)材料,发现ASP能促进红细胞生成和造血祖细胞分化,并能促进血管生成。ASP与HAp结合可以弥补HAp诱导小鼠血管生成,能有效促进小鼠血管生成、造血和成骨。其还发现ASP通过IκB激酶-(IKKs-)IκBα通路抑制NF-κB p65的活化,从而减少IL 6和肿瘤坏死因子-α(TNF-α)的分泌,从而减轻其抑制红细胞生成的抑制作用,以改善大鼠炎症性贫血。
高加巍等[29]以脑缺血-再灌注损伤大鼠为研究对象,探讨了当归多糖对其脑微血管内皮细胞血管新生的促进作用。发现当归多糖可明显改善大鼠的生存状态、体质量和功能缺损评分,降低血清中IL-1β、IL-18水平以及脑组织含水量,同时升高受损皮质的微血管密度(MVD)和脑组织中VEGF、VEGFR2的mRNA及蛋白表达,降低Caspase-1、Gasdermin D、IL-1β、IL-18的mRNA及蛋白表达。发现当归多糖可能通过抑制细胞焦亡Caspase-1/Gasdermin D通路,上调VEGF和VEGFR2的表达,从而促进脑缺血-再灌注损伤大鼠微血管内皮细胞的血管新生。
当归多糖具有补血促血的作用。此外,当归多糖还可以改善造血组织容量,提高造血机能,缓解造血机能抑制状态。这些作用使得当归多糖在补血促血方面具有重要的应用价值。
3.3 抗氧化作用
氧化应激在癌症、衰老、糖尿病、脂肪肝、关节炎和神经系统疾病等多种慢性疾病中发挥着关键作用。抗氧化机制主要包括清除自由基、抑制氧化酶活性、提高机体自身抗氧化酶的活性等。
Zhuang等[30]采用H2O2诱导人OA软骨细胞和正常软骨细胞培养,探讨人骨关节炎(OA)软骨细胞的氧化应激及当归多糖(ASP)的抗氧化作用。其发现ASP作为抗氧化剂,通过下调抗氧化酶(SOD)和过氧化氢酶(CAT)的活性,抑制H2O2诱导的软骨细胞氧化应激,从而抑制H2O2诱导的软骨细胞对H2O2的反应,体现其抗氧化作用。PPARγ作为人体一种重要的核转录因子,调节人体的各种生理功能,调节诱导型一氧化氮合酶(iNOS)的表达。随着iNOS表达的增加,大量的NO会导致过度的氧化应激。基于这一理论,发现OA软骨细胞中PPARγ表达下调,iNOS表达上调,同时NO释放增加,说明PPARγ对iNOS具有负反馈调节作用。其所建立的氧化应激模型进一步验证了这一理论,推测ASP可能通过上调PPARγ活性发挥抗氧化作用,但具体的信号转导途径有待进一步研究。
Niu等[31]调查了ASP对血管周围间充质祖细胞(PMP)的保护性抗氧化作用,检测细胞增殖、衰老、细胞凋亡和氧化指数,通过实时定量逆转录聚合酶链反应和蛋白质印迹分析细胞间和细胞内信号,发现ASP改善了PMP中活性氧的产生,以及减轻造血细胞的衰老,发现ASP通过下调过度激活的Wnt/β-catenin信号传导来延迟氧化应激诱导的造血细胞的过早衰老。
阿魏酸的抗氧化作用机制复杂,主要基于抑制活性氧(ROS)或氮的形成。阿魏酸亦能充当自由基清除剂、催化自由基生成酶的抑制剂以及抑制酶活性的强化剂。阿魏酸在保护免受外部因素如紫外线辐射、空气污染和自由基清除的影响具有重要作用,它对于主要的皮肤构造,即角质形成细胞、成纤维细胞、胶原蛋白以及弹性蛋白均具备保护效能,因此常用于抗衰老化妆品配方[32]。阿魏酸对皮肤的良好渗透性,其与众多化妆品配方的适配性以及和其他成分搭配时的稳定性,让它逐渐成为在美容学领域应用愈发广泛的化合物。
3.4 抗菌作用
现代药理研究表明,当归中挥发油具有一定的抗菌作用。A imovi
imovi 等[33]采用改良微量滴定板法测定其对金黄色葡萄球菌和大肠杆菌的抑菌活性,最低抑菌浓度为14.2 μL/mL。对金黄色葡萄球菌和大肠杆菌的敏感性分别为28.4和28.4 μL/mL。其最低杀菌浓度分别为56.8和113.6 μL/mL。根据所获得的结果,当归根精油,可作为食品中的天然防腐剂和作为天然抗生素用于治疗由这两种细菌引起的多种感染性疾病。
等[33]采用改良微量滴定板法测定其对金黄色葡萄球菌和大肠杆菌的抑菌活性,最低抑菌浓度为14.2 μL/mL。对金黄色葡萄球菌和大肠杆菌的敏感性分别为28.4和28.4 μL/mL。其最低杀菌浓度分别为56.8和113.6 μL/mL。根据所获得的结果,当归根精油,可作为食品中的天然防腐剂和作为天然抗生素用于治疗由这两种细菌引起的多种感染性疾病。
Du等[34]以当归水提物为原料,采用绿色合成法制备大粒径AgNPs模型,通过测定硝酸银对食源性致病菌李斯特菌的最低抑菌浓度和最低杀菌浓度,探讨硝酸银对单核细胞增生李斯特菌的抑菌和杀菌效果。结果表明,AgNPs可破坏单核细胞增生李斯特菌细胞膜的完整性,并诱导细胞释放核酸,从而破坏细胞的繁殖,达到抑菌抗菌的效果。
周桂生等[35]对当归地上部分80%乙醇提取物运用硅胶柱色谱之类的方法展开系统分离,从而获13个单体化学成分,再采用串行两倍稀释法来探究这些化合物所具备的抗菌活性,用串行两倍稀释法考察这些化合物的抗菌活性,结果表明5个化合物均对嗜水气单胞菌的生长有不同程度的抑制作用。
3.5 抗肿瘤作用
当归属中的活性化合物,如香豆素、呋喃香豆素、苯酞类和多糖,通过各种机制表现出抗癌特性,其通过靶向细胞途径、产生活性氧物质和诱导凋亡性细胞死亡而具有作为抗癌剂的潜力[36]。
Zhao等[37]在当归中发现了一种新的溶解性多糖(AASP),体内抗肿瘤实验表明,AASP对H22肝癌细胞有明显的抑制作用,抑制率为48.57%,并对荷瘤小鼠胸腺和脾脏有明显的保护作用。AASP还具有刺激免疫细胞(脾细胞、腹腔巨噬细胞和自然杀伤细胞)增殖,促进细胞因子(TNF-α、IL-2和IFN-γ)释放的作用,使H22实体瘤细胞的凋亡阻滞于G0/G1期。因此AASP作为一种安全有效的抗肿瘤补充剂具有很大的应用潜力。此外,就荷LNCaP瘤裸鼠体内的肿瘤而言,此化合物能够对其予以有效抑制,其抑瘤率可高达68%[38]。吴素珍等[39]以S180荷瘤小鼠作为模型开展实验,实验结果显示,硫酸酯化当归多糖在高、中、低剂量下,其抑瘤率呈逐步递减态势。这表明当归多糖经硫酸酯化处理后,于小鼠体内具备一定的肿瘤抑制功效。当归部分药用机制见图5。
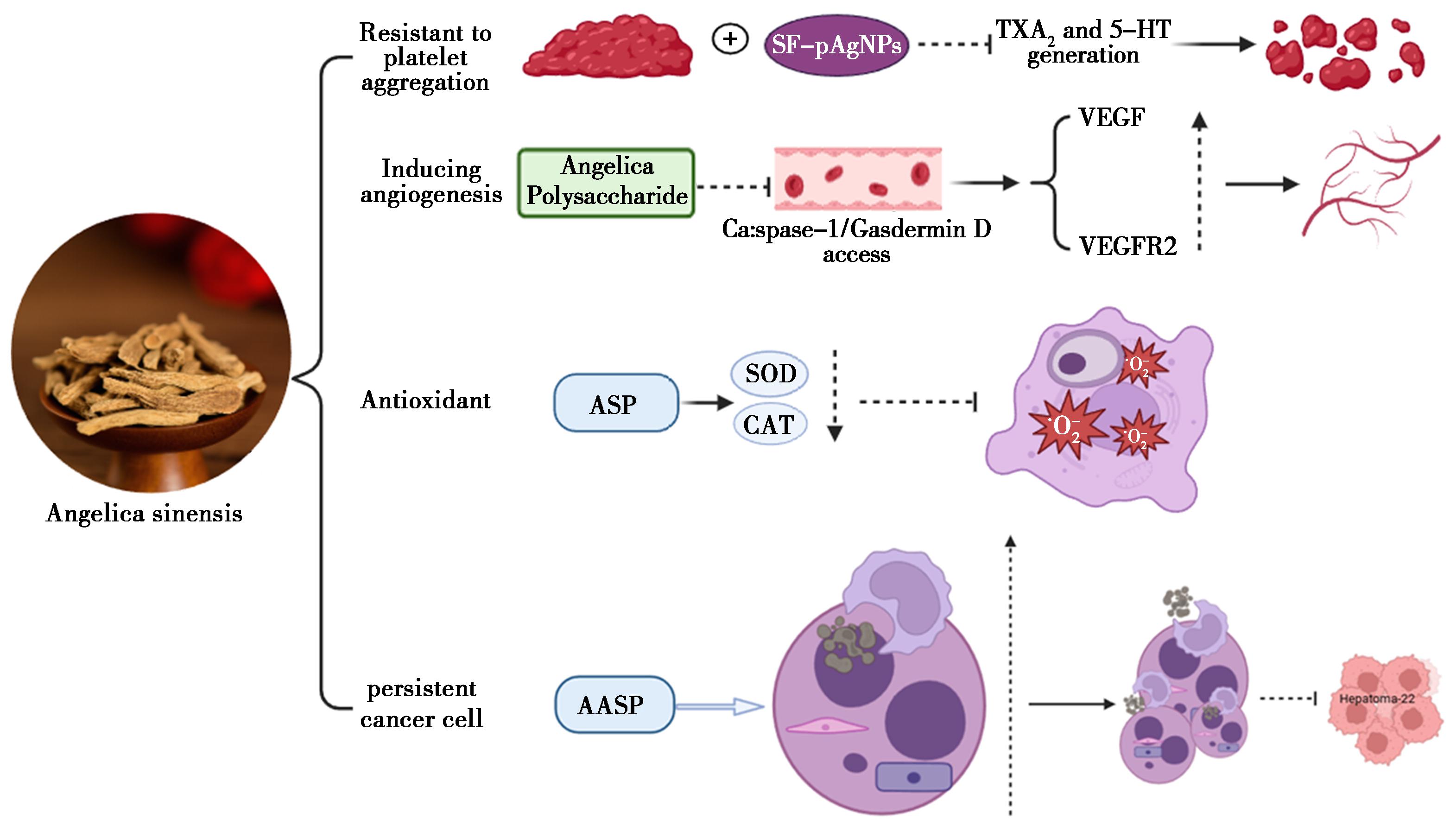
图5 当归部分药理作用机制
Fig.5 Partial pharmacological mechanism of angelica sinensis
4 常见当归单方药品类型与功效主治
当归单方药品剂型多样,涵盖了片剂、胶囊剂、丸剂、口服液、注射剂等,以满足不同患者群体的用药需求。例如当归浸膏片,主要用于补血活血,对血虚引起的面色萎黄、眩晕心悸有一定疗效。当归补血胶囊,适用于气血两虚证,能有效改善乏力、气短等症状。当归丸,由当归细粉加炼蜜制成,多用于调经止痛,对女性月经不调、经行腹痛疗效确切。当归口服液,以当归水提物为主要成分,可快速补充气血,缓解疲劳,增强机体活力。注射剂多用于危急重症或不宜口服给药的情况,可使药物迅速进入血液循环发挥作用,例如当归注射液,在临床上常用于活血化瘀,辅助治疗跌打损伤、瘀血肿痛等病症,能促进局部血液循环,加速瘀血消散。
5 分析与讨论
5.1 当归提取技术现状
传统的水提法、醇提法是当归有效成分提取的基础手段,操作相对简单、成本较低,可广泛应用于初期的研究与生产实践。然而,这些方法存在明显缺陷。例如水提法易导致热敏性成分如藁本内酯的损失,提取时间长、效率低,且提取物杂质较多,后续分离纯化难度大;醇提法虽对脂溶性成分有较好溶解性,但有机溶剂残留问题不容忽视,不仅影响产品质量,还可能带来潜在的健康风险,限制了其在高端医药产品中的应用。
超临界流体萃取、超声辅助提取、微波辅助提取等现代技术为当归提取带来了新契机。超临界流体萃取利用超临界态二氧化碳的特殊性质,能在较低温度下高效萃取挥发油等成分,且无溶剂残留,产品纯度高,但设备昂贵、操作复杂,大规模工业化应用受限;超声辅助提取和微波辅助提取通过超声、微波的空化、振动效应,加速细胞破壁,提高提取效率,缩短提取时间,不过其作用机制复杂,工艺参数优化难度高,如超声频率、功率,微波强度等因素需精细调控,否则易造成有效成分降解或提取不完全。
5.2 当归在医药领域的应用
当归作为传统中药材,在中医经典方剂中占据核心地位,如四物汤、当归补血汤等,历经千百年临床实践验证其补血、活血、调经等功效。在现代医学体系下,科研人员借助先进技术深入探究其药理机制,发现当归中的活性成分对血液系统、神经系统、心血管系统等多方面具有调节作用。然而,传统应用与现代研究之间仍存在一定的“隔阂”,如何将古籍记载的经验精准转化为现代临床的精准用药方案,是亟待解决的问题。例如,传统中医对于当归的使用依据辩证论治,用药剂量、配伍灵活多变,而现代医学追求标准化、规范化,两者的融合需要建立在对当归药理全面且深入的理解之上。
5.3 当归的安全性说明
当归在民间即可以作为药用也可以作为食材,以往文献中对当归的安全性进行系统性研究的比较少,对微剂量或者小剂量的累积毒性没有定论,在一定时间内符合规定食用,安全性能可以得到保证,这是基于中医药的配伍规律得出的结论。我国传统将当归作为香辛料和调味品食用,而美国、欧盟、日本也将当归作为香辛料食用,食品中添加当归时,应不得偏离配伍规则,合理使用。
6 展望
6.1 新型绿色提取技术研发
在当归提取技术领域,新型绿色提取技术的研发是未来发展的关键方向之一。随着全球对环境保护意识的不断增强以及对天然药物品质要求的日益严苛,传统提取方法所带来的环境污染、成分损失等问题亟待解决。离子液体萃取技术作为一种极具潜力的新型绿色提取手段,逐渐进入研究者的视野。离子液体是由有机阳离子与无机或有机阴离子构成的、在室温或接近室温下呈液态的盐类化合物,具有独特的物理化学性质,如极低的挥发性、良好的热稳定性、可设计的溶解性等。
在当归提取应用中,通过精心设计离子液体的阴阳离子结构,能够使其对当归中的特定有效成分,如阿魏酸、藁本内酯等,展现出卓越的选择性萃取能力。有研究初步表明,特定结构的离子液体在萃取当归阿魏酸时,不仅萃取率相较于传统有机溶剂显著提高,而且能够有效避免阿魏酸在高温、强酸碱环境下的降解,最大程度保留其生物活性。同时,由于离子液体几乎无挥发性,可大幅降低提取过程中的溶剂挥发损耗,减少对大气环境的污染,实现清洁生产。
酶辅助提取技术前景同样广阔。生物酶具有高度的专一性,能够精准识别并作用于当归药材细胞壁的特定组分,如纤维素酶可特异性降解细胞壁中的纤维素,果胶酶分解果胶成分,破坏细胞壁结构,使细胞内的有效成分更易溶出。酶辅助提取条件温和,通常在常温、近中性pH环境下进行,有效避免了高温、极端pH对当归活性成分结构与活性的破坏,确保提取物的品质与药效。这些新型绿色提取技术的深入研发与广泛应用,有望从源头上革新当归提取工艺,推动当归产业迈向绿色、可持续发展的新征程。
6.2 系统生物学方法解析机制
未来,借助系统生物学的多组学技术,如基因组学、转录组学、蛋白质组学、代谢组学等,将有望全方位、深层次地解析当归的药理作用机制。通过对不同组学数据的整合与分析,构建细胞-动物-人体的多尺度研究模型,深入探究其在体内的代谢过程、作用靶点及信号传导网络,为精准医疗提供理论支撑;针对临床应用难题,开展大规模、多中心的临床试验,依据患者个体特征制定个性化用药方案,优化联合用药策略,提升临床疗效与安全性。
6.3 个性化医疗与临床应用拓展
随着精准医疗时代的到来,基于个体基因、代谢组学等多维度信息实现当归的个性化用药将成为趋势。通过对个体基因多态性的检测,如药物代谢酶基因、药物靶点基因等关键位点的分析,预测患者对当归及其复方制剂的敏感性、代谢速率与不良反应风险,从而实现精准剂量调整,提高治疗效果,降低药物副作用。针对亚健康人群,依据其代谢紊乱、疲劳应激等指标,开发以当归为核心的功能性食品、保健品,通过调节机体气血平衡、抗氧化应激等作用,提升机体活力,预防疾病发生。同时,可以开展更多的临床研究,验证当归在不同疾病治疗中的有效性和安全性,为临床提供更丰富的治疗选择。
总之,未来当归的研究将在新型绿色提取技术研发、系统生物学方法解析机制、个性化医疗与临床应用拓展等方面不断推进,为中医药的发展和人类健康事业做出更大的贡献。
[1]Dong P L,Li H,Han H.Chin.Tradit.Med.inf.,2019,36(2):127-130.董培良,李慧,韩华.中医药信息,2019,36(2):127-130.
[2]Zhou Q,Zhang G C,Zhang J M,Zhao Y,Liu H N.Moder.Tradit.Chin.Med.Mater.,2024,26:1-15.周权,张高传,章家敏,赵益,刘红宁.世界科学技术-中医药现代化,2024,26:1-15.
[3]Wei J X,Li Y F,Yang X J,Li S,Yang Z J,Duan G J,Guo J J.Chin.Arch.Tradit.Chin.Med.,2024,42(10):127-134. 魏江霞,李越峰,杨秀娟,李硕,杨志军,段国建,郭晶晶.中华中医药学刊,2024,42(10):127-134.
[4]Qiao M,Xiang C M.Chin.Arch.Tradit.Chin.Med.,2005,(10):1 892-1 893.乔明,向纯明.中医药学刊,2005,(10):1 892-1 893.
[5]Qin S Z,Yuan R W,Zhang Y,Zhao X,Teng L R,Zhao C G.Chin.Med.Reports,2014,20(3):74-75.秦书芝,袁如文,张瑶,赵曦,滕利荣,赵成国.中医药导报,2014,20(3):74-75.
[6]Wu G X,Yang X J,Deng Y,Chen H,Yang Y Z,Yang Z J.Chin.J.Inf.Tradit.Chin.Med.,2018,25(5):77-81.吴国霞,杨秀娟,邓毅,陈晖,杨延泽,杨志军.中国中医药信息杂志,2018,25(5):77-81.
[7]Yang S S.J.Gansu Sci.Tec.,2015,31(18):74-76.杨树声.甘肃科技,2015,31(18):74-76.
[8]Wang G Y,Wei H Q,Liu J.Heilongjiang Med.Pharm.,2003,(1):30.王桂艳,魏怀春,刘娟.黑龙江医药科学,2003,(1):30.
[9]Shi Y,Li M Q,Yang S Y,Hu Y,Sun W X,Li L J.Chin.J.Mod.Appl.Pharm.,2024,41(7):1 006-1 014.石玉,李梦琦,杨诗宇,胡豫,孙文秀,李凌军.中国现代应用药学,2024,41(7):1 006-1 014.
[10]Chen L,Zhu J,Wang S,Xi Q.Shanghai Med.Pharm.,2021,42(9):71-75.陈琳,朱靖,王嵩,郤庆.上海医药,2021,42(9):71-75.
[11]Wan N,Lan J,Wu Z F,Chen X Y,Zheng Q,Gong X C.Separations,2022,9(6):1-15.
[12]Fan Y,Li Q.Sustainable Chem.Pharm.,2022,(29):100 792-100 804.
[13]Pyrzynska K.J.Separations,2024,11(7):204-218.
[14]Ning N,Han J J,Yv J S,Zou Z Y,Mu S X.Heilongjiang J.Anim.Sci.Vet.Med.,2016,(3):166-170.宁娜,韩建军,郁建生,邹宗尧,牟少霞.黑龙江畜牧兽医,2016,(3):166-170.
[15]Liu K,Bi Y Y,Li Y N,Xu C,He M,Guo Y M,Zhao X.Chem.Reagents,2023,45(9):97-104.刘珂,毕映燕,李亚楠,徐成,何敏,郭玉梅,赵鑫.化学试剂,2023,45(9):97-104.
[16]Huang H H,Qin R H,Liu X F.World Latest Med.Inf.,2019,19(58):127-153.黄红泓,覃日宏,柳贤福.世界最新医学信息文摘,2019,19(58):127-153.
[17]Wang Y,Xiong X,Huang G.Ultrason.Sonochem.,2023,95:106 395-106 411.
[18]Tian S,Hao C,Xu G,Yang J,Sun R.J.Food Drug Anal.,2016,25(4):766-775.
[19]Zhang L,Jiang Y,Pang X,Hua P,Gao X,Li Q.Molecules,2019,(19):3 461-3 488.
[20]Yu J F,Lou Q,Zheng X Y,Cui Z W,Fu J.Molecules,2017,22(12):2 216-2 228.
[21]Song Z R,Chen X L,Xiong Q R.J.Chin.Inspec.exam.,2019,27(2):39-40.宋正蕊,陈秀粮,熊启瑞.中国检验检测,2019,27(2):39-40.
[22]Fu X,Liu Q,Sun X,Chang H,Liu Y,Han J.JAD J.Alzheimer′s Dis.,2022,85(1):7-19.
[23]Mamache W,Benslama A,Benchikh F,Benabdellah H,Lassas S,Amira H,Amira S.Turkish J.Agriculture-Food Sci.Tech.,2022,10(2):334-340.
[24]Jin H,Guo Y R,Kim M S,Pil G M,Bravo P L W,Shin M B,Cha S Y,Lee M J,Park H,Suh J W.J.Med.Food,2021,24(2):135-144.
[25]Xu L N,Ouyang R,Wang J P.Chin.J.Integr.Tradit.West.Med.,1981,1:36-64.徐理纳,欧阳蓉,王建平.中西医结合杂志,1981,1:36-64.
[26]Guo W J,Li Y Y,An D G,Zhou M,Xiong J M,Jiang Z J,Ding Y M,Huang R R,Miao W J.Colloids Surf.B,2022,220:112 925-112 940.
[27]Tian Y X,Shen X R,Hu T T,Liang Z Y,Ding Y,Dai H L,Liu X Y,Lu T L,Yin F Z,Shu Y C,Guo Z J,Su L L,Li L.Front.Pharmacol.,2024,15:1 405 342-1 405 355.
[28]Zhang W J,Zhao L,Ma J Z,Yang C G,Wang X C,Pu X Y,Wang Y G,Ran F,Wang Y L,Ma H.Int.J.Polym.Mater.Polym.Biomater.,2018,67(4):205-211.
[29]Gao J W,Cui M D.J.Chin.Med.Mater.,2024,4:977-983.高加巍,崔梦迪.中药材,2024,(4):977-983.
[30]Zhuang C,Wang Y,Zhang Y,Xu N.Int.J.Biol.Macromol.,2018,115:281-286.
[31]Niu Y,Xiao H,Wang B,Wang Z,Du K,Wang Y,Wang L.Pharm.Biol.,2023,61(1):768-778.
[32]Zduńska K,Dana A,Kolodziejczak A,Rotsztejn H.Skin Pharmacol.Physiol.,2018,31(6):332-336.
[33]A imovi
imovi M G,Pavlovi
M G,Pavlovi S
S ![]() A O,Filipovi
A O,Filipovi V M,Cvetkovi
V M,Cvetkovi M T,Stankovi
M T,Stankovi J M,
J M, abarkapa I S.Nat.Prod.Commun.,2017,12(2):205-206.
abarkapa I S.Nat.Prod.Commun.,2017,12(2):205-206.
[34]Du J,Hu Z,Dong W J,Wang Y,Wu S,Bai Y.Microchem.J.,2019,147:333-338.
[35]Zhou G S,Yang N Y,Tang Y P,Duan J A,Jiang S,Yan H,Guo S,Song B S,He Z Q.Chin.J.Nat.Med.,2012,10(4):295-298.周桂生,杨念云,唐于平,段金廒,江曙,严辉,郭盛,宋秉生,何子清.中国天然药物,2012,10(4):295-298.
[36]Sabeel Z,Liang Y,Hao M,Ying L,Guo R,Chen R,Yang Z.Phytother.Res.,2023,37(5):2 187-2 211.
[37]Zhao Y,Feng Y,Jing X,Liu Y,Liu A.Chem.Biodiversity,2021,18(6):e2 100 089.
[38]Chiu S C,Chen S P,Huang S Y,Wang M J,Lin S Z,Harn H J,Pang C Y.J.PloS One,2012,7(3):33 742.
[39]Wu S Z,Li J L,Chen S Q,Zhu X Z.J.Lishizhen Med.Mater.Med.Res.,2012,23(2):319-320.吴素珍,李加林,陈水亲,朱秀志.时珍国医国药,2012,23(2):319-320.