Helmut Sies受Hans Selye的应激理论启发,在1985年首次提出了“氧化应激”的概念[1]。2015年,该定义得到了进一步完善,更新为“氧化剂和抗氧化剂之间氧化还原信号/控制的破坏和分子损伤失衡”[2]。自该概念提出以来,许多科学家开始投身于生物过程中的氧化剂、自由基以及抗氧化剂的研究,揭示了ROS在生物学领域的作用。根据Lushchak的说法,氧化应激可以重新表述为生物系统中ROS的生成和消除之间的不平衡[3]。近年来,ROS在各种疾病中的作用越来越明显[4-6]。
过氧化氢(H2O2)、次氯酸(HCIO)、过氧亚硝酸盐(ONOO-)等ROS是广泛存在于生物体内的含氧物质,它们具有高反应活性[7-9]。一般认为,正常水平的ROS对于维持生物体的正常生理功能有着重要作用[10]。若ROS含量出现显著异常波动,高浓度的ROS则会损害蛋白质、DNA等生物分子,活体内往往就会产生与炎症相关的疾病。因此,在癌症、关节炎、阿尔兹海默症等疾病领域,ROS在生物体内的时空分布研究受到了空前关注[11,12],开发一种有效可靠的评估细胞内ROS水平的技术对于癌症和各种临床评估也就有着重要意义。
迄今为止,已经开发出多种用于量化ROS的分析技术。这些技术包括高效液相色谱法、表面增强拉曼散射法、比色法、电化学技术、光电化学方法和电化学发光法[13]。然而,这些方法存在一些缺点,如需要昂贵的仪器、复杂的样品制备、严格的操作程序以及侵入性检测[14]。相比之下,荧光成像是一种引人注目的非侵入性实时技术,可用于可视化和量化分子信息,以及监测生物体的病理变化[15,16]。凭借着高灵敏度、操作简单的特点以及可实现原位成像从而获得生物系统中ROS可视化信息的优势,ROS荧光探针为这一交叉学科领域贡献了不可多得的助力[17]。近年来,科研工作者制备了许多荧光探针,可以用于选择性监测某一种ROS。在这篇综述里将重点关注H2O2、HClO和ONOO-探针,并根据其响应基团对其进行分类(图1)。
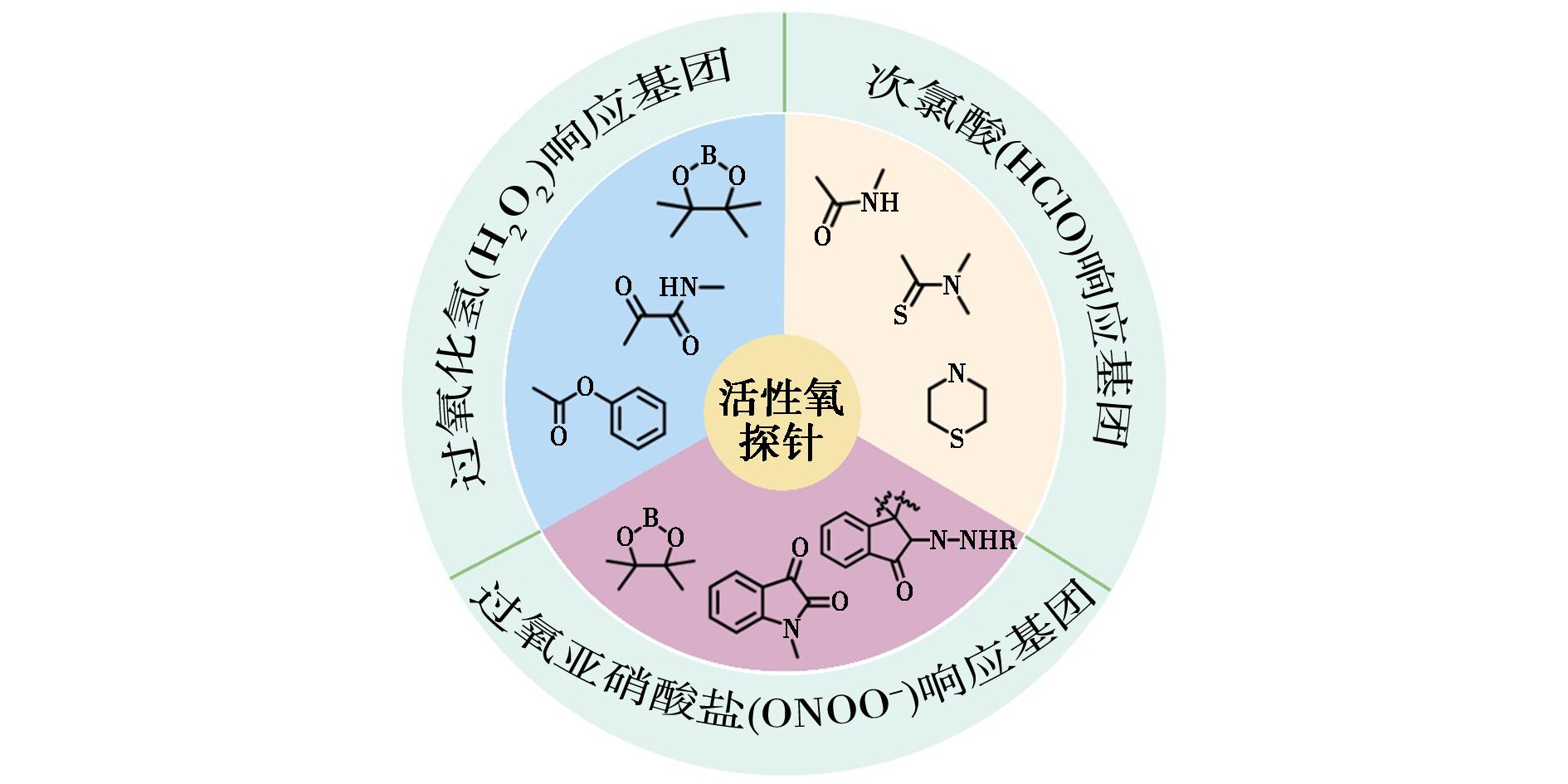
图1 ROS荧光探针专属响应基团
Fig.1 Exclusive response group for ROS fluorescent probes
1 H2O2荧光探针
H2O2作为ROS的关键成员,在生物体内众多生理过程中扮演着至关重要的调节角色[18]。它不仅能够通过氧化参与细胞增殖、迁移和分化等过程的蛋白质,进而激活或抑制这些蛋白质的功能,而且还能够有选择性地调节体内的免疫防御机制[19]。在健康哺乳动物细胞中,H2O2的平均浓度维持在1~700 nmol/L的低水平动态平衡状态,这种平衡对于促进正常细胞生长至关重要。然而,一旦H2O2浓度升高,就可能在生物系统中引发氧化应激,导致细胞凋亡。人体内H2O2的过量积累更是与多种疾病和紊乱密切相关,如癌症、阿尔茨海默病和心血管疾病,同时还会对哺乳动物的早期胚胎发育产生不良影响[20-22]。
目前,已开发出各种荧光传感器用于检测生物体或细胞内的H2O2水平。这些荧光探针的响应机制主要基于芳基硼酸盐或苯基硼酸与酚的转化反应,或是磺酸基的氧化反应,能够灵敏地捕捉到H2O2的存在,并通过荧光信号的变化来反映其浓度水平。
1.1 基于硼酸酯的H2O2荧光探针
Liu等[23]开发了一种新型荧光探针(Mito-FBN),用于检测癌细胞线粒体中的内源性H2O2(图2)。该探针同时利用硼酸盐驱动的内酰胺形成和可消除的猝灭部分来降低背景荧光,最终实现超过50倍的荧光开启,从而实现了对肿瘤细胞线粒体中内源性H2O2的高灵敏度检测。此外,该探针也在KB细胞中进行了共定位实验,用线粒体特异性探针Mito Tracker Red CM-H2Ros进行染色,以确认Mito-FBN探针的亚细胞定位。红色和绿色荧光区域之间有明显的重叠,这意味着Mito-FBN可以有效地扩散到线粒体中,而强烈的绿色荧光则表明线粒体产生H2O2。这些结果表明癌细胞可以在没有外界刺激的情况下在线粒体中产生大量的内源性H2O2。
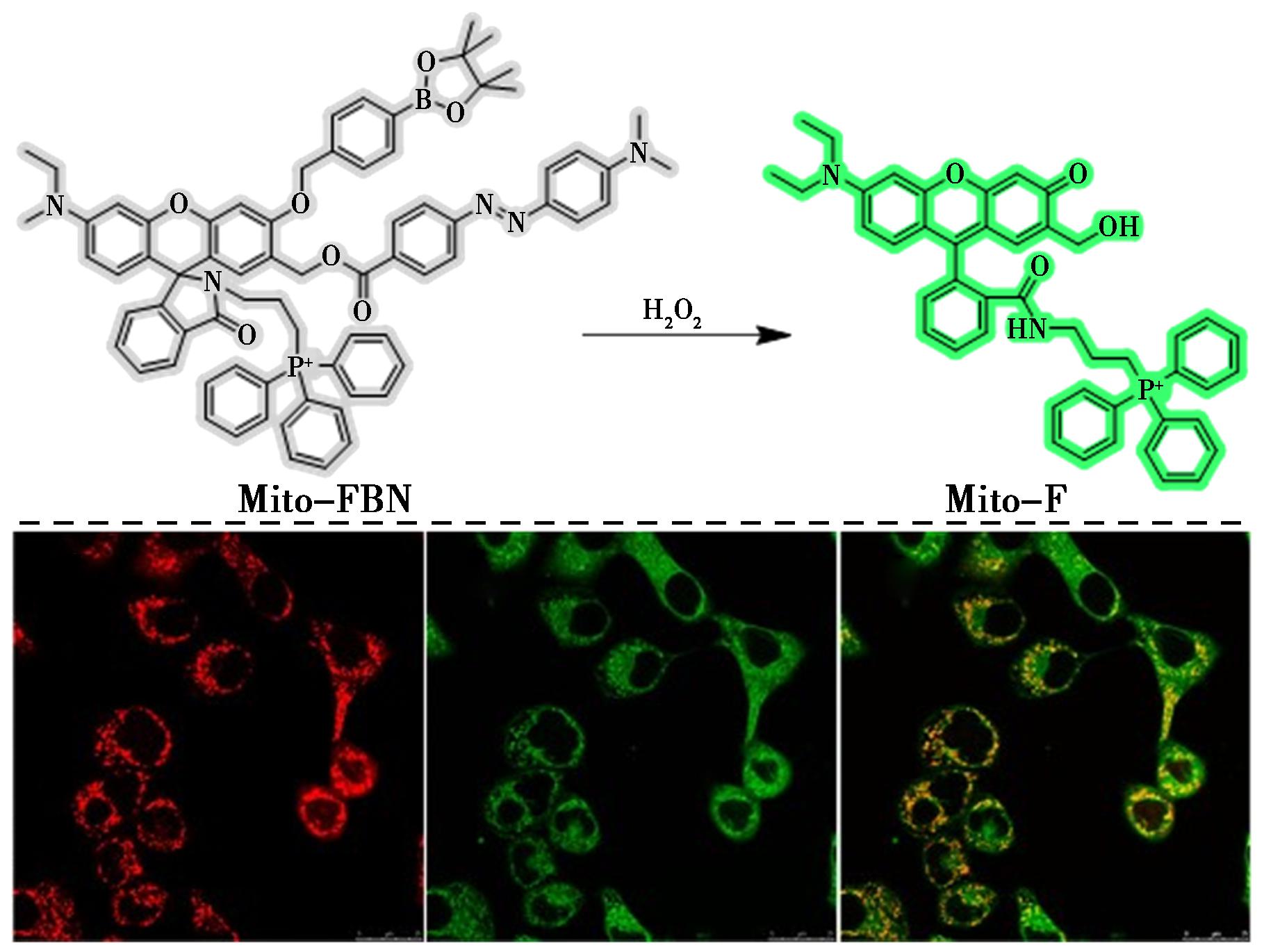
图2 探针Mito-FBN对H2O2的检测机理(上)及在KB细胞中的共定位细胞成像(下)[23]
Fig.2 Detection mechanism of H2O2 by probe Mito-FBN (top) and co-localization cell imaging in KB cells (bottom)[23]
2022年,Hang等[24]首次设计了以新型融合喹喔啉为荧光团,硼酸酯部分为反应位点,用于检测H2O2的开关型荧光探针QX9A-H2O2(图3)。QX9A-H2O2对H2O2表现出高灵敏度,检测限低至46 nmol/L,并且对H2O2表现出比其他反应物(如ROS、生物硫醇和各种离子)更好的选择性。该检测基于分子内电荷转移(ICT),经过连续的氧化水解、1,6-重排消除和脱羧过程释放荧光团QX9A。此外,探针QX9A-H2O2具有细胞通透性,可成功用于活细胞中的外源性和内源性H2O2成像。
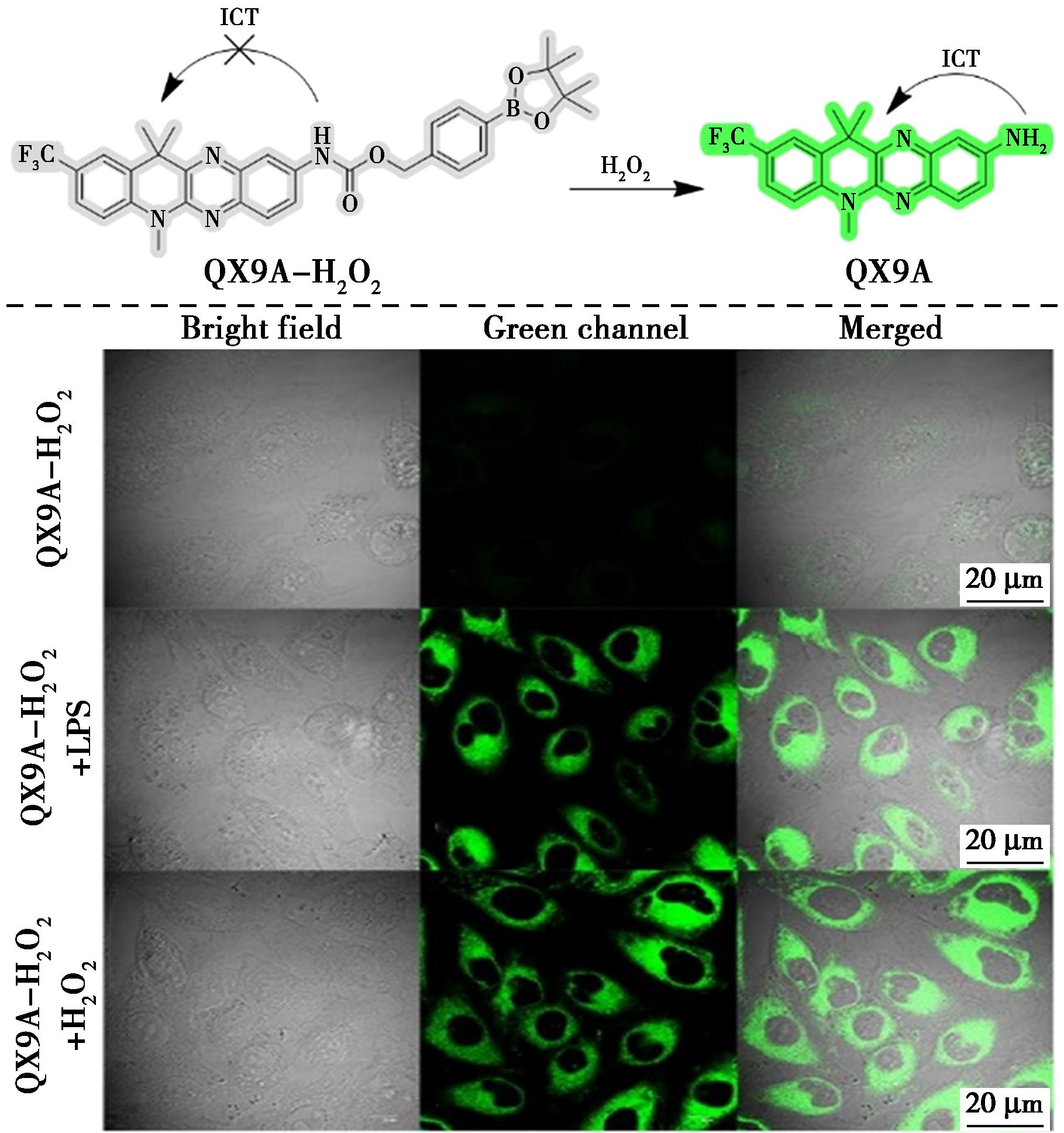
图3 探针QX9A-H2O2对H2O2的检测机理(上)及外源性和内源性H2O2的细胞成像(下)[24]
Fig.3 Detection mechanism of probe QX9A-H2O2 for H2O2 (top) and cell imaging for exogenous and endogenous H2O2 (bottom)[24]
同年6月,Ma等[25]将2-氨基苯硫醇与5-溴乙醛结合合成亮蓝色荧光探针,并与4-溴甲基苯基硼酸酯进行亲核取代反应得到BBS探针(图4)。此探针同样通过ICT机制用于检测H2O2。在生理环境中BBS探针对H2O2具有良好的特异性检测。同时,BBS的荧光强度与H2O2浓度(0~40 μmol/L)呈极好的线性关系,线性相关系数(R2)为0.999,BBS的检测限为132 nmol/L。另外,通过MCF-7细胞成像研究,探针BBS具有良好的生物适应性和通透性,可以高效准确地分散在细胞质中。BBS可有效检测MCF-7细胞中的内源性和外源性H2O2。
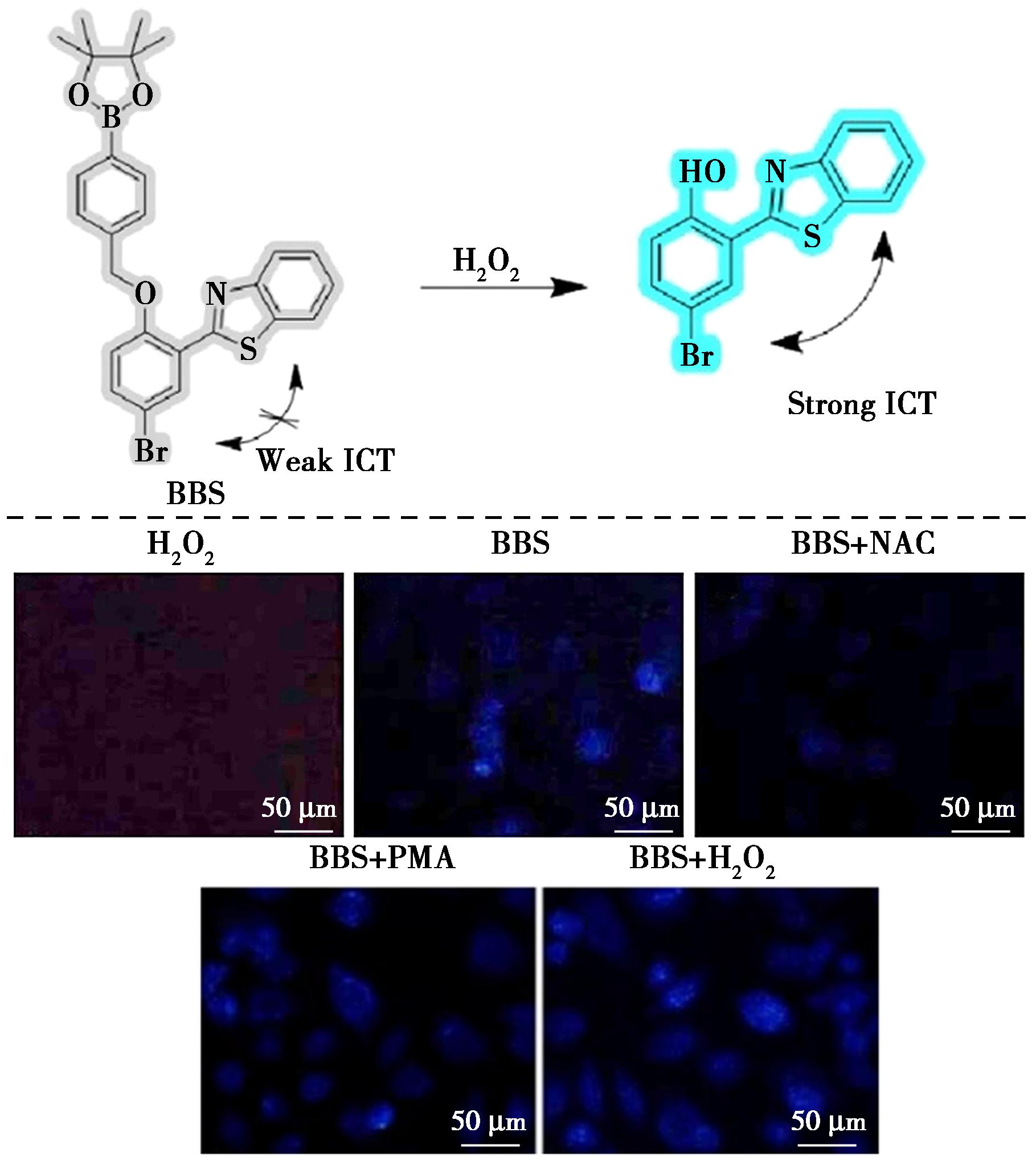
图4 探针BBS与H2O2反应机理(上)及外源性和内源性H2O2的细胞成像(下)[25]
Fig.4 Reaction mechanism between probe BBS and H2O2 (top) and cell imaging for exogenous and endogenous H2O2 (bottom)[25]
二氰基氟酮的衍生物由于其优异的光稳定性、近红外发射和较大的斯托克斯位移,被广泛应用于生物成像和传感领域。一种新型近红外探针TMN-H2O2[26]是通过酯键将H2O2反应基团(4-取代硼酸酯)添加到TMN-NH2上制备的(图5)。与H2O2反应后,TMN-NH2的荧光团因失去苯基硼酸基团而释放,导致发射峰波长发生偏移。一系列实验表明,TMN-H2O2对H2O2表现出高选择性。此外,TMN-H2O2在与H2O2反应后显示出近红外(NIR)发射峰(660 nm)和较大的斯托克斯位移(180 nm),表明其在体内应用中具有潜力。并且TMN-H2O2表现出出色的灵敏度(检测限为 76 nmol/L)和快速响应时间(40 min)。通过斑马鱼进行荧光成像,在仅使用探针的斑马鱼中未观察到荧光。然而,当添加探针和H2O2时,检测到斑马鱼发出明显的红色发射。因此,TMN-H2O2可用于检测活体生物系统中的H2O2。
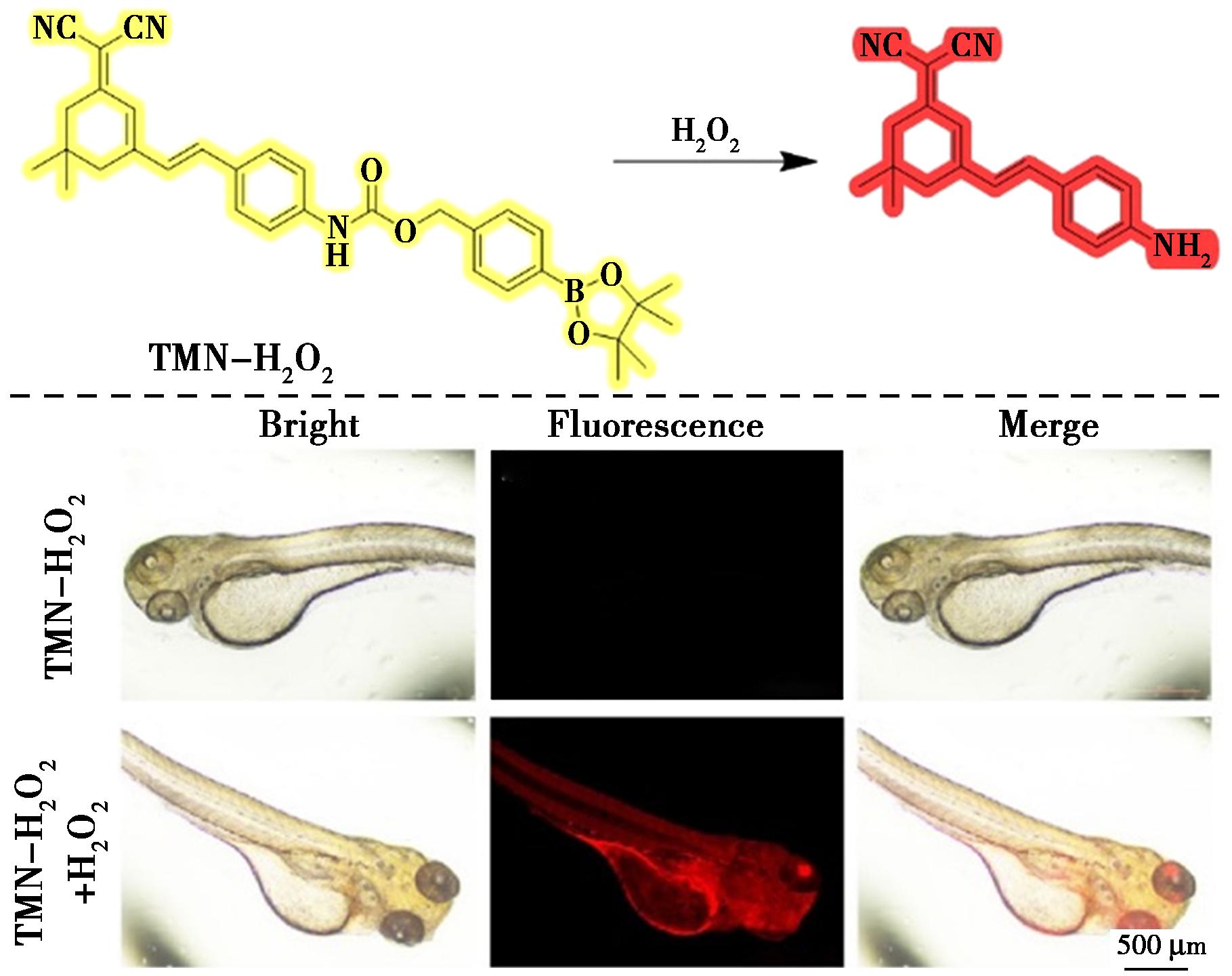
图5 探针TMN-H2O2与H2O2的反应机理(上)及斑马鱼的荧光成像(下)[26]
Fig.5 Reaction mechanism of probe TMN-H2O2 with H2O2 (top) and fluorescence imaging in zebrafish (bottom)[26]
利用激发态分子内质子转移(ESIPT)特性,Chen等[27]设计并合成了一种具有较大斯托克斯位移(234 nm)的近红外发射(λem=656 nm)荧光探针HBQ-B,用于检测H2O2(图6)。HBQ-B对H2O2表现出比其他生物活性分析物更高的特异性。同时,HBQ-B的荧光比(I656/I538)变化与H2O2浓度(0~10 μmol/L)之间表现出良好的线性关系。由于ESIPT被阻断,这种水溶性探针在水性缓冲液中发出绿色荧光,而H2O2诱导的 ESIPT过程有效恢复导致荧光从绿色显著变为红色。通过对活体斑马鱼体内H2O2的成像,对照组未发现荧光,单纯用HBQ-B处理的斑马鱼诱导出明显的绿色荧光。外源H2O2处理斑马鱼后,可见红色荧光。用佛波酯(PMA)刺激后,红色通道荧光较HBQ-B组明显增多,说明PMA刺激促进了内源性H2O2的增多。然而,用抑制剂N-乙酰半胱氨酸(NAC)处理斑马鱼后,红色荧光明显减少,绿色荧光增强,说明NAC能有效消除PMA刺激产生的H2O2。因此,HBQ-B可以同时监测活体斑马鱼体内外源H2O2水平。

图6 探针HBQ-B对H2O2的识别机理(上)及斑马鱼的比率监测成像(下)[27]
Fig.6 Recognition mechanism of probe HBQ-B for H2O2 (top) and ratiometric monitoring imaging in zebrafish (bottom)[27]
2024年,Zeng等[28]以氧蒽类似物为分子框架,构建了一种新型H2O2近红外荧光探针JH(图7)。该探针的荧光发射波长位于近红外区,具有较大的斯托克斯位移,使得探针对生物样品的损伤较小,背景干扰较低,有利于提高检测分辨率。探针对H2O2的响应时间95 min,检测限较低(4.72 μmol/L),响应后溶液颜色由深蓝色变为浅蓝色,易于观察,无需借助任何辅助工具。此外,探针JH已成功用于细胞内H2O2的检测,有望成为疾病早期诊断的工具。
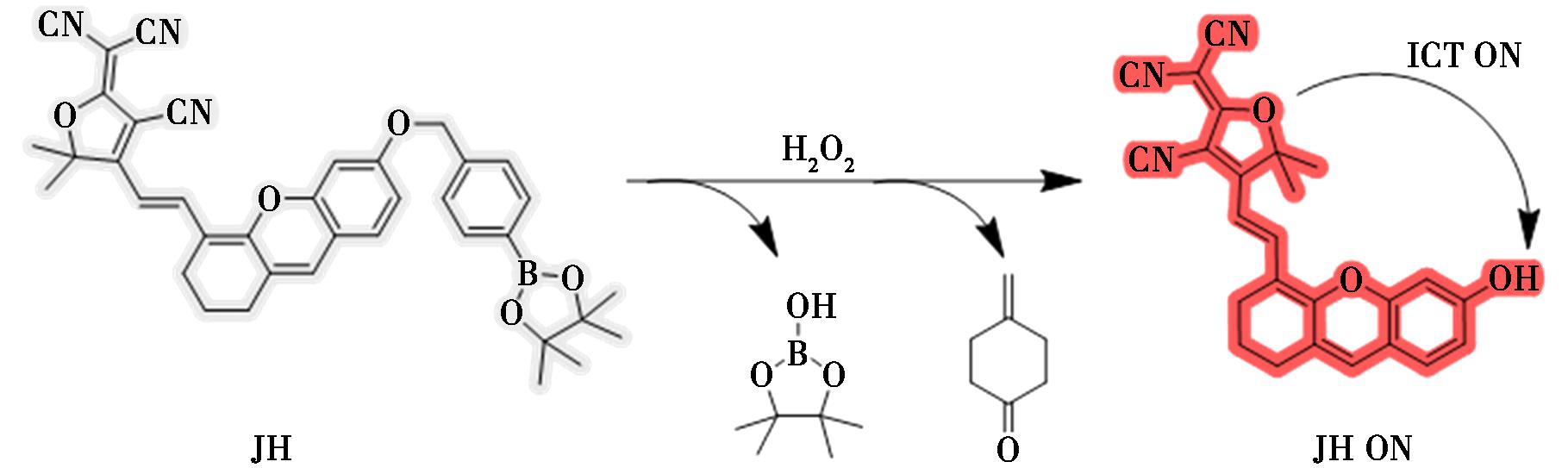
图7 探针JH对H2O2的检测机理[28]
Fig.7 Detection mechanism of probe JH for H2O2[28]
1.2 基于α-酮酰胺的H2O2荧光探针
罗丹明染料表现出优异的光学性能,例如对光照射具有良好的稳定性,高荧光量子产率。然而,罗丹明及其衍生物的荧光发射波长大多 <600 nm,其斯托克斯位移一般<50 nm,这可能会在荧光检测中引起严重的背景干扰问题。Hu等[29]设计了一种结构修饰的罗丹明探针RhB-NIR,以4-硝基-α-酮酰胺为识别基团,探针经历了供体激发光诱导电子转移的过程(图8)。加入H2O2后,识别基团断裂,释放出新的荧光团,该荧光团在730 nm处有明显的荧光,新荧光团的斯托克斯位移为140 nm,因此可以大大降低荧光检测中严重的背景干扰的影响。该探针对H2O2检测具有较高的选择性和灵敏度,检测限为61 nmol/L,适合靶向线粒体并直观检测活细胞中的内源性H2O2。通过细胞共定位成像实验表明,RhB-NIR的荧光光谱与罗丹明123的荧光光谱有很好的重叠性,皮尔逊系数达到0.91。总之,RhB-NIR在细胞共定位实验中显示出靶向线粒体的潜力。
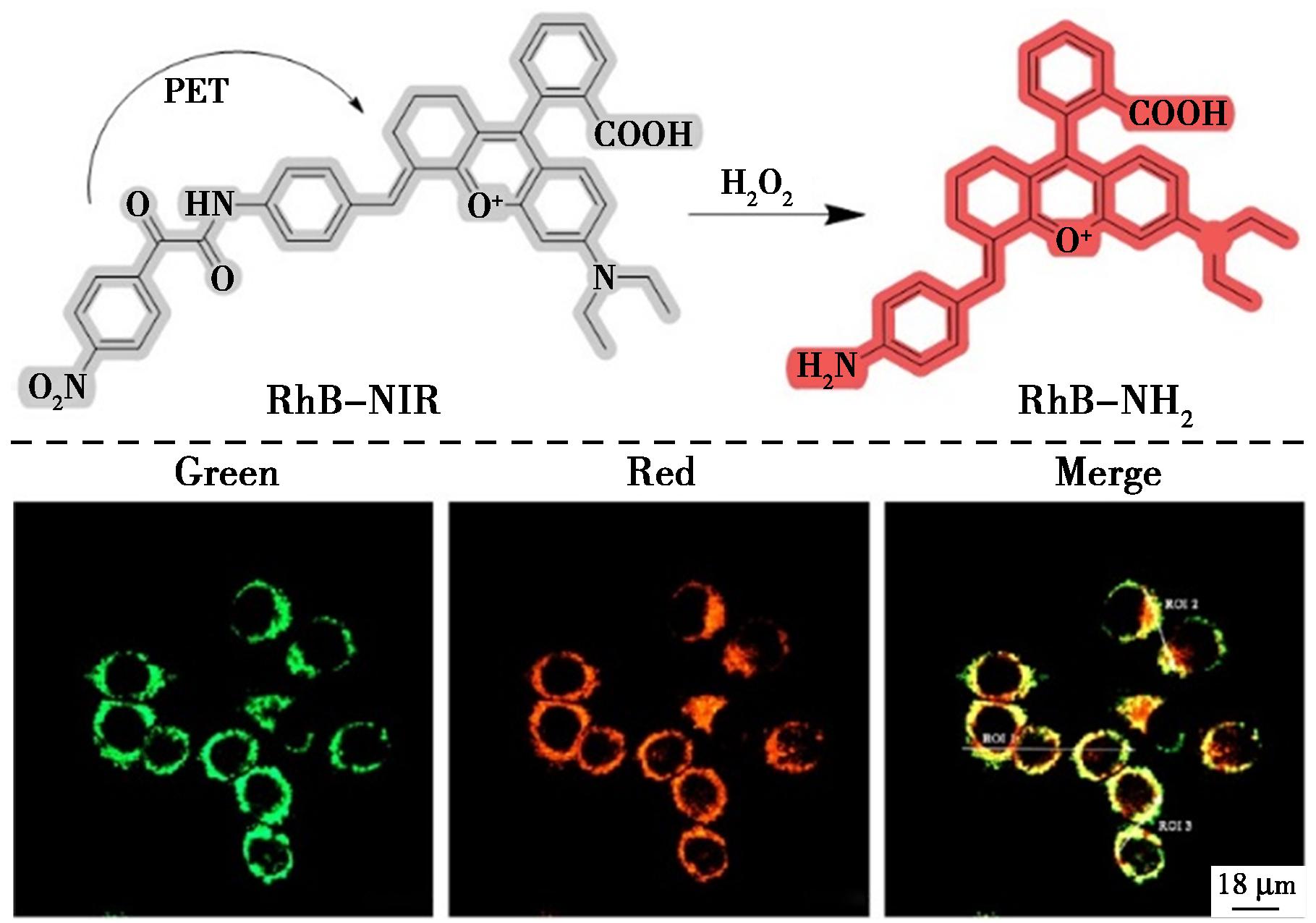
图8 探针RhB-NIR与H2O2的反应机理(上)及RhB-NIR和罗丹明123的共定位成像(下)[29]
Fig.8 Reaction mechanism of probe RhB-NIR with H2O2 (top) and co-localization imaging of RhB-NIR with rhodamine 123 (bottom)[29]
Wang等[30]也采用α-酮酰胺作为H2O2的识别位点,并结合生物素作为靶向配体,成功设计出了荧光探针BBHP,加快了对H2O2的荧光响应速度(图9)。如图所示,经BBHP处理后,肿瘤切片中可观察到强荧光。相比之下,在相同条件下用探针处理新鲜肝组织切片,荧光非常弱。荧光强度的定量分析显示,与肝组织相比,肿瘤组织的荧光增强了3倍以上。该探针能够选择性检测肿瘤细胞中的H2O2,并成功实现了肿瘤组织与正常组织的区分。同年,Wang等[31]设计了一种新型荧光探针(Mito-H2O2),用于基于半菁骨架的H2O2特异性检测,具有明亮的近红外荧光发射(图10)。该探针通过将4-硝基-α-酮酰胺基团掺入半菁荧光团中制备而成,在H2O2存在下开启其近红外荧光信号。Mito-H2O2高灵敏度、对H2O2的优异选择性以及在生理pH下的完美功能性。如图10所示,给小鼠腹膜内注射探针后,几乎没有荧光。另一方面,给实验小鼠腹膜内注射H2O2和Mito-H2O2后,可以观察到H2O2处理的小鼠体内有明显的荧光。与对照组相比,用鱼藤酮(H2O2诱导剂)预处理的小鼠也显示出荧光增加。此外,Mito-H2O2已成功应用于细胞和小鼠中外源性和内源性H2O2的成像,且细胞毒性可忽略不计。
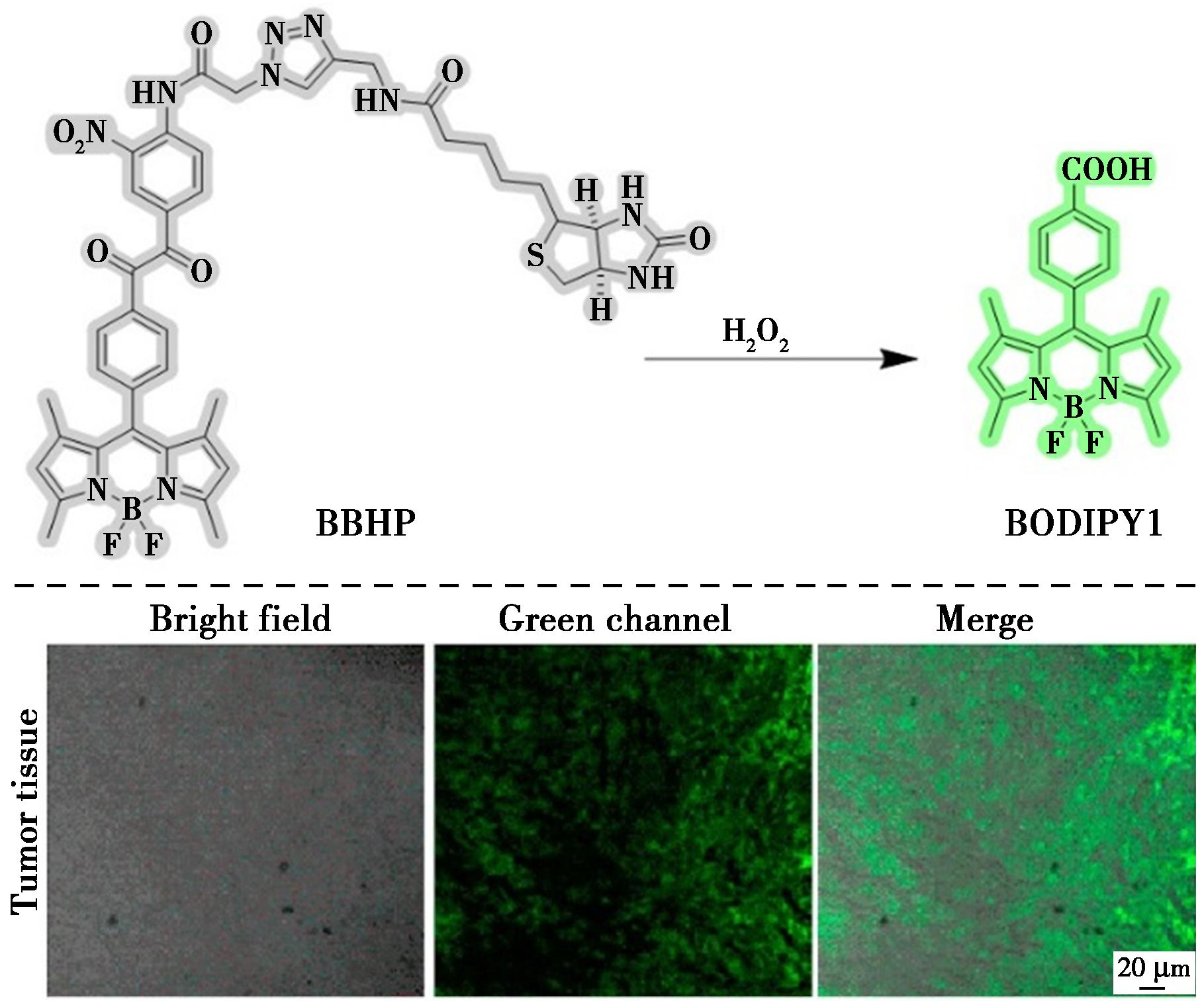
图9 探针BBHP对H2O2的检测机理(上)及肿瘤组织中H2O2的荧光成像(下)[30]
Fig.9 Detection mechanism of H2O2 by probe BBHP (top) and fluorescence imaging of H2O2 in tumor tissue (bottom)[30]
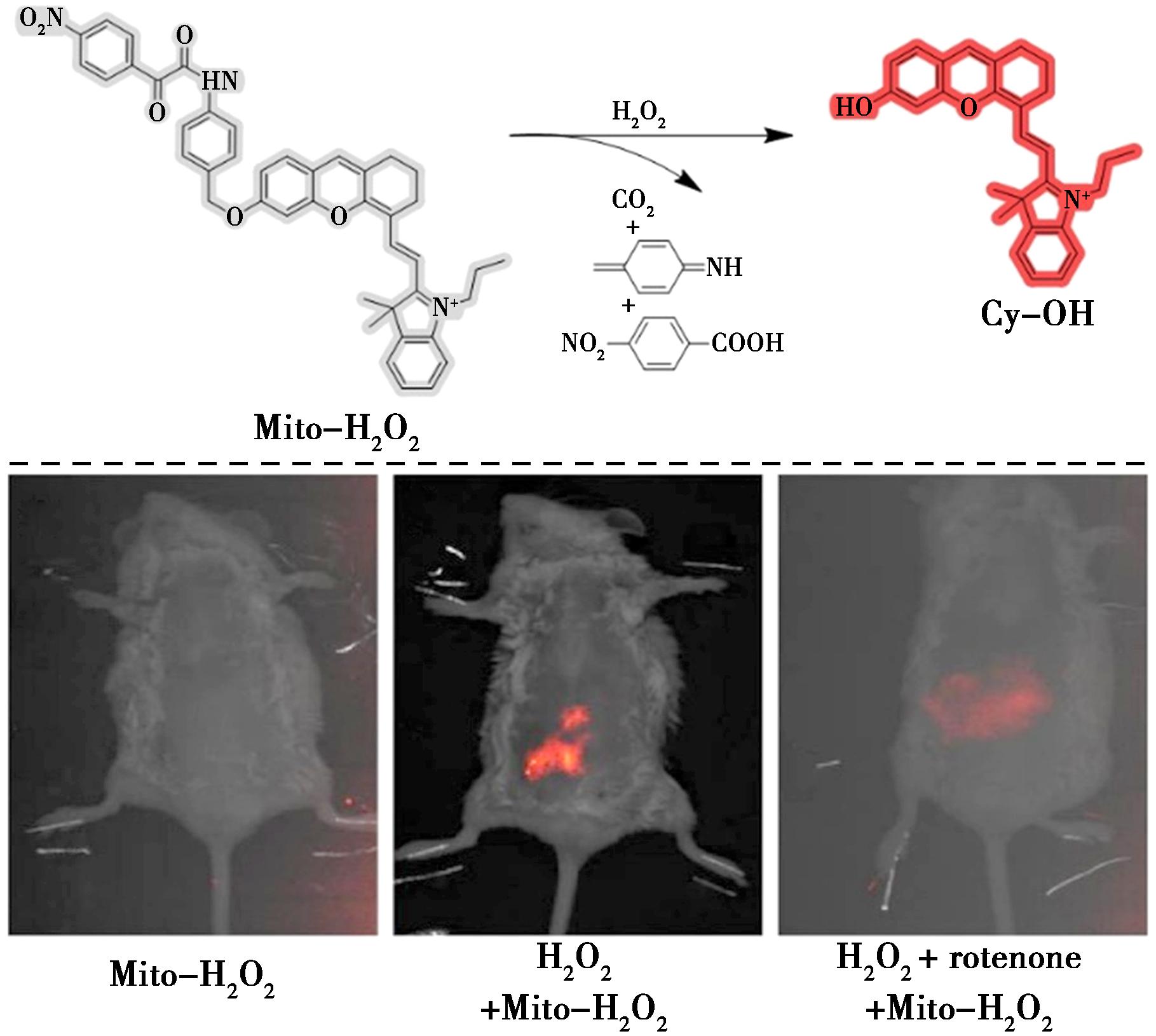
图10 探针Mito-H2O2检测H2O2的机制(上)及活体小鼠体内H2O2的荧光成像(下)[31]
Fig.10 Proposed mechanism of probe Mito-H2O2 for detecting H2O2 (top) and fluorescence imaging of H2O2 in living mice (bottom)[31]
Wang等[32]结合了α-酮酰胺和BODIPY荧光团,设计了一种用于检测H2O2和H2O2蒸气的开启荧光探针BOD(图11)。由于分子内供体激发的光诱导电子转移(PET)效应,合成的探针BOD具有非常弱的荧光。但在H2O2识别后,苯甲酰可以转化为苯甲酸,释放出游离的BODIPY荧光团(BOD-COOH),发出强荧光,在吸收光谱中可以观察到从508 nm到498 nm的蓝移。同时,探针BOD对H2O2表现出良好的选择性,不受其他常见ROS和爆炸物残留物离子的影响,检测限为4.41 μmol/L。此外在涂有SMU图像的BOD薄层色谱板在H2O2蒸气下发出明显的绿色荧光,表明基于BOD检测H2O2蒸气的成功。更重要的是,探针BOD对H2O2蒸气的检测表现出快速响应(低至20 min)和高灵敏度,在公共安全、法医分析和环境监测中具有巨大的实际应用潜力。
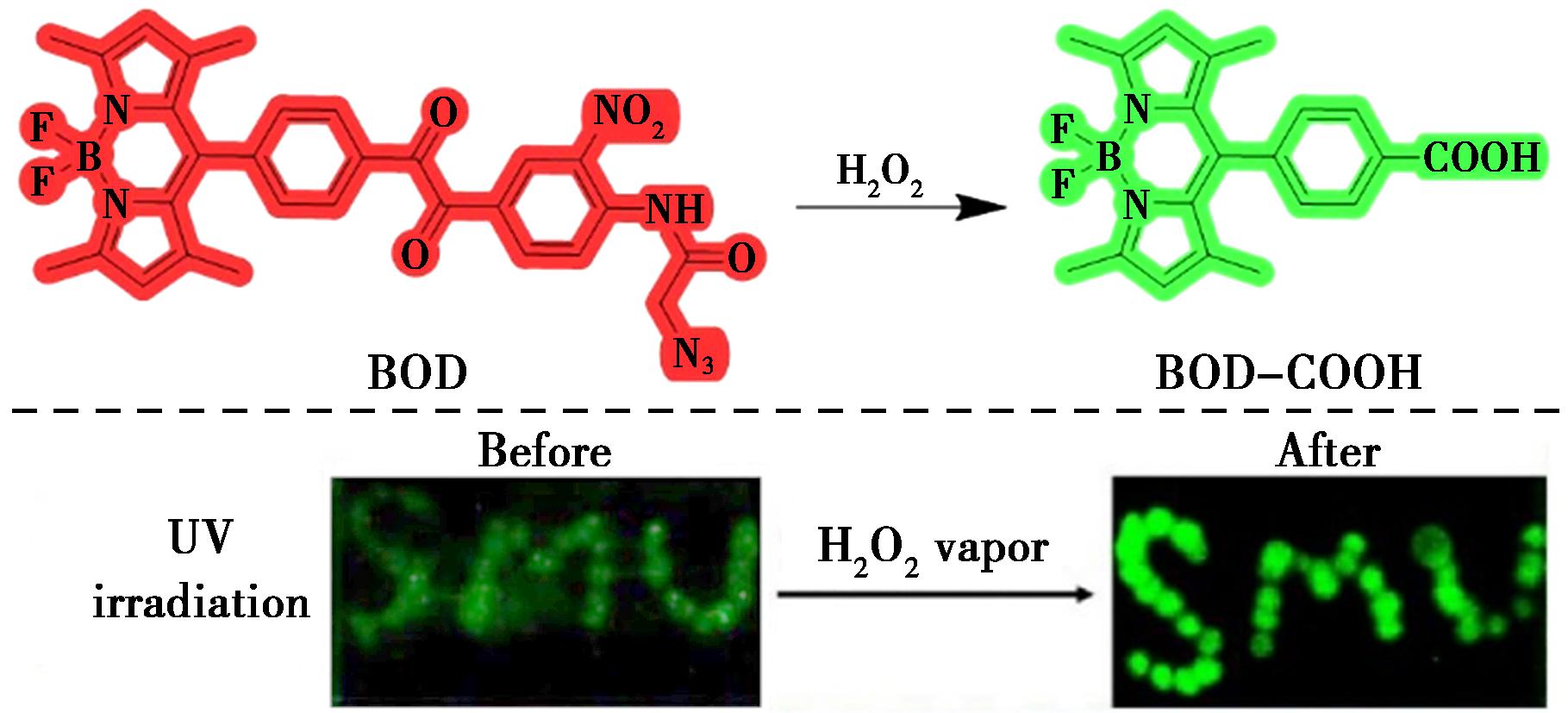
图11 探针BOD对H2O2的检测机理(上)及印有SMU图像的BOD涂层薄层色谱板暴露于H2O2蒸气前后的发射响应(下)[32]
Fig.11 Detection mechanism of H2O2 by probe BOD (top) and the emissive response of the BOD-coated TLC plate with the image of SMU before and after being exposed to H2O2 vapor (bottom)[32]
1.3 基于乙酰基的H2O2荧光探针
2023年,Li等[33]利用一种易于合成的二氰基异佛尔酮衍生物作为NIR荧光团,以独特的乙酰基作为H2O2识别基团,研制出一种用于检测H2O2的近红外荧光探针(YQ-2)(图12)。该探针使用H2O2水解乙酰基,对H2O2表现出高灵敏度和高选择性以及斯托克斯位移显著(128 nm)。探针YQ-2具有近红外发射、高选择性和低细胞毒性等优良特性。在细胞成像中,探针YQ-2在没有H2O2时发出微弱的红色荧光,而加入H2O2后发出较强的红色荧光,而加入NAC后则没有荧光。因此,探针YQ-2可用于检测和成像活细胞中的外源性和内源性H2O2。
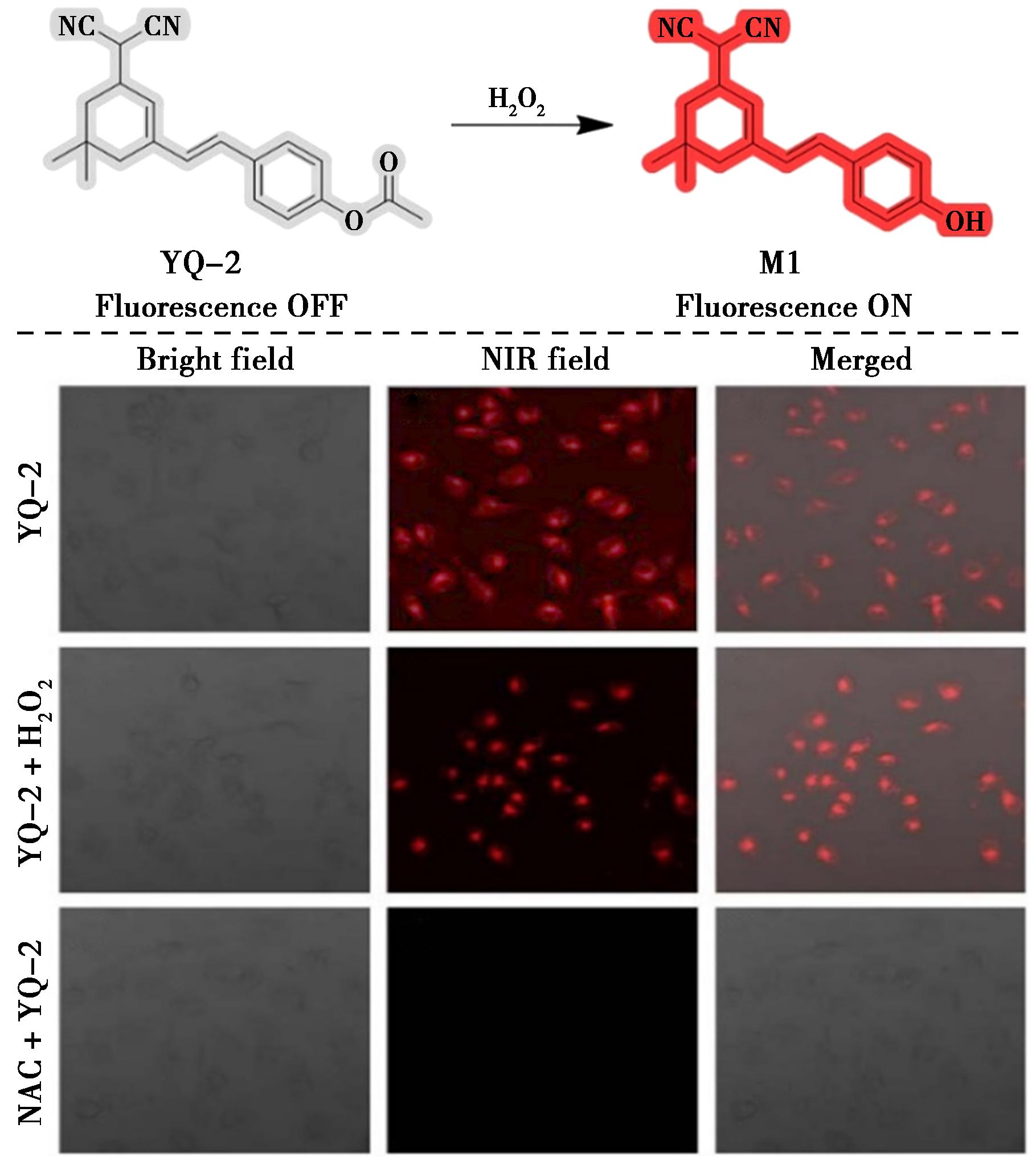
图12 探针YQ-2对H2O2的检测机理(上)及HeLa细胞荧光成像(下)[33]
Fig.12 Detection mechanism of probe YQ-2 for H2O2 (top) and fluorescence imaging in HeLa cells (bottom)[33]
Peng等[34]成功合成了5种基于二氰基异佛尔酮的探针,通过将甲氧基或甲基(供体)引入二氰基异佛尔酮(受体)的不同位置,构建供体-受体系统。根据结构-性能关系筛选出探针3a和3c,并以乙酰基为识别基团,构建比色和荧光双信号探针用于检测H2O2(图13)。基于ICT原理,探针3a和3c对H2O2发出比色和荧光双信号,检测限低(0.20和0.14 μmol/L)。此外,他们还利用斑马鱼进行了探针3a在活体H2O2检测实验,并在未处理的空白组和仅用探针3a处理的组均未观察到明显的荧光发射,而用H2O2处理后再与探针3a孵育的斑马鱼的荧光明显增强。因此,通过活体细胞和斑马鱼的生物成像结果揭示了探针3a在生物系统中H2O2监测的潜力。
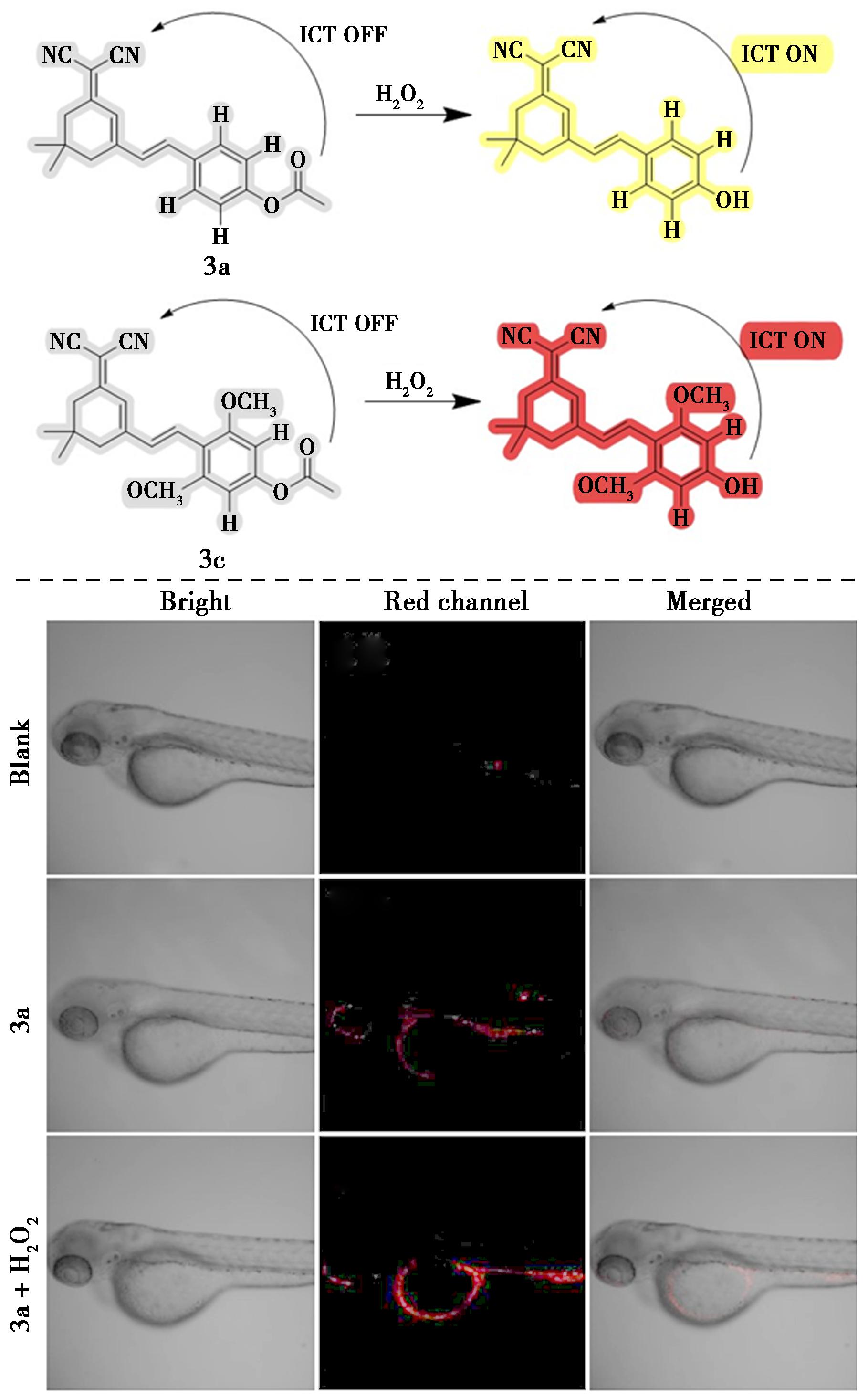
图13 探针3a和3c对H2O2的检测机理(上)及斑马鱼中H2O2的探针3a生物成像(下)[34]
Fig.13 Detection mechanism of probe 3a and 3c for H2O2 (top) and bioimaging of probe 3a for H2O2 in zebrafish (bottom)[34]
2 HClO荧光探针
HClO是生物系统中最重要的ROS之一,常见于生物体中。HClO可由Cl-和H2O2的过氧化反应产生,该反应由髓过氧化物酶(MPO)催化,并在其生理条件下产生内源性HClO[35]。作为信号分子,HClO系统在许多生理和病理过程中起着关键作用,包括抗炎、免疫调节和衰老[36]。然而,过量的HClO产生会导致多种生物分子氧化,例如DNA、RNA、蛋白质和胆固醇,从而导致多种严重疾病,包括癌症、神经元退化、关节炎和肾脏疾病[37]。近年来,已报道了各种检测HClO的方法。
有机化学在设计HClO选择性荧光探针以提供有效的设计策略(例如HClO选择性氧化、脱保护和氧化裂解)方面起着关键作用[38]。
2.1 基于酰胺基的HClO荧光探针
众所周知,吩噻嗪具有与亚甲蓝相似的光物理特性,最大荧光发射发生在近红外区域。两种基于吩噻嗪的荧光探针BC-2和BC-3[39]可用于精确的体外和体内检测HClO。其反应机理为,酰胺上的酰胺羰基受到HClO的攻击,这导致酰胺断裂并释放还原的吩噻嗪,从而产生荧光(图14)。两种探针BC-2和BC-3在存在HClO的情况下释放吩噻嗪荧光团时,近红外荧光强度均有所增加。值得注意的是,HClO的存在会导致溶液颜色从无色变为明显的蓝色,从而可以通过肉眼检测HClO。这些探针表现出极佳的选择性、高灵敏度和对HClO的快速响应。此外,BC-3可以快速检测小鼠关节炎模型中活细胞和炎症区域中的内源性HClO。
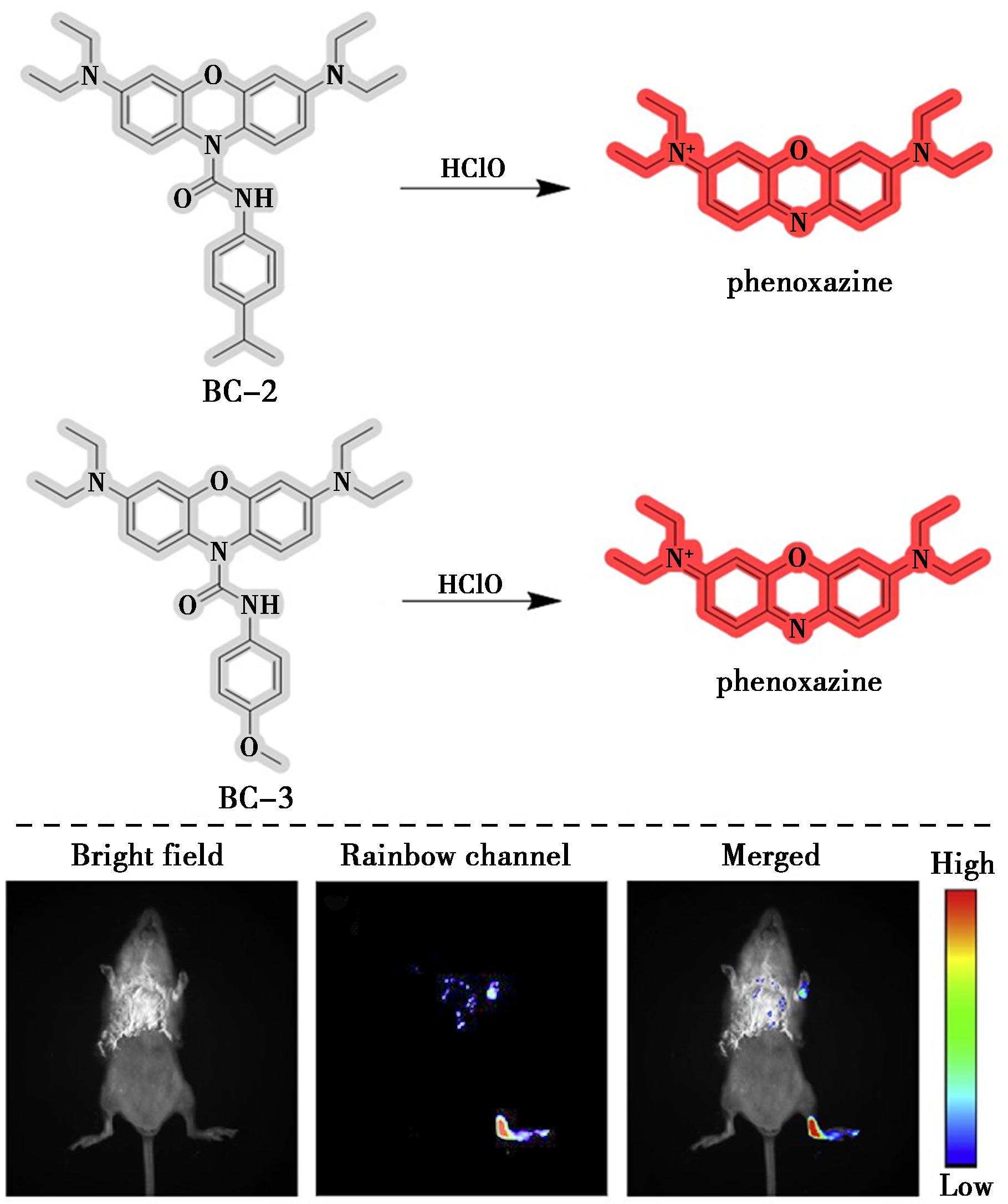
图14 探针BC-2和BC-3对HClO的识别机理(上)及探针BC-3在类风湿关节炎小鼠模型中HClO的检测(下)[39]
Fig.14 Recognition mechanism of probes BC-2 and BC-3 towards HClO (top) and detection of HClO in the mouse model of rheumatoid arthritis with probe BC-3 (bottom)[39]
2023年,Li等[40]设计并合成了一种NIR肝细胞特异性荧光探针MBH-MT,可用于检测生物样本中的HClO(图15)。探针MBH-MT的设计策略是通过将部分黑色素转移到亚甲蓝荧光基团来靶向肝细胞。MBH-MT表现出快速荧光反应(5 s)、高选择性和对HClO(20.4 nmol/L)的敏感性。通过细胞成像实验以及原位成像实验证明,该探针可以区分正常细胞和癌细胞,以及正常肝组织和肝癌组织。此外,如图15所示,对照组未检测到荧光信号。当将探针MBH-MT喷洒在肝癌肿瘤部位时,肝癌肿瘤中观察到强荧光。对小鼠切除的肿瘤也进行荧光成像,未显示荧光信号。因此,MBH-MT可用于早期诊断和指导肝癌手术。
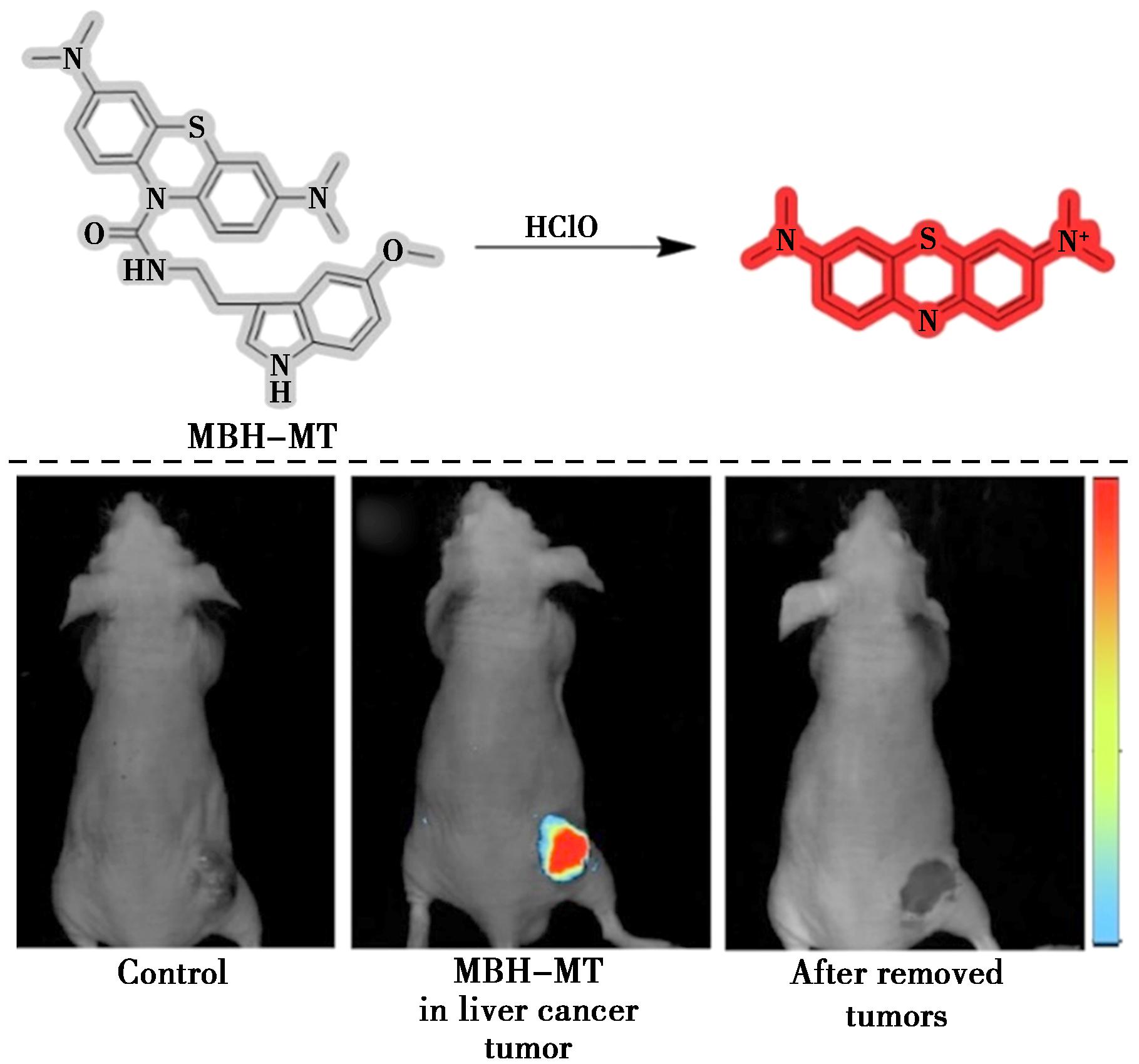
图15 探针MBH-MT对HClO的识别机理(上)及探针MBH-MT在HepG2异种移植瘤小鼠的手术切除成像(下)[40]
Fig.15 Recognition mechanism of probe MBH-MT for HClO (top) and surgical resection imaging of probe MBH-MT in HepG2 xenograft tumour-bearing mice (bottom)[40]
2.2 基于硫代氨基甲酸酯的HClO荧光探针
为了追踪活细胞内的HClO水平,Zeng等[41]设计了一种ICT的小分子荧光探针HTCP-NTC(图16)。该探针将富含氰基的杂环化合物羟基三氰基吡咯(HTCP)作为电子受体,选择苯酚作为电子供体,以苯酚羟基位置修饰的二甲基硫代氨基甲酸酯作为HClO的特异性响应位点。在HClO存在下,HTCP-NTC释放出羟基,由于ICT过程的恢复,羟基发出强荧光,覆盖从可见光到近红外区域的宽波长范围。此外,HTCP-NTC在 18 s内对HClO做出快速响应,可以实时监测细胞内的HClO。该探针表现出202倍的荧光增强,同时伴有较大的斯托克斯位移和低检测限(21.7 μmol/L),为定量分析HClO提供了可靠的基础。在活细胞中的HClO成像中,用HTCP-NTC孵育未处理的RAW 264.7细胞显示较弱的荧光信号。然而,用脂多糖(LPS)/PMA预处理的RAW 264.7细胞的荧光信号比未处理细胞高出约两倍,表明HClO增加。当向未处理和处理过的细胞中添加NAC时,荧光强度显著降低,表明细胞内HClO水平降低。因此,探针HTCP-NTC能够监测内源性活细胞中的HClO水平。
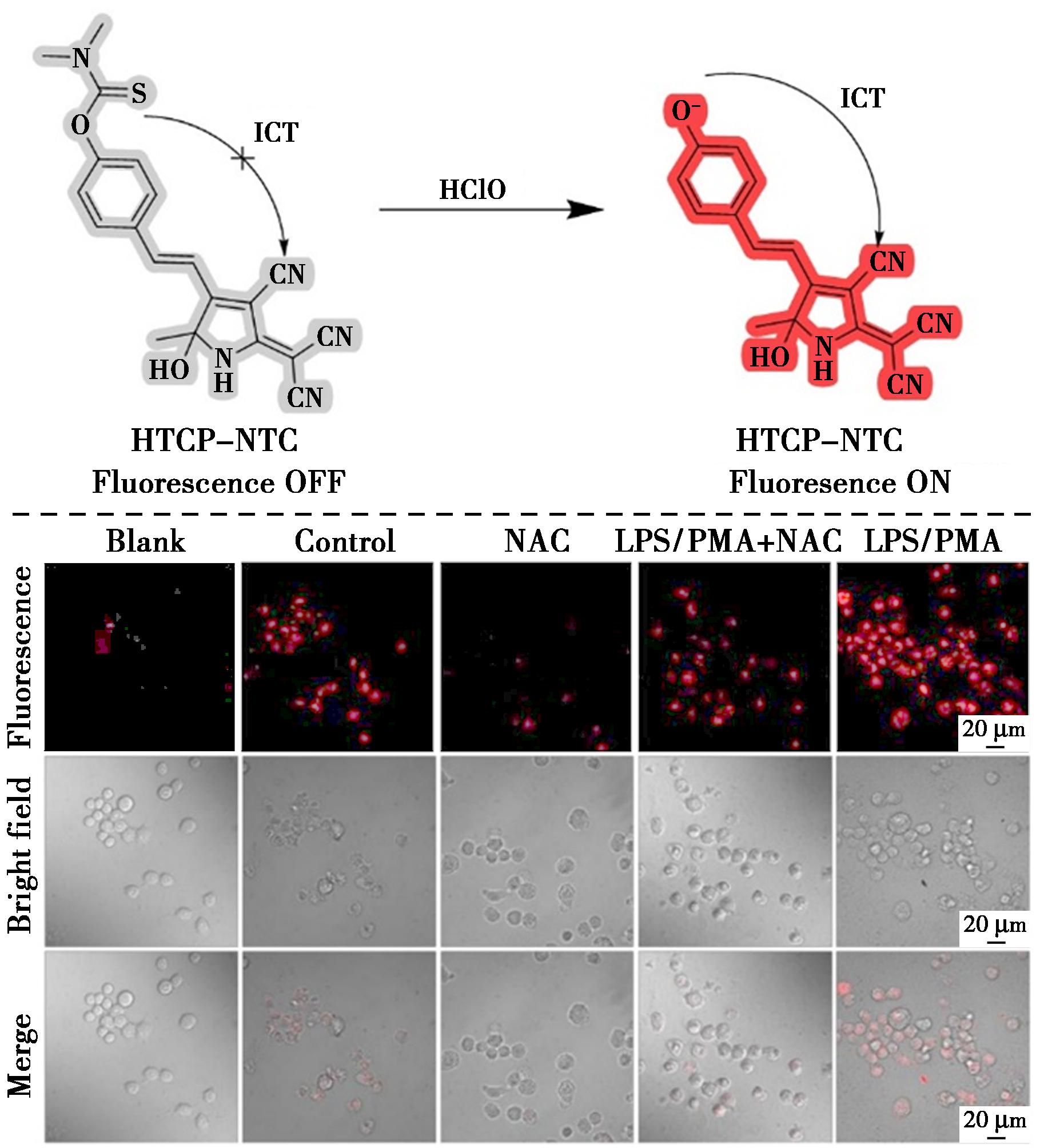
图16 探针HTCP-NTC对HClO的识别机理(上)及活细胞中HClO的荧光成像(下)[41]
Fig.16 Recognition mechanism of probe HTCP-NTC for HClO (top) and fluorescence imaging of HClO in living cells (bottom)[41]
2024年,Lou等[42]开发了一种快速检测HClO的近红外双光子荧光探针(HDM-Cl-HClO)(图17)。该探针可以在5 s内对HClO作出反应并在660 nm处触发亮红色荧光,对HClO表现出很高的特异性和灵敏度。在炎症和肿瘤小鼠模型中,与对照组相比,LPS组显示出明显的荧光信号,表明该探针可用于跟踪炎症小鼠体内HClO的波动。然而,当LPS与硒代半胱氨酸(Sec2)一起孵育时,红色荧光信号迅速减弱,这应归因于Sec2的存在,导致HClO水平降低,因为Sec2是抗氧化剂并有助于对抗细胞氧化应激和维持细胞氧化还原平衡。此外他们还在肿瘤部位观察到了强烈的荧光信号。这些结果表明该探针不仅可以用于监测炎症环境中的HClO水平,还可以用于对肿瘤部位的HClO进行成像。目前,HDM-Cl-HClO已成功实现了对炎症和肿瘤细胞、斑马鱼和小鼠模型组中HClO的追踪,有望成为检测各种疾病模型中HClO水平的可靠工具。
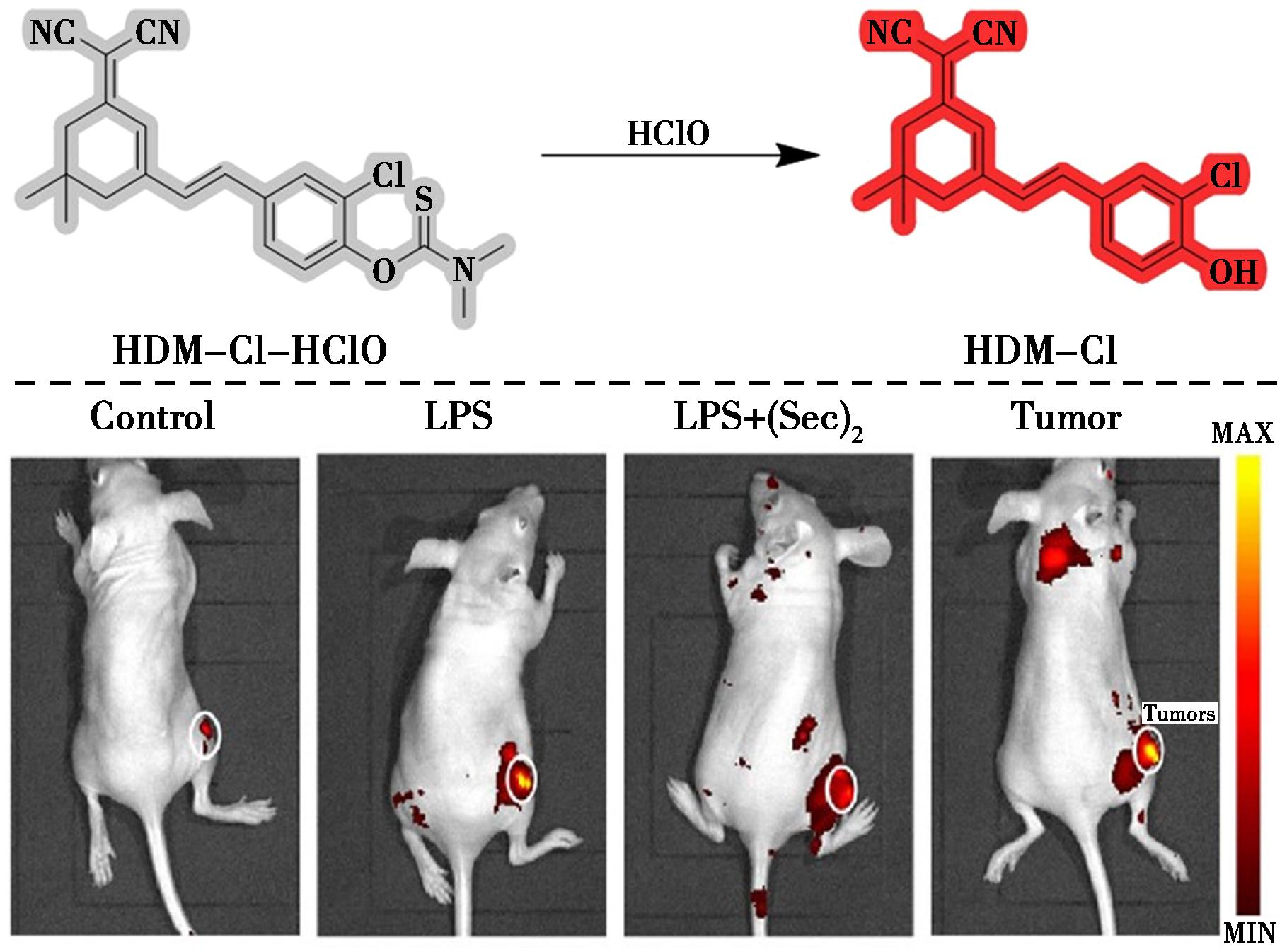
图17 探针HDM-Cl-HClO对HClO的识别机理(上)及小鼠炎症和肿瘤模型中HClO的荧光成像(下)[42]
Fig.17 Recognition mechanism of probe HDM-Cl-HClO for HClO (top) and fluorescence imaging of HClO in mice models of inflammation and tumor (bottom)[42]
瘢痕疙瘩是一种典型的皮肤纤维化疾病,其发病机理与氧化应激状态密切相关[43]。据多项研究表明,瘢痕疙瘩细胞中的活性氧/氮物质水平异常升高,这可能是由细胞环境中某些关键调节因子的异常表达所导致的。为了深入研究瘢痕疙瘩中的HClO水平,Yuan等[44]开发了一种新型的特异性荧光探针Pro-NBS(图18)。该探针的设计原理是将HClO特异性识别基团N,N-二甲基硫代甲酰基与近红外染料尼罗蓝(NB)相结合,并引入自消除基团以提高其特异性。实验结果显示,Pro-NBS对HClO表现出极高的灵敏度和选择性,其检测限低至6 nmol/L,且在1~9 μmol/L的浓度范围内呈现出良好的线性关系。基于这些有希望的结果,Pro-NBS的应用范围以扩展到HClO相关疾病的诊断,例如被用于监测与ROS上调相关的瘢痕疙瘩衍生成纤维细胞。通过靶向转化生长因子β(TGF-β,一种在瘢痕疙瘩发展中起关键作用的细胞因子),Pro-NBS成功地展示了其在监测瘢痕疙瘩进展方面的潜力,这对于疾病的早期诊断具有重要意义。此外,该研究团队还利用植入正常皮肤成纤维细胞(NDF)和瘢痕疙瘩皮肤成纤维细胞的裸鼠模型,评估了Pro-NBS在区分这两种细胞类型方面的能力。实验结果表明,Pro-NBS能够准确地区分NDF细胞和KF细胞,进一步验证了其在瘢痕疙瘩诊断中的独特价值。
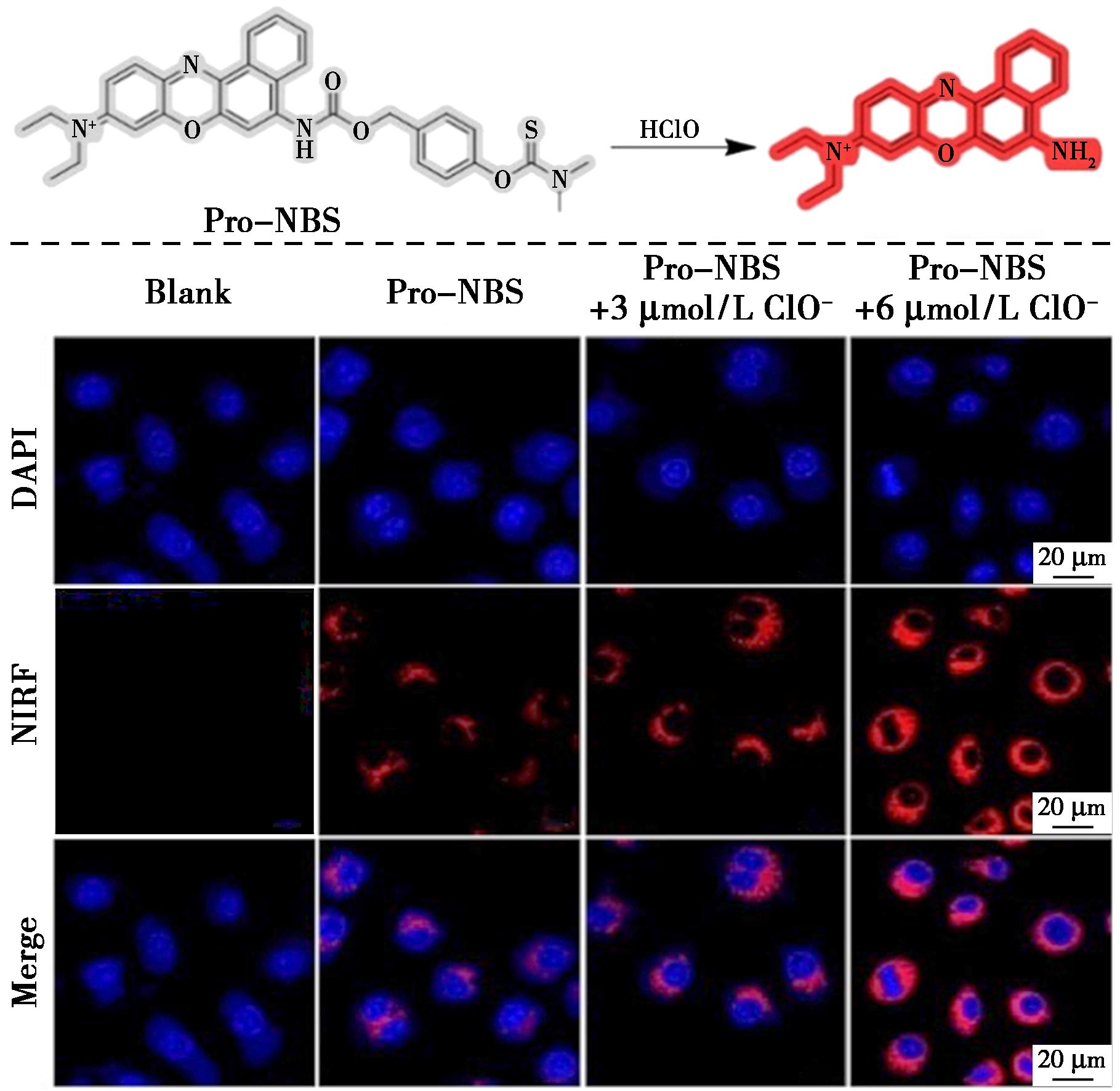
图18 探针Pro-NBS对HClO的识别机理(上)与Pro-NBS孵育后的巨噬细胞共聚焦成像(下)[44]
Fig.18 Recognition mechanism of probe Pro-NBS for HClO (top) and confocal imaging of macrophages after incubation with Pro-NBS (bottom)[44]
2.3 基于硫代吗啉的HClO荧光探针
2021年, wierczyńska等[45]合成了一种新型荧光探针NBD-TM(图19),该探针由7-硝基苯并-2-氧杂-1,3-二唑(NBD)荧光团和硫代吗啉(TM)部分组成,用于选择性检测HClO。TM部分通过PET效应有效猝灭NBD荧光团的发射,在与HClO反应后,TM被氧化为亚砜NBD-TSO并发出绿色荧光。NBD-TM探针具有快速响应、高灵敏度和选择性,且在水溶性和pH适用范围方面表现出色。此外,该探针已成功用于酶系统中的HClO检测,为酶系统中HClO的定量检测提供了新的可能性,同时也可用于监测MPO抑制剂筛选试验中的HClO生成。
wierczyńska等[45]合成了一种新型荧光探针NBD-TM(图19),该探针由7-硝基苯并-2-氧杂-1,3-二唑(NBD)荧光团和硫代吗啉(TM)部分组成,用于选择性检测HClO。TM部分通过PET效应有效猝灭NBD荧光团的发射,在与HClO反应后,TM被氧化为亚砜NBD-TSO并发出绿色荧光。NBD-TM探针具有快速响应、高灵敏度和选择性,且在水溶性和pH适用范围方面表现出色。此外,该探针已成功用于酶系统中的HClO检测,为酶系统中HClO的定量检测提供了新的可能性,同时也可用于监测MPO抑制剂筛选试验中的HClO生成。
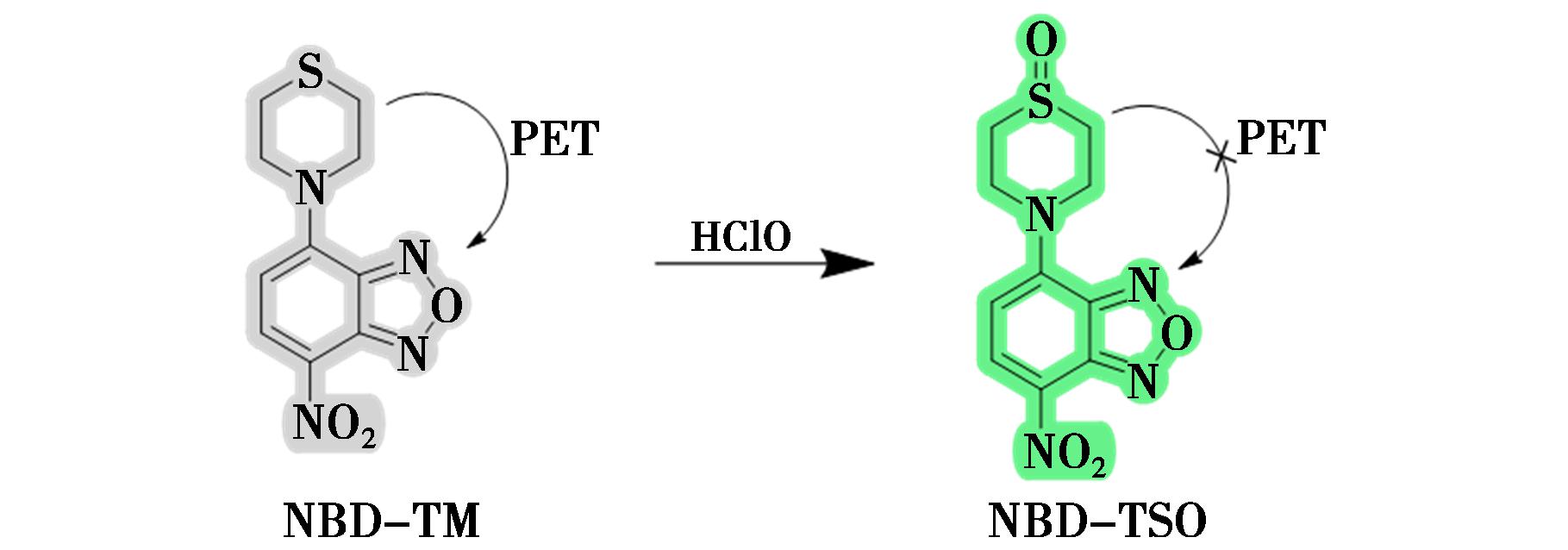
图19 探针NBD-TM对HClO的识别机理[45]
Fig.19 Recognition mechanism of probe NBD-TM for HClO[45]
间隔一年, wierczyńska等[46]又设计了一种新型“开启型”硝基苯并硒二唑基荧光探针(NBD-Se-TM)。该探针可以灵敏、选择性地区分HClO和各种分析物。根据机理研究,该探针的硫代吗啉基团被HClO氧化生成S-氧化物(NBD-Se-TSO)(图20)。在pH从6.0~8.5的范围内,荧光强度仅有微不足道的变化,表明该探针也相对稳定。
wierczyńska等[46]又设计了一种新型“开启型”硝基苯并硒二唑基荧光探针(NBD-Se-TM)。该探针可以灵敏、选择性地区分HClO和各种分析物。根据机理研究,该探针的硫代吗啉基团被HClO氧化生成S-氧化物(NBD-Se-TSO)(图20)。在pH从6.0~8.5的范围内,荧光强度仅有微不足道的变化,表明该探针也相对稳定。
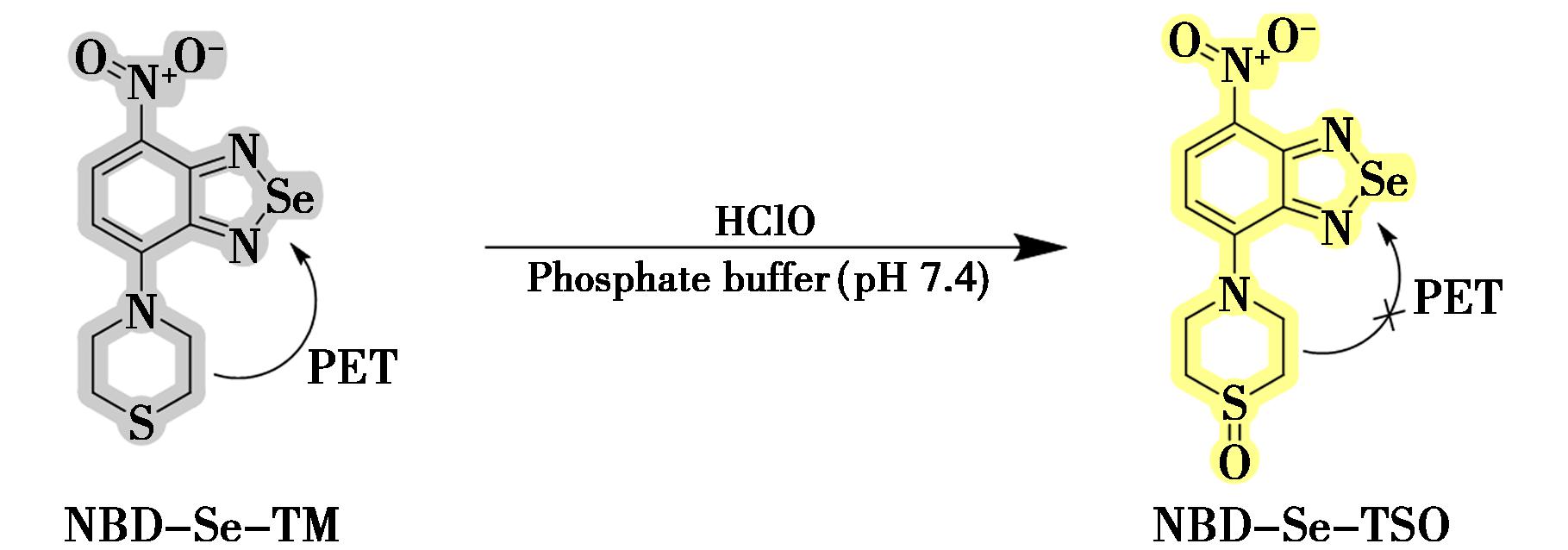
图20 探针NBD-Se-TM对HClO的识别机理[46]
Fig.20 Recognition mechanism of probe NBD-Se-TM for HClO[46]
扭曲分子内电荷转移(TICT)激发态的形成是一个光物理过程,会显著影响荧光量子产率,抑制TICT的发生,能够提高荧光强度。最近的研究表明,含有氨基辅助发色团的荧光分子在极性溶剂中更容易形成非荧光的TICT状态,而氨基辅助发色团电离电位的提高有效地抑制了TICT状态的发生。因此,Shao等[47]研究开发了一种新型荧光探针BCy-S,该探针基于新的苯并半菁荧光团和含有氨基辅助发色团的硫代吗啉基团作为次氯酸的特异性识别部分,能够快速灵敏地检测水溶液中的HClO(图21)。该探针表现出对HClO的高选择性、快速动力学(<40 s)、大斯托克斯位移(约170 nm)和低检测限(35.2 nmol/L)等特点,这些特点源于HClO与探针中硫原子的特定氧化反应。此外,BCy-S成功应用于生物成像实验中,能够实时荧光可视化活体HeLa细胞和斑马鱼中的HClO,为研究HClO的生理功能及其在疾病中的病理作用提供了一种新工具。
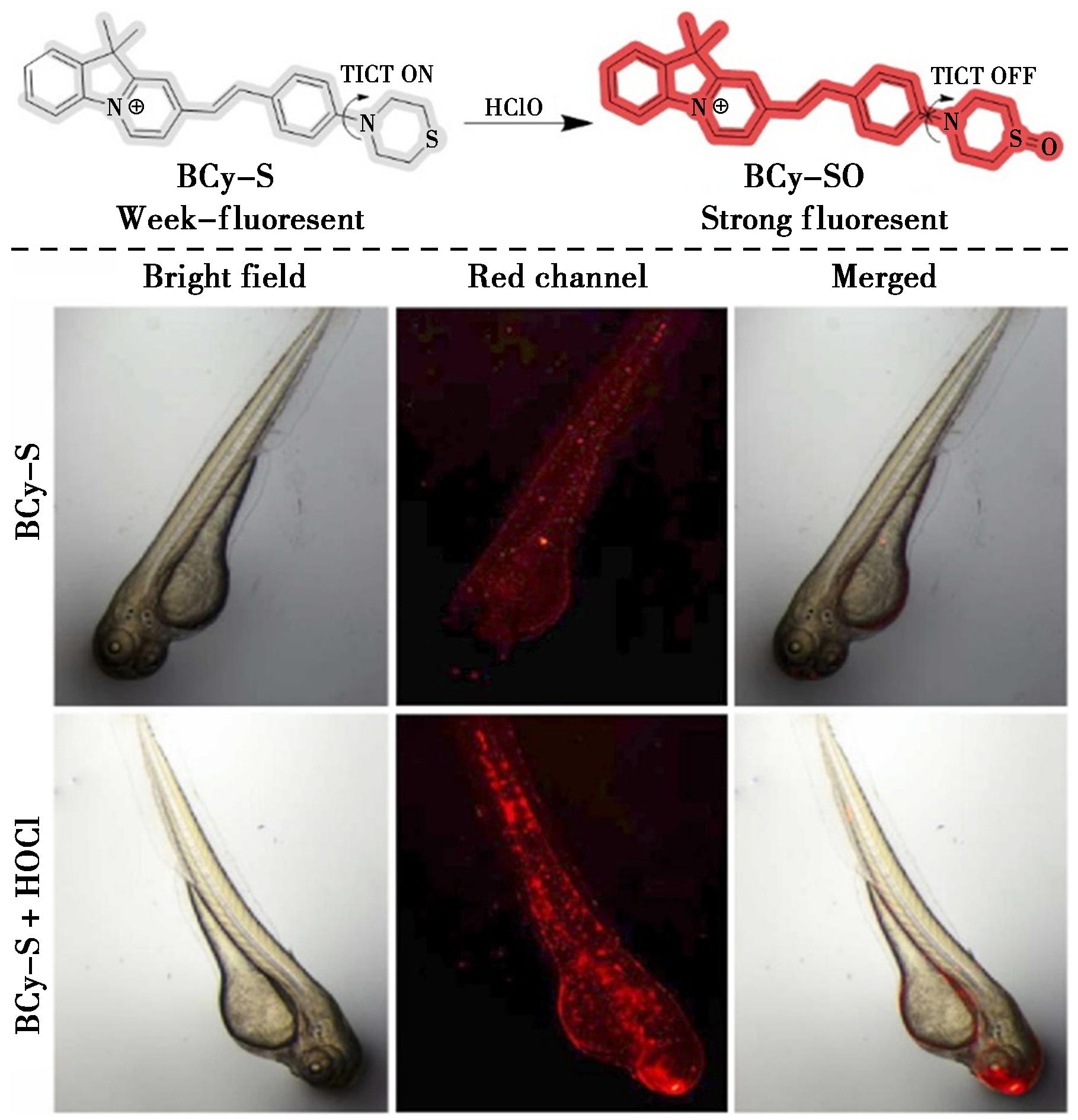
图21 探针BCy-S对HClO的识别机理(上)及斑马鱼荧光成像(下)[47]
Fig.21 Recognition mechanism of probe BCy-S for HClO (top) and fluorescent imaging in zebrafish (bottom)[47]
3 ONOO-荧光探针
作为ROS家族的一员,ONOO-具有很强的氧化和硝化能力,在细胞信号转导和稳态调节中起重要作用[48]。ONOO-可以破坏许多重要的生物分子(如核酸、蛋白质和脂质)[49-53],是许多疾病的重要诱发因素,包括心血管疾病、神经退行性疾病、炎症性疾病和癌症。因此,精确检测ONOO-对于探索其生理和病理功能至关重要[54-58]。
3.1 基于硼酸酯的ONOO-荧光探针
2019年,Li等[59]开发了一种ONOO-可激活的第二近红外窗口(NIR-Ⅱ)分子探针,用于药物诱导的肝毒性监测,该探针基于NIR-Ⅱ荧光开启苯并硫代吡喃菁骨架和苯基硼酸酯的融合(图22)。在ONOO-存在下,探针IRBTP-B可以通过产生其荧光团IRBTP-O来开启其NIR-Ⅱ荧光,并对ONOO-显示出良好的线性响应。组织幻像研究证实可以在高达5 mm的穿透深度处获得可靠的激活信号。对于体内成像,对照组小鼠肝脏中获得了微弱的荧光信号,这意味着在正常条件下ONOO水平的产生很少。相反,在注射对乙酰氨基酚(APAP)时,小鼠肝脏的荧光强度随时间逐渐增加,并在注射IRBTP-B 15 min后达到最大值,表明药物治疗后ONOO-的产生增加。该探针揭示了临床前药物诱导的肝损伤模型中ONOO-的上调以及体内NAC的修复。
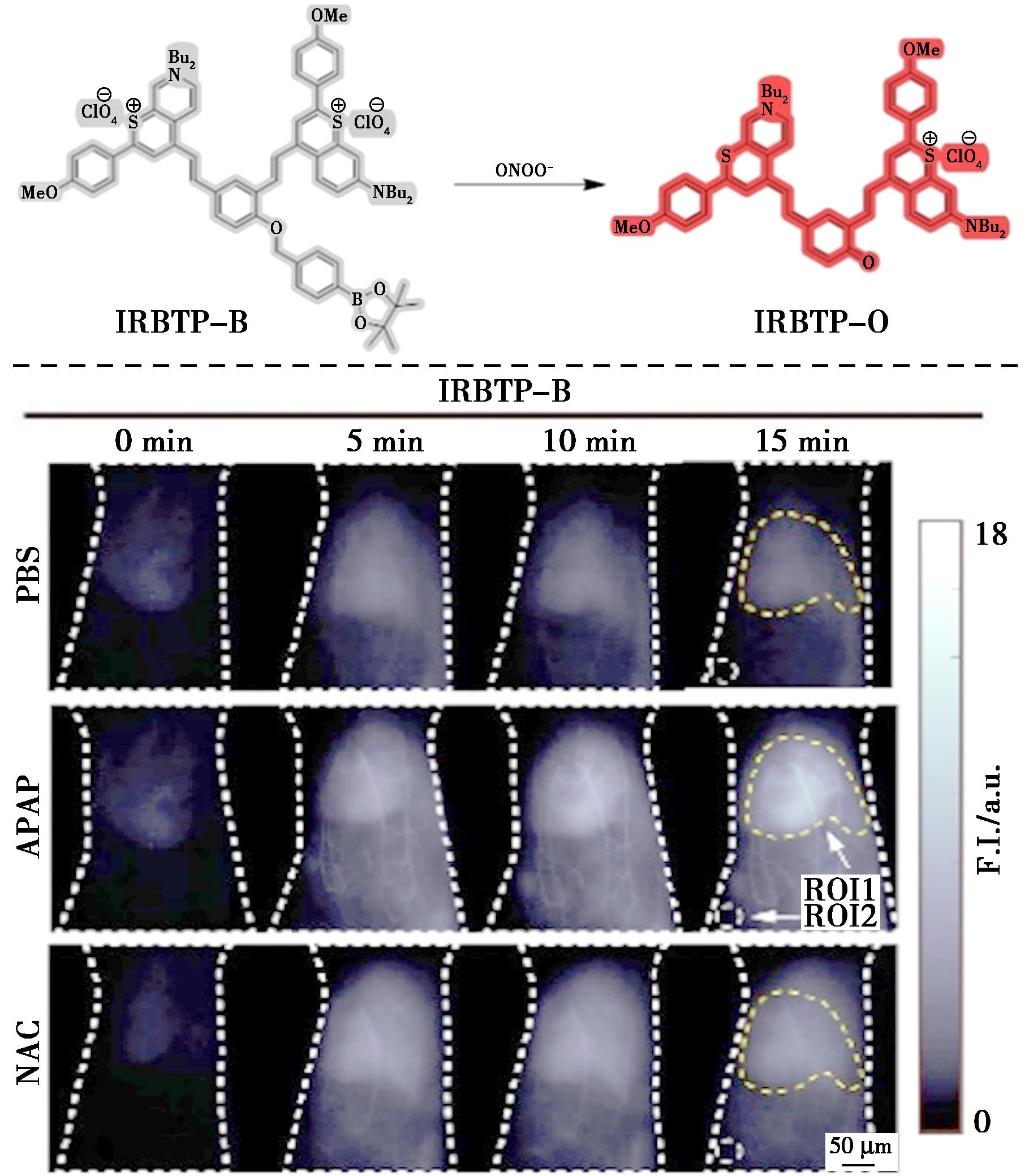
图22 探针IRBTP-B对ONOO-的识别机理(上)及在APAP诱导的IRBTP-B肝毒性过程中小鼠肝脏中内源性ONOO-的体内成像(下)[59]
Fig.22 Recognition mechanism of probe IRBTP-B for ONOO- (top) and in vivo imaging of endogenous ONOO- in the livers of mice during an APAP-induced hepatotoxicity by IRBTP-B (bottom)[59]
聚集诱导发射(AIE)荧光团与传统的聚集诱导淬灭(ACQ)荧光团不同,它在分散状态下不显示荧光信号或非常弱的荧光信号,但它们在聚集状态下显示强荧光信号。因此,开发一种具有AIE特性的ONOO-探针,实时监测高尔基体中的ONOO-水平,对了解高尔基体的生物学功能和病理过程非常必要。Li等[60]设计并合成了首个可靶向高尔基体识别ONOO-的AIE荧光探针Gol-ONOO-(图23)。该探针以喹啉丙二腈为荧光团,苯磺酰胺为靶向基团,硼酸盐为识别位点,具有即时响应、高选择性、低检测限(250 nmol/L)和大斯托克斯位移(180 nm)的优点。Gol-ONOO-不仅成功识别了HeLa细胞中的内源性和外源性ONOO-,还首次实现了高尔基体中ONOO-水平的实时成像,监测到莫能菌素诱导的氧化应激引起的高尔基体中ONOO-水平升高。
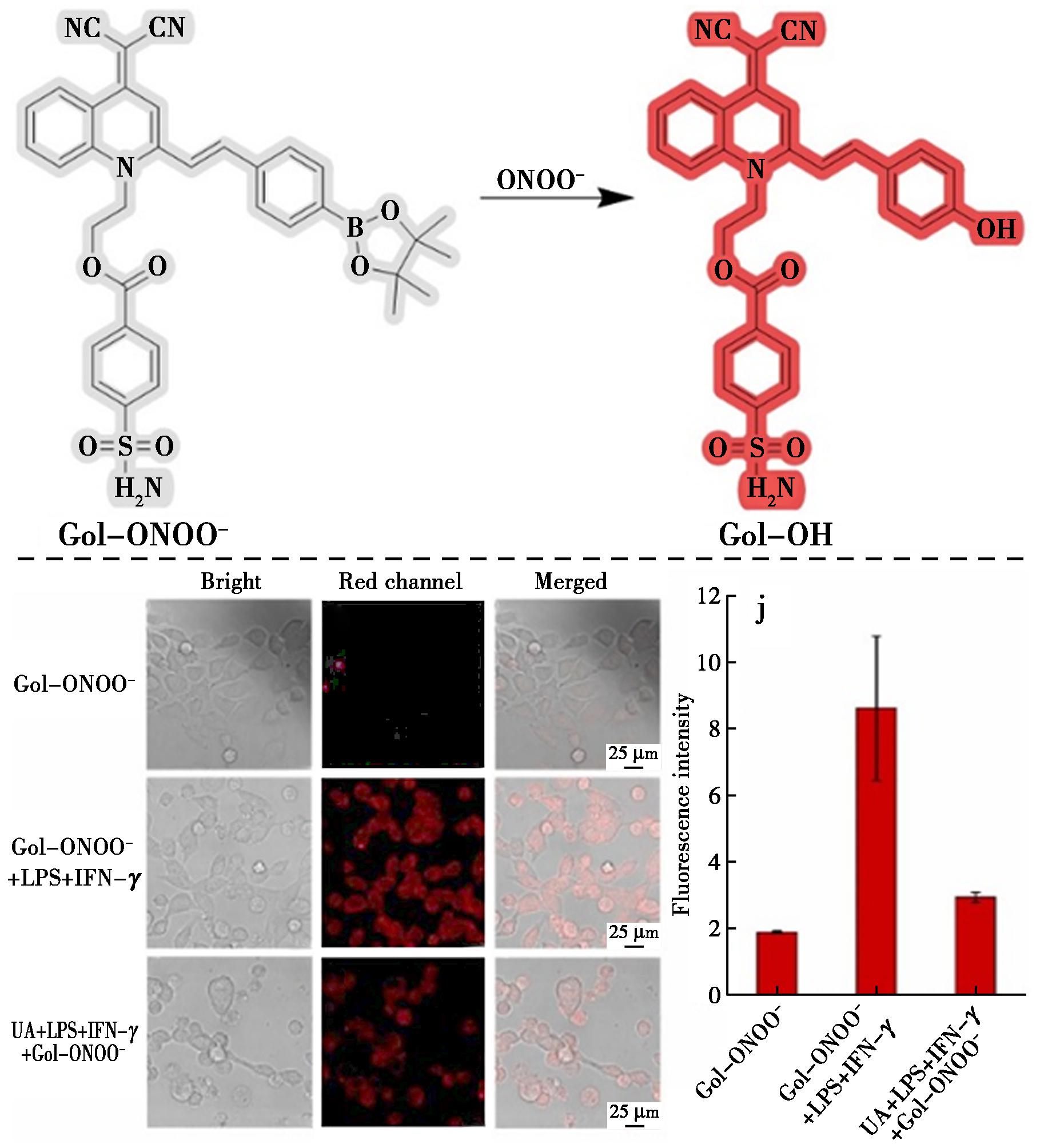
图23 探针Gol-ONOO-对ONOO-的识别机理(上)及内源性ONOO-的细胞成像(下)[60]
Fig.23 Recognition mechanism of probe Gol-ONOO- for ONOO- (top) and cell imaging for endogenous ONOO-(bottom)[60]
Han等[61]设计并合成了一种名为PTZ-H的双响应比率荧光探针,能够高灵敏度和选择性地以比率方式分别或同时检测和成像HClO和ONOO-。在该探针中,选择吩噻嗪基香豆素部分作为HClO响应荧光片段,并使用2-(苯并[d]噻唑-2-基)苯胺的前体作为ONOO-的传感器(图24)。PTZ-H探针在HClO存在下发出绿色通道荧光,在ONOO-存在下发出蓝色通道荧光,实现了对这两种离子的特异性识别和比率定量,检测限分别低至17和21 nmol/L。此外,该探针已成功应用于活体RAW 264.7细胞和斑马鱼中外源性和内源性HClO和ONOO-的成像,展现出其在解读生物活动中HClO和ONOO-分布和相关性方面的潜力。
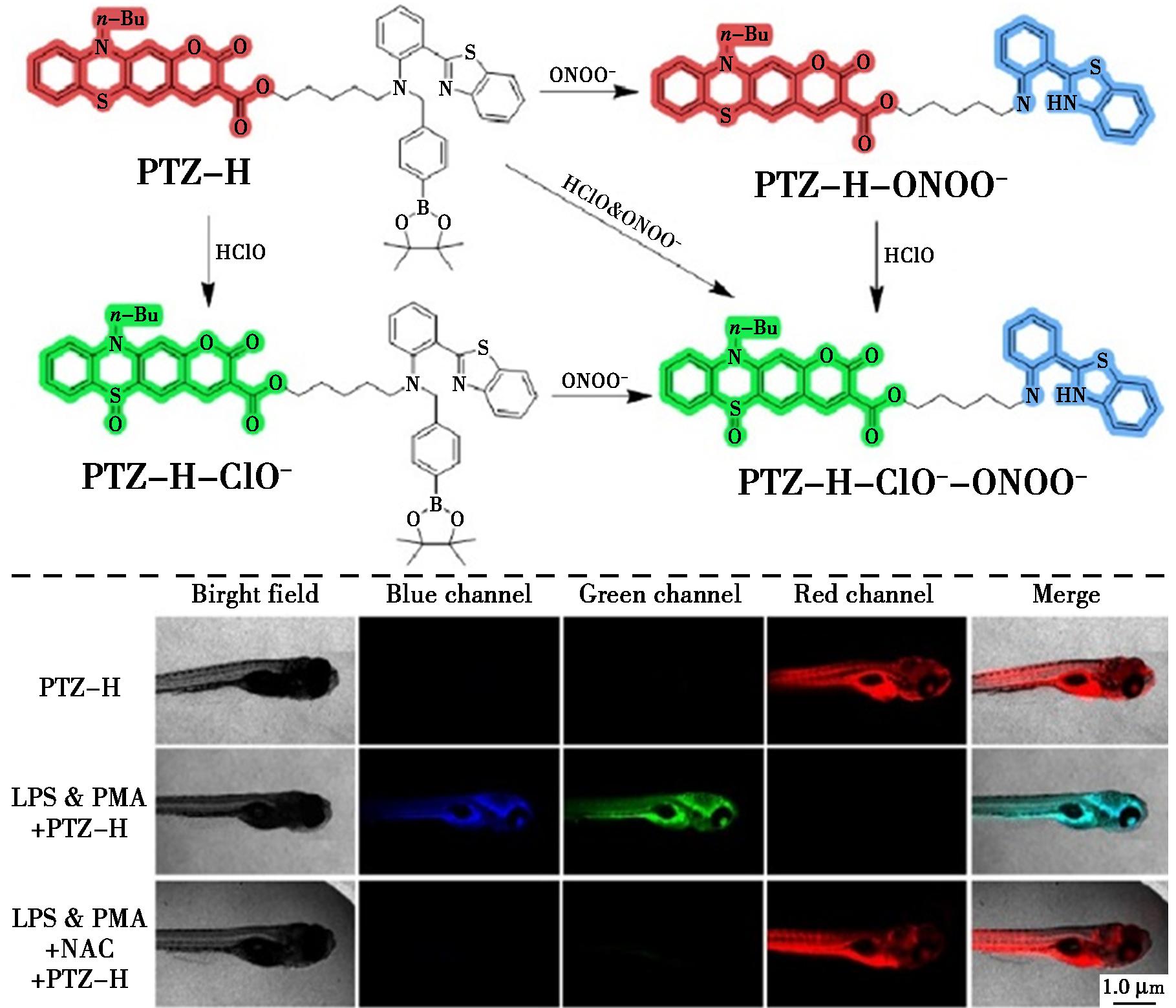
图24 探针PTZ-H对ONOO-的识别机理(上)及LPS和PMA诱导的炎症斑马鱼的荧光成像(下)[61]
Fig.24 Recognition mechanism of probe PTZ-H for ONOO- (top) and fluorescence imaging of the LPS and PMA-induced inflammatory zebrafish (bottom)[61]
2023年,Huang等[62]设计合成了一种多功能荧光探针DPB,该探针可用于区分线粒体中的极性、粘度和ONOO-(图25)。DPB探针由二乙胺基团、香豆素、吡啶阳离子和苯硼酸酯组成,其中带正电荷的吡啶基团负责靶向线粒体。D-π-A结构具有强ICT和TICT特性,可响应极性和粘度。氰基和苯基硼酸酯的引入则增加了DPB探针中C![]() C的亲电性,导致其被ONOO-氧化水解,最终导致荧光开关。在低极性条件下,ICT效应增强,香豆素部分呈现局部激发态,导致蓝移和发射增加。在高极性介质中,DPB探针在470 nm处产生弱而长的荧光。同时,在658 nm处,DPB的荧光强度与粘度成正比,与ONOO-浓度成反比。此外,该探针不仅可成功用于监测线粒体的极性、粘度和内源性/外源性ONOO-水平波动,而且还可通过多种参数区分癌细胞和正常细胞。
C的亲电性,导致其被ONOO-氧化水解,最终导致荧光开关。在低极性条件下,ICT效应增强,香豆素部分呈现局部激发态,导致蓝移和发射增加。在高极性介质中,DPB探针在470 nm处产生弱而长的荧光。同时,在658 nm处,DPB的荧光强度与粘度成正比,与ONOO-浓度成反比。此外,该探针不仅可成功用于监测线粒体的极性、粘度和内源性/外源性ONOO-水平波动,而且还可通过多种参数区分癌细胞和正常细胞。
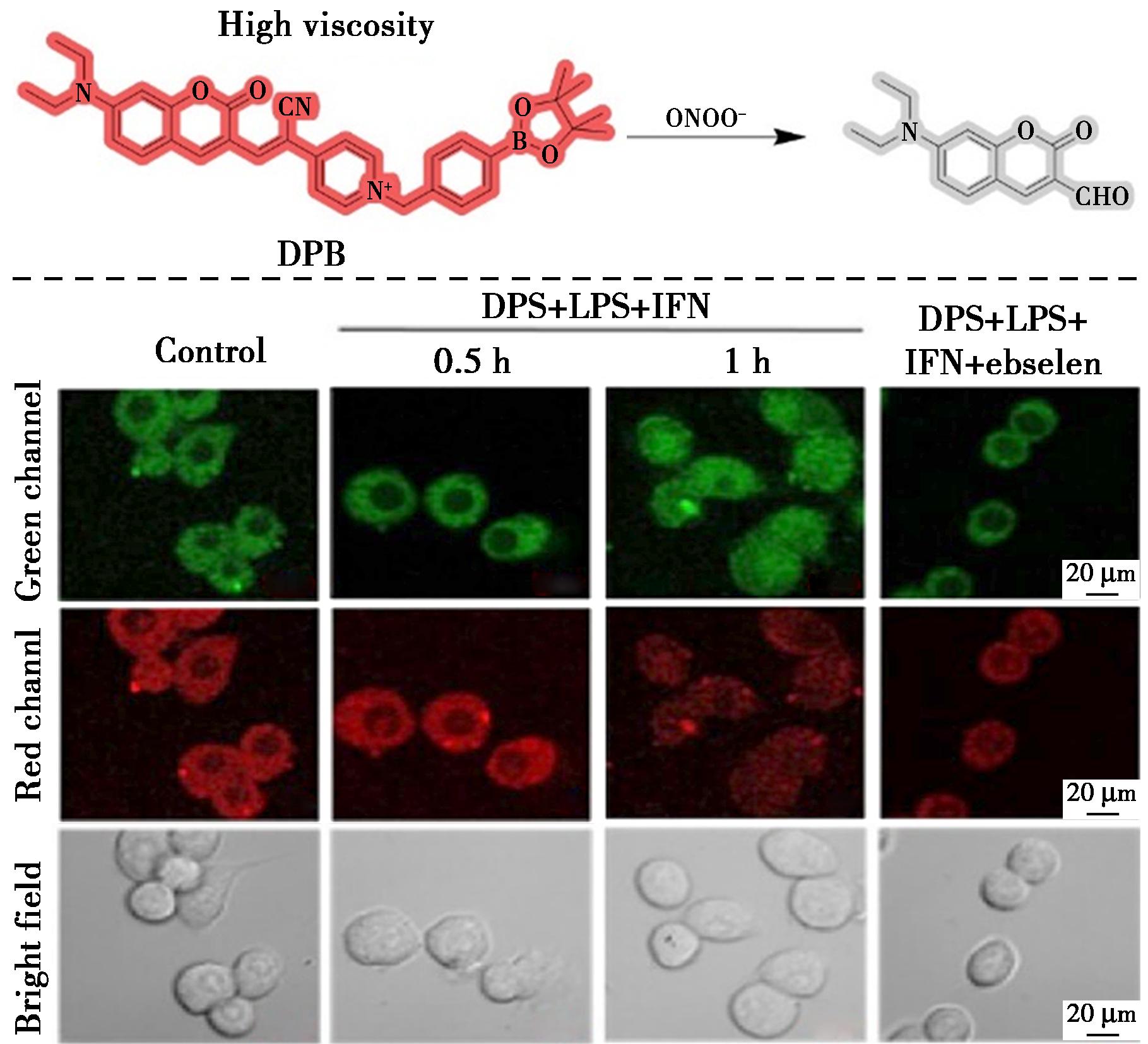
图25 探针DPB对ONOO-的识别机理(上)及RAW 264.7细胞内源性ONOO-的荧光成像(下)[62]
Fig.25 Recognition mechanism of probe DPB for ONOO- (top) and fluorescence imaging of endogenous ONOO- in RAW 264.7 cells (bottom)[62]
3.2 基于靛蓝的ONOO-荧光探针
DHQ-Rd-PN是一种可激活的双光子近红外(TP-NIR)荧光探针,可用于实体瘤中ONOO-的体内成像(图26)[63]。该探针利用二胺化取代的Rhodol荧光团作为新型近红外发射双光子荧光团,并使用优化的靛蓝衍生物基团作为ONOO-的特定识别域。它与ONOO-反应迅速,表现出选择性特异性、高灵敏度和低检测限(72 nmol/L)。此外,它在pH 3~10的条件下保持稳定的荧光响应性能。DHQ-Rd-PN不仅在溶液中表现出优异的ONOO-近红外检测性能,还可用于活细胞中内源性和外源性ONOO-的TP-NIR成像检测。探针可以选择性地在斑马鱼胰腺中积累,并且在3-吗啉代亚胺盐酸盐(SIN-1,ONOO-供体)存在下能够在体内监测斑马鱼幼体胰腺中的ONOO-水平。值得一提的是,该探针利用双光子激发特性和近红外发射特性,首次实现了肿瘤发生发展过程中ONOO-的无创活体成像,为肿瘤内ONOO-的检测提供了一种无创、高效的方法,有望在肿瘤诊断和治疗中得到更广泛的应用。
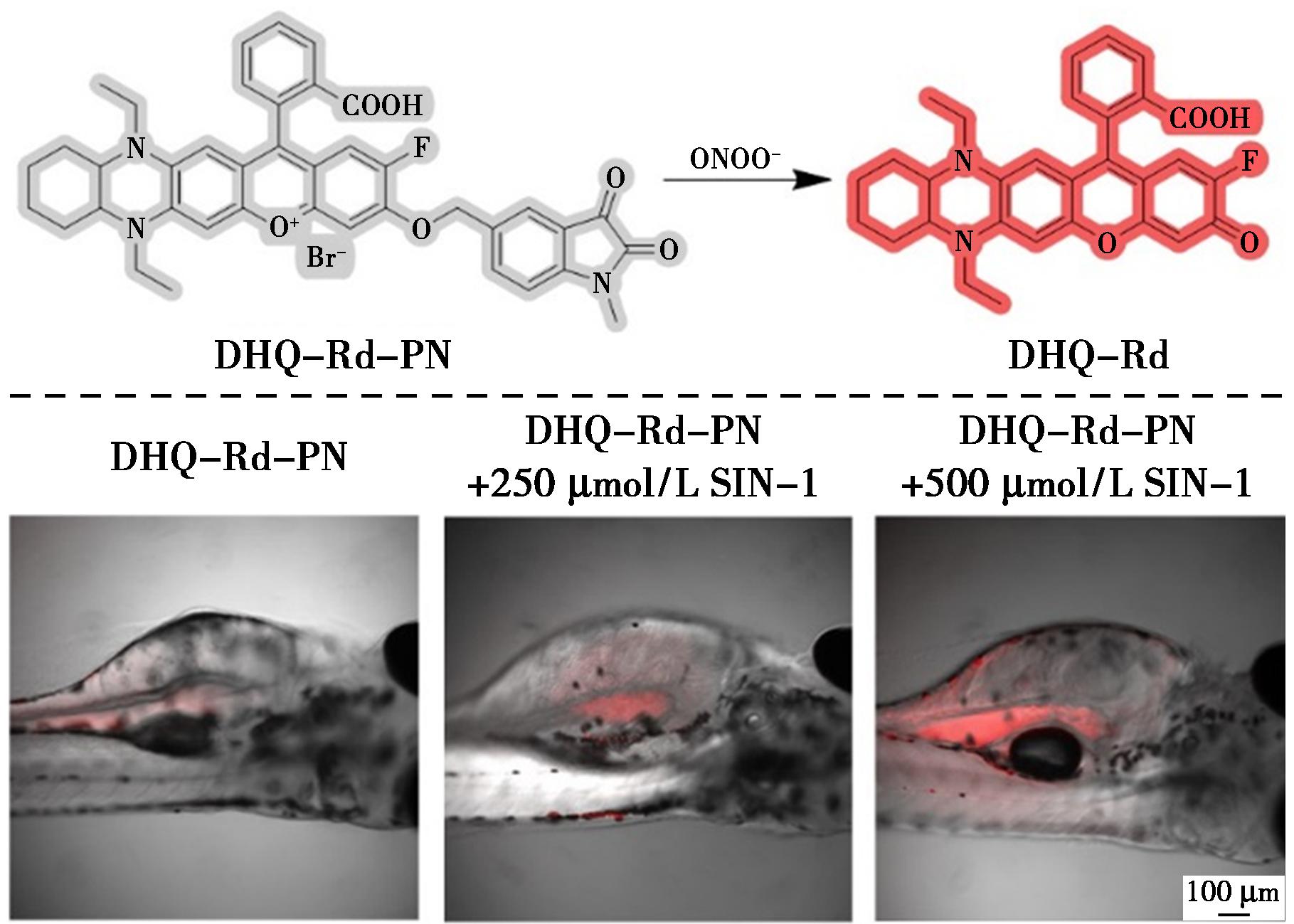
图26 探针DHQ-Rd-PN对ONOO-的识别机理(上)及斑马鱼幼体中ONOO-的双光子体内成像(下)[63]
Fig.26 Recognition mechanism of probe DHQ-Rd-PN for ONOO- (top) and two-photon in vivo imaging of ONOO-in zebrafish larvae (bottom)[63]
Gong等[64]制备了一种高灵敏度和快速响应的近红外探针Rd700-PN,用于探索ONOO-与细胞焦亡之间的关系(图27)。探针Rd700-PN表现出卓越的选择性、灵敏度和pH稳定性,能够对ONOO-快速响应,同时表现出近红外发射(λem=702 nm)。Rd700-PN在细胞焦亡过程中检测到ONOO-的波动,并且能够在体内检测到化疗药物诱导肿瘤细胞焦亡的能力。
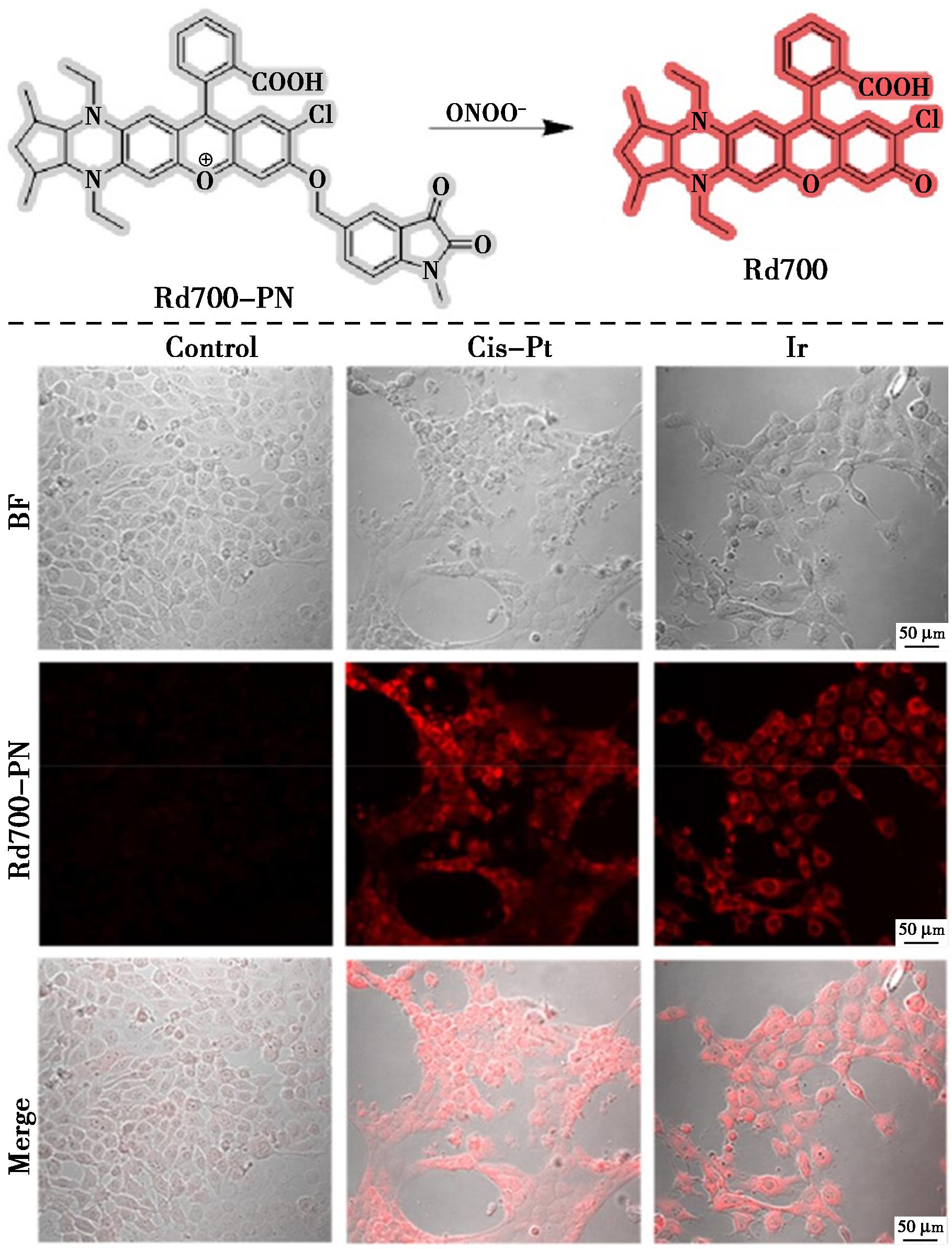
图27 探针Rd700-PN对ONOO-的识别机理(上)及在药物诱导的4T1细胞焦亡过程中对细胞内ONOO-的荧光成像(下)[64]
Fig.27 Recognition mechanism of probe Rd700-PN for ONOO- (top) and fluorescence imaging of intracellular ONOO- during drug-induced pyroptosis in 4T1 cells (bottom)[64]
3.3 基于酰肼ONOO-荧光探针
Feng等[65]设计了一种基于香豆素-半罗丹明杂化结构的双通道近红外荧光探针CS-ONOO(图28),用于检测ONOO-。该探针结合了半罗丹明和香豆素荧光团的特点,在近红外区域(700 nm)和可见光区域(515 nm)具有双发射波长。在ONOO-存在下,探针在515 nm处的荧光强度显著下降,而在700 nm处的荧光强度显著增加,实现了从绿色到红色的发射颜色变化。该探针表现出对ONOO-的高选择性和灵敏度,检测限低至59 nmol/L,且响应迅速。此外,探针已成功应用于活细胞中外源性和内源性ONOO-的生物成像,以及小鼠体内ONOO-的检测。凭借其优异的性能和双通道荧光变化,该探针在体外和体内检测ONOO-方面展现出巨大的潜力,成为研究ONOO-的有用成像工具。
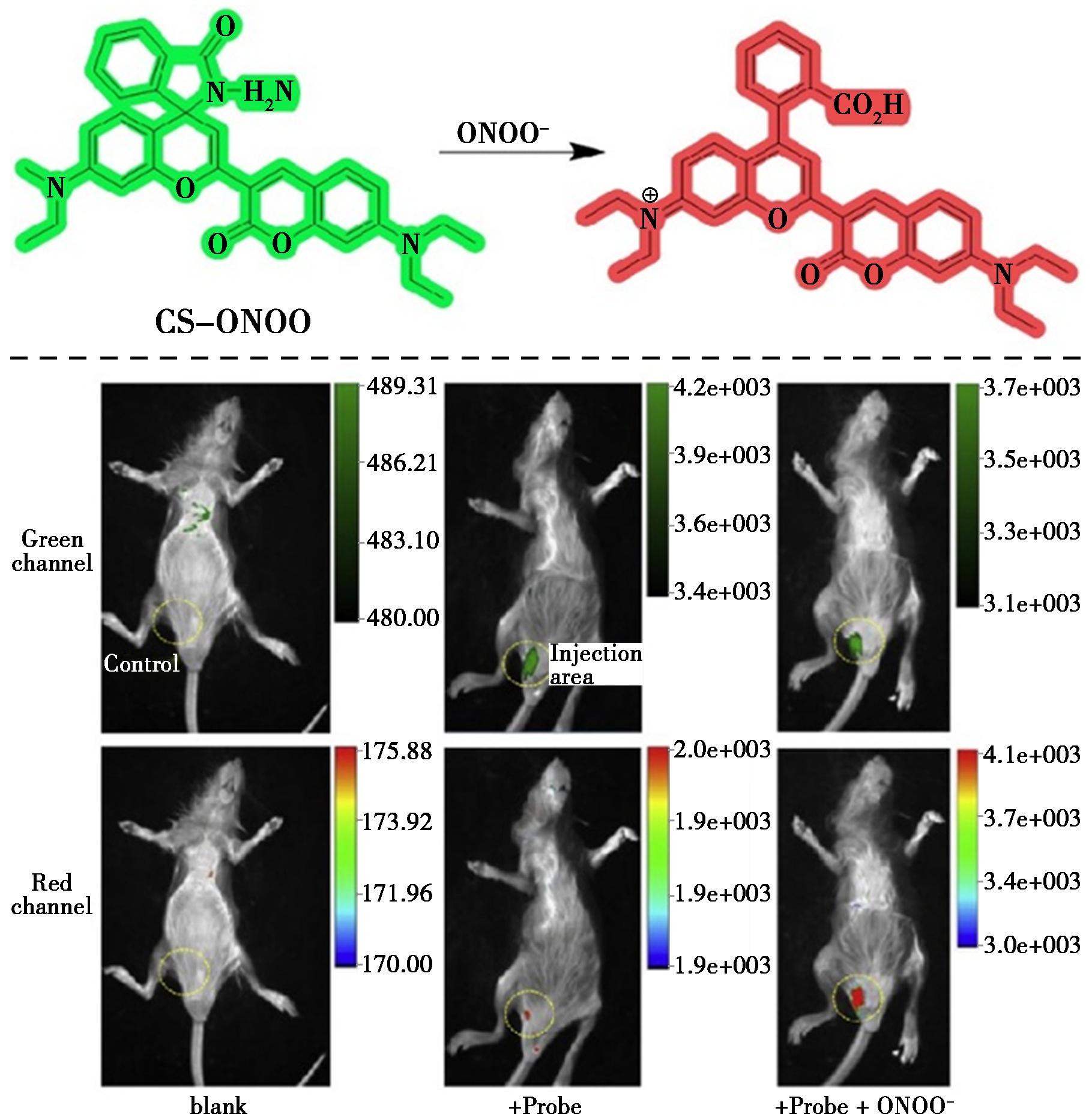
图28 探针CS-ONOO对ONOO-的识别机理(上)及活体小鼠中ONOO-的成像(下)[65]
Fig.28 Recognition mechanism of probe CS-ONOO for ONOO- (top) and imaging of ONOO- in living mice (bottom)[65]
2021年,Mao等[66]报道了一种基于扩展传统罗丹明π-共轭体系开发的双光子激发近红外荧光探针NIR-ONOO(图29),该探针具有近红外发射(610~800 nm)和双光子吸收截面,对过氧亚硝基阴离子(ONOO-)表现出高选择性和高灵敏度,检测线性范围宽(5.0×10-8~1.0×10-5 mol/L),检测限低(15 nmol/L),荧光增强显著(340倍)。NIR-ONOO已成功应用于细胞及炎症小鼠体内ONOO-的监测与成像,展现出低自发荧光、稳定持久的荧光和深穿透(204 μm)等优异性能,是一种强大的化学工具,可用于ONOO-成像和检测药物诱导的肝毒性。
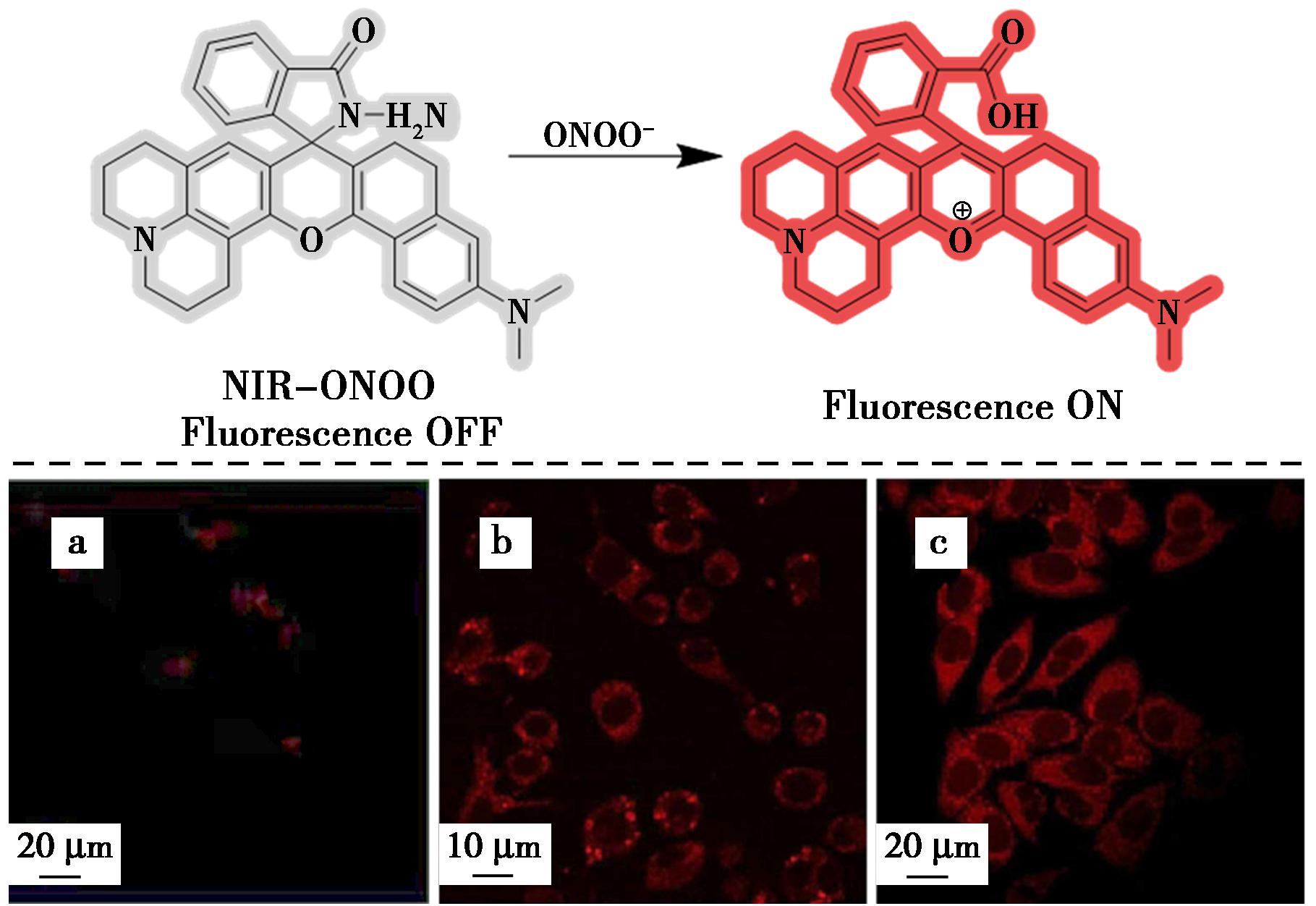
图29 探针NIR-ONOO对ONOO-的识别机理(上)及活细胞中外源性和内源性ONOO-的双光子荧光成像(下)[66]
Fig.29 Recognition mechanism of probe NIR-ONOO for ONOO- (top) and two-photon fluorescence imaging of exogenous and endogenous ONOO- in living cells (bottom)[66]
Huang等[67]报道了一种荧光探针CB2-H的开发,用于同时检测HClO和ONOO-(图30)。该探针由香豆素-苯并吡喃(CB)二元体构成。由于大量共轭结构的中断和分子内PET效应,螺环化探针CB2-H几乎没有近红外荧光信号,而ONOO-可以选择性地氧化CB2-H的肼部分,得到CB2。CB2-H在两个通道中对HClO和ONOO-的检测具有荧光信号间隔大、选择性好、响应快、灵敏度高的优点,并已成功用于不同刺激下的细胞和斑马鱼。该探针为进一步研究HClO和ONOO-在各种生物系统中的分布和关系提供了有价值的工具。
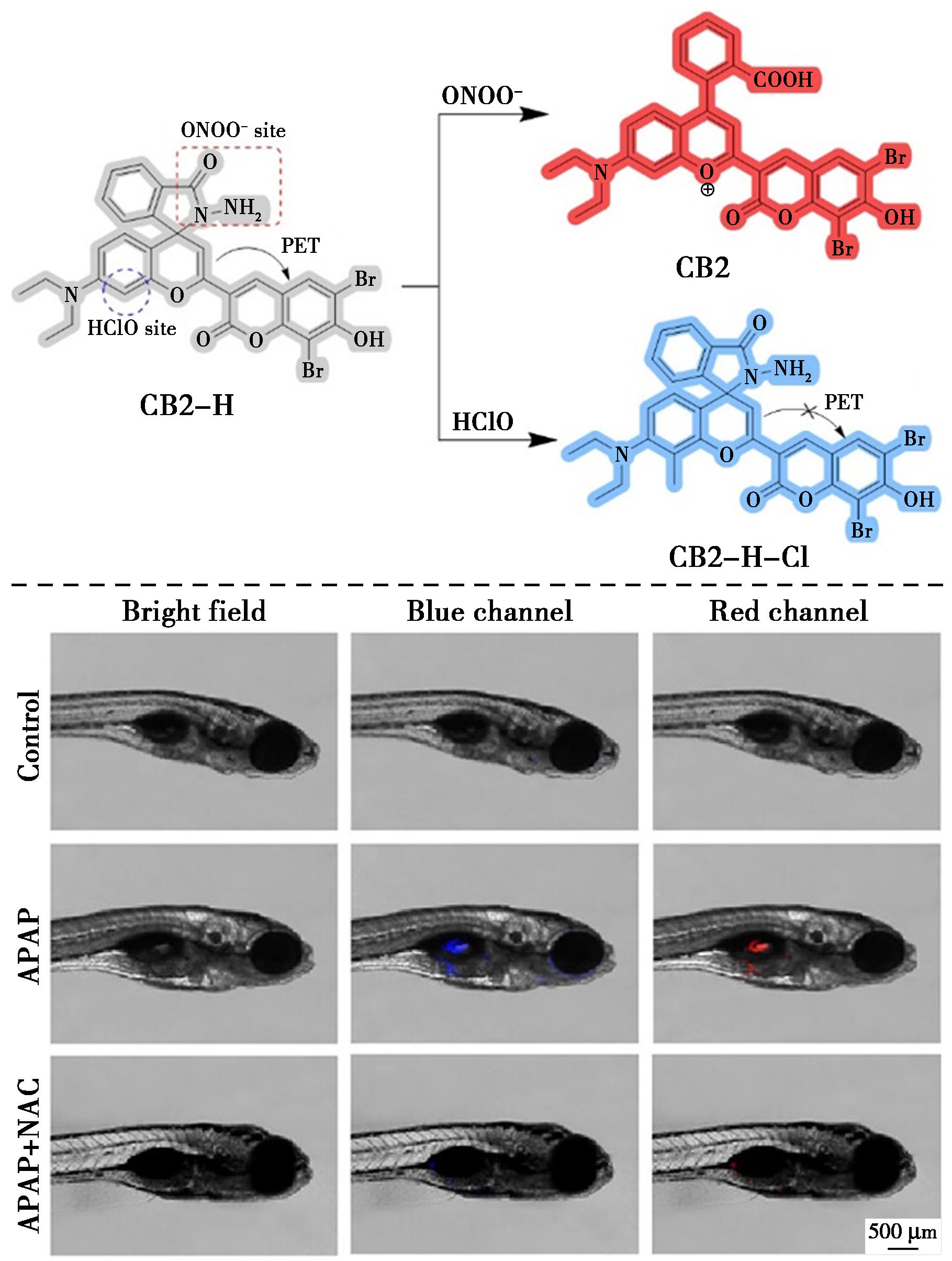
图30 探针CB2-H对ONOO-的识别机理(上)及斑马鱼中APAP诱导产生ONOO-的荧光成像(下)[67]
Fig.30 Recognition mechanism of probe CB2-H for ONOO- (top) and fluorescence imaging of APAP-induced production of ONOO- in zebrafish (bottom)[67]
4 总结与展望
本文概述了用于监测ROS的小分子荧光探针的最新发展。除了探索它们的应用外,还专注于这些荧光探针的设计、合成和特性。很明显,ROS荧光探针开发取得的进步有助于揭示ROS在生物体中发挥的重要作用。目前对ROS在各种生理和病理逻辑生命系统中的详细功能的理解仍处于早期阶段,还有更多有待探索。尽管使用有机荧光探针研究生物ROS取得了显着进展,但ROS的多种功能在很大程度上仍未被探索。未来,将进行进一步的研究和创新,以创造具有更高响应灵敏度、快速反应速率或器官兼容性更好的新一代ROS荧光探针,为ROS相关研究提供更有效的技术工具,加速药物筛选、疾病诊断和癌症治疗的实际应用,从而为生物医学领域做出重大贡献。
[1]Toyokuni S.Pathol.Int.,2016,66(5):245-259.
[2]Sies H.Redox Biol.,2015,4:180-183.
[3]Kazumura K,Takeuchi K,Hara A,Miwa T,Hattori M,Kondo F,Morishita N,Tsuchiya H,Osawa T.Sci.Rep.,2021,11(1):14 545.
[4]Chami B,Martin N J,Dennis J M,Witting P K.Arch.Biochem.,2018,645:61-71.
[5]Glennon A,Hackett A P,Chapman E A,Wright H L.Free Radic.Biol.Med.,2018,125:25-35.
[6]Hoffmann M H,Griffiths H R.Free Radic.Biol.Med.,2018,125:62-71.
[7]Wen X,Wu J,Wang F,Liu B,Huang C,Wei Y.Free Radic.Biol.Med.,2013,65:402-410.
[8]Zhang X W,Zhang F.Anal.Lab.,2024,43(6):871-875.张晓文,张飞.分析试验室,2024,43(6):871-875.
[9]Winterbourn C C.Biochim.Biophys.Acta,2014,1840(2):730-738.
[10]Wang H S.TrAC Trends Anal.Chem.,2016,85:181-202.
[11]Brieger K,Schiavone S,Francis J,Miller J,Krause-heinz K.Swiss Med.Wkly.,2012,142(3 334):13 659.
[12]Adegoke O,Forbes P B.Anal.Chim.Acta,2015,862:1-13.
[13]Wang D,Qiu S,Wang W,Pan S,Ma H,Zou J.Spectrochim.Acta A Mol.Biomol.Spectros.,2019,221:117 138.
[14]Yu Z,Zhang J,Chen J,Zhao L,Yu D,Liu L,Dong S.Anal.Chem.,2023,95(9):4 261-4 265.
[15]Lou C,Chen Y,Gu J,Cai H,Lin H,Jin Z,Huang C.Anal.Chem.,2024,96(24):9 969-9 974.
[16]Yao J,Li L,Xu J X,Liu Y H,Shi J,Yu X Q,Kong Q,Li K.Anal.Chem.,2024,96(18):7 082-7 090.
[17]Wang S,Li N,Pan W,Tang B.TrAC Trends Anal.Chem.,2012,39:3-37.
[18]Song X,Bai S,He N,Wang R,Xing Y,Lv C,Yu F.ACS Sens.,2021,6(3):1 228-1 239.
[19]Li D,Lin S,Ye C,Lin Z,Huang L,Li D.Talanta,2024,268:125 264.
[20]Wu L,Ishigaki Y,Zeng W,Harimoto T,Yin B,Chen Y,Liao S,Liu Y,Sun Y,Zhang X,Liu Y.Nat.Commun.,2021,12(1):6 145.
[21]Li D,Pan J,Xu S,Fu S,Chu C,Liu G.Biosensors,2021,11(11):436.
[22]Dou W T,Han H H,Sedgwick A C,Zhu G B,Zeng Y,Yang X R,Yoon J,James T D,Li J,He X P.Sci.Bull.,2022,67(8):853-878.
[23]Liu J,Liang J,Wu C,Zhao Y.Anal.Chem.,2019,91:6 902-6 909.
[24]Hang Y,Yang M,Wang Y,Huang W,Ji M.Spectrochim.Acta A Mol.Biomol.Spectrosc,2022,267:120 528.
[25]Ma T,Zhang Y,Fu K,Li Z,Yuan C,Ma W.Bioorg.Chem.,2022,123:105 798.
[26]Chunpo G,Yan Y,Pengfei T,Hu S,Yibo J,Yuyang S,Yun Y,Feng R.Sens.Actuat.B Chem.,2022,350:130 831.
[27]Chen M,Liang Z,Zeng G,Wang Y,Mai Z,Chen X,Wu G,Chen T.Dyes Pigment,2022,198:109 995.
[28]Zeng H,Wu Y,Chen S,Wang H,Wang Y,Huang M,Li Y,Ma X,Hou S.New J.Chem.,2024,48:18 514-18 519.
[29]Gu T C,Mo S Y,Mu Y Q,Huang X,Hu L M.Sens.Actuat.B Chem.,2020,309:127 731.
[30]Wang M,Zhang F,Wang C Q,Yin N,Wang Y,Qin G,Xu Q,Gong J,Liu H,Duan X.Anal.Chem.,2022,94:5 962-5 969.
[31]Wang S,Zhang Y,Wang T R,Liu Y J,Shen S L,Cao X Q.Spectrochim.Acta A Mol.Biomol.Spectrosc.,2022,266:120 435.
[32]Wang Y X,Liu Y,Liu B,Yuan Y H,Wei L X,Wang M X,Chen Z.Molecules,2023,29:229.
[33]Li Y,Zhou Y,Lei J,Lu Q,Qin X,Xu Q,Wang Y,Wu C,Yang Z,He B.J.Mol.Struct.,2023,1 271:134 042.
[34]Peng T,Ye S,Liu R Y,Qu J Q.Spectrochim.Acta A Mol.Biomol.Spectrosc.,2023,297:122 757.
[35]Kwon N,Chen,Y,Chen X,Kim M H,Yoon J.Dyes Pigment,2022,200:110 132.
[36]Zhang Y Y,Chen X Z,Liu X Y,Zhang X Y,Gao G,Hou S C,Wang H M.Anal.Chim.Acta,2019,1 078:135-141.
[37]Lin S,Ye C,Lin Z,Huang L,Li D.Talanta,2024,268:125 264.
[38]Wu D,Chen L,Xu Q,Chen X,Yoon J.Acc.Chem.Res.,2019,52(8):2 158-2 168.
[39]Zheng W,Yang J,Shen Y,Yao Y,Lv G,Hao S,Li C.Dyes Pigment,2020,179:108 404.
[40]Li S,Wang P,Yang K,Liu K,Liu Y,Cheng D,He L.Anal.Chim.Acta,2023,1 252:341 009.
[41]Zeng C,Chen Z,Yang M N,Lv J,Li H,Gao J,Yuan Z.Molecules,2022,27(21):7 237.
[42]Lou X,Yu F,Wang R,Su T,Lou P,Wen P,Yu F.Chin.Chem.Lett.,2024,1:110 531.
[43]Liu X,Chen W,Zeng Q,Ma B,Li Z,Meng T,Chen J,Yu N,Zhou Z,Long X.J.Invest.Dermatol.,2022,142(1):124-135.
[44]Yuan F,Zhang S,Wang Y,Gao X,Zhao Y,Ning L,Wang Y,Guo Y,Zhang J.Anal.Chem.,2024,96(42):16 964-16 970.
[45] wierczyńska M,Slowinski D,Grzelakowska A,Szala M,Romanski J,Pierzchala K,Siarkiewicz P,Michalski R,Podsiadly R.Dyes Pigment,2021,193:109 563.
wierczyńska M,Slowinski D,Grzelakowska A,Szala M,Romanski J,Pierzchala K,Siarkiewicz P,Michalski R,Podsiadly R.Dyes Pigment,2021,193:109 563.
[46] wierczyńska M,Slowinski D,Michalski R,Romanski R,Podsiadly R.Spectrochim.Acta A Mol.Biomol.Spectrosc.,2023,289:122 193.
wierczyńska M,Slowinski D,Michalski R,Romanski R,Podsiadly R.Spectrochim.Acta A Mol.Biomol.Spectrosc.,2023,289:122 193.
[47]Shao S F,Yang T R,Han Y F.Sens.Actuat.B Chem.,2023,392:134 041.
[48]Ma Q,Xu S,Zhai Z,Wang K,Liu X,Xiao H,Zhou S,Liu Y.Chem.Eur.J.,2022,28(39):e202 200 828.
[49]Zhang X F,Shen L,Wang S,Chen Q,Cao X Q,Shen S L,Li X.J.Chem.Eng.,2023,472:145 065.
[50]Ren M,Zhou C,Wang L,Lv X,Guo W.Chin.Chem.Lett.,2023,34(4):107 646.
[51]Zuo Y,Zhang K,Zhang Y,Wang F,Gou Z,Yan M.Anal.Chim.Acta,2023,1 249:340 939.
[52]Shu W,Wu Y,Shen T,Cui J,Kang H,Jing J,Zhang X.Dyes Pigment,2019,170:107 609.
[53]Lu J,Li Z,Zheng X,Tan J,Ji Z,Sun Z,You J,J.Mater.Chem.B,2020,8(40):9 343-9 350.
[54]Zeng X,Li Z,Fu J,Jiang C,Ma M,Zhu L,Jin X.Dyes Pigment,2021,186:108 982.
[55]Zhang J,Zhen J,Pu K.Anal.Chem.,2018,90(15):9 301-9 307.
[56]Huang Y,Yu L,Fu L,Hou J,Wang L,Sun M,Wang X,Chen L.Sens.Actuat.B Chem.,2022,370:132 410.
[57]Feng S,Zheng Z,Gong S,Feng G.Sens.Actuat.B Chem,2022,361:131 751.
[58]Wu L,Liu J,Tian X,Groleau R R,Bull S D,Li P,Tang B,James T D.Chem.Sci.,2021,12(11):3 921-3 928.
[59]Li D,Wang S,Lei Z,Sun C,Eltoni A M,Alhoshan M S,Fan Y,Zhang F.Anal.Chem.,2019,91(7):4 771-4 779.
[60]Li J S,Tang J,Yang X P,Xie P Y,Liu J F,Zhang D,Ye Y.Sens.Actuat.B Chem.,2022,358:131 513.
[61]Huang T,Yan S,Yu Y,Xue Y,Yu Y,Han C.Anal.Chem.,2022,94(2):1 415-1 424.
[62]Huang Y,Li M,Zan Q,Wang R,Shuang S,Dong C.Anal.Chem.,2023,95(27):10 155-10 162.
[63]Wang W,Xiong J,Song X,Wang Z,Zhang F,Mao Z.Anal.Chem.,2020,92(19):13 305-13 312.
[64]Gong J,Wang X,Fan H E,Wang J,Zhang F,Mao Z.Talanta,2014,267:125 216.
[65]Feng S M,Liu D D,Feng G Q.Anal.Chim.Acta,2019,1 054:137-144.
[66]Mao G J,Gao G Q,Dong W P,Wang Q Q,Wang Y Y,Li Y,Li L,Zhang G S.Talanta,2021,221:121 607.
[67]Huang W,Du X,Zhang C,Zhang S,Zhang J,Yang X F.Anal.Chem.,2022,94(50):17 485-17 493.