亚硝酸盐是由氨气氧化或硝酸盐还原、细菌硝化与反硝化生成的自然环境中氮循环的中间产物[1,2]。长时间放置的菜、腌制咸菜都含有亚硝酸盐[3,4]。亚硝酸盐是一类易溶于水的无机盐,农业生产中含亚硝酸盐化肥的大量使用会导致水体中富亚硝酸盐[5,6]。世界卫生组织和美国环境保护协会限定饮用水中亚硝酸盐含量的最大浓度分别为3和1 mg/L[7,8]。建立快速、灵敏、准确的亚硝酸盐定量分析方法对于保障饮用水的质量安全、保证人体健康有着重要意义。
亚硝酸盐的检测方法有色谱法[9]、Griess比色法[10]、电化学法[11]、毛细管电泳法[12]、化学发光法[13]、荧光光谱法[14]。Kodamatani等[9]用 222 nm紫外光转化亚硝酸盐为过氧亚硝酸盐,结合离子色谱-鲁米诺发光技术,检测海水中的亚硝酸盐(检测限1×10-8 mol/L),解决了污染和背景发光干扰,但是该方法需要采用阴离子交换膜纯化洗脱液、用Dionex lonPac AS19色谱柱对样液进行分离,操作程序复杂、样品预处理繁琐和仪器价格昂贵,尚不便实现亚硝酸盐的现场分析[15];Griess比色法是最著名的亚硝酸盐检测方法。该检测方法是在酸性条件下![]() 与对氨基苯磺酸盐发生重氮化反应形成重氮盐,然后再与盐酸萘乙二胺盐偶联生成紫色的染料,根据其在538 nm波长处的吸光度值完成对亚硝酸盐含量的检测[10]。Griess比色法重现性较好、操作简单、检测成本低、检测结果可视化,但是该方法需要耗费较长的时间,灵敏度低、易受到实际样品中其它物质的干扰[11]。更为关键的是,用于检测的试剂具有毒性或致癌性,可能对操作人员的健康构成危害,该方法的应用受到了一定限制。传统的检测方法,难以实现对亚硝酸盐含量的现场实时可视化检测[16,17]。
与对氨基苯磺酸盐发生重氮化反应形成重氮盐,然后再与盐酸萘乙二胺盐偶联生成紫色的染料,根据其在538 nm波长处的吸光度值完成对亚硝酸盐含量的检测[10]。Griess比色法重现性较好、操作简单、检测成本低、检测结果可视化,但是该方法需要耗费较长的时间,灵敏度低、易受到实际样品中其它物质的干扰[11]。更为关键的是,用于检测的试剂具有毒性或致癌性,可能对操作人员的健康构成危害,该方法的应用受到了一定限制。传统的检测方法,难以实现对亚硝酸盐含量的现场实时可视化检测[16,17]。
荧光光谱法具有简便、快速、灵敏度高、特异性强、便于现场实时可视化检测等特点[18],在亚硝酸盐的快速检测中具有潜在优势。近年来,基于荧光探针的亚硝盐检测受到了科研工作者的广泛关注[19,20]。基于荧光探针与亚硝酸盐之间的重氮化反应[21]、亚硝化反应[22]和配位配合[23],人们设计了一系列的亚硝酸盐荧光探针。重氮环化反应是最常见的亚硝酸盐响应荧光探针的构建策略[24,25]。Kumar等[21]基于罗丹明类衍生物上的—NH2基团与![]() 发生重氮化反应导致螺环开环并发生分子内重排反应,构建了一种荧光开启型荧光探针Probe 1,该探针检出限为1×10-7 mol/L,在0~5 ℃下反应1 h完成水体中亚硝酸盐含量的检测。Wang等[26]使用4-氨基-5-甲基氨基-2′,7′-二氟荧光素二乙酸酯作为荧光探针Probe 2,在65℃的酸性条件下Probe 2与
发生重氮化反应导致螺环开环并发生分子内重排反应,构建了一种荧光开启型荧光探针Probe 1,该探针检出限为1×10-7 mol/L,在0~5 ℃下反应1 h完成水体中亚硝酸盐含量的检测。Wang等[26]使用4-氨基-5-甲基氨基-2′,7′-二氟荧光素二乙酸酯作为荧光探针Probe 2,在65℃的酸性条件下Probe 2与![]() 反应30 min生成苯并三唑类化合物,体系在517 nm处有绿色荧光,检出限为3.3×10-8 mol/L。上述探针为亚硝酸盐的检测提供了简便、灵敏的方法,但是存在反应速度慢,探针水溶性差等问题。
反应30 min生成苯并三唑类化合物,体系在517 nm处有绿色荧光,检出限为3.3×10-8 mol/L。上述探针为亚硝酸盐的检测提供了简便、灵敏的方法,但是存在反应速度慢,探针水溶性差等问题。
苯二胺是常用的亚硝酸盐重氮化荧光探针设计的活性反应基团,其原理是与![]() 发生反应生成苯并三唑类化合物,改变探针分子内的电子结构,进而引发荧光信号发生变化,实现
发生反应生成苯并三唑类化合物,改变探针分子内的电子结构,进而引发荧光信号发生变化,实现![]() 的特异性检测[27]。在强酸性条件下—NH2比—OH更容易发生质子化反应,使其亲核性降低。理论上来说,—OH替代—NH2更加有利于反应的快速进行,同时氧原子与水分子之间形成氢键,可以提高探针分子的水溶性。
的特异性检测[27]。在强酸性条件下—NH2比—OH更容易发生质子化反应,使其亲核性降低。理论上来说,—OH替代—NH2更加有利于反应的快速进行,同时氧原子与水分子之间形成氢键,可以提高探针分子的水溶性。
罗丹明类荧光染料是常用的荧光探针设计母核[28]。罗丹明800是常见的罗丹明衍生物,其具有良好的水溶性,荧光激发和发射波长位于红外光区,有利于降低样品基质吸收对体系的干扰。因此,本研究以罗丹明800为荧光母核,如图1所示,以—OH取代的偕胺肟为反应活性位点,通过亲核加成反应制备了新型的罗丹明衍生物,实现了亚硝酸盐的灵敏识别和快速反应。
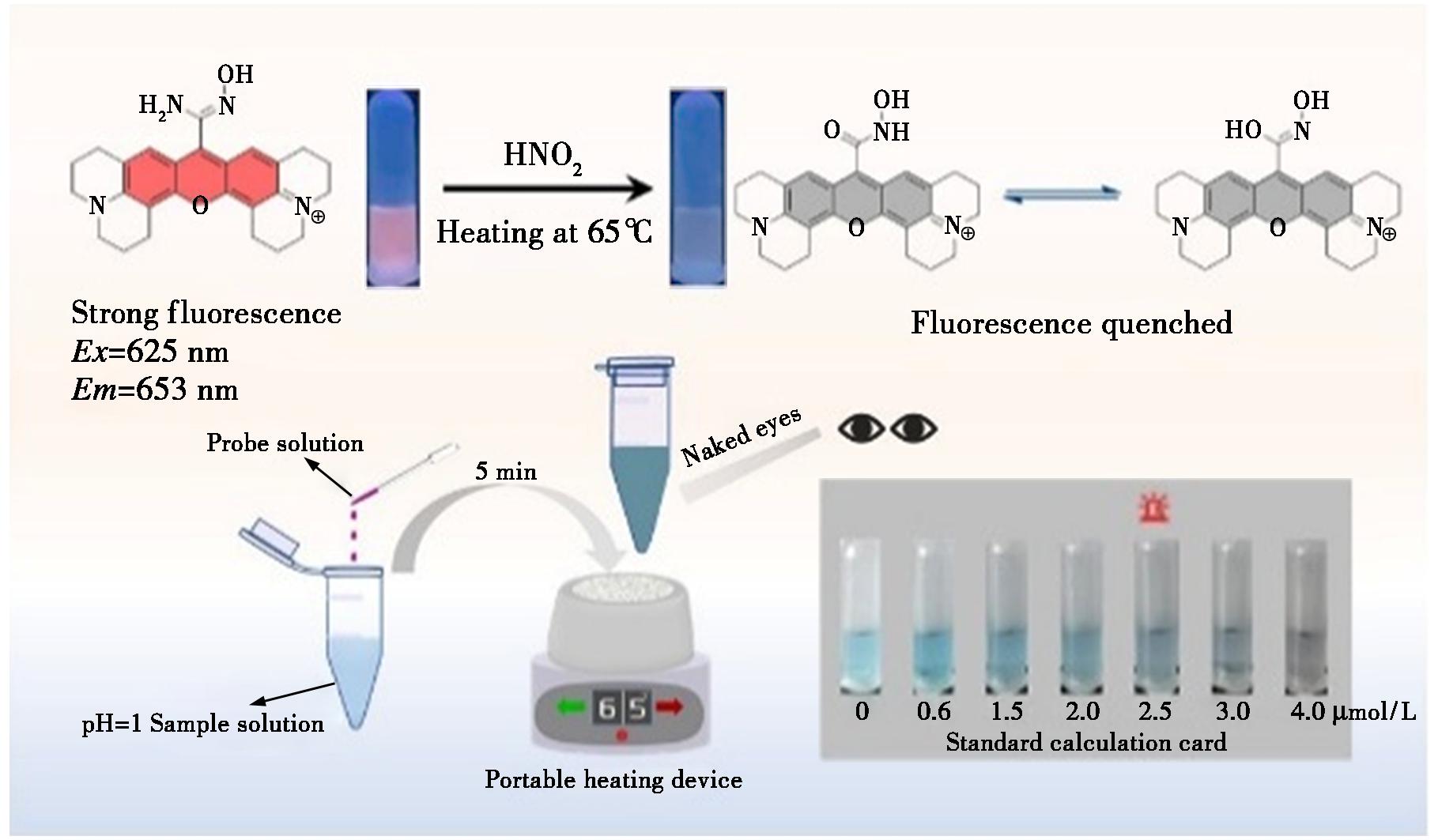
图1 探针Rh-PAO对亚硝酸盐响应的原理图及便携检测平台模型示意图
Fig.1 Principle diagram of probe Rh-PAO response to nitrite and schematic diagram of portable detection platform model
F4600型荧光光谱仪(日本日立高新技术公司);T6型新世纪紫外-可见分光光度计(北京普析通用仪器有限责任公司);AVANCE Ⅲ型HD 600 MHz核磁共振波谱仪(瑞士拜厄斯宾有限公司);CESI-8000型TRIPLETOF无鞘液毛细管电泳-超快速飞行时间串联质谱仪(新加坡AB SCIEX公司)。
罗丹明800(98%,梯希爱(上海)化成工业发展有限公司);二氯甲烷(99.9%,萨恩化学技术(上海)有限公司);无水甲醇(分析纯,国药集团化学试剂有限公司);乙醚(分析纯,洛阳市化学试剂厂);二甲亚砜(99.8%,上海阿拉丁生化科技股份有限公司);亚硝酸钠(分析纯,天津市四通化工厂);盐酸(分析纯,洛阳市化学试剂厂);磷酸盐缓冲溶液(PBS,武汉赛维尔生物科技有限公司);羟胺水溶液(50 wt%,上海韶远试剂有限公司)。
1.2.1 探针Rh-PAO的合成及核磁共振(NMR)检测
称取111.5 mg罗丹明800固体粉末于圆底烧瓶中,加入400 μL质量分数为50%的羟胺水溶液,加入3 mL无水甲醇和3 mL二氯甲烷作为溶剂,在室温下搅拌10 h,即得探针粗产物。用旋转蒸发仪将溶剂蒸干后通过硅胶柱色谱纯化,以不同体积比的二氯甲烷和无水甲醇作为洗脱剂进行梯度洗脱,收集1:1洗脱液,乙醚中重结晶,得紫红色固态探针纯品。
1HNMR(DMSO-d6,600 MHz),δ:10.05(s,1H);7.33(s,2H);6.41(s,2H);3.53(q,8H,J=5.5 Hz);2.94(t,4H,J=6.4 Hz);2.82(t,4H,J=6.3 Hz);1.99(t,4H);1.92(t,4H,J=8.1 Hz)。13CNMR(DMSO-d6,151 MHz),δ:152.00,151.26,146.36,145.36,126.20,124.10,111.99,105.41,50.80,50.32,27.47,20.67,19.62。HR-MS:![]() 实测值(计算值),m/z:429.265 6(429.228 5)[M]+。
实测值(计算值),m/z:429.265 6(429.228 5)[M]+。
1.2.2 分析体系的建立
将6 μL(2×10-3 mol/L)探针储备液加入 2 mL HCl溶液(pH 1)中,再加入适量的亚硝酸溶液(加入体积<5 μL),混匀后在65℃水浴中加热10 min,冷却至室温后进行测定。λEx/λEm=625 nm/653 nm,入射狭缝/出射狭缝宽度=5 nm/5 nm。
如图2a所示,在pH 1条件下探针有两个明显的罗丹明类衍生物特征吸收峰,分别位于580、625 nm处,最佳荧光发射峰位于653 nm处。加入亚硝酸盐后,在625 nm波长的激发下,653 nm处的荧光信号明显猝灭,在580、625 nm处的吸光度有明显的减弱,并且可以用裸眼观察到蓝色的溶液颜色逐渐变浅,在365 nm紫外灯照射下观察到红色荧光逐渐猝灭。这是由于探针Rh-PAO与亚硝酸盐发生重氮化反应导致荧光的猝灭,猝灭量是起始荧光强度的93.4%。该结果表明探针Rh-PAO可以与亚硝酸盐响应使光学信号发生改变。由图2b和2c可知探针光谱信号的改变是亚硝酸盐的加入导致的,而不是加热造成的。因此,该探针在加热条件下可以完成对亚硝酸盐的检测。
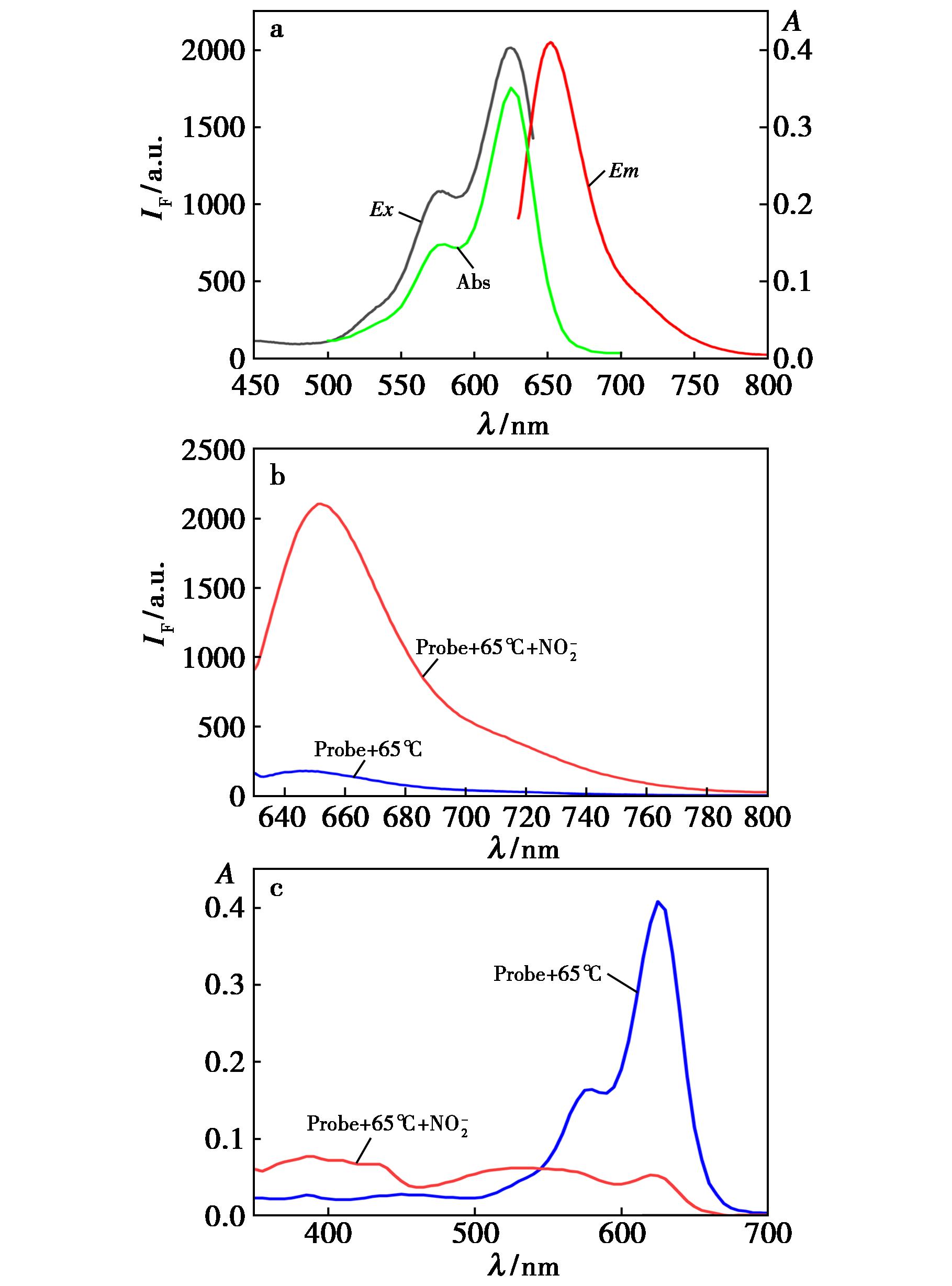
![]() a.UV及荧光光谱;b.荧光光谱;c.UV
a.UV及荧光光谱;b.荧光光谱;c.UV
图2 探针Rh-PAO与![]() 反应的光谱特性
反应的光谱特性
Fig.2 Spectral characteristics of Rh-PAO reacting![]()
以加入亚硝酸盐后探针荧光信号猝灭的程度为指标,对反应体系中探针的浓度、反应pH、反应温度和反应时间进行优化。如图3所示,实验的最佳条件是:探针浓度为6×10-6 mol/L,pH 1 HCl溶液作为缓冲溶液,反应温度设为65℃,反应5 min。
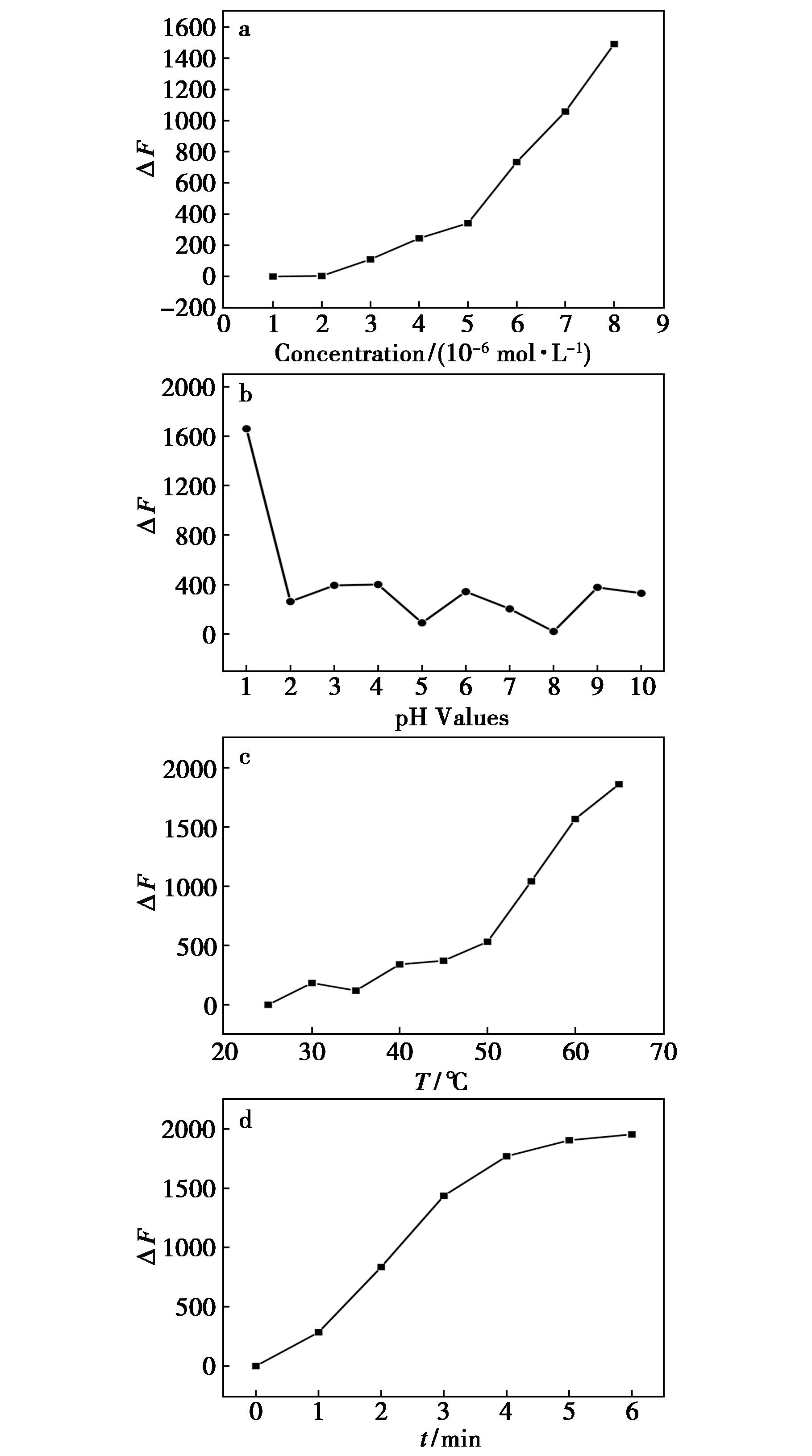
ΔF=F0-F1a.探针浓度;b.pH;c.反应温度;d.反应时间
图3 反应条件对荧光体系的影响
Fig.3 Effect of reaction conditions on the fluorescence intensity
基于实际样品中可能共存的其它离子和物质,配制了0.01 mol/L ![]()
![]() 的钠盐与氯盐溶液,以及0.01 mol/L GSH和Cys溶液作为干扰物对亚硝酸盐与探针反应的选择性进行考察。在6×10-6 mol/L探针和5×10-6 mol/L
的钠盐与氯盐溶液,以及0.01 mol/L GSH和Cys溶液作为干扰物对亚硝酸盐与探针反应的选择性进行考察。在6×10-6 mol/L探针和5×10-6 mol/L ![]() 的溶液中(pH 1,65℃)分别加入不同干扰物溶液,溶液中干扰物的浓度是亚硝酸盐的50倍(2.50×10-4 mol/L)。由图4a可知,除Fe3+和
的溶液中(pH 1,65℃)分别加入不同干扰物溶液,溶液中干扰物的浓度是亚硝酸盐的50倍(2.50×10-4 mol/L)。由图4a可知,除Fe3+和![]() 可以使体系的荧光信号明显猝灭外,50倍的其它干扰物对探针的荧光不具有明显的猝灭效应,表明了探针对亚硝酸盐的高度选择性。根据美国环境保护署规定水体中Fe3+的含量不超过0.3 mg/L,即 5.36×10-6 mol/L的标准,实际的水样中不可能存在大量的Fe3+[7,8]。从图4c中可知,5×10-6 mol/L的Fe3+导致的荧光猝灭程度不超过亚硝酸猝灭程度的1%。说明实际应用中Fe3+不会对检测造成干扰。
可以使体系的荧光信号明显猝灭外,50倍的其它干扰物对探针的荧光不具有明显的猝灭效应,表明了探针对亚硝酸盐的高度选择性。根据美国环境保护署规定水体中Fe3+的含量不超过0.3 mg/L,即 5.36×10-6 mol/L的标准,实际的水样中不可能存在大量的Fe3+[7,8]。从图4c中可知,5×10-6 mol/L的Fe3+导致的荧光猝灭程度不超过亚硝酸猝灭程度的1%。说明实际应用中Fe3+不会对检测造成干扰。
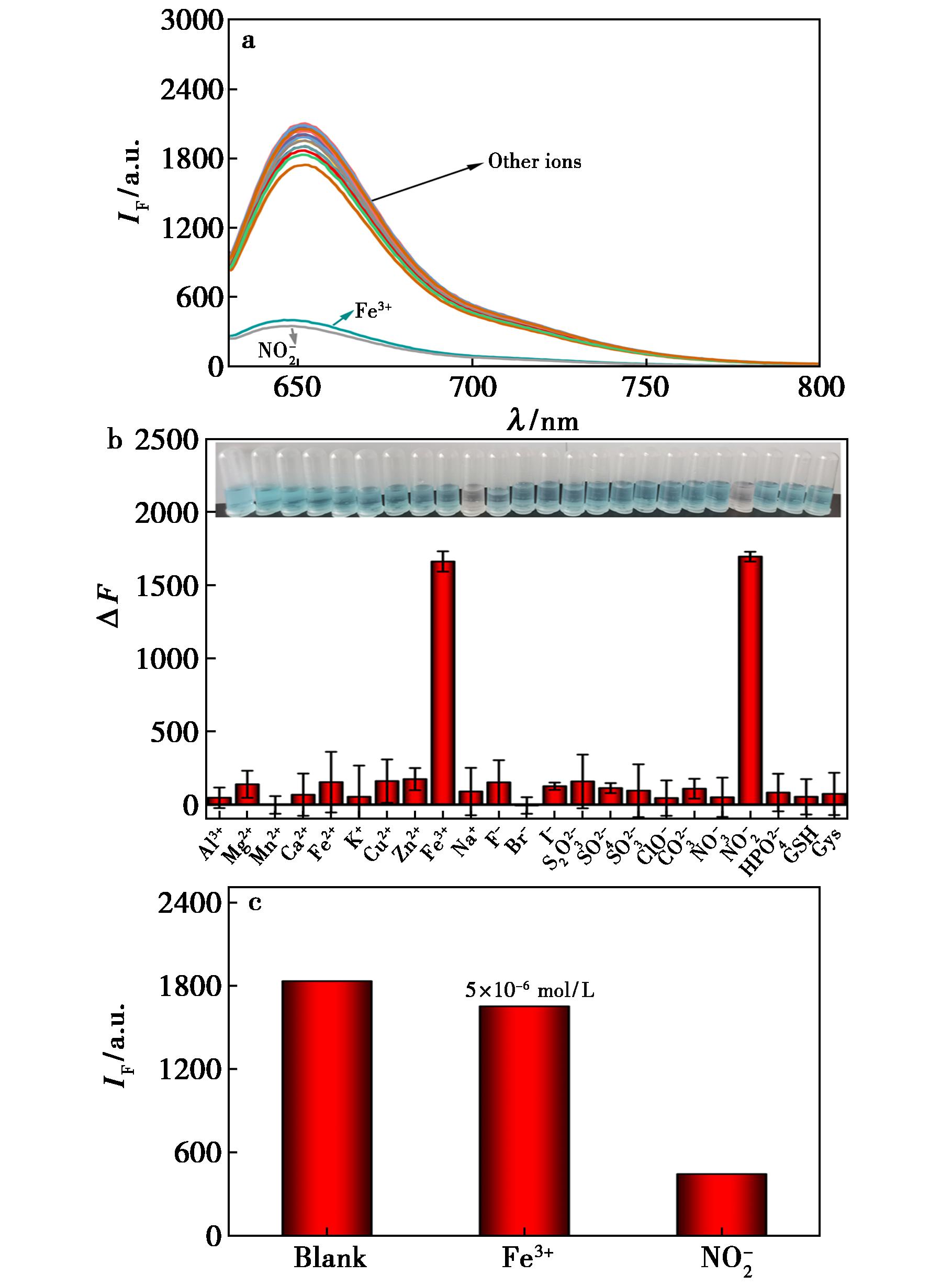
pH 1,65℃,λEx/λEm=625 nm/653 nm a、b.6×10-6 mol/L Rh-PAO+5×10-6 mol/L ![]() mol/L金属离子/GSH/CyS;c.6×10-6 mol/L Rh-PAO+5×10-6
mol/L金属离子/GSH/CyS;c.6×10-6 mol/L Rh-PAO+5×10-6 ![]()
图4 探针对不同物质的选择性测试
Fig.4 Selective testing of probes for different substances
由图5可知,随着亚硝酸盐的加入,可以用裸眼观察到体系的溶液颜色从蓝色逐渐变为粉红色,在365 nm紫外灯照射下观察到红色荧光逐渐下降。体系在653和625 nm下的荧光和吸收与亚硝酸盐的浓度在0.5~5.5×10-6 mol/L范围内呈良好线性,最低检测限分别为9.7×10-8和8.6×10-8 mol/L,远低于水中亚硝酸盐含量的最高限量标准0.1 mg/L[8]。
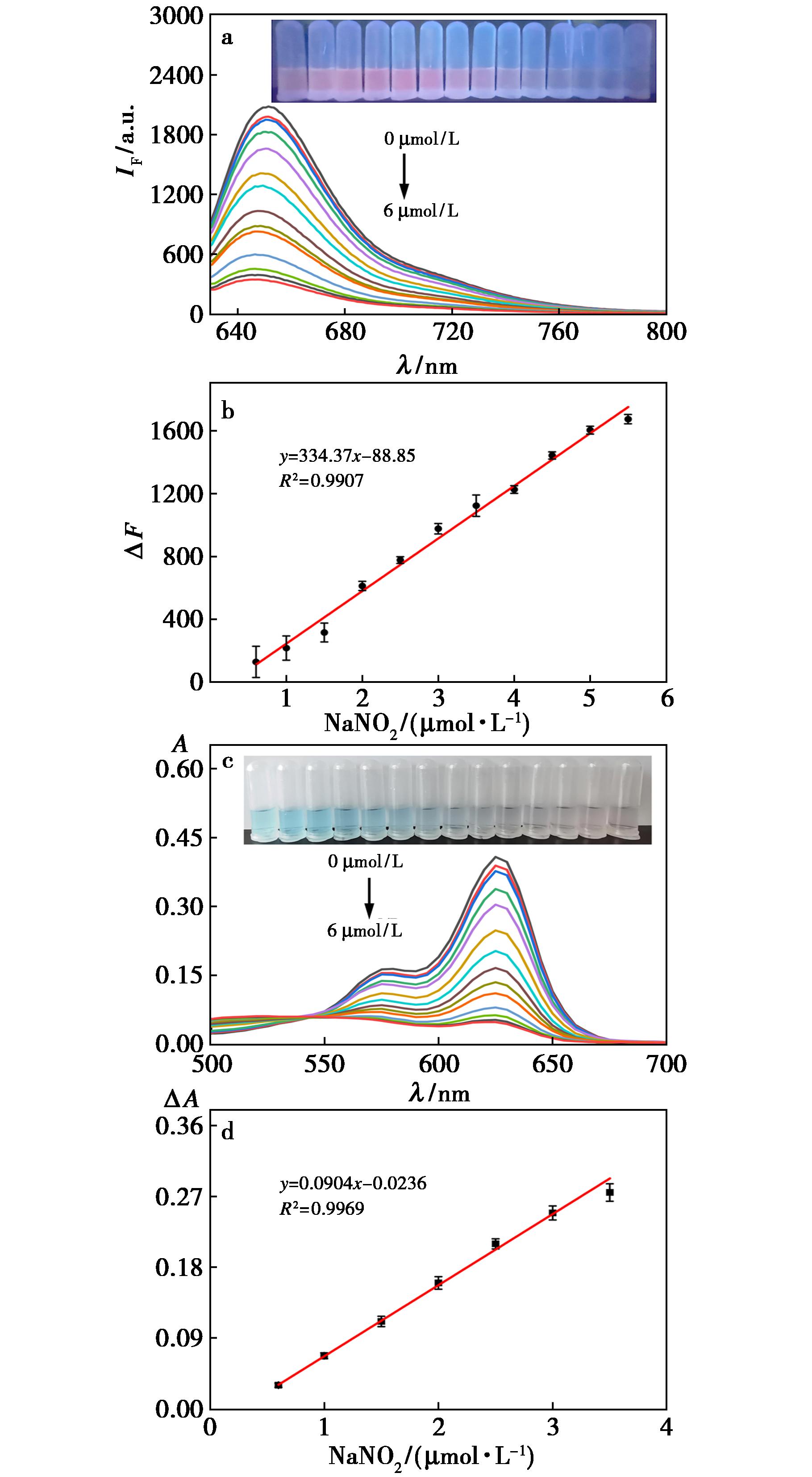
a.探针![]() 在653 nm处体系的荧光强度;
在653 nm处体系的荧光强度;![]() 浓度在0.5~5.5×10-6 mol/L内荧光强度的线性关系;c.探针
浓度在0.5~5.5×10-6 mol/L内荧光强度的线性关系;c.探针![]() 在625 nm处体系的吸光度;
在625 nm处体系的吸光度;![]() 浓度在0.5~3.5×10-6 mol/L内吸光度的线性关系
浓度在0.5~3.5×10-6 mol/L内吸光度的线性关系
图5 探针的响应性能
Fig.5 Respond performance of the probe
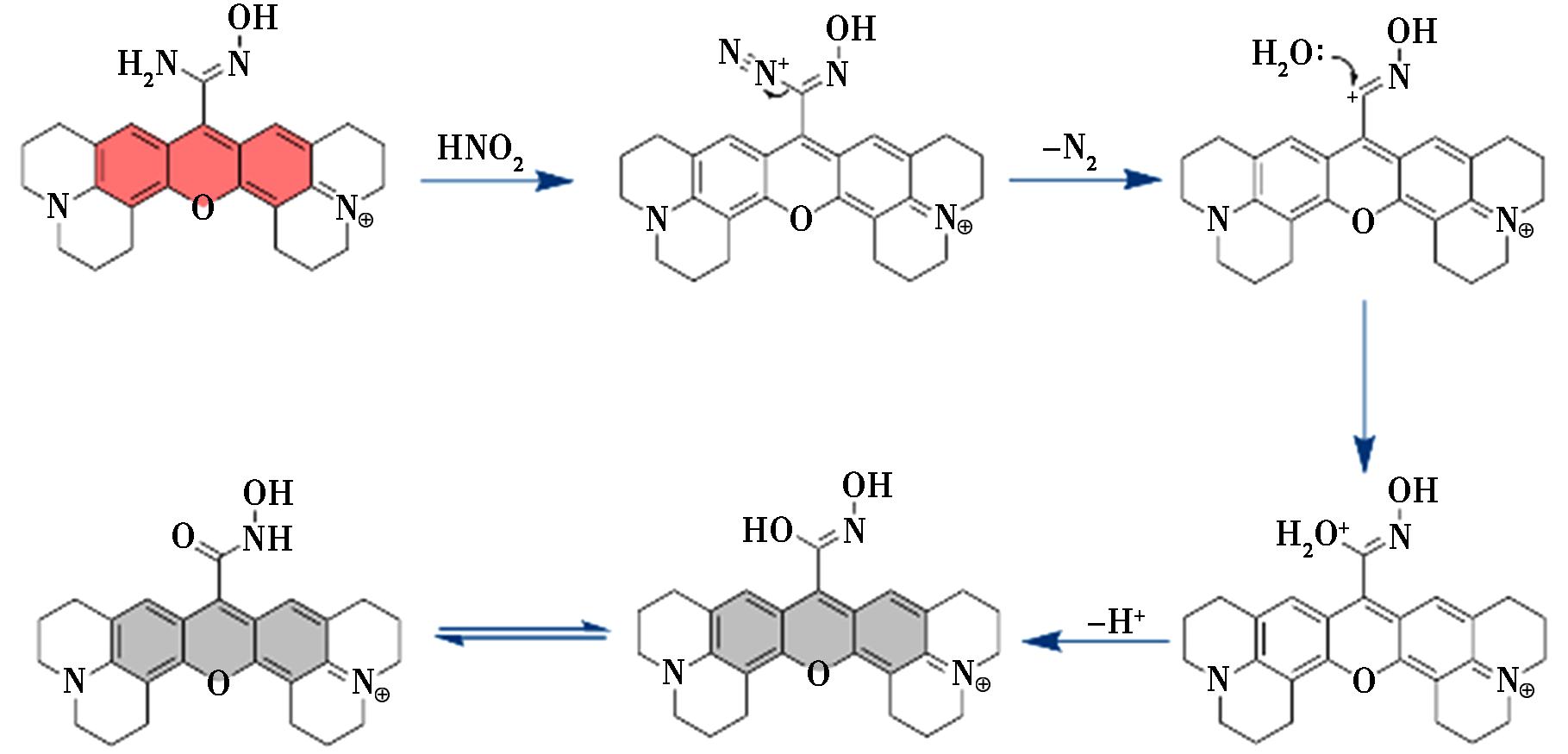
图6 探针的反应机理
Fig.6 Reaction Mechanisms of Probes
如表1所示,该探针在更短的时间内完成亚硝酸盐的检测,更好的选择性和检测灵敏度。以上数据表明,应用荧光光谱法和紫外-可见吸收光谱法均可以较为灵敏的完成对亚硝酸盐的检测,该探针具有一定的应用潜力。
表1 不同荧光探针检测![]() 的能力对比
的能力对比
Tab.1 Comparison of ability of different fluorescent probes to detect ![]()
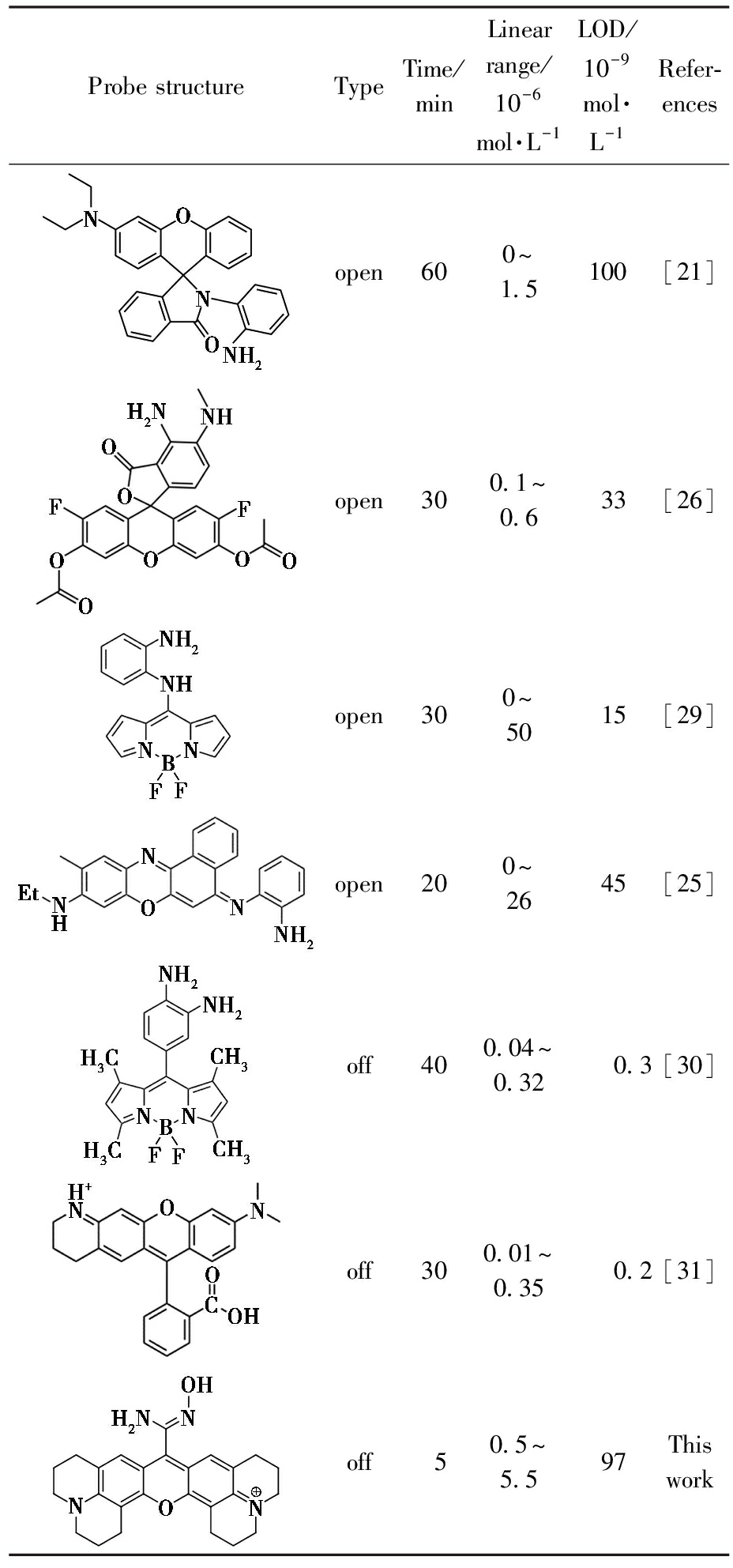
Probe structureTypeTime/minLinear range/10-6mol·L-1LOD/10-9mol·L-1Refer-encesopen600~1.5100[21]open300.1~0.633[26]open300~5015[29]open200~2645[25]off400.04~0.320.3[30]off300.01~0.350.2[31]off50.5~5.597This work
探针与亚硝酸发生重氮化反应生成重氮盐,重氮盐不稳定而以N2的形式脱离形成碳正离子,水中氧的孤对电子作为亲核试剂进攻碳正离子,最后生成稳定的酮类化合物。
在超市购买瓶装饮用水,使用时未进行进一步处理;环境水样为郑州大学主校区内眉湖中所取水样,水样过0.22 μm水系滤膜后备用。水样用同体积0.2 mol/L HCl稀释后直接测定,探针浓度6×10-6 mol/L。
将待测水样与盐酸等体积混合后加入6 μL的探针Rh-PAO储备液,再分别配制浓度不同的亚硝酸钠溶液,根据荧光数据计算检出量及加标回收率,其结果如表2所示。从表中数据得出实际检出亚硝酸盐含量与理论应检出含量有较好的吻合,回收率在97.4%~112.9%之间,RSD值均小于3.87%(n=3)。以上结果表明该探针可以较为准确的完成水体中亚硝酸盐的检测,在监测水体中亚硝酸盐含量是否超标方面具有较好的应用前景。
表2 山泉水样与眉湖水样中亚硝酸盐含量的测定
Tab.2 Determination results of nitrite content in mountain spring water samples and Meihu water samples
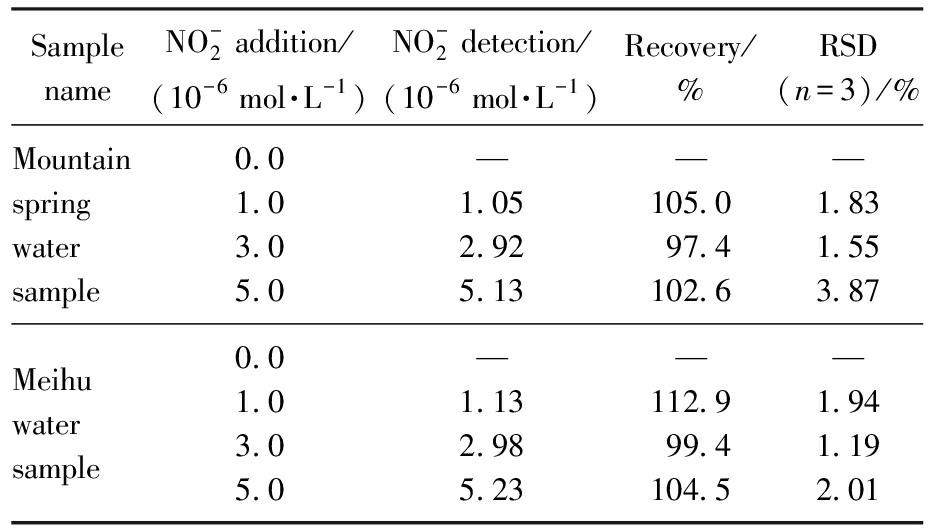
Sample nameNO-2 addition/(10-6 mol·L-1)NO-2 detection/(10-6 mol·L-1)Recovery/%RSD(n=3)/%Mountain spring water sample0.01.03.05.0—1.052.925.13—105.097.4102.6—1.831.553.87Meihu water sample0.01.03.05.0—1.132.985.23—112.999.4104.5—1.941.192.01
本文针对苯二胺结构与亚硝酸盐重氮化反应速度慢的问题,通过—OH取代设计偕胺肟结构的水溶性荧光探针,基于—OH更强的亲核加成反应性能,提升了重氮化反应的速度,实现了亚硝酸盐5 min的快速识别反应。可能共存的干扰离子在50倍亚硝酸盐的浓度下,对体系的测定不产生干扰,显现了优异的抗干扰性能。反应前后溶液的颜色和荧光信号发生明显变化,实现灵敏的荧光光谱法和紫外-可见吸收光谱法双模式检测。该探针成功完成饮用水与环境水样中亚硝酸盐含量的检测;通过简易的加热装置共同搭建了便携的亚硝酸盐可视化检测装置。本研究对亚硝酸盐的探针设计提供了新思路,为生活水样中亚硝酸盐的快速检测和监控提供了新的方法参考和依据。
[1]Liao F,Song X,Yang S W,Hu C Y,He L,Yan S,Ding G Q.J.Mater.Chem.A,2015,3(14):7 568-7 574.
[2]Tao H H,Zhang Z,Cao Q,Li L F,Xu S H,Jiang C L,Li Y C,Liu Y Y.R.Soc.Chem.Adv.,2022,12:12 655-12 662.
[3]Wu S H,Liu Y H,Cui X,Zhang Q,Wang Y P,Cao L P,Luo X,Xiong J H,Ruan R.Foods,2021,10:2 953.
[4]Zhang G Q,Shi Y H,Wu W,Zhao Y,Xu Z H.Spec.Trochim.Acta A,2023,286:122 025.
[5]Xu J Y,Qi Q,Sun L L,Guo X J,Zhang H M,Zhao X Z.J.Alloys Compd.,2022,908:164 519.
[6]Yilmaz M D.Anal.Chim.Acta,2021,1 166:338 597.
[7]Li W S,Huang S P,Wen H Y,Luo Y E,Cheng J W,Jia Z,Han P,Xue W M.Anal.Bioanal.Chem.,2020,412:993-1 002.
[8]Wang M Z,Zhao M H,Liu P,Zhu H J,Liu B X,Hu P W,Niu X H.Sens.Actuat.B-Chem.,2021,355:131 308.
[9]Kodamatani H,Kubo S,Takeuchi A,Kanzaki R,Tomiyasu T.Environ.Sci.Technol.,2023,57:5 924-5 933.
[10]Tsikas D.Chromb,2007,851:51-70.
[11]Wang Q H,Yu L J,Liu Y,Lin L,Lu R G,Zhu J P,He L,Lu Z L.Talanta,2017,165:709-720.
[12]D′amore T,Di T A,Vita V,Berardi G,Iammarino M.Food Anal.Methods,2019,12: 1 813-1 822.
[13]Townshend A.Analyst,1990,115:495-500.
[14]Chen L L,Fan T J,Li W,Song J Q,Zhang J X,Wang L,Han K.Spectrochim.Acta A,2023,286:121 960.
[15]Yang Y Q,Wei S M,Wang J L,Li J J,Tang J L,Aaron A A,Cai Q Y,Wang N N,Li Z H.Anal.Chim.Acta,2023,1 263:341 245.
[16]Yu M,Zhang H,Liu Y N,Zhang Y L,Shang M H,Wang L,Zhuang Y T,Lv X.Food Chem.,2022,374:131 768.
[17]Zeng L T,Ke Y J,Yang X R,Lan M H,Zhao S J,Zhu B T.Food Chem.,2024,438:138 044.
[18]Zhan Y J,Zeng Y B,Li L,Luo F,Qiu B,Lin Z Y,Guo L H.ACS Sens.,2019,4:1 252-1 260.
[19]Wang Y S,Yu H L,Zhang Y Z,Jia C L,Ji M.Dyes Pigm.,2021,190:109 284.
[20]Li Y X,Xie D T,Yang Y X,Chen Z,Guo W Y,Yang W C.Molecules,2022,27:4 501.
[21]Kumar V,Banerjee M,Chatterjee A.Talanta,2012,99:610-615.
[22]Zhang F Y,Zhu X Y,Jiao Z J,Liu X Y,Zhang H X.Spectrochim.Acta A,2018,200:275-280.
[23]He L Z,Zou W,Zeng D,Gong F C,Wang Q G,Xia J X,Cao Z.Dyes Pigm.,2020,177:108 256.
[24]Zhang Q Q,Wang Y J,Song A,Yang X,Yin D,Shen L L.J.Mol.Struct.,2024,1 296:136 926.
[25]Zhan Y H,Sun R,Zhu W J,Xu Y J,Ge J F.Sens.Actuat.B-Chem.,2017,240:1 283-1 290.
[26]Wang Q H,Huang H W,Ning B M,Li M F,He L.Food Anal.Methods,2016,9:1 293-1 300.
[27]Wu J J,Jiang L R,Verwilst P,An J,Zeng H Y,Zeng L T,Niu G L,Kim J S.Chem.Commun.,2019,55:9 947-9 950.
[28]Beija M,Afonso C A M,Martinho J M G.Chem.Soc.Rev.,2009,38:2 410-2 433.
[29]Zhang J,Pan F C,Jin Y,Wang N N,He J L,Zhang W J,Zhao W L.Dyes Pigm.,2018,155:276-283.
[30]Li J S,Wang H,Zhang X,Zhang H S.Talanta,2003,61:797-802.
[31]Liu Q H,Yan X L,Guo J C,Wang D H,Li L,Yan F Y,Chen L G.Spectrochim.Acta A,2009,73:789-793.