金属离子对人类社会的发展起着至关重要的作用,但也产生了大量的金属污染物,导致生态环境的恶化,进而危及人类健康[1-3]。铜离子和锌离子都是生命体内重要的金属离子[4,5],在许多生理过程中发挥着重要作用,与人体健康关系密切[6]。人体内过量的铜会损害肾脏、心脏和肝脏等器官[7],导致贫血[8,9]、胃肠道疾病[10,11]、阿尔茨海默氏病[12,13]、帕金森氏病[14,15]、急性肾衰竭和缺血性心脏病等疾病[16]。锌是人体必需的微量元素之一[17],在细胞生长发育、基因转录、神经信号传递等生命活动中起着重要的作用[18,19]。然而,过量的锌可能导致严重的神经系统疾病,如帕金森病[20,21]、癫痫和缺血性中风[22]。同时,铜过量导致神经元毒性,锌缺少会造成神经元损伤,是引起认知障碍的生物因子[23]。因此,Cu2+和Zn2+的检测至关重要。近些年,文献已报道了一些Cu2+/Zn2+荧光传感器[24-26],但仍然存在合成过程复杂、选择性和灵敏性不足等问题,所以急需开发合成步骤简单、灵敏性好、应用环境温和的新型Cu2+/Zn2+荧光探针。
席夫碱类化合物分子中C![]() N键的存在,以及分子内氢键的影响,使其可以表现出荧光增强的聚集诱导发光现象(AIE)[27]。席夫碱的立体电子结构具有高度可调节性,使其能够与多种过渡金属形成稳定的配合物。而香豆素类的化合物能有效地与大部分过渡金属形成配合反应。同时,它们也因其优秀的荧光特性而备受关注,例如:它们的光物理和光化学性质可调[28];拥有高的荧光产量[29];较大的Stokes位移;以及良好的光稳定性能[30]等。这些特点使得含有香豆素荧光基团的探测器具备了优良的光谱稳定性和强大的渗透力,并且有着较高的量子效率[31]。所以,以香豆素为基础的荧光检测方法成为了当前的研究焦点。
N键的存在,以及分子内氢键的影响,使其可以表现出荧光增强的聚集诱导发光现象(AIE)[27]。席夫碱的立体电子结构具有高度可调节性,使其能够与多种过渡金属形成稳定的配合物。而香豆素类的化合物能有效地与大部分过渡金属形成配合反应。同时,它们也因其优秀的荧光特性而备受关注,例如:它们的光物理和光化学性质可调[28];拥有高的荧光产量[29];较大的Stokes位移;以及良好的光稳定性能[30]等。这些特点使得含有香豆素荧光基团的探测器具备了优良的光谱稳定性和强大的渗透力,并且有着较高的量子效率[31]。所以,以香豆素为基础的荧光检测方法成为了当前的研究焦点。
荧光探针的设计遵循多种荧光机制,包括激发态分子内质子转移(ESIPT)[32,33]、分子内电荷转移(ICT)[34]、荧光共振能量转移(FRET)[35,36]、光诱导电子转移(PET)[37,38]和聚集诱导发光(AIE)[39-41]等。分子内电荷转移(ICT)是指当分子受到光照射时,探针供体部分的电子可以通过π-共轭体系转移到受体,实现分子内电荷转移[42]。本文研究的荧光探针L是在结合Cu2+/Zn2+后脱质子的ICT机制的基础上,通过分子内电荷转移(ICT)过程增强了香豆素单元的联肼氮原子的接受电子的能力,从而增强了香豆素单元向对联肼氮原子的分子接受能力。
本文基于香豆素和席夫碱设计合成一种化合物(图1)。首先,利用4-二乙氨基水杨醛作为起始材料,通过Knoevenagel缩合关环反应(中间体Ⅰ)和后期的水解脱羧过程,得到了中间产物7-(二乙氨基)香豆素(Ⅱ)。接着,该中间产物被用于生成7-(二乙氨基)香豆素-3-甲醛(Ⅲ),最终经过与2-噻吩甲酰肼之间的亲核加成反应完成整个流程,得到产物7-二乙氨基-3-甲酰基香豆素(2′-噻吩甲酰)腙(L)。并对荧光探针L进行了紫外-可见光光谱(UV-Vis)、核磁共振谱(1HNMR和 13CNMR)研究及其在Cu2+和Zn2+识别方面的应用。
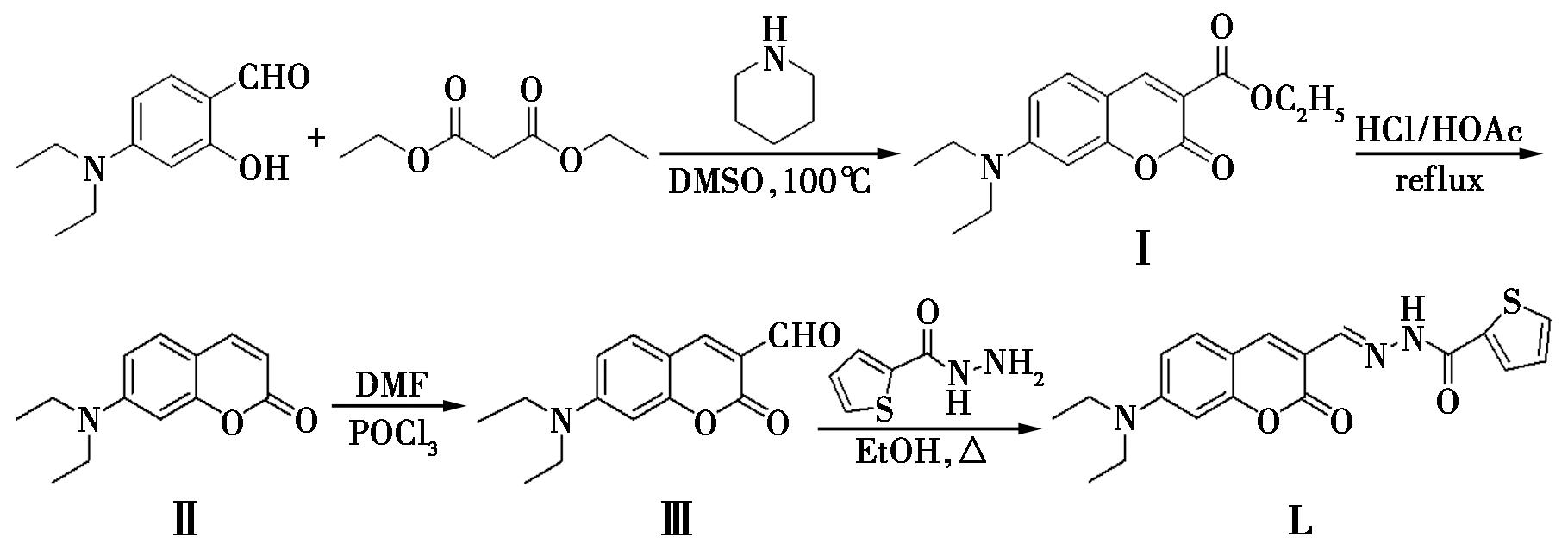
图1 荧光探针L的合成路线
Fig.1 Synthetic route of fluorescent probe L
1 实验部分
1.1 主要仪器与试剂
Bruker 400 Ultra-shield型核磁共振仪(DMSO为溶剂,TMS为内标,德国布鲁克公司);TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);F97Pro型荧光分光光度计(上海棱光技术有限公司);X-5A型显微熔点仪(巩义市科瑞仪器有限公司)。
4-二乙氨基水杨醛、三氯氧磷、哌啶、2-噻吩甲酰肼(安徽泽升科技股份有限公司);丙二酸二乙酯(萨恩化学技术(上海)有限公司);四氢呋喃(THF)、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、无水乙醇(国药集团化学试剂有限公司);浓盐酸(成都市科隆化学品有限公司);冰醋酸(江苏强盛功能化学股份有限公司);环己烷(天津市致远化学试剂有限公司);所用试剂均为分析纯。
1.2 实验方法
1.2.1 7-(二乙氨基)香豆素-3-羧酸乙酯(Ⅰ)的合成
称取6.00 g(0.03 mol)4-二乙氨基水杨醛、35 mL DMSO,放入圆底烧瓶(500 mL)中,搅拌至完全溶解,加入7.5 mL(0.05 mol)丙二酸二乙酯,再滴入15滴哌啶。在油浴中于100 ℃的高温下对混合物进行3 h的回流反应。反应结束后静置降温至室温,在200 mL冰水中倒入反应液静置30 min(在4 ℃的环境下进行),持续搅拌至淡黄色固体析出,进行抽滤,用15%乙醇淋洗,干燥,再用V(无水乙醇)∶V(环己烷)=1∶10混合溶剂进行重结晶,最后得到7.32 g淡黄色晶体中间体Ⅰ,产率81.5%,m.p.81.9~82.3 ℃。1HNMR(CDCl3,400 MHz),δ:8.44(s,1H);7.37(d,1H,J=8.92 Hz);6.65(dd,1H,J=2.36,8.96 Hz);6.49(s,1H);4.38(q,2H,J=7.16 Hz);3.45(q,4H,J=7.16 Hz);1.39(t,3H,J=7.12 Hz);1.24(t,6H,J=7.12 Hz)。
1.2.2 7-二乙氨基香豆素(Ⅱ)的合成
称取2.05 g(7 mmol)中间体Ⅰ和10 mL冰醋酸加入圆底烧瓶中,加热反应1 h(100 ℃油浴),冷却3~5 min,再加入20 mL浓盐酸,继续100 ℃油浴加热反应12 h。反应完成后,将反应液倒入100 mL冰水中,用氢氧化钠(NaOH)溶液调节pH至中性,有浅黄色固体析出,抽滤并且用蒸馏水淋洗,干燥后得到1.04 g中间体Ⅱ,产率67.3%;m.p.87.6~88.6 ℃。1HNMR(DMSO-d6,400 MHz),δ:7.82(d,1H,J=9.32);7.43(d,1H,J=8.84 Hz);6.68(dd,1H,J=2.28,8.84 Hz);6.51(d,1H,J=2.04);5.99(d,1H,J=9.28 Hz);3.42(q,4H,J=7.00 Hz);1.12(t,6H,J=7.00 Hz)。
1.2.3 7-(二乙氨基)香豆素-3-甲醛(Ⅲ)的合成
量取3 mL(0.038 9 mol)DMF于50 mL圆底烧瓶中,在-7~-10 ℃下冰浴搅拌并缓慢滴加3.5 mL(0.037 5 mol)POCl3,持续搅拌直至形成冻盐,磁子搅拌不动即可。再称取0.50 g(1.7 mmol)中间体Ⅱ用足量的DMF溶解至澄清,再缓慢加入上述冻盐中,90 ℃油浴加热反应10 h。待反应结束后,将反应液倒入100 mL冰水中,调节pH至中性,在氢氧化钠(NaOH)溶液中观察到红褐色固体析出,抽滤,水洗,干燥,最后色谱柱分离得到0.41 g中间体Ⅲ,产率72.4%,m.p.158.7~160.3 ℃。1HNMR(DMSO-d6,400 MHz),δ:9.90(s,1H);8.42(s,1H);7.69(d,1H,J=9.08 Hz);6.84(dd,1H,J=2.44,9.08 Hz);6.62(d,1H,J=2.24 Hz);3.52(q,4H,J=7.04 Hz);1.15(t,6H,J=7.00 Hz)。
1.2.4 目标产物L的合成
称取0.060 9 g(0.43 mmol)2-噻吩甲酰肼和0.100 0 g(0.41 mmol)中间体Ⅲ于50 mL圆底烧瓶中,加入适量的无水乙醇溶解至澄清。在80 ℃油浴中,反应6 h后冷却至产物结晶析出,减压抽滤,粗产品用无水乙醇淋洗3次,干燥后得0.120 5 g橙色晶体产物L,产率79.6%,m.p.220.4~222.1 ℃。1HNMR(DMSO-d6,400 MHz),δ:11.89(d,1H,J=24.7 Hz);8.49(s,1H);8.37(s,1H);8.14(d,1H,J=21.2 Hz);7.91(d,1H,J=18.8 Hz);7.67(d,1H,J=8.7 Hz);7.28~7.20(d,1H);6.79(d,1H,J=8.4 Hz);6.60(d,1H,J=1.8 Hz);3.49(d,4H,J=7.1 Hz);1.15(t,6H,J=7.0 Hz)。13CNMR(DMSO-d6,101 MHz),δ:160.9,157.4,156.5,151.3,142.1,138.6,134.7,131.8,130.9,128.9,128.2,112.4,109.7,108.1,96.4,12.4。
1.3 光学性质测试
为研究目标产物L的溶剂化效应,配制了DMF体系的母液。移取40 μL该母液分置于7支5 mL离心管中,分别加入苯、二氯甲烷、乙酸乙酯、THF、乙醇、乙腈及DMF溶剂,定容至4 mL(1×10-5 mol/L),测试其紫外光谱和荧光光谱。
1.4 荧光探针L识别Cu2+和Zn2+测试
1.4.1 选择性实验
配制20种5×10-3 mol/L的硝酸盐水溶液(Na+、Ba2+、K+、Hg2+、Mn2+、Al3+、Cu2+、Cr3+、Ni2+、Pb2+、Zn2+、Cd2+、Co2+、Sr2+、Fe3+、Ag+、Ca2+、Bi3+、Mg2+、Li+)。分别取40 μL(2.5×10-4 mol/L)探针母液于21个5 mL的塑料离心管中,其中一个加入6 μL蒸馏水,另外20个离心管中加入6 μL不同金属离子水溶液,最后用THF定容到4 mL刻度线,测试其UV-可见吸收光谱和荧光发射光谱。
1.4.2 荧光滴定实验
取16个5 mL的塑料离心管,用移液枪移取200 μL(2.5×10-4 mol/L)DMF探针母液,再分别用移液枪移入0、20、40、60、……、260、280、300 μL(2.5×10-4 mol/L)硝酸铜(硝酸锌)水溶液,并用THF定容到4 mL刻度线,测试荧光发射光谱。
1.4.3 抗干扰试验
取20个5 mL的塑料离心管,向每个离心管中分别加入40 μL(2.5×10-4 mol/L)的探针母液和6 μL(5×10-3 mol/L)的硝酸铜(硝酸锌)水溶液,分别继续加入20种6 μL(5×10-3 mol/L)的硝酸盐水溶液,并用THF定容到4 mL刻度线,测试荧光发射光谱。
1.4.4 配合比实验
探针母液溶液和硝酸铜(硝酸锌)水溶液的总体积200 μL不变,n(探针L)∶n(硝酸铜(硝酸锌))分别为200∶0、195∶5、……、165∶35、160∶40、140∶60、……、20∶180,共16个不同的物质的量比配取,并用THF定容到4 mL,进行荧光光谱测试。
2 结果与讨论
2.1 化合物L的光学性质
2.1.1 紫外光谱(UV-Vis)和荧光光谱
根据图2a及表1所示数据,随着溶剂极性的增加,化合物L的紫外-可见吸收光谱呈现出一定的红移现象,这一溶剂化效应揭示了溶剂分子与溶质分子之间存在相互作用,促使吸收峰向长波方向迁移。另外,该荧光探针在440 nm附近有1个吸收峰,其摩尔消光系数(ε)均达到 104 L/(mol·cm),据此可推断该吸收峰的跃迁可归因于整个分子的π→π*跃迁或分子内电荷转移(ICT)[42,43]。
表1 化合物L在不同溶剂中的UV-Vis和荧光光谱结果注
Tab.1 UV-Vis and fluorescence spectra of compound L in different solvents
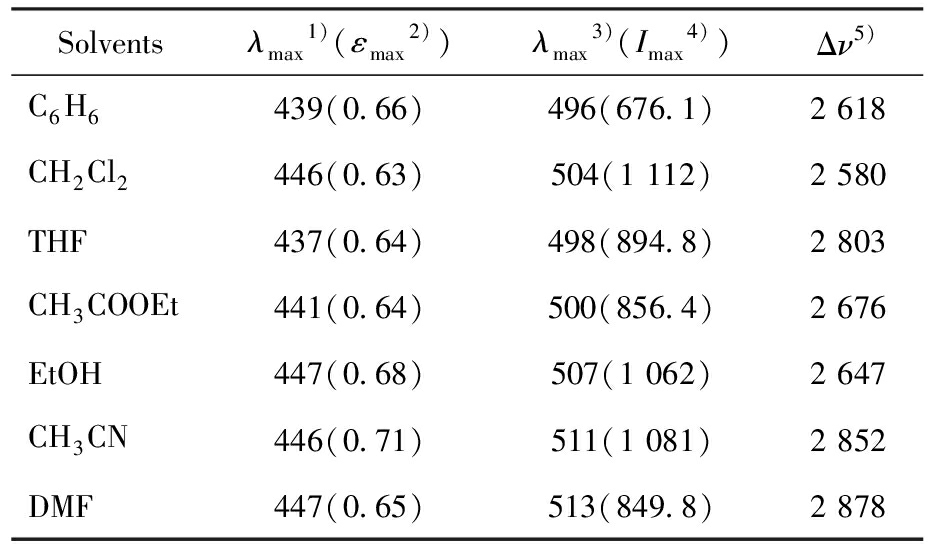
Solventsλmax1)(εmax2))λmax3)(Imax4))Δν5)C6H6439(0.66)496(676.1)2 618CH2Cl2446(0.63)504(1 112)2 580THF437(0.64)498(894.8)2 803CH3COOEt441(0.64)500(856.4)2 676EtOH447(0.68)507(1 062)2 647CH3CN446(0.71)511(1 081)2 852DMF447(0.65)513(849.8)2 878
Note:1)Position of the maximum absorption peak in nm (1.0×10-5 mol/L);2)Maximum molar absorbance is 105 L/(mol·cm);3)Peak position of SPEF (steady-state photoluminescence emission) when excited at the absorption maximum;4)Fluorescence intensity at the emission peak;5)Stokes shift in cm-1.
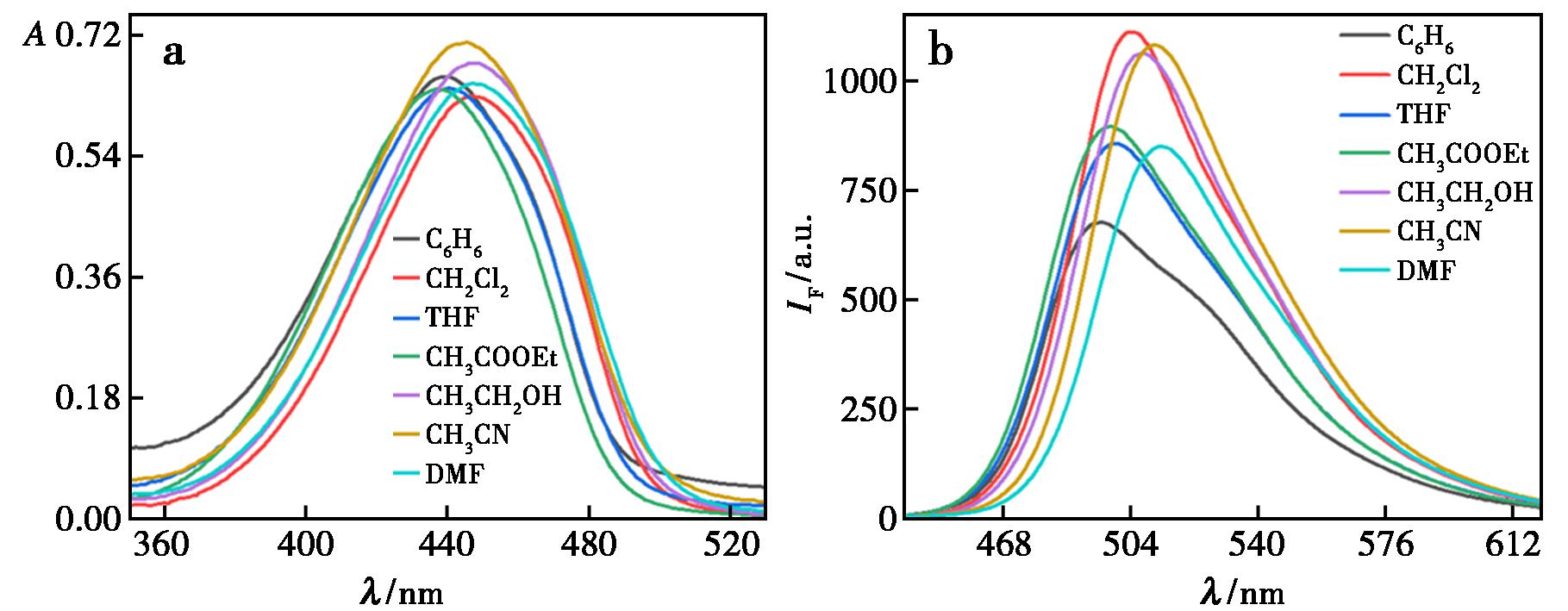
图2 化合物L的紫外吸收光谱图(a)和荧光发射光谱图(b)
Fig.2 UV absorption spectra (a) and fluorescence emission spectrum (b) of compound L
荧光光谱(图2b)显示,在不同极性的溶剂中,化合物L均有1处发射峰位于500 nm长波方向,并展现出较大的斯托克斯位移,尤其在DMF中,斯托克位移值最大,为2 878 cm-1。荧光分子由于斯托克位移较大,因此在检测灵敏度较高的同时,具有较低的背景干扰优势。这表现出化合物L在作为荧光探针时,展现出较大潜能。
2.1.2 聚集态荧光光谱(AIE)
为了探讨荧光探针L的聚集诱导发光特性,将一系列不同含水量(fw,范围从0~95%)的混合溶液加入到四氢呋喃溶液中,然后对它们的紫外和荧光变化进行测试与对比。由图3可知,在365 nm紫外灯照射下,四氢呋喃溶液呈翠绿色荧光,当含水量逐渐增加至60%时,荧光强度达到最高,随后荧光逐渐减弱,这些表明了该化合物显示出典型的聚集态发光(AIE)现象。随着含水量的增加,在长波方向出现由米氏效应和光散射引起的“拖尾”现象和高的吸收率,表明不良溶剂的增加形成了纳米聚集[44]。
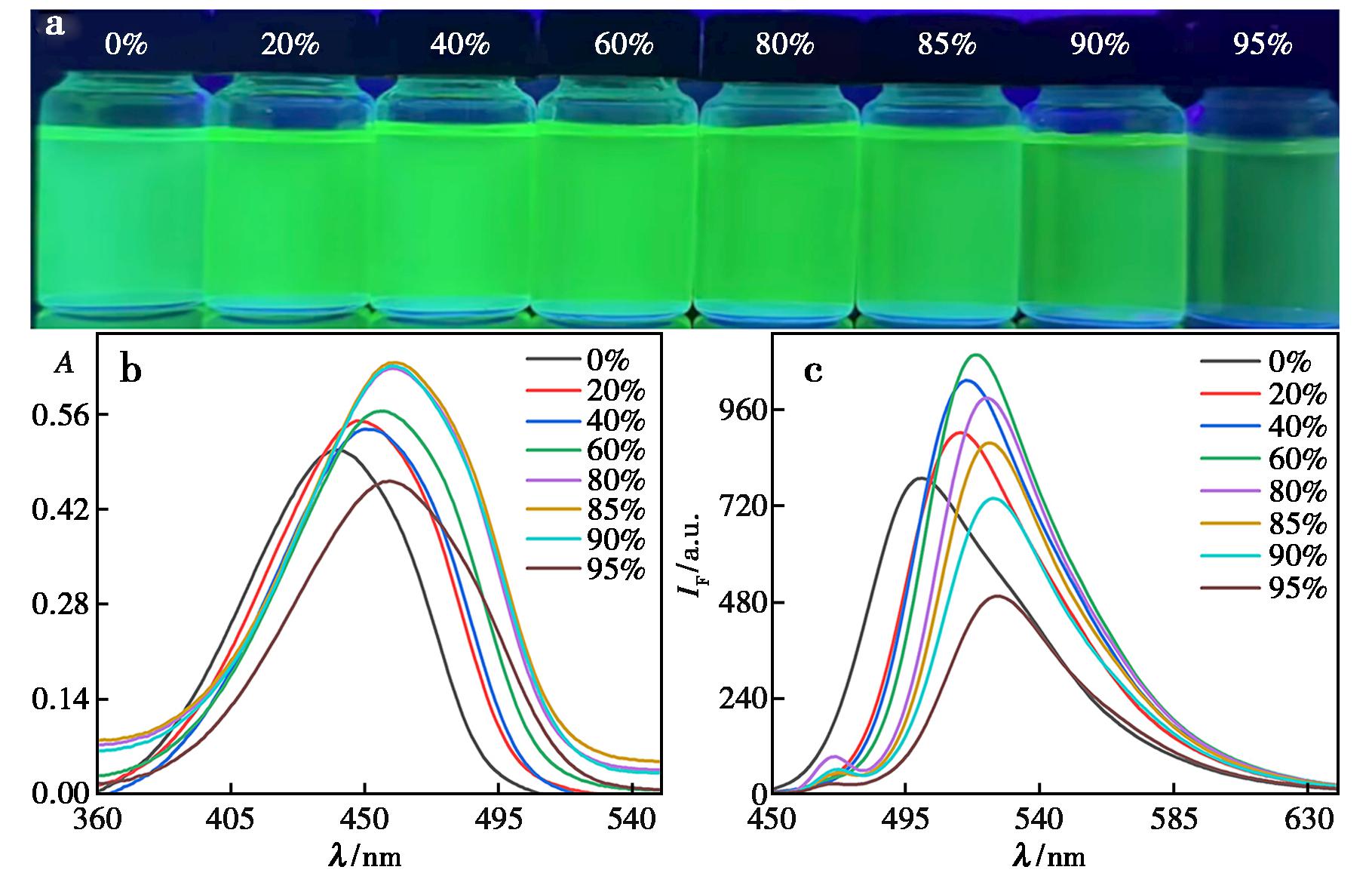
图3 在不同水比例THF/水混合溶剂中化合物L的荧光照片(a)、紫外吸收光谱图(b)和荧光图(c)
Fig.3 Fluorescence photos (a);UV absorption spectra (b);emission spectrum (c) of compound L in THF/water mixtures with varying water fractions
图4的荧光响应曲线表明,该化合物的发光行为呈现显著的水分依赖性特征:荧光强度随含水量梯度变化呈现先显著增强后快速淬灭的变化规律,这一典型浓度响应特性证实了其聚集诱导发光(AIE)的本质属性。可归因于,在纯THF溶剂体系中,分子内单键可自由旋转,导致激发态能量通过非辐射衰减途径大量耗散,表现为荧光量子效率的显著抑制[38]。随着含水量增加,荧光强度先升后降,这表明体系中的纳米聚集体从有序晶态向无序非晶态转变,导致荧光强度呈现断崖式衰减[45,46]。
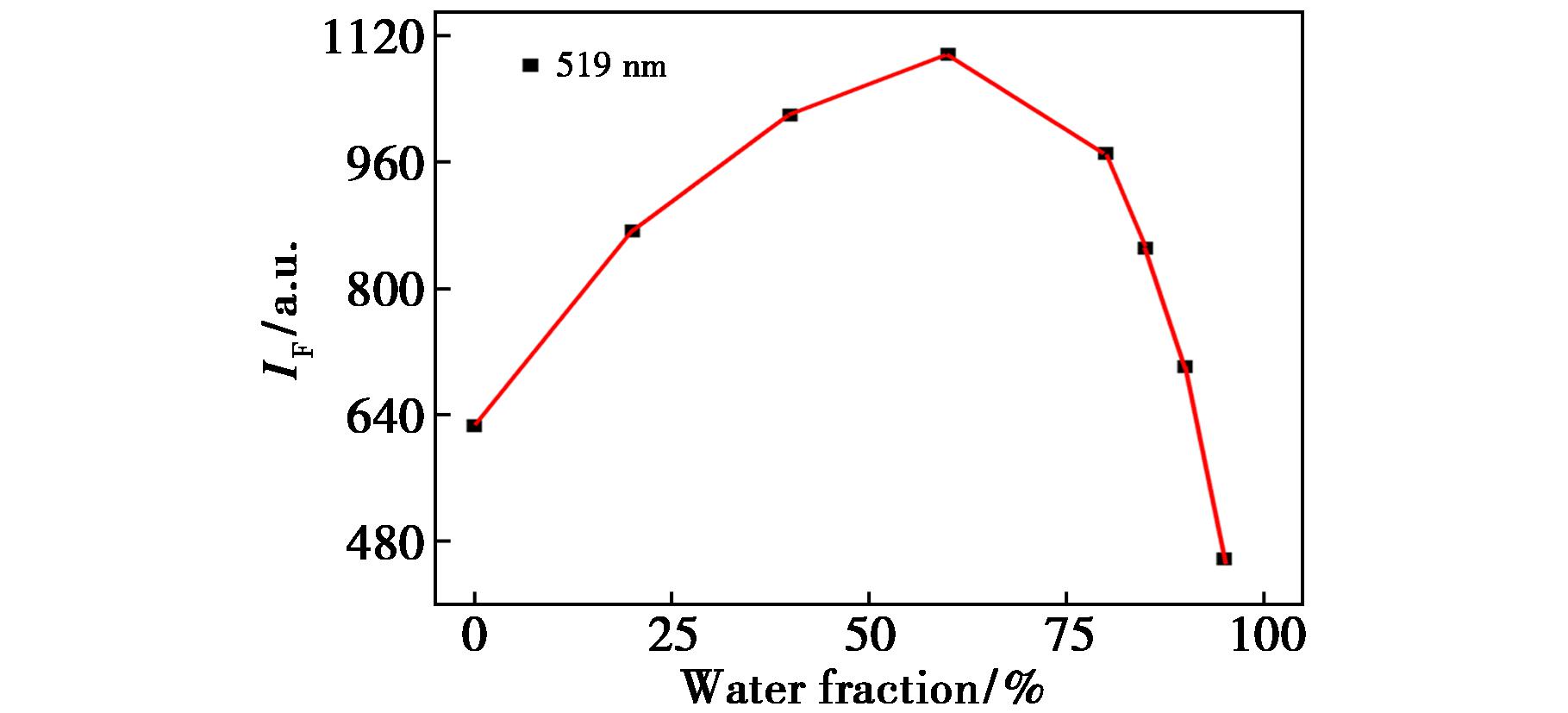
图4 化合物L的荧光强度随水含量变化曲线
Fig.4 Fluorescence intensity curve of compound L with varying water content
2.2 荧光探针L对Cu2+和Zn2+的识别
2.2.1 选择性
为了深入探究荧光探针L对不同金属离子的识别能力,本文在四氢呋喃(THF)溶剂环境下展开。探针L的溶液中分别加入了3倍物质的量的20种常见金属离子。随后,通过观察溶液的颜色变化以及对其荧光光谱进行分析,以此来研究探针L对不同金属离子的识别效果。如图5所示,探针L在加入Cu2+时溶液发生荧光淬灭,在加入Zn2+时溶液呈现强烈的黄色荧光,而加入其他金属离子时则产生绿色荧光。探针L溶液于501 nm处有1个显著的荧光发射峰,如图6a所示。当Cu2+加入该溶液后,系统荧光强度由最初的491.3急剧下降至5.05,荧光强度减弱至97.3倍之多,这一显著变化明确显示出探针L荧光强度被迅速抑制。与之相比,其他金属离子的荧光强度在与探针L作用时,效果就没有那么明显。探针L对Cu2+表现为荧光淬灭效应,这可能是因为Cu2+与探针L结合后,产生了螯合型荧光淬灭(CHEQ)效应[47,48]。与此同时,在365 nm紫外灯照射下,探针L的初始溶液显示强烈的绿色荧光,而加入Zn2+后,溶液呈现黄色荧光,于447 nm激发波长下,荧光光谱的最大荧光波长由496 nm红移至520 nm,产生了明显的红移现象。此外,图6b显示了在探针L和各自金属离子的混合溶液中记录的521和514 nm(F521 nm/F514 nm)的荧光发射强度比值,其中Zn2+的存在显著增加。综上所述,探针L对Cu2+和Zn2+有着明显的选择性识别。

图5 在365 nm的紫外灯照射下,化合物L加入各种金属离子的荧光效果图
Fig.5 Fluorescence responses of compound L to various metal ions under 365 nm UV light irradiation
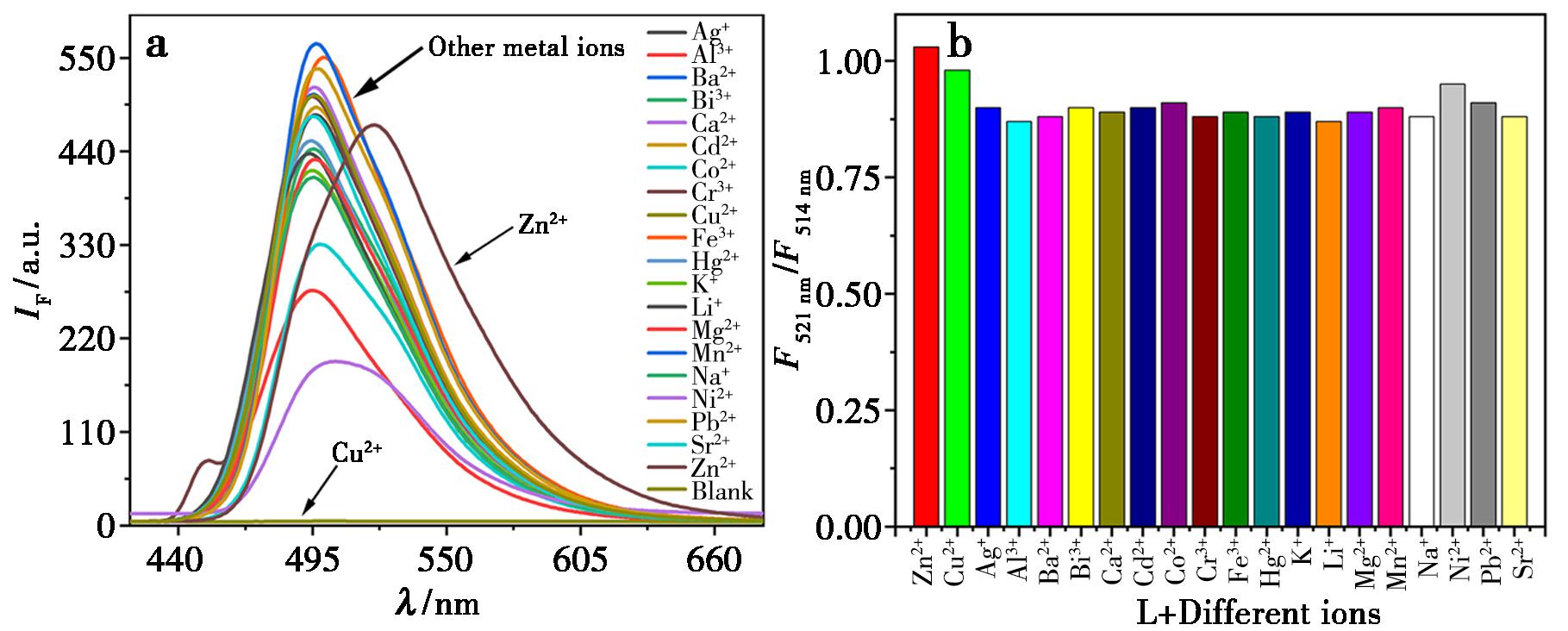
图6 a.化合物L加入各种金属离子后的荧光发射光谱;b.相同的条件下,不同的金属离子存在下的比率荧光响应曲线变化(F521 nm/F514 nm)
Fig.6 a.Fluorescence emission spectra of compound L after adding various metal ions;b.Changes in ratio fluorescence response curves (F521 nm/F514 nm) in the presence of different metal ions under the same conditions
2.2.2 抗干扰实验及应用
L-Cu2+和L-Zn2+系统中其他金属离子的干扰作用,在共存离子竞赛实验中进行评价。在L+Cu2+(L+Zn2+)体系中加入相同物质的量之比的上述20种金属离子进行荧光光谱测试。由图7可知,在该体系中加入Cu2+和其他金属离子后,体系的荧光强度几乎保持不变,这表明共存阳离子对探针L对Cu2+的识别效果的影响较小;在该体系中加入Zn2+及其他金属离子后,体系的荧光发射强度比率在521和514 nm(F521 nm/F514 nm)时几乎可以忽略,对探针L对Zn2+的比值检测的影响较小,说明了Zn2+的比值检测的准确性。上述结果表明,探针L对其他金属离子具有良好的抗干扰能力,且具有一定的应用价值。
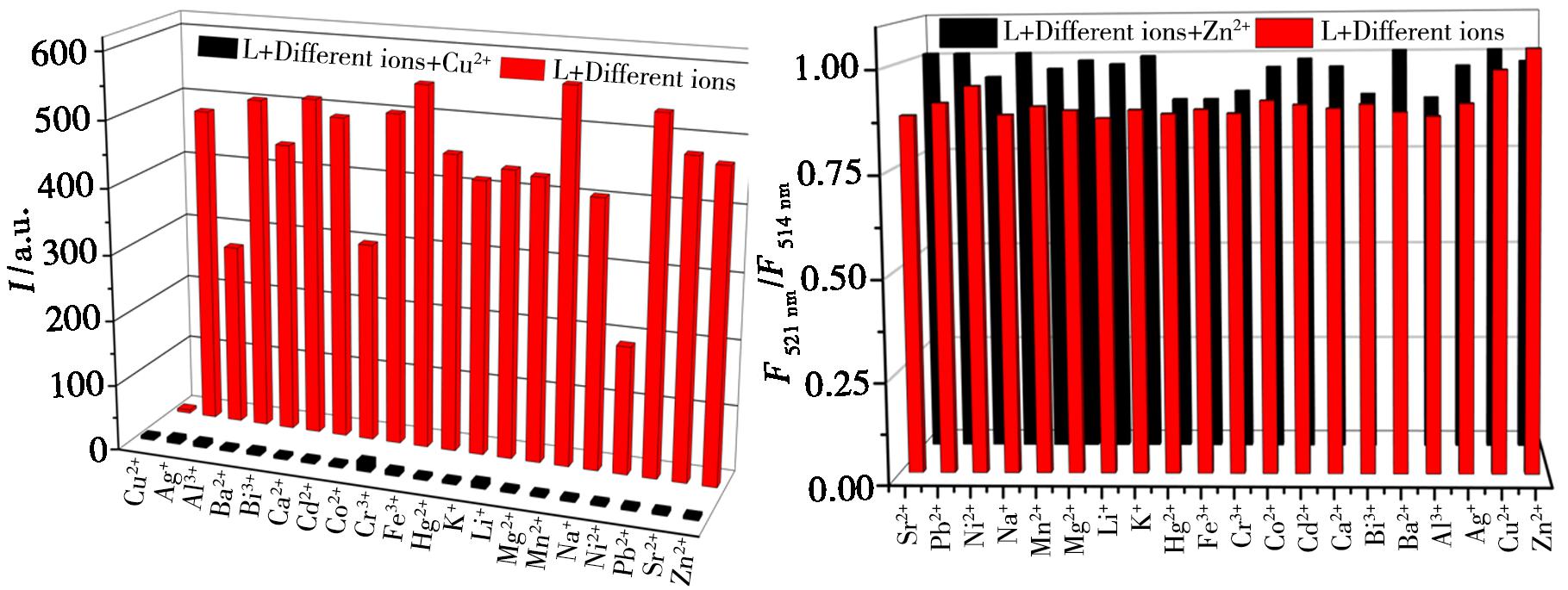
图7 其他金属离子对探针L识别Cu2+(a)、Zn2+(b)的干扰
Fig.7 Interference of other co-existing meta lions on the recognition of Cu2+ (a),Zn2+ (b) by probe L
通过上述实验,可以得知探针L对Cu2+和Zn2+的识别具有明显效果,因此研究了该探针在这两个离子检测中的实际应用。首先将星形试纸浸泡在含探针L的THF溶液中后在室温下干燥,接着将试纸浸入Cu2+和Zn2+两种离子溶液中。在365 nm紫外灯下观察到Cu2+和Zn2+在试纸上的颜色发生了明显的变化(图8)。Zn2+离子加入后,试纸由黄色荧光转变为绿色,而Cu2+加入后则变为暗蓝色。因此,该探针可应用于快速检测,实现金属离子的快速、可视化检测。

图8 涂有探针L(a)、Zn2+(b)和Cu2+(c)金属离子的星形试纸在紫外光下的颜色变化
Fig.8 Color changes of star-shaped test strips coated with probe L (a),Zn2+ (b) and Cu2+ (c) under UV light
2.2.3 荧光滴定实验与检测限分析
为评估探针L对Cu2+(Zn2+)的识别的反应灵敏性,于四氢呋喃溶液中进行荧光滴定实验。图9a显示,随着铜离子浓度(0~1.2×10-5 mol/L)的增加,探针溶液在λ=501 nm处的荧光强度呈减弱趋势。定量分析表明(图9b),该波长处荧光强度(y)与加Cu2+(x)呈显著负线性关系,拟合方程为y=-47.320 96x+646.615 53(R2=0.912 06)。
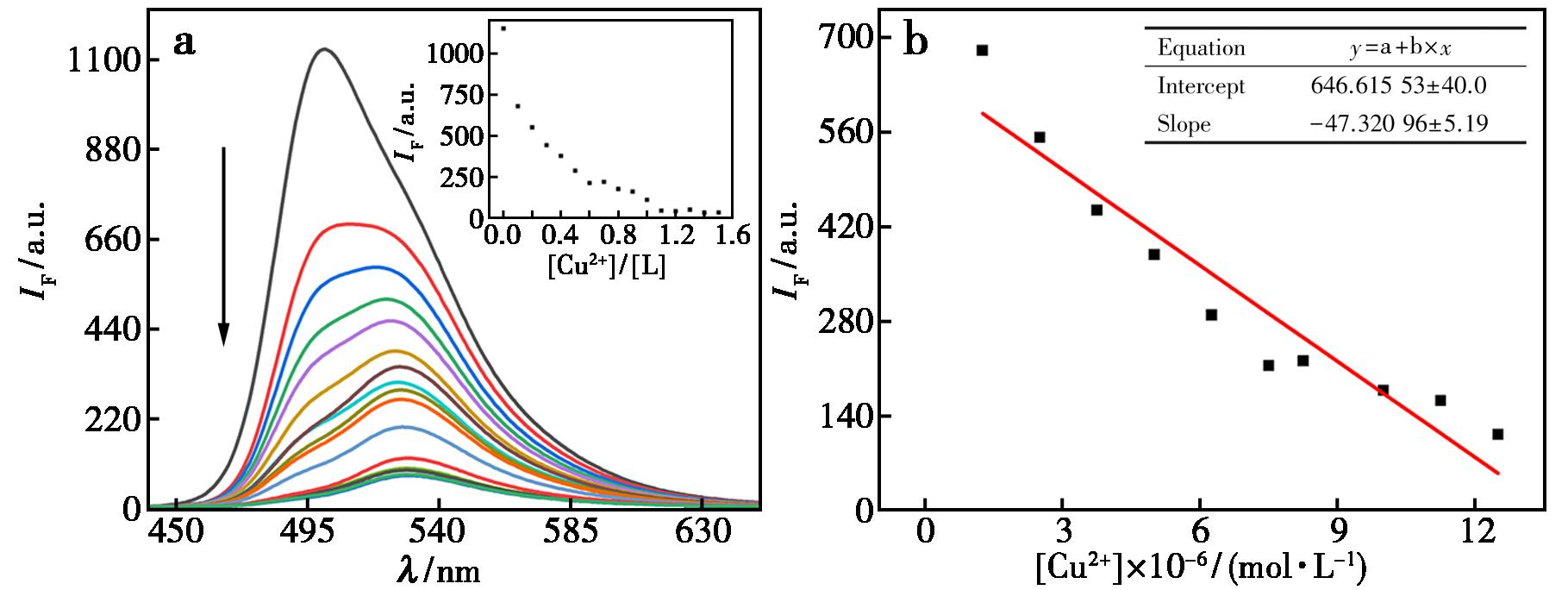
a.按比例加入铜离子后荧光变化谱图,沿箭头方向铜离子浓度逐渐增加;插图为不同铜离子浓度时,探针荧光强度变化;b.铜离子的滴定标准曲线斜率图
图9 探针L对Cu2+的荧光识别
Fig.9 Fluorescence recognition of copper ions by probe L
对于Zn2+的识别研究(图10a),探针体系的荧光光谱在添加Zn2+后发生13 nm红移(514~527 nm)。值得注意的是,当Zn2+当量增至0.5时,发射峰荧光发射强度比F521 nm/F514 nm从0.89跃升至1.04,随后该比值趋于稳定,表明探针L和Zn2+之间形成2∶1的配合物。在λ=503 nm处的荧光发射强度(y)与Zn2+(x)的校正曲线(0~1.0×10-5 mol/L)呈线性关系(图10b),其回归方程为y=-23.063 28x+908.039 49(R2=0.928 63)。
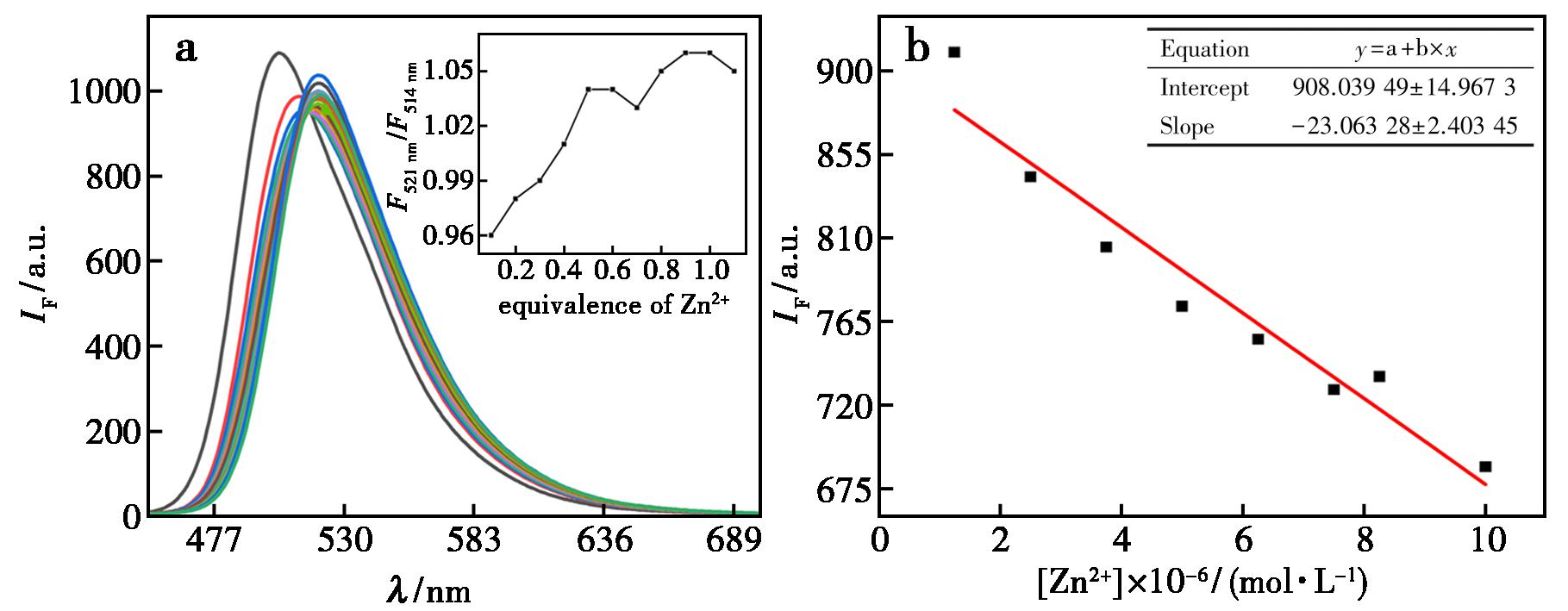
a.按比例加入锌离子后荧光变化谱图,曲线为加入不同锌离子浓度;插图为不同锌离子浓度时,探针荧光强度变化;b.锌离子的滴定标准曲线斜率图
图10 探针L对Zn2+的荧光识别
Fig.10 Fluorescence recognition of zinc ions by probe L
结合荧光滴定实验线性关系斜率,按LOD=3σ/S[27,49-51],计算出探针L的检出限,其中σ为20个空白样品的标准差,S为探针L在λCu=501 nm(λZn=503 nm)处荧光强度与金属离子浓度相关的线性回归斜率,计算得出铜离子的LOD=0.55 μmol/L,远低于WHO规定饮用水中铜的最大允许浓度(30 μmol/L)[52];锌离子的LOD=1.13 μmol/L,远低于WHO规定饮用水中锌的最大允许浓度(76 μmol/L)[53]。因此,与其他Cu2+/Zn2+探针相比,探针L具有检测环境和生物体中Cu2+和Zn2+的潜在用价值。
2.2.4 配合比与缔合常数
探究探针L与Cu2+(Zn2+)物质的量的结合比,在保持探针L溶液和Cu(NO3)3溶液[Zn(NO3)3溶液]的总体积(200 μL)和总浓度均不变的情况下,通过等摩尔连续变化法(Job′s plot)系统研究探针L与铜离子和锌离子的配位特性。
如图11a显示,当Cu2+物质的量分数([Cu2+]/([Cu2+]+[L]))增至0.504时,501 nm处荧光强度达到最小值,随后保存不变,此拐点明确指示探针L与Cu2+形成1∶1化学计量配合物。进一步通过线性分析验证配位模型(图11b),[1/(F-F0)]与1/[Cu2+]的线性回归方程为 1/(F-F0)=1.77×10-3/[Cu2+]+9.17×10-4(R2=0.970)。
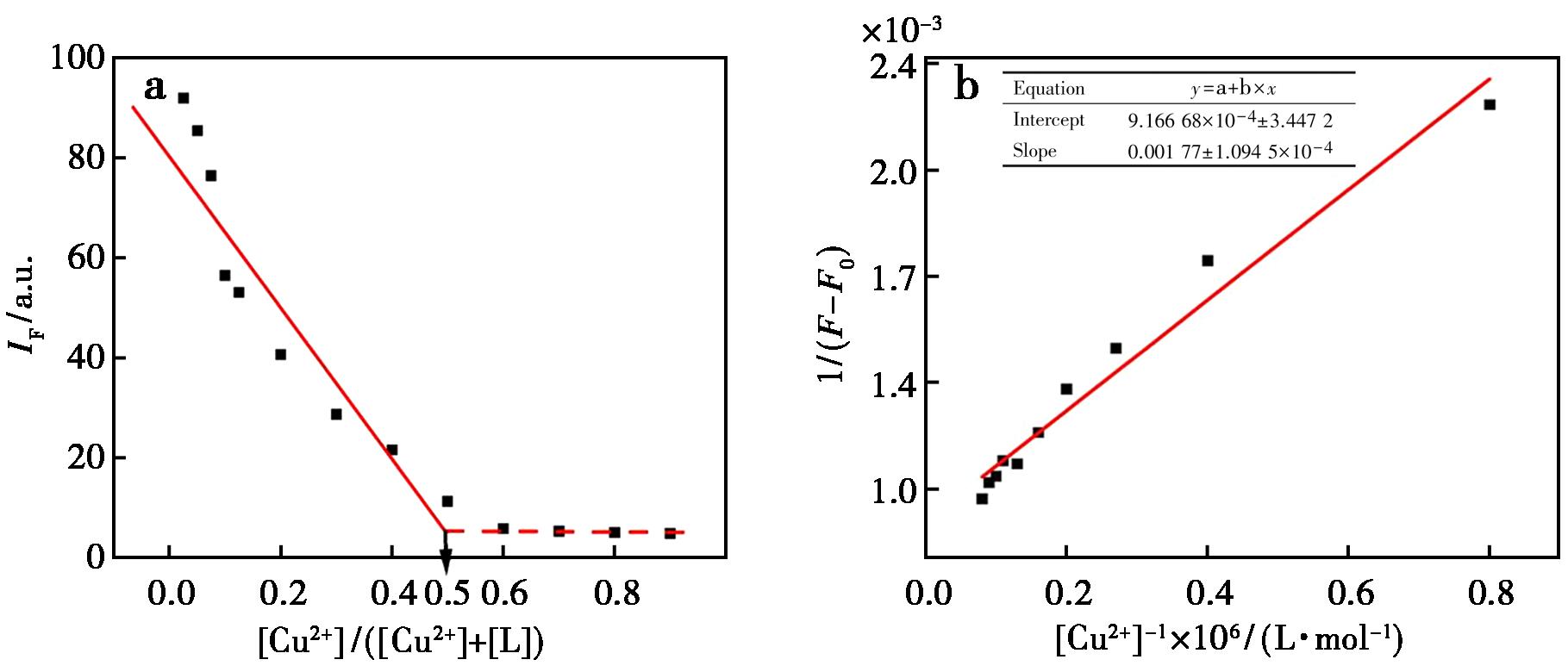
图11 探针L与铜离子的Job′s plot曲线(a)和缔合常数曲线(b)
Fig.11 Job′s plot (a) and association constant curve (b) of probe L and copper ions
对于Zn2+体系(图12a),Job′s曲线显示,466 nm处荧光强度随Zn2+物质的量分数增加先升至峰值(物质的量分数0.321),随后显著下降,此动态变化符合2∶1型配位机制(L:Zn2+)。如图12b所示,[1/(F-F0)]与1/[Zn2+]的线性关系1/(F-F0)=9.20×10-4/[Zn2+]+1.39×10-3(R2=0.931)进一步支持此配位比结论。
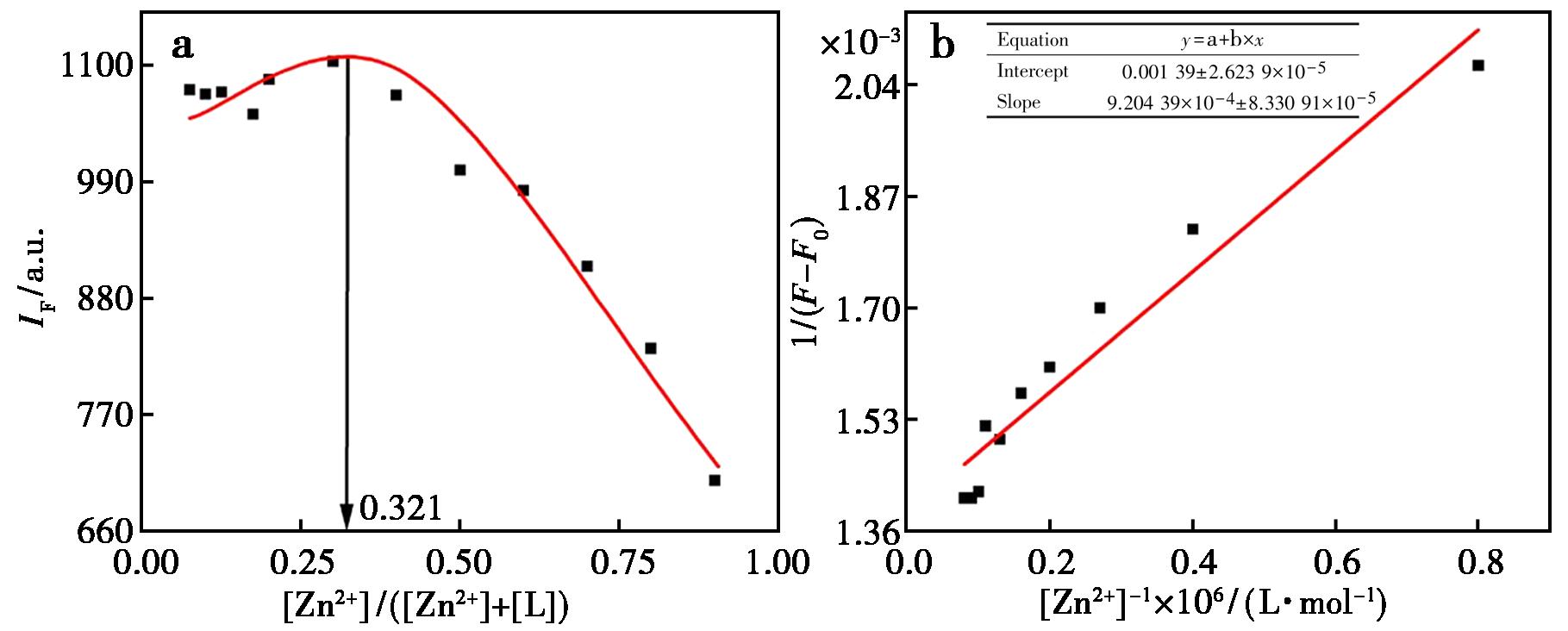
图12 探针L与锌离子的Job′s plot曲线(a)和缔合常数曲线(b)
Fig.12 Job′s plot association (a) and constant curve (b) of probe L and zinc ions
根据Benesi-Hildebrand方程可计算出探针L和Cu2+、Zn2+的结合常数Kb[54]分别为5.18×105和1.51×106 L/mol。
2.2.5 识别机理
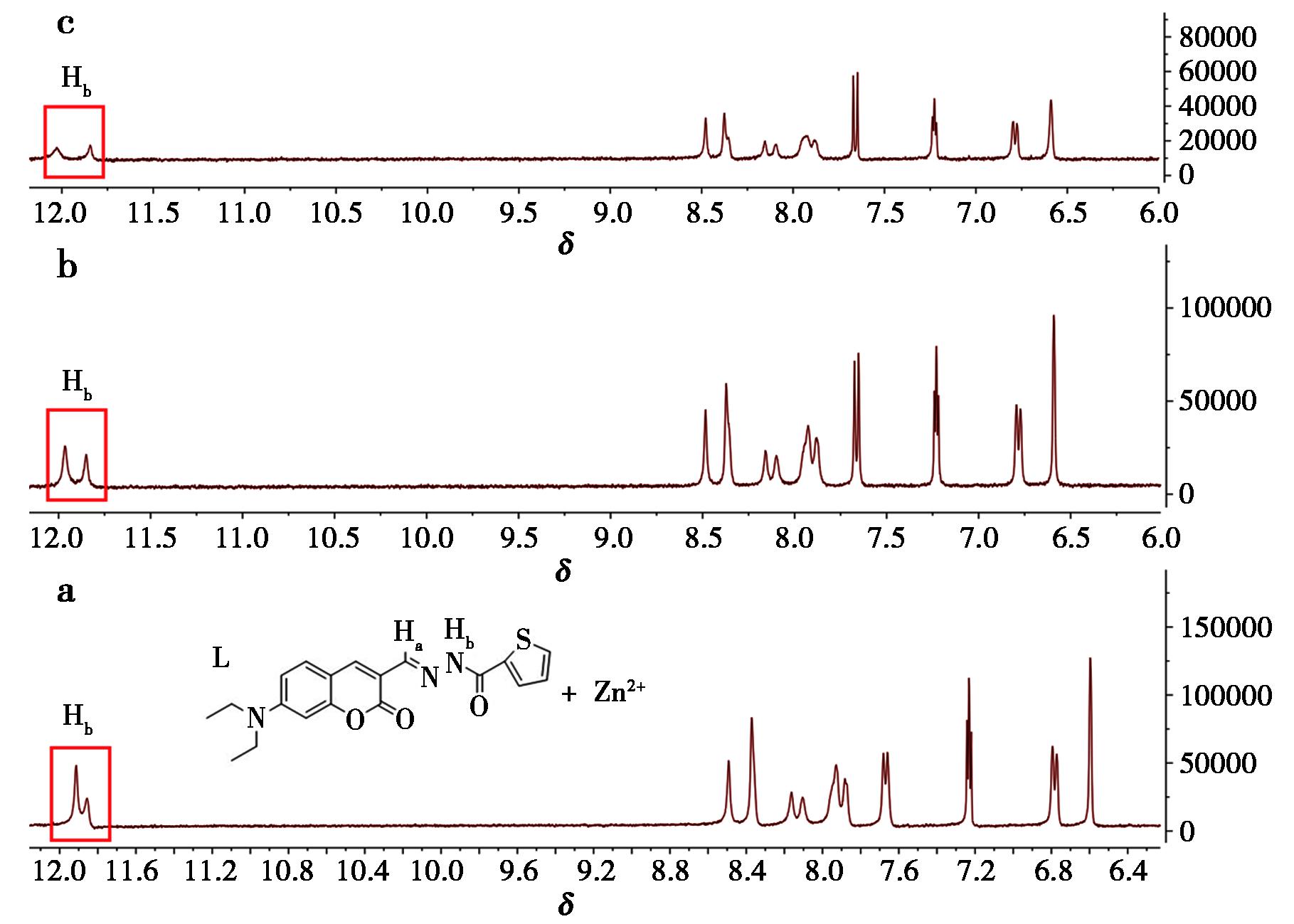
通过核磁共振氢谱动态滴定表征了探针L与Cu2+/Zn2+的分子识别机制(图13、14)。在氘代二甲亚砜(DMSO-d6)体系中,逐渐加入Cu2+溶液后,化学位移(δ)在8.49的Ha(—CH![]() N—)信号强度呈现浓度依赖性衰减,上述现象表明:Cu2+与探针L的席夫碱单元发生配位作用,质子积分面积定量分析显示Ha信号衰减程度与Cu2+浓度呈线性相关,进一步验证了1∶1物质的量之比的配位模式。此后,滴定后的溶液在紫外灯照射下,未呈现出明显的荧光现象。图14描述了探针L在DMSO-d6中加入Zn(NO3)2·6H2O后的核磁氢谱变化。当Zn2+加到探针L的溶液中时,亚氨基(—NH—)的质子信号化学位移从11.91移至12.03,积分面积减小。然而,在Zn2+存在下,探针L中其他质子的化学位移几乎没有变化,这表明来自探针L中的席夫碱氮原子参与了配位并与Zn2+形成配合物。
N—)信号强度呈现浓度依赖性衰减,上述现象表明:Cu2+与探针L的席夫碱单元发生配位作用,质子积分面积定量分析显示Ha信号衰减程度与Cu2+浓度呈线性相关,进一步验证了1∶1物质的量之比的配位模式。此后,滴定后的溶液在紫外灯照射下,未呈现出明显的荧光现象。图14描述了探针L在DMSO-d6中加入Zn(NO3)2·6H2O后的核磁氢谱变化。当Zn2+加到探针L的溶液中时,亚氨基(—NH—)的质子信号化学位移从11.91移至12.03,积分面积减小。然而,在Zn2+存在下,探针L中其他质子的化学位移几乎没有变化,这表明来自探针L中的席夫碱氮原子参与了配位并与Zn2+形成配合物。
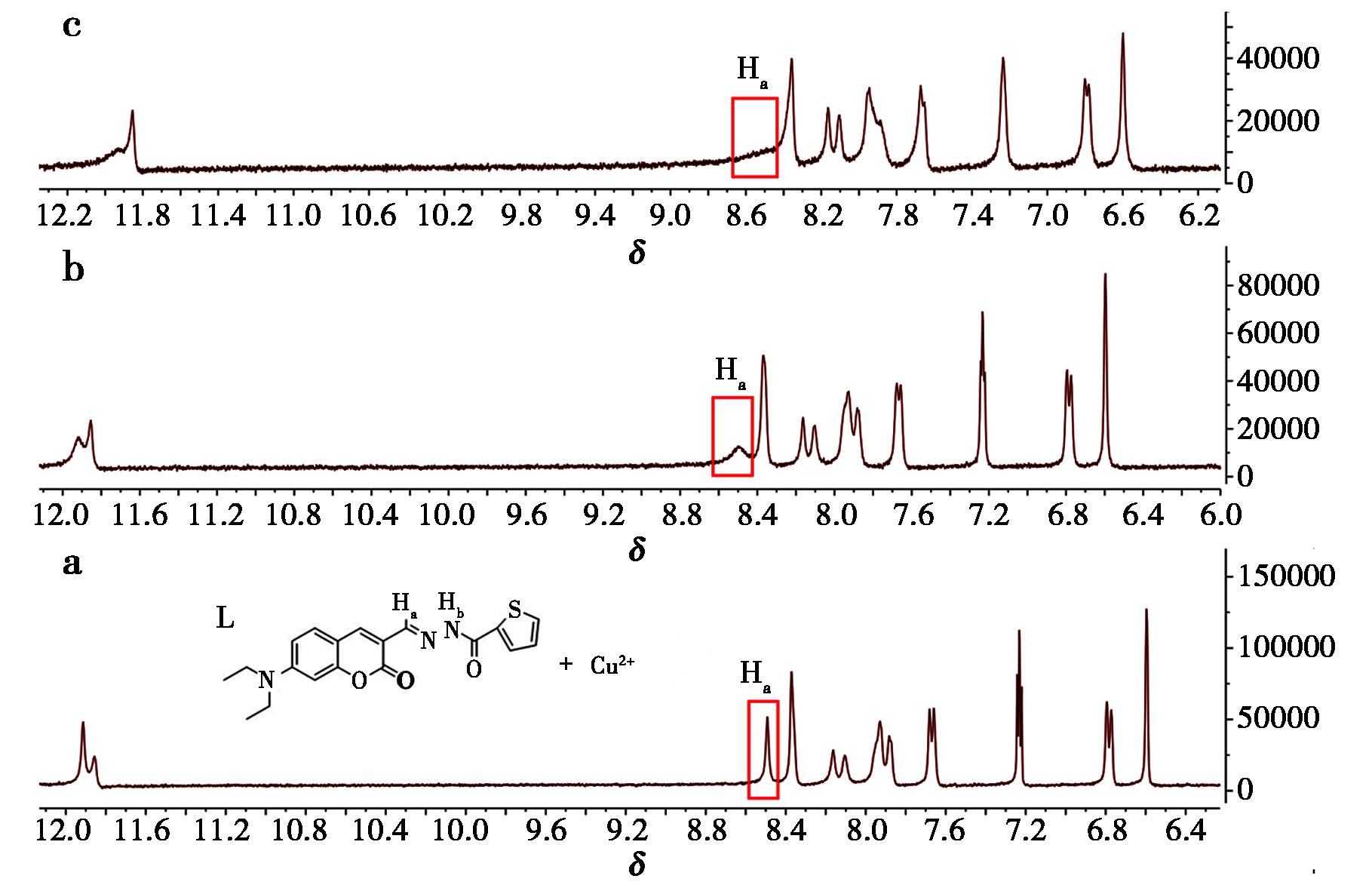
a、b、c为配体L的浓度保持不变,Ha的强度随Cu2+的加入逐渐减低
图13 不同浓度的Cu2+下的探针L的 1HNMR谱(DMSO-d6)
Fig.13 1HNMR spectrum of probe L at different concentrations of Cu2+ (DMSO-d6)
a、b、c为配体L的浓度保持不变,Ha的强度随Zn2+的加入逐渐减低
图14 不同浓度Zn2+下探针L的 1HNMR谱(DMSO-d6)
Fig.14 1HNMR spectrum of probe L at different concentrations of Zn2+ (DMSO-d6)
3 结论
本文设计合成一种基于7-二乙氨基香豆素-3-甲醛为母核构建的新型席夫碱荧光探针L,成功实现了对Cu2+和Zn2+的差异化识别检测。该探针通过配位模式差异展现出独特的双模式响应特征:与Cu2+结合时呈现荧光猝灭效应(OFF型响应),而与Zn2+作用则显示比率型荧光,两种检测模式具有显著区分度。并且Job′s曲线与荧光滴定数据确证探针与金属离子配合的物质的量之比分别为1∶1(Cu2+)和2∶1(Zn2+),该探针的检测限(LOD)达到0.55 μmol/L(Cu2+)和1.13 μmol/L(Zn2+),均低于WHO饮用水标准限值,展现出在环境水质监测中的实际应用潜力。
[1]Zhao H,Huang X,Jiang D H,Ren P P,Wang R J,Liu Z G,Li G,Pu S Z.J.Solid State Chem.,2024,339:124 987.
[2]Zeng Z H.Synthesis and Properties of 4-Methyl-7-hydroxycoumarin Schiff Base Fluorescent Probes.Ningxia:Ningxia Normal University,2023.曾姿涵.4-甲基-7-羟基香豆素席夫碱类荧光探针的合成及性能研究.宁夏:宁夏师范大学,2023.
[3]Li R,Chen T T,Pan X L.ACS Nano,2021,15(3):3 808-3 848.
[4]Liu Y,Nguyen M,Robert A,Meunier B.Acc.Chem.Res.,2019,52(7):2 026-2 035.
[5]Kaur K,Gupta R,Saraf S A,Saraf S K.Compr.Rev.Food Sci.Food Saf.,2014,13(4):358-376.
[6]Silva C S,Moutinho C,Ferreira D V A,Matos C.Int.J.Sci.Res.Methodol.,2019,13(3):57-80.
[7]Sailer J,Nagel J,Akdogan B,Jauch A T,Engler J,Knolle P A,Zischka H.Redox Biol.,2024,75:103 256.
[8]Abramowicz B,Kurek L,Chalabis-mazurek A,Lutnicki K.J.Elemental.,2021,26(1):301-311.
[9]Myint Z W,Oo T H,Thein K Z,Tun A M,Saeed H.Ann.Hematol.,2018,97:1 527-1 534.
[10]Collins J F.Copper:Basic Physiological and Nutritional Aspects.New York:Academic Press,2017.
[11]Karim N.J.Bahria.Univ.Med.Dent.College,2018,8(2):117-122.
[12]Coelho F C,Squitti R,Ventriglia M,Cerchiaro G,Daher J P,Rocha J G,Rongioletti M C,Moonen A C.Biomolecules,2020,10(6):897.
[13]Sensi S L,Granzotto A,Siotto M,Squitti R.Trends Pharmacol.Sci.,2018,39(12):1 049-1 063.
[14]Bisaglia M,Bubacco L.Biomolecules,2020,10(2):195.
[15]Davies K M,Mercer J F,Chen N,Double K L.Clin.Sci.,2016,130(8):565-574.
[16]Kang Y J.Pharmacol.Ther.,2011,129(3):321-331.
[17]Zhan J Y,Zhao J,Gan C F,Huang Y M.Chem.Reagents,2025,47(2):33-38.展军颜,赵杰,甘春芳,黄燕敏.化学试剂,2025,47(2):33-38.
[18]Chasapis C T,Ntoupa P S A,Spiliopoulou C A,Stefanidou M E.Arch.Toxicol.,2020,94:1 443-1 460.
[19]Sloup V,Jankovsk I,Nechybov
I,Nechybov S,Pe
S,Pe inkov
inkov P,Langrov
P,Langrov I.Sci.Agric.Bohem.,2017,48(1):13-21.
I.Sci.Agric.Bohem.,2017,48(1):13-21.
[20]Sikora J,Ouagazzal A M.Int.J.Mol.Sci.,2021,22(9):4 724.
[21]Wojtunik-kulesza K,Oniszczuk A,Waksmundzka-hajnos M.Biomed.Pharmacother.,2019,111:1 277-1 289.
[22]Li Z,Liu Y,Wei R X,Yong V W,Xue M Z.Biomolecules,2022,13(1):28.
[23]Brewer G J.Biofactors,2012,38(2):107-113.
[24]Pandey R,Kumar A,Xu Q,Pandey D S.Dalton Transactions,2020,49(3):542-568.
[25]Pandey R,Kumar P,Singh A K,Shahid M,Li P Z,Singh S K,Xu Q,Misra A,Pandey D S.Inorg.Chem.,2011,50(8):3 189-3 197.
[26]Sun J,Li T R,Liu C,Xue J,Tian L M,Liu K,Li S L,Yang Z Y.J.Photochem.Photobiol.A,2021,406:113 007.
[27]Liu J,Chen Q A,Li C H,Yu Q Q,Li Z K,Wang L,Wu X Y,Zhang Z.Anal.Lab.,2024,43(12):1 721-1 727.刘杰,陈全安,李辰昊,于庆庆,李子康,汪琳,吴心姨,张震.分析试验室,2024,43(12):1 721-1 727.
[28] apk
apk n A,Pi
n A,Pi kin M,Durmu
kin M,Durmu M,Bulut M.J.Mol.Struct.,2020,1 213:128 145.
M,Bulut M.J.Mol.Struct.,2020,1 213:128 145.
[29]Wetosot S,Pewklang T,Duangkamol C,Muangsopa P,Ngivprom U,Chansaenpak K,Ngernsoungnern A,Sritangos P,Chudapongse N,Lai R Y.J.Mol.Struct.,2022,1 260:132 840.
[30]Pramod A,Nadaf Y,Renuka C.Spectrochim.Acta,Part A,2019,223:117288.
[31]Arauzo A,Gasque L,Fuertes S,Tenorio C,Bernès S,Bartolomé E.Dalton Trans.,2020,49(39):13 671-13 684.
[32]Sedgwick A C,Wu L L,Han H H,Bull S D,He X P,James T D,Sessler J L,Tang B Z,Tian H,Yoon J.Chem.Soc.Rev.,2018,47(23):8 842-8 880.
[33]Zhao J Z,Ji S M,Chen Y H,Guo H M,Yang P.Phys.Chem.Chem.Phys.,2012,14(25):8 803-8 817.
[34]Nie L,Zhang Q.Chem.Reagent,2005,27(5):289-291.聂丽,张强.化学试剂,2005,27(5):289-291.
[35]Chen G W,Song F L,Xiong X Q,Peng X J.Ind.Eng.Chem.Res.,2013,52(33):11 228-11 245.
[36]Yuan L,Lin W Y,Zheng K B,Zhu S S.Acc.Chem.Res.,2013,46(7):1 462-1 473.
[37]De S A P,Moody T S,Wright G D.Analyst,2009,134(12):2 385-2 393.
[38]Zhu H,Fan J L,Wang J Y,Mu H Y,Peng X J.J.Am.Chem.Soc.,2014,136(37):12 820-12 823.
[39]Ding D,Li K,Liu B,Tang B Z.Acc.Chem.Res.,2013,46(11):2 441-2 453.
[40]Mei J,Huang Y H,Tian H.ACS Appl.Mater.Inter.,2017,10(15):12 217-12 261.
[41]Würthner F.Angew.Chem.Int.Ed.,2020,59(34):14 192-14 196.
[42]Li Y J,Liu T F,Liu H B,Tian M Z,Li Y L.Acc.Chem.Res.,2014,47(4):1 186-1 198.
[43]Tanaka H,Shizu K,Nakanotani H,Adachi C.J.Phys.Chem.C,2014,118(29):15 985-15 994.
[44]Chen Z,Zhang J,Song M,Yin J,Yu G A,Liu S H.Chem.Commun.,2015,51(2):326-329.
[45]Cai M M,Gao Z Q,Zhou X H,Wang X P,Chen S F,Zhao Y Z,Qian Y,Shi N,Mi B X,Xie L H.Phys.Chem.Chem.Phys.,2012,14(15):5 289-5 296.
[46]Yang Z Y,Chi Z G,Yu T,Zhang X Q,Chen M N,Xu B J,Liu S W,Zhang Y,Xu J R.J.Mater.Chem.,2009,19(31):5 541-5 546.
[47]Duarte T A,Coelho F L,Germino J C,Da C G G,Berbigier J F,Rodembusch F S,Atvars T D Z.Dyes Pigm.,2020,181:108 566.
[48]Formica M,Fusi V,Giorgi L,Micheloni M.Coord.Chem.Rev.,2012,256(1/2):170-192.
[49]Guo Y J,Cai B W,Xu H,Zhang M F.Hans J.Chem.Eng.Technol.,2024,14:147.郭玉洁,蔡博文,徐环,张茂峰.化学工程与技术,2024,14:147.
[50]Cao W B,Guo T,Ding Y G,Hu Y M,Liu D.Appl.Surf.Sci.,2023,634:157 650.
[51]Liu J,Leng C R,Chen Q A,Liang Q R,Li C H,Li S,Zhang Z,Xiao L F.ChemistrySelect,2022,7(45):e202 203 313.
[52]Pinacho-olaciregui J,Verde-sesto E,Taton D,Pomposo J A.Macromol.Rapid Commun.,2024,45(14):2 400 116.
[53]Kim M S,Yun D J,Chae J B,So H,Lee H,Kim K T,Kim M,Lim M H,Kim C.Sensors,2019,19(24):5 458.
[54]Barra M,Bohne C,Scaiano J.J.Am.Chem.Soc.,1990,112(22):8 075-8 079.