糖尿病是世界范围内导致死亡和残疾的重要原因,严重威胁着人类健康,其中大约90%的是2型糖尿病(T2DM),其表现为胰岛素抵抗和胰岛素分泌异常导致的持续高血糖水平[1,2]。目前临床针对T2DM的治疗方案仍以口服降糖药为主,口服降糖药从作用机制上可分为促进胰岛素分泌如磺脲类和格列奈类、抑制肝脏糖异生如双胍类、延缓碳水化合物的消化从而抑制糖吸收如α-糖苷酶抑制剂和α-淀粉酶抑制剂、激活过氧化物酶体增殖物激活受体(PPARs)如噻唑烷二酮类、调控胰岛素信号通路如蛋白酪氨酸磷酸酶1B(PTP1B)抑制剂和其他类等[3,4]。
咔唑是一类重要的天然杂环结构(图1),许多来源于植物和微生物的天然产物中含有咔唑结构,如九里香碱、玫瑰树碱等[5]。研究表明,咔唑类化合物具备抗菌、抗肿瘤、抗氧化、抗炎以及抗糖尿病等诸多活性,因而受到广泛关注[6]。咔唑现已成为药物设计中的关键药效团,许多研究者以咔唑为药效团设计合成了大量具有各种生物活性的衍生物。本文根据作用靶点的不同,对天然来源和合成的具有抗糖尿病活性的咔唑类化合物进行分类综述,以期能为后续抗糖尿病药物的研发提供借鉴和参考。
图1 咔唑的化学结构
Fig.1 Chemical structure of carbazole
1 咔唑类化合物抗糖尿病活性研究
1.1 α-葡萄糖苷酶抑制剂
α-葡萄糖苷酶对膳食碳水化合物的肠道消化、糖原水解至关重要。α-葡萄糖苷酶催化复合碳水化合物中α-葡萄糖苷键的水解,释放葡萄糖,从而升高血糖浓度[7]。抑制碳水化合物消化及其导致的吸收延迟是2型糖尿病治疗中控制血糖水平的有效途径[8]。α-葡萄糖苷酶抑制剂可以抑制小肠粘膜中α-葡萄糖苷酶的活性,延缓碳水化合物的消化[9]。因此,α-葡萄糖苷酶抑制剂可以降低餐后高血糖达到治疗糖尿病的重要作用。
Deng等[10]从黄皮(Clausena lansium)的果皮中分离得到了一种新的咔唑生物碱(化合物1,图2)和6种已知的咔唑生物碱,并对所有化合物进行了体外α-葡萄糖苷酶抑制活性评价。研究表明,化合物1(IC50=0.11 mmol/L)具有抗α-葡萄糖苷酶活性,且抑制活性明显强于阿卡波糖(IC50=1.55 mmol/L)。Raj等[11]采用茄呢醇溴化物将2-羟基-3-甲基咔唑进行烷基化修饰,合成了一种咔唑衍生物(化合物2,图2),并筛选了其体外抗糖尿病活性。结果表明,化合物2具有一定的α-葡萄糖苷酶抑制活性。
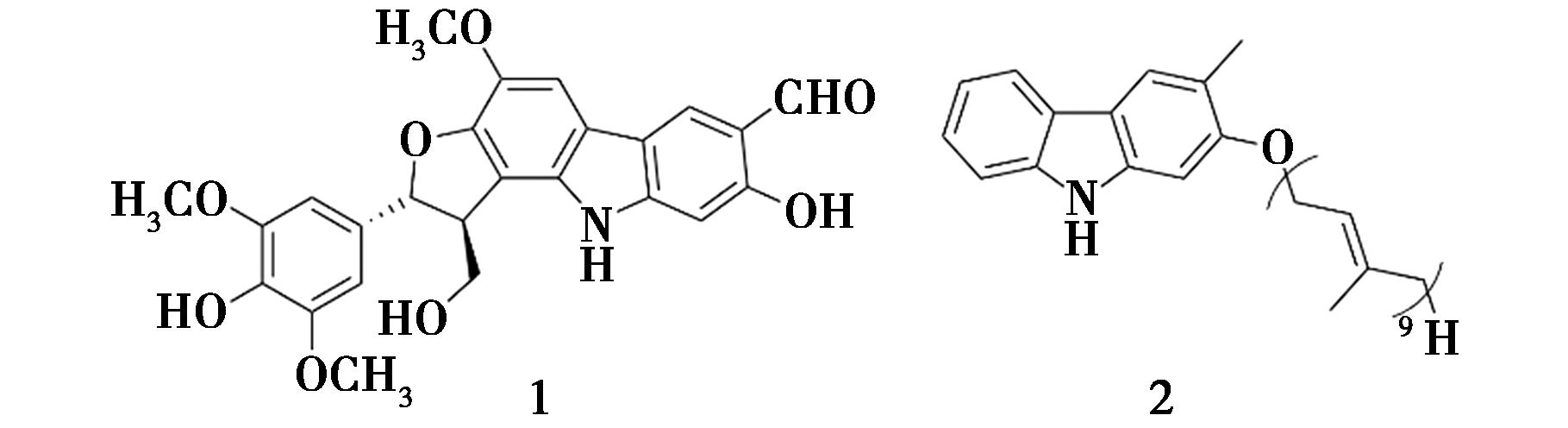
图2 化合物1和2的化学结构[10,11]
Fig.2 Chemical structure of compound 1 and 2[10,11]
Wang等[12]合成了一系列咔唑-三嗪类衍生物(化合物3,图3),大多数化合物显示出较强的α-葡萄糖苷酶抑制活性,IC50值在(4.27±0.07)~(47.75±0.25)μmol/L范围内。其中,化合物3k的活性最强,IC50值为(4.27±0.07)μmol/L。动力学分析表明,化合物3k为非竞争性抑制剂,Ki值为4.43 μmol/L。此外,通过分子对接证实了化合物3k与α-葡萄糖苷酶的结合作用。
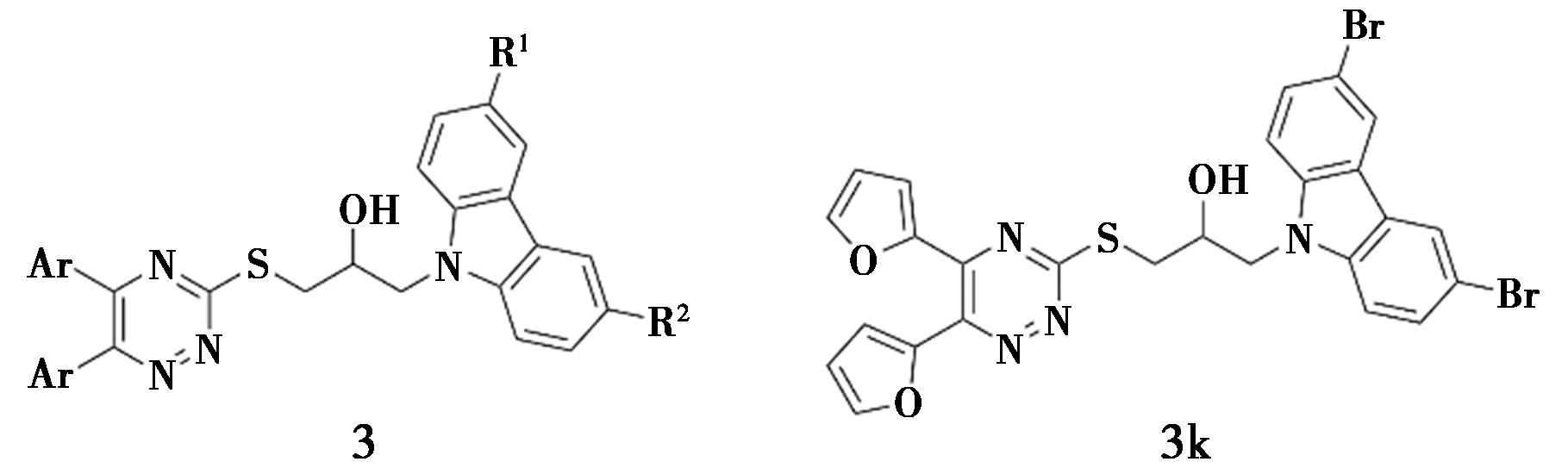
图3 咔唑衍生物3的化学结构[12]
Fig.3 Chemical structure of carbazole derivatives 3[12]
Iqbal等[13]通过点击化学反应合成了一系列咔唑衍生物(化合物4,图4)。化合物4g、4i、4j、4s、4t和4w~4z(IC50=(0.8±0.01)~(100.8±3.6)μmol/L)在体外对α-葡萄糖苷酶的抑制活性是阿卡波糖的几倍。其中,化合物4w、4y的活性最强,IC50值分别为(1.0±0.057)、(0.8±0.01)μmol/L。研究发现,除了化合物4f和4n~4p外,其他化合物在测试浓度下对3T3细胞系无明显毒性,但部分化合物的细胞毒性和酶活性之间没有明显的差距,这表明可能存在实现足够治疗指数的问题。然而化合物4w、4y对α-葡萄糖苷酶的IC50值≤1 μmol/L,它们的细胞毒性和酶活性IC50值之间至少有50倍的差距,因此使用化合物4w、4y可以获得良好的治疗指标。
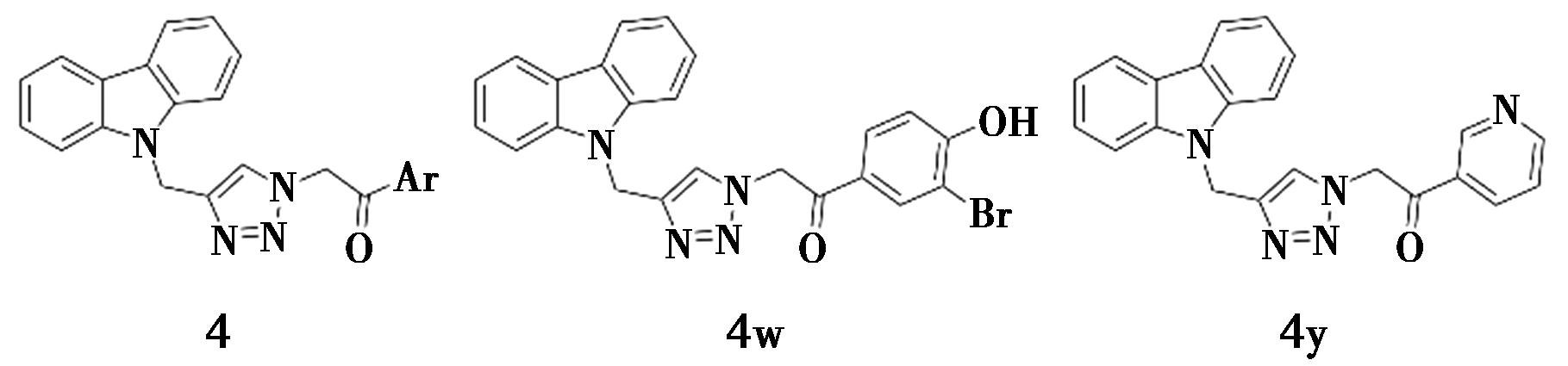
图4 咔唑衍生物4的化学结构[13]
Fig.4 Chemical structure of carbazole derivatives 4[13]
Ghani等[14]合成了8个咔唑衍生物5(图5),并对其进行抗α-葡萄糖苷酶活性研究和动力学分析。结果表明,所有衍生物都是非竞争性α-葡萄糖苷酶抑制剂,Vmax值随化合物浓度增加而降低而Km值保持不变,Ki值范围为0.17~51.65 μmol/L。其中,最有效的是含有2-苯并咪唑取代的化合物5a(Ki=0.17 μmol/L),用2-苯并噻唑取代后(化合物5b),其抑制活性显著降低了48倍以上(Ki=8.25 μmol/L)。同时,2-苯并噁唑环(Ki=11.75 μmol/L)替代的化合物5c对抑制活性的损害程度相同。化合物5a中苯并咪唑环的—NH基团似乎与酶形成了氢键。因此,苯并咪唑环比苯并噻唑环、苯并噁唑环对α-葡萄糖苷酶的抑制作用更强。杂环与酶结合的优先顺序为:咪唑>噻唑>噁唑。其他具有4-氯苯基、3-乙基苯基、2,3-二甲基苯基取代的咔唑衍生物5d~5f显示出相等水平的效力(Ki=14.53、14.35和18.15 μmol/L)。此外,具有喹啉-8-基取代的化合物5g(Ki=8.62 μmol/L)比化合物5h(Ki=51.65 μmol/L)表现出更高的抑制活性,表明喹啉环比1,1-联苯环更有利于抑制α-葡萄糖苷酶。
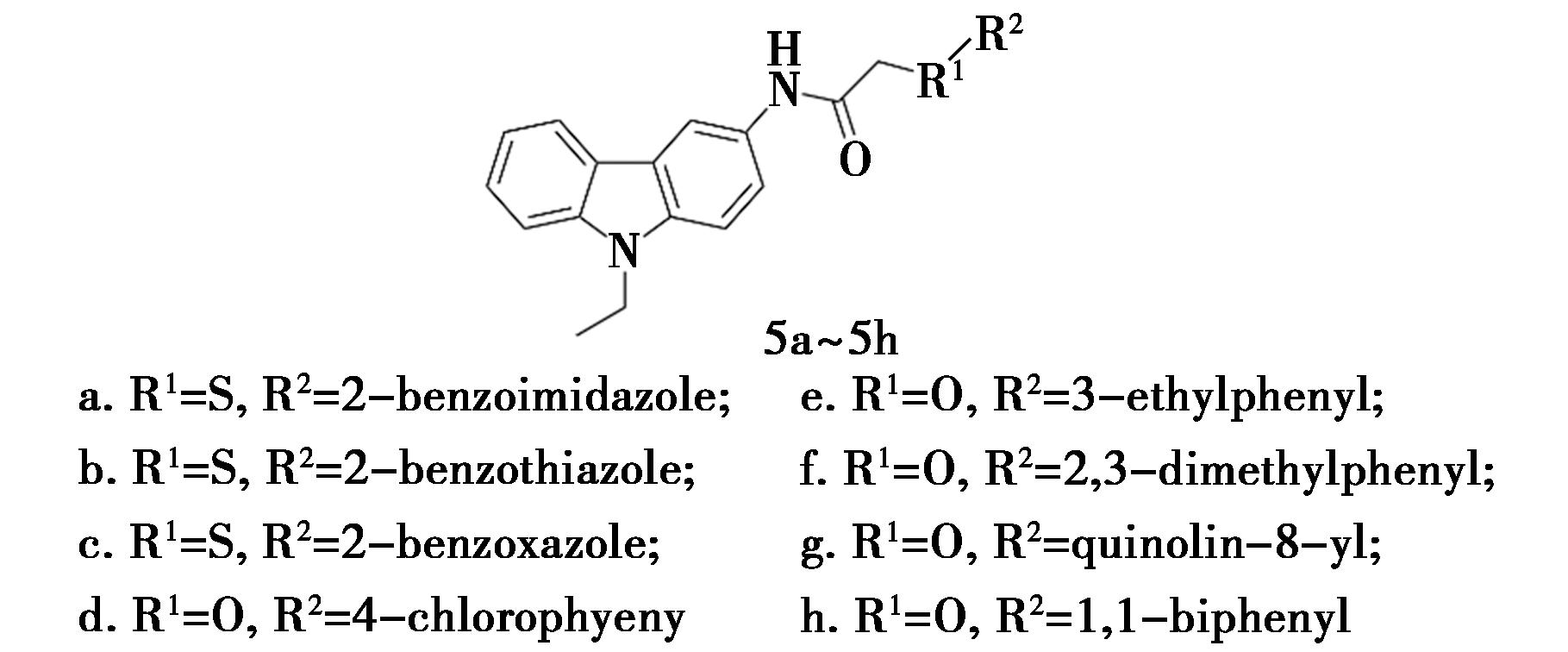
图5 咔唑衍生物5的化学结构[14]
Fig.5 Chemical structure of carbazole derivatives 5[14]
1.2 α-淀粉酶抑制剂
碳水化合物的消化吸收与餐后血糖浓度的变化密切相关。抑制碳水化合物代谢或吸收可以降低糖尿病患者的高血糖。碳水化合物在被身体吸收之前,必须分解成单糖[15]。α-淀粉酶是一种在膳食淀粉和糖原等的消化中起着重要作用的酶,由胰腺和唾液腺分泌。α-淀粉酶催化淀粉和其他葡萄糖聚合物的α-(1,4)-D-糖苷键水解为低聚糖[16]。因此,α-淀粉酶抑制剂通过抑制α-淀粉酶的活性来控制血糖水平,是糖尿病治疗的重要靶点。
Hassine等[17]对壳聚糖(Cs)进行化学修饰,合成了一种咔唑-三唑类壳聚糖(Cs-tri-carb)(化合物6,图6)。研究表明,Cs和Cs-tri-carb对α-淀粉酶和脂肪酶具有明显的抑制作用,对α-淀粉酶的IC50值分别为1.01和0.73 mg/mL,对脂肪酶的IC50值分别为1.70和0.87 mg/mL。此外,与未治疗的糖尿病组相比,Cs和Cs-tri-carb治疗组分别使肠道α-淀粉酶活性降低了26%和32%,血糖降低了26%和40%。同时,分别使肠道脂肪酶活性降低了33%和41%。综上所述,Cs-tri-carb的体内和体外抑制作用均强于Cs,这表明引入咔唑/三唑可以提高对α-淀粉酶和脂肪酶的抑制活性。分子对接研究表明,化合物6和α-淀粉酶的结合能为-9.1 kcal/mol,与11个α-淀粉酶的氨基酸残基形成了19个非共价相互作用。化合物6与残基TYR-62、HIS-101、ASP-197、LYS-200、GLU-233、GLU-240和HIS-305形成了7个氢键,与残基TRP-59形成了3个π-π堆积作用。同时,在其与残基VAL-163和LEU-165间观察到了5个π-烷基键,化合物6与残基HIS-101、ASP-197和ASP-300形成4种碳氢相互作用。
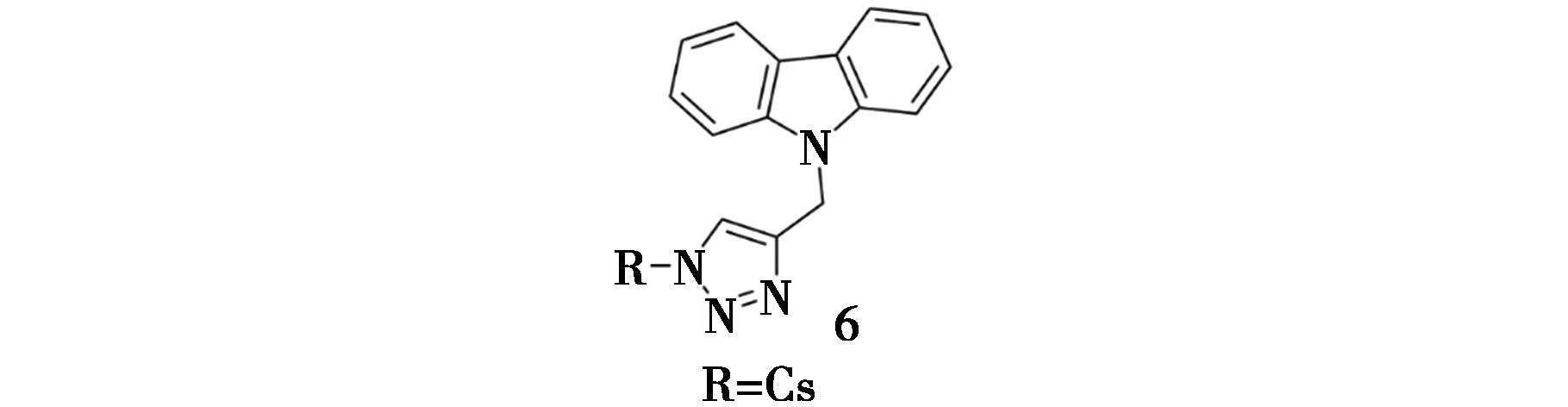
图6 化合物6的化学结构[17]
Fig.6 Chemical structure of compound 6[17]
1.3 过氧化物酶体增殖物激活受体PPARs激动剂
过氧化物酶体增殖物激活受体(PPARs)是核受体超家族的一个亚家族,分为PPARγ、PPARα和PPARδ这3个亚型。PPARs是配体依赖的转录因子,通过与调控基因增强子位点上的特定过氧化物酶体增殖物反应元件(PPREs)结合来调节靶基因的表达[18]。PPARs在调节血糖、胰岛素敏感性、脂肪贮存与代谢等方面起着至关重要的作用,PPARα和PPARγ与脂质代谢紊乱、糖尿病等代谢疾病密切相关[19]。PPARγ激动药罗格列酮和吡格列酮(噻唑烷二酮类)是临床上治疗2型糖尿病的重要药物[20],但其长期使用会存在体重增加等不良反应。因此,理想PPARγ激动剂的发现是糖尿病领域的重要研究方向。
Kumar等[21]以羟基咔唑为原料将连接体和受体结合单元连接在氧或者氮上合成了一系列羟基咔唑衍生物(化合物7),并评价了PPARα/γ双激动剂和抗氧化活性。研究发现,α-烷氧基丙酸系列显示出良好的PPARα激动活性(比匹立尼酸高约2倍),但PPARγ激动活性仅在较高浓度下可见。L-酪氨酸基化合物7a(图7)及其L-赖氨酸盐7b具有良好的PPARα/γ双重活性。它们表现出比匹立尼酸更好的活性,与罗格列酮具有同等效力。
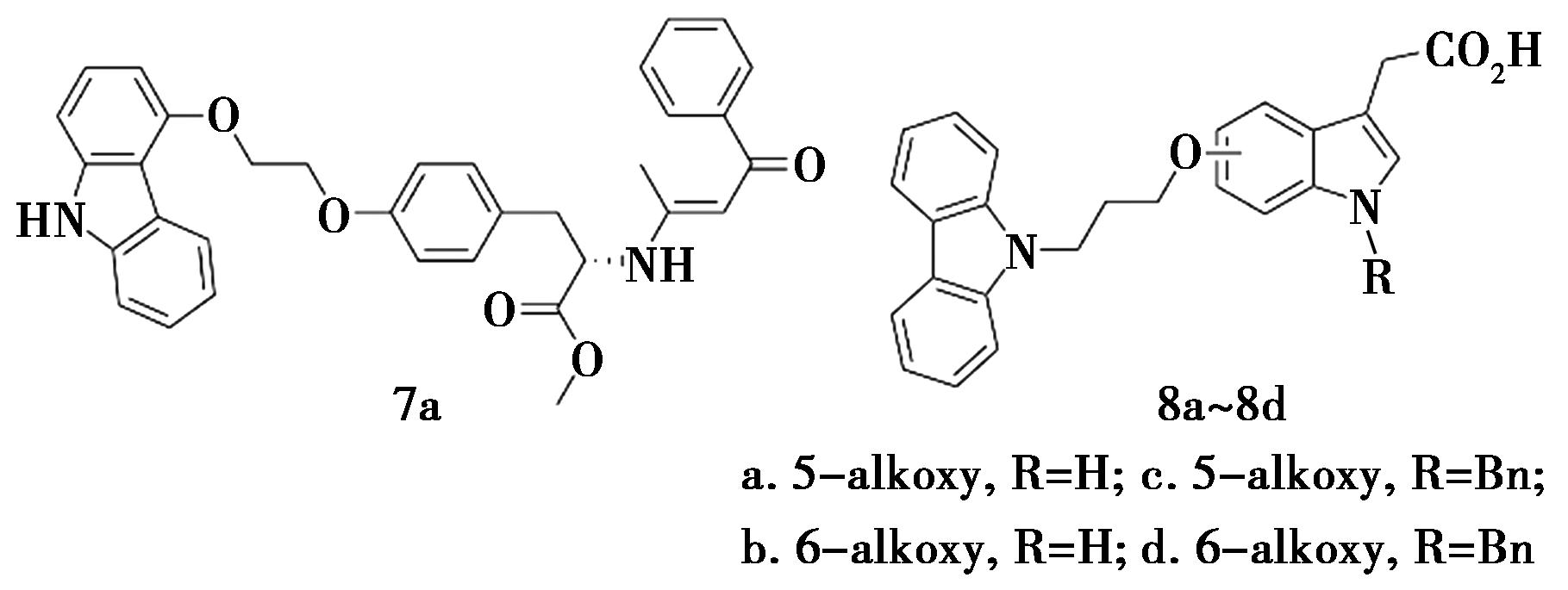
图7 咔唑衍生物7a和8的化学结构[21,22]
Fig.7 Chemical structure of carbazole derivatives 7a and 8[21,22]
Gim等[22]合成了含有5-或6-烷氧基乙酸的咔唑衍生物(化合物8,图7),并通过体外瞬时反活化试验评价了合成化合物的PPARs激动剂活性。研究发现,烷氧基连接在吲哚环上的连接位置会影响其PPARs激动活性。5-烷氧基衍生物8a和8b对PPARγ/δ的活化活性均高于相应的6-烷氧基衍生物8c和8d。其中,化合物8a对PPARα的激动活性最强,10 μmol/L化合物8a的激动活性是1 μmol/L阳性对照GW0746的10.1%。化合物8a对PPARα的激动活性最强。化合物8b被发现是最有效的PPARγ/δ双激动剂,10 μmol/L化合物8a对PPARγ的激动活性是1 μmol/L罗格列酮活性的28.7%,对PPARδ的激动活性是0.1 μmol/L参考药物GW0742活性的41.3%。
1.4 蛋白酪氨酸磷酸酶PTP1B抑制剂
胰岛素通过激活胰岛素受体来发挥作用,从而增加葡萄糖吸收和胰岛素信号转导。蛋白酪氨酸磷酸酶1B(PTP1B)作为胰岛素信号通路的负调控因子,使胰岛素受体和胰岛素受体底物去磷酸化,导致胰岛素信号传导减少。抑制PTP1B可改善胰岛素受体和胰岛素受体底物磷酸化和对胰岛素的敏感性,从而增强葡萄糖吸收[23]。因此,PTP1B是2型糖尿病的可行治疗靶点。
Ma等[24]从调料九里香(Murraya koenigii(L.) Spreng)中分离得到4种新的和14种已知的咔唑生物碱,并筛选了所有化合物9的PTP1B抑制活性。结果表明,化合物9k、9l和9r具有显著的PTP1B抑制活性,IC50值分别为1.773、1.875和2.286 μmol/L(图8)。
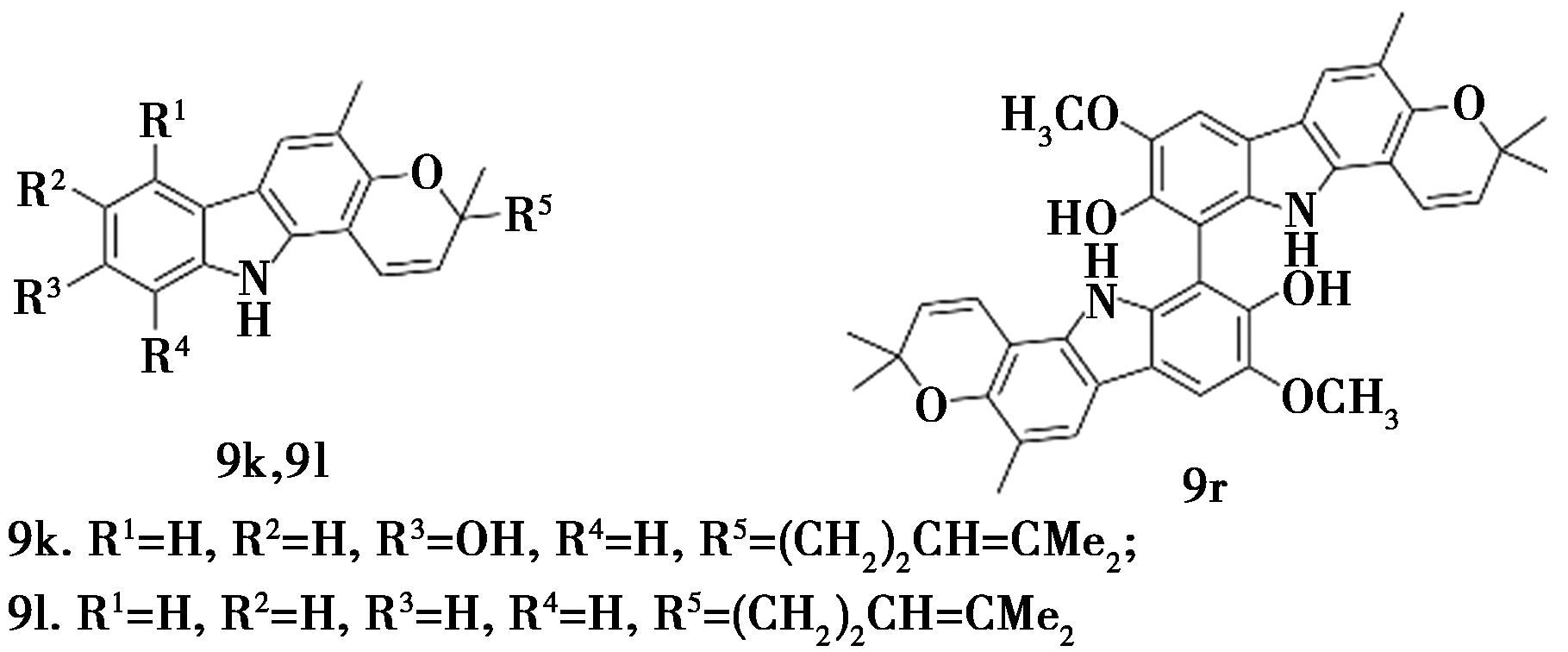
图8 化合物9k、9l和9r的化学结构[24]
Fig.8 Chemical structure of compound 9k、9l and 9r[24]
2019年,Li等[25]合成了一系列咔唑-酰腙衍生物(化合物10),这些化合物在20 μg/mL浓度下对PTP1B的抑制率为83.60%~96.86%,显示出较强的抑制活性。化合物10e、10g和10h(IC50=(1.06±0.23)~(1.91±0.29)μg/mL)的活性均高于齐墩果酸(IC50=(1.92±0.02)μg/mL),其中化合物10g(IC50=(1.06±0.23)μg/mL)的抑制作用最强(图9)。构效关系表明,单咔唑衍生物的活性强于双咔唑衍生物,且在双咔唑化合物中咔唑环N原子上烷基链太长或太短都不利于抑制活性。分子对接发现化合物10g的咔唑基和PTP1B氨基酸残基形成了2个氢键,酰胺基和萘环上的羟基各与氨基酸残基间形成1个氢键。
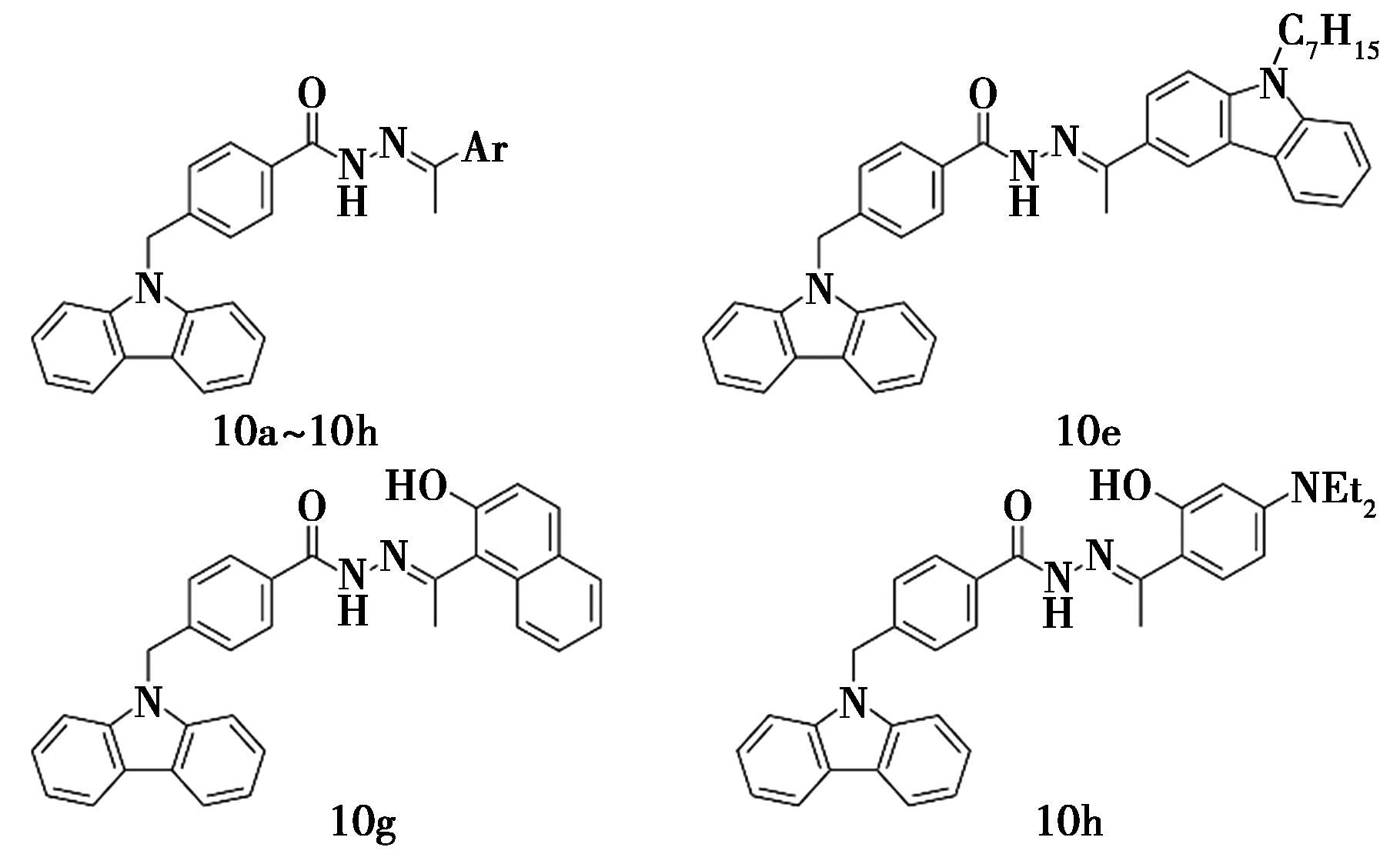
图9 咔唑衍生物10的化学结构[25]
Fig.9 Chemical structure of carbazole derivatives 10[25]
2020年,Li等[26]将N-直链烷基咔唑与碳酰肼药效团拼合形成了新型咔唑衍生物(化合物11,图10),并对其PTP1B抑制活性进行了测定。大多数化合物均具有较强的抗PTP1B活性,IC50值范围为(4.81±0.41)~(33.46±3.53)μmol/L,含有丁基取代的双咔唑基衍生物的活性最强,IC50值为(4.81±0.41)μmol/L。构效分析发现,双咔唑基的PTP1B抑制作用比单咔唑基衍生物更强,且双咔唑衍生物中烷基链为短链时更有利于PTP1B抑制活性。
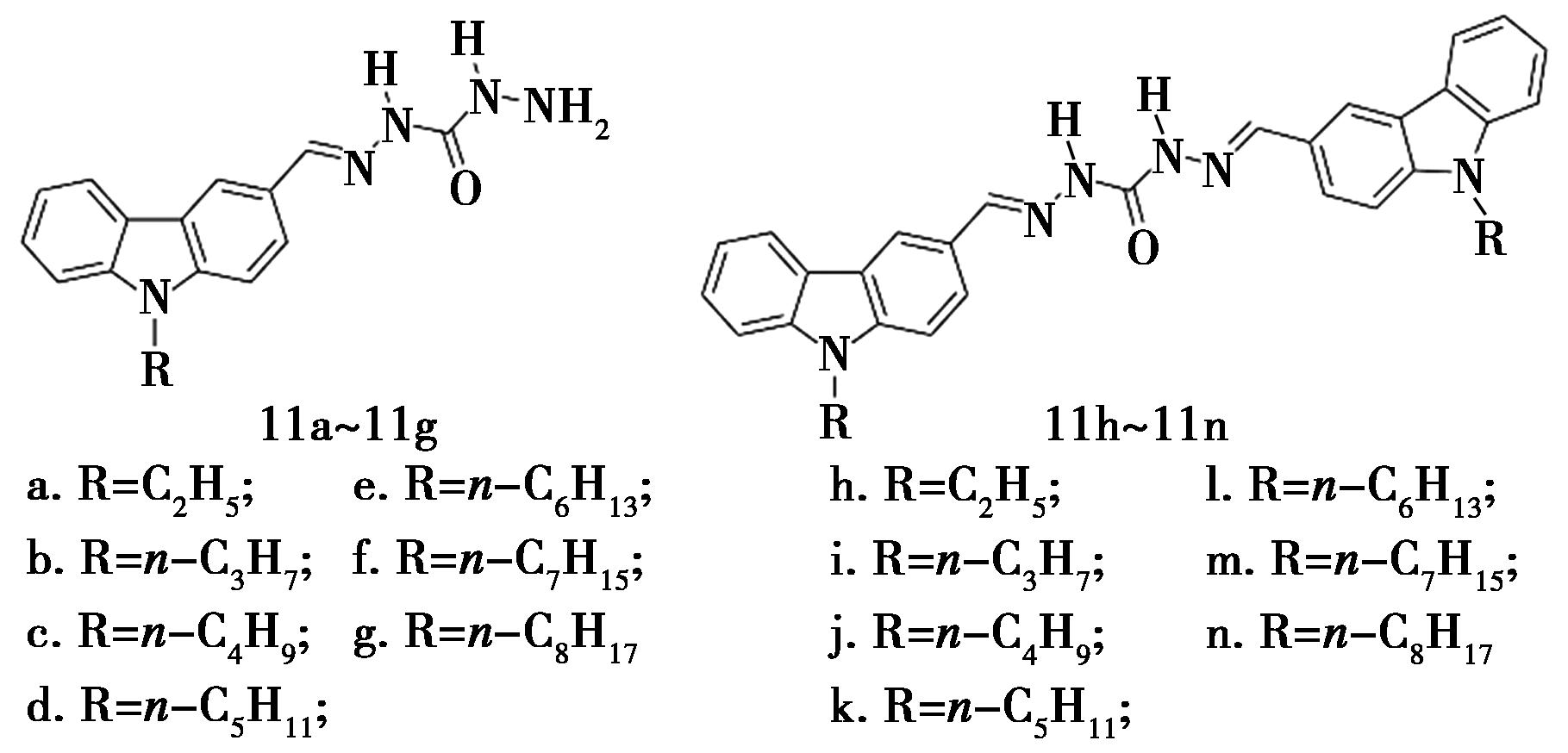
图10 咔唑衍生物11的化学结构[26]
Fig.10 Chemical structure of carbazole derivatives 11[26]
Li等[27]在前期工作的基础上通过酰腙基团将咔唑骨架与芳氨基连接合成了一系列咔唑衍生物(化合物12,图11),并评价了其对PTP1B的抑制作用。化合物12对PTP1B的IC50值范围为(2.78±0.04)~(9.91±1.72)μmol/L,表现出强烈的抑制作用,尤其是化合物12t活性最好(IC50=(2.78±0.04)μmol/L),约是对照药物的1.4倍。分子对接显示,其对PTP1B的抑制活性,主要取决于酰腙骨架,而芳氨基基团的引入能够进一步增强这种活性。在脂溶性方面,咔唑基团起到了关键作用。此外,化合物12t能够嵌入由α3和α6螺旋形成的活性腔,这一特性可能是其对PTP1B具有强抑制性的原因。
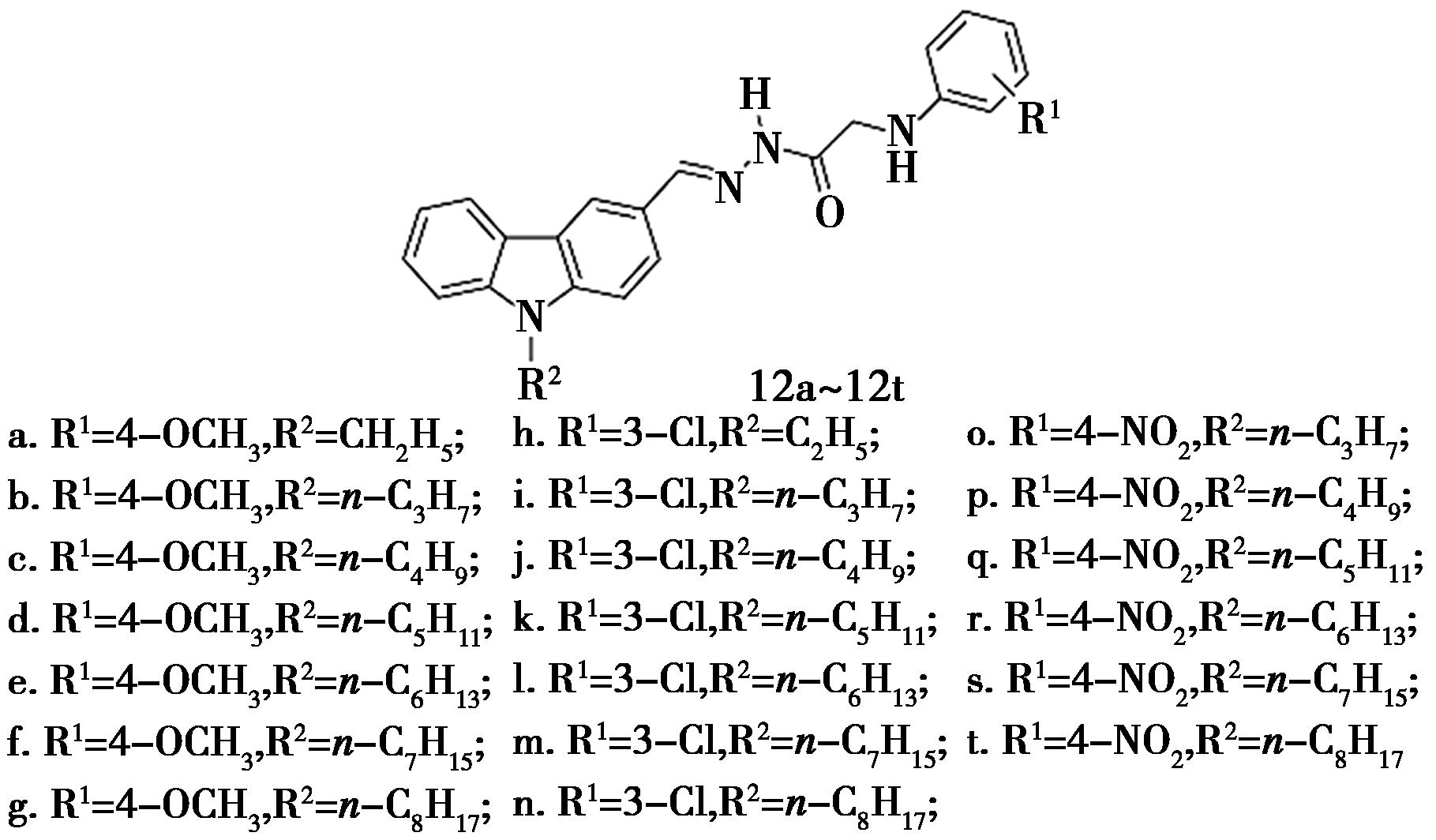
图11 咔唑衍生物12的化学结构[27]
Fig.11 Chemical structure of carbazole derivatives 12[27]
1.5 α-葡萄糖苷酶和α-淀粉酶双靶点抑制剂
α-葡萄糖苷酶定位于小肠,能够催化碳水化合物转化为葡萄糖,而唾液腺和胰腺分泌的α-淀粉酶可以将淀粉水解为低聚糖。因此,α-葡萄糖苷酶和α-淀粉酶分别参与碳水化合物水解过程中的不同环节。通过抑制这两种酶的活性可以延缓餐后血糖水平的上升,进而实现管理T2DM的目的[28]。
Eseyin等[29]采用酸催化烷基化法合成了4种烷基化咔唑(化合物13,图12),并对其抑制α-淀粉酶和α-葡萄糖苷酶的活性进行研究。咔唑、甲基咔唑、乙基咔唑、丙基咔唑和丁基咔唑对α-淀粉酶的IC50值分别为87.47、50.23、47.20、42.36和42.11 μg/mL,咔唑、甲基咔唑对α-葡萄糖苷酶无抑制作用,其他3个烷基咔唑的IC50值分别为205.30、153.93和152.90 μg/mL,参比药物对这两种酶的抑制效果优于合成产物。结果表明,咔唑的烷基化作用增加了咔唑对α-淀粉酶的抑制作用,且其抑制活性与烷基的链长成正比。Sampath等[30]从九里香(Murraya koenigii(L.) Spreng)中分离到一种新的二聚咔唑生物碱(化合物14,图12)其具有显著的α-淀粉酶抑制活性(IC50=44.92 μmol/L)和α-葡萄糖苷酶抑制活性(IC50=45.79 μmol/L)。
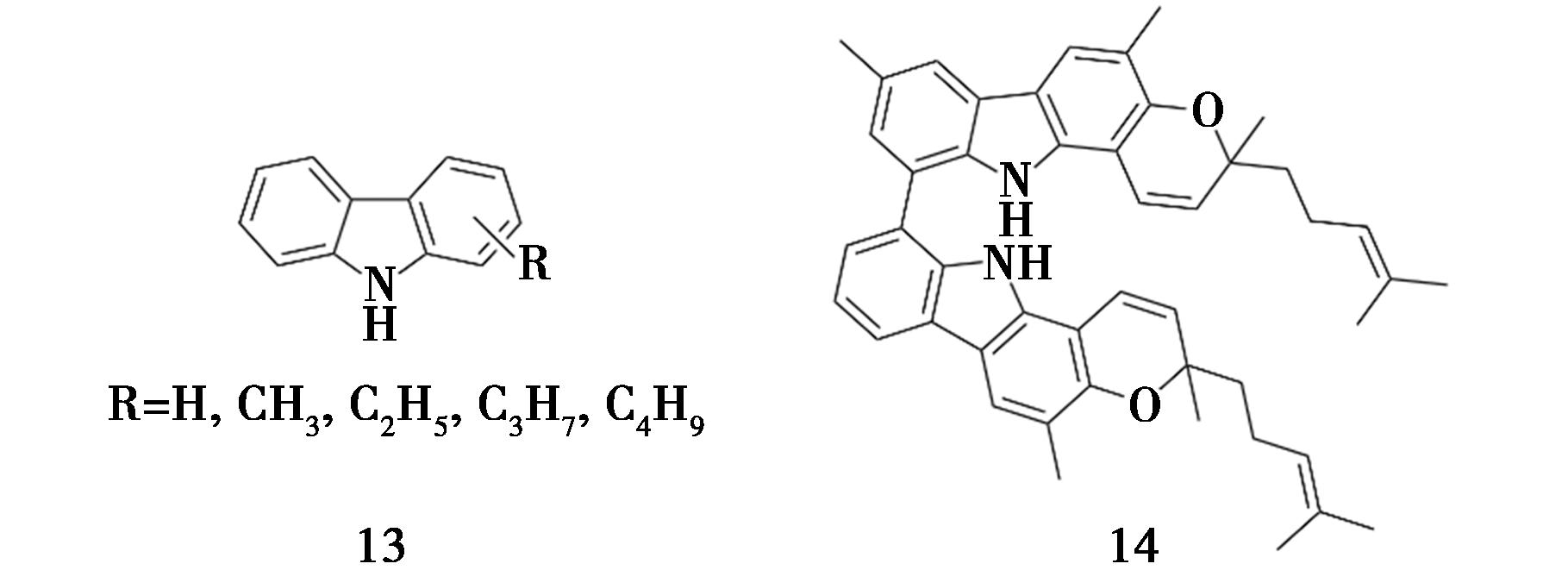
图12 化合物13和14的化学结构[29,30]
Fig.12 Chemical structure of compound 13 and 14[29,30]
Çapan等[31]合成了一系列咔唑-三唑-噻酮衍生物(化合物15,图13),其中7个衍生物对α-淀粉酶具有潜在的抑制活性,IC50值低于6.4 μmol/L,化合物15f、15l和15n的效价最高,IC50值分别为0.56、0.53和0.97 μmol/L,优于阿卡波糖(IC50=5.31 μmol/L)。此外,化合物15f、15n是α-葡萄糖苷酶的中度抑制剂,IC50值分别为11.03和13.76 μmol/L。在100 μmol/L浓度下,大多数化合物对LX-2细胞系的毒性可以忽略不计,特别是15l和15o,其细胞毒性活性比阳性对照低3倍(细胞活力13.45%)。化合物15f的体内活性评估表明,给药组小鼠的血糖浓度相比对照组显著降低,从290.54降至216.15mg/dL。
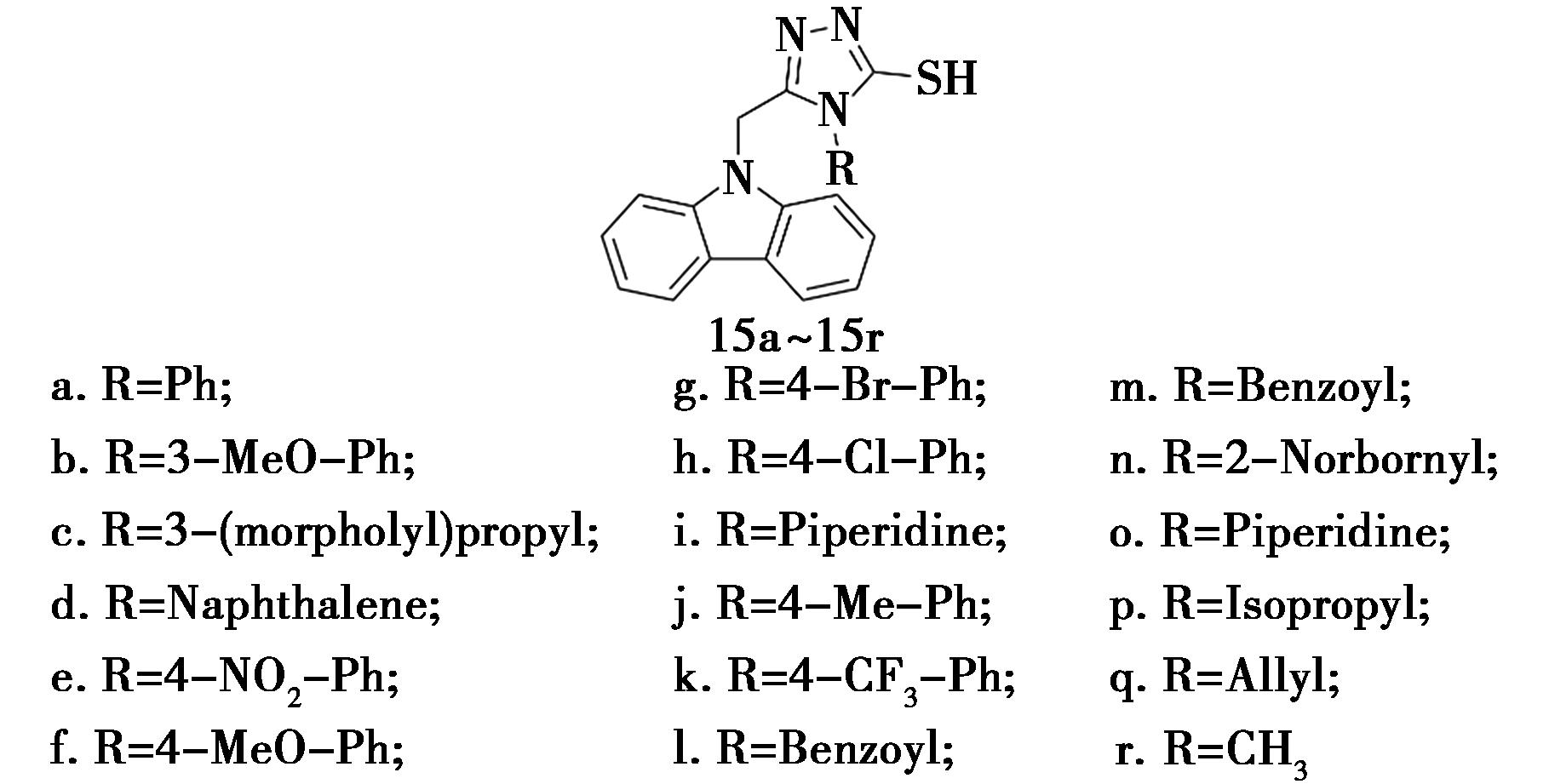
图13 咔唑衍生物15的化学结构[31]
Fig.13 Chemical structure of carbazole derivatives 15[31]
1.6 α-葡萄糖苷酶和PTP1B双靶点抑制剂
α-葡萄糖苷酶抑制剂能够减少碳水化合物的水解,延缓葡萄糖的生成与吸收,进而控制餐后血糖水平。而PTP1B抑制剂可减少胰岛素受体底物磷酸化,提升胰岛素受体对胰岛素的敏感性。因此,α-葡萄糖苷酶和PTP1B双靶点抑制剂可在糖代谢和胰岛素信号通路两个层面发挥协同效应,更有效的改善胰岛素抵抗和降低血糖水平。
Liu等[32]从细叶黄皮(Clausena anisum-olens)果实中分离得到了3种新的咔唑类化合物、3种新的天然存在的咔唑生物碱以及12种已知的类似物,这些咔唑类化合物表现出显著的PTP1B和α-葡萄糖苷酶抑制作用,IC50值范围分别在(0.58±0.05)~(38.48±0.32)μmol/L和(3.28±0.16)~(192.23±0.78)μmol/L之间。其中,化合物16a(图14)显示出最显著的双靶点抑制活性,对PTP1B和α-葡萄糖苷酶的IC50值分别为(0.58±0.05)和(3.28±0.16)μmol/L,这表明在这些咔唑生物碱的结构中保持独特的五元环醚更有可能发挥显著的PTP1B和α-葡萄糖苷酶抑制活性。
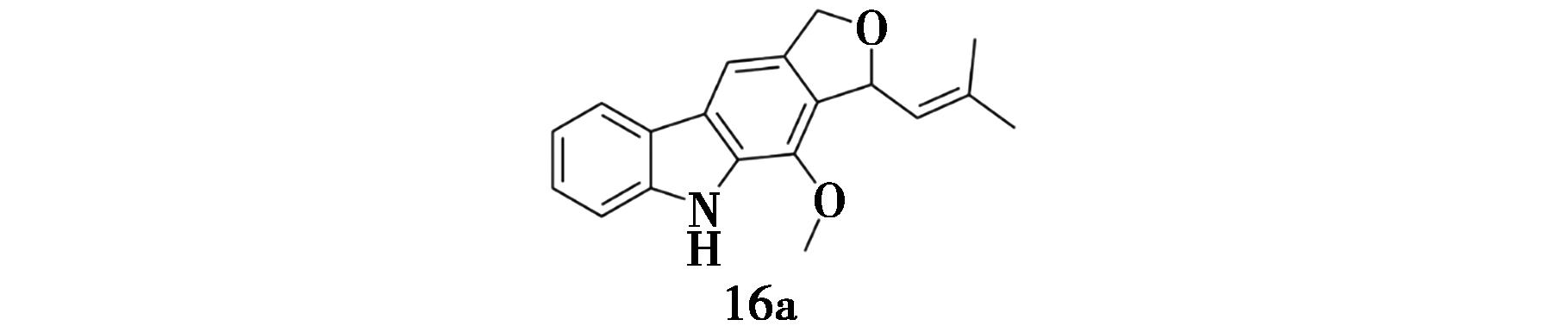
图14 化合物16a的化学结构
Fig.14 Chemical structure of compound 16a
1.7 α-葡萄糖苷酶、PPARs和PTP1B多靶点抑制剂
多靶点降糖药能同时作用于多个与血糖调节相关的靶点,发挥协同效应,更全面地调控糖代谢过程,还可通过不同作用机制延缓耐药性产生,且可能对糖尿病并发症有一定防治作用,能改善多种病理生理过程。因此,多靶点抑制剂的开发是糖尿病治疗中重要的方向[33]。
Huang等[34]设计合成了6个咔唑类衍生物(化合物17,图15)。活性筛选发现,在10 μg/mL浓度时,化合物17的 PPRE相对激动活性为11.20%~28.25%,α-葡萄糖苷酶抑制活性为2.31%~9.74%,PTP1B抑制活性为7.37%~98.22%。这表明化合物对PPARs有一定的激动作用,对α-葡萄糖苷酶的抑制活性较弱,但对PTP1B的抑制活性较显著,尤其是化合物17d和17f展现出优异的PTP1B抑制活性,抑制率分别达到了98.22%和92.35%。毒性预测结果显示,高活性化合物具有低毒性,为新型多靶点抗糖尿病药物的研发提供了一定参考。
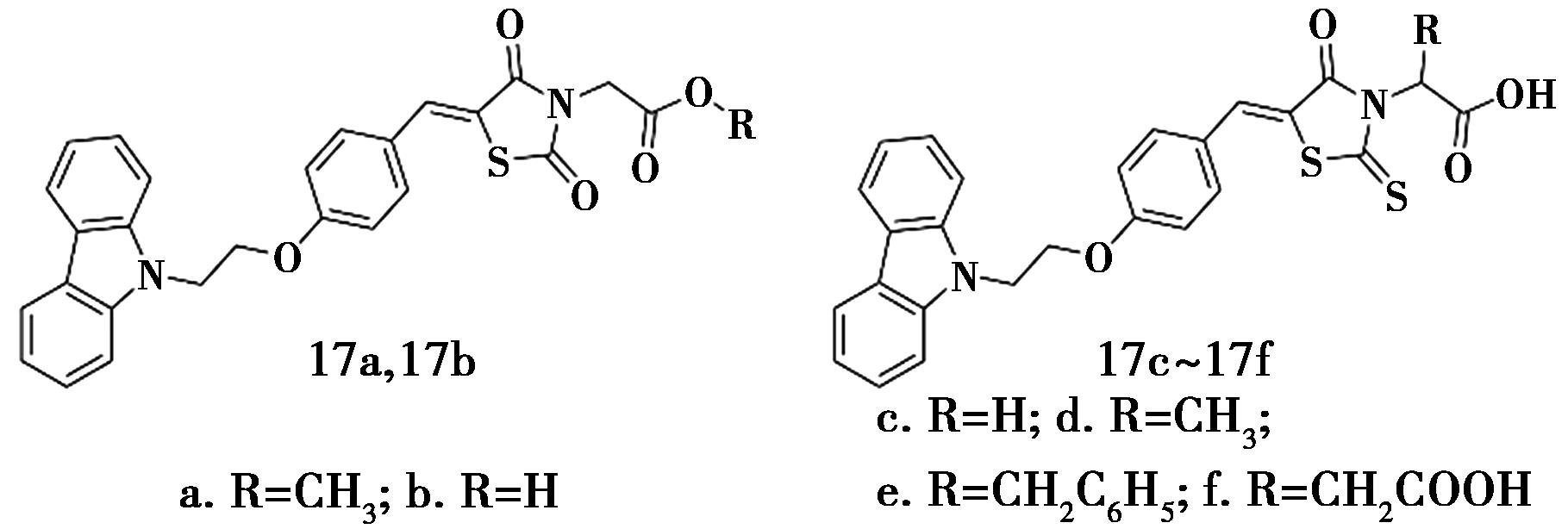
图15 咔唑衍生物17的化学结构[34]
Fig.15 Chemical structure of carbazole derivatives 17[34]
2 结论与展望
现有研究成果显示,天然来源抗糖尿病分子中广泛存在咔唑结构。通过将咔唑与三嗪、三唑、咪唑、噻唑、噁唑、吲哚、酰腙和酰肼等药效团进行拼合,成功设计合成了大量结构新颖的咔唑类衍生物。这些衍生物在单个或多个抗糖尿病靶点上展现出生物活性。鉴于临床糖尿病治疗中联合给药策略的广泛应用,开发多靶点抑制剂已成为抗糖尿病药物研发的关键方向。现有文献报道的多靶点活性咔唑衍生物,不仅证实了该研发策略的可行性,更为后续研究提供了重要依据和参考。然而,当前关于咔唑类衍生物作为抗糖尿病药物的研究仍处于发展初期。现有研究中,该类化合物作为α-葡萄糖苷酶抑制剂,以及α-淀粉酶和α-葡萄糖苷酶双靶点抑制剂的相关报道较多,但研究大多局限于体外实验阶段。同时,针对其他潜在作用靶点的研究相对匮乏。在已报道的少数多靶点抗糖尿病咔唑衍生物研究中,化合物未能在所有预期靶点上均表现出理想的生物活性,提示该领域仍存在广阔的研究空间。展望未来,亟需开展系统性研究与创新性探索,通过合理的药物设计策略,构建更多具有优良生物活性和低毒性的新型咔唑类多靶点降糖药物。同时,应加强体内药效学实验和作用机制研究,深入探索和验证多靶点协同作用机制,为抗糖尿病药物的研发提供新的理论和实践支持。
[1]Tao Z,Shi A,Zhao J.Cell.Biochem.Biophy.,2015,73(1):181-185.
[2]Zhang X,Zheng Y Y,Hu C M,Wu X Z,Lin J,Xiong Z,Zhang K,Xu X T.Arab.J.Chem.,2022,15(9):104 072.
[3]Hu P,Chen J.Contemp.Med.Symp.,2020,18(4):101-102.胡萍,陈俊.当代医药论丛,2020,18(4):101-102.
[4]Yang Y,Chen X B,Chen G Y,Liu G M.Guide China Med.,2012, 10(27):67-68.杨艳,陈旭冰,陈光勇,刘光明.中国医药指南,2012,10(27):67-68.
[5]Kasim S M,Al-dabbagh B M,Mustafa Y F.Eurasian.Chem.Commun.,2022,4(6):495-512.
[6]Dwivedi A K,Gupta S K,Verma R S.World.J.Pharm.Res.,2020,9(11):590-604.
[7]Ernst H A,Leggio L,Willemo⊇s M,Leonard G,Blum P,Larsen S.J.Mol.Biol.,2006,358(4):1 106-1 124.
[8]Kevin C,Maki P,Michael L,Carson D,Marvin P,Miller P,Maciej T P,Bell M,Wilder D M,Matthew S,Reeves D.Diabetes Care,2007,30(5):1 039-1 043.
[9]Liu Z,Ma S.ChemMedChem,2017,12(11):819-829.
[10]Deng H D,Mei W L,Wang H,Guo Z K,Dong W H,Wang H,Li S P,Dai H F.J.Asian Nat.Prod.Res.,2014,16(10):1 024-1 028.
[11]Raj K,Misra N,Pachauri G,Sharma M,Tamrakar A K,Singh A B,Srivastava A K,Phani K K,Narasimha R C V,Prubhu S R.Nat.Prod.Res.,2009,23(1):60-69.
[12]Wang G,Wang J,He D,Li X,Li J,Peng Z.Bioorg.Med.Chem.Lett.,2016, 26(12):2 806-2 809.
[13]Iqbal S,Khan M A,Javaid K,Sadiq R,Fazalur R S,Choudhary M I,Basha F Z.Bioorg.Chem.,2017,74:72-81.
[14]Ghani U,Albarrag A,Yurtta L,Demirci F,Kaplancikli Z A.Chem.Select.,2018,3(27):7 921-7 925.
L,Demirci F,Kaplancikli Z A.Chem.Select.,2018,3(27):7 921-7 925.
[15]Mahmood N.Comp.Clin.Pathol.,2014,25(6):1 253-1 264.
[16]Sales P M,Souza P M,Simeoni L A,Magalhães P O,Silveira D.J.Pharm.Pharmaceut.Sci.,2012,15(1):141-183.
[17]Hassine K,Zrida H,Saidi I,Hriz K,Hamdan K,Ben J H,Majdoub H.Chem.Afr.,2023,7(2):643-659.
[18]Berger J,Moller D E.Annu.Rev.Med.,2002,53:409-435.
[19]Huang Y,Zhang H B,Zhou J P,Huang W L.Prog.Pharm.Sci.,2004,28(5):193-198.黄莺,张惠斌,周金培,黄文龙.药学进展,2004,28(5):193-198.
[20]Henke B R.J.Med.Chem.,2004,47:4 118-4 127.
[21]Kumar R,Ramachandran U,Srinivasan K,Ramarao P,Raichur S,Chakrabarti R.Bioorgan.Med.Chem.,2005,13(13):4 279-4 290.
[22]Gim H J,Li H,Lee E,Ryu J H,Jeon R.Bioorg.Med.Chem.Lett.,2013, 23(2):513-517.
[23]Agrawal N,Dhakrey P,Pathak S.Chem.Biol.Drug.Des.,2023,102(4):921-938.
[24]Ma Q,Tian J,Yang J,Wang A,Ji T,Wang Y,Su Y.Fitoterapia,2013,87:1-6.
[25]Li Y,Wang S,Jin K,Gao L,Sheng L,Zhang N,Liu J,Li J.Chinese.J.Org.Chem.,2019,39(2):491-499.
[26]Li Y,Liu X,Liu J,Gao L,Jin K,Sheng L,Yang H,Lin L,Li J.Chinese.J.Org.Chem.,2020,40(2):478-488.
[27]Li J,Liu J,Sheng L,Gao L,Jin K,Lin L,Li Y.Chinese.J.Org.Chem.,2021,41(8):3 157-3 170.
[28]Kashtoh H,Baek K H.Plants,2022,11(20):2 722.
[29]Eseyin O A,Edem E,Johnson E,Ahmad A,Afzal S.Trop.J.Pharm.Res.,2018,17(3):537-541.
[30]Sampath S N,Jayasinghe S,Attanayake A P,Karunaratne V,Yaddehige M L,Watkins D L.Phytochem.Lett.,2022,52:87-91.
[31]Çapan ![]() M,Qaoud M T,Jaradat N.ACS Omega,2024,10(1):848-861.
M,Qaoud M T,Jaradat N.ACS Omega,2024,10(1):848-861.
[32]Liu Y P,Li Y J,Zhao Y Y,Guo J M,Liu Y Y,Wang X P,Shen Z Y,Qiang L,Fu Y H.Bioorg.Chem.,2021,110:104 775.
[33]Zhou J T,Jiang X Y,Feng F,Sun H P.Acta Pharm.Sin.,2018, 53(12):2 012-2 025.周俊廷,蒋学阳,冯锋,孙昊鹏.药学学报,2018,53(12):2 012-2 025.
[34]Huang M,Xu J,Fan L,Liu H P,Zhang K,Feng J Z,Yang D C.Acta Pharm.Sin.,2017,52(8):1 287-1 298.黄敏,许荩,范莉,刘红萍,张坤,冯计周,杨大成.药学学报,2017,52(8):1 287-1 298.