万寿菊(Tagetes erecta L.)是菊科一年生草本植物,现在主要分布在美国、拉丁美洲、亚洲等地[1],其花中含有丰富的类胡萝卜素[2],尤其是是叶黄素类化合物[3]。叶黄素在万寿菊中多以叶黄素酯存在,常见的主要为二分子的肉豆蔻酸、棕榈酸或硬脂酸等形成的双酯[4]。其中,叶黄素二肉豆蔻酸酯、叶黄素肉豆蔻酸-棕榈酸酯、叶黄素二棕榈酸酯、叶黄素棕榈酸-硬脂酸酯结构如图1所示。
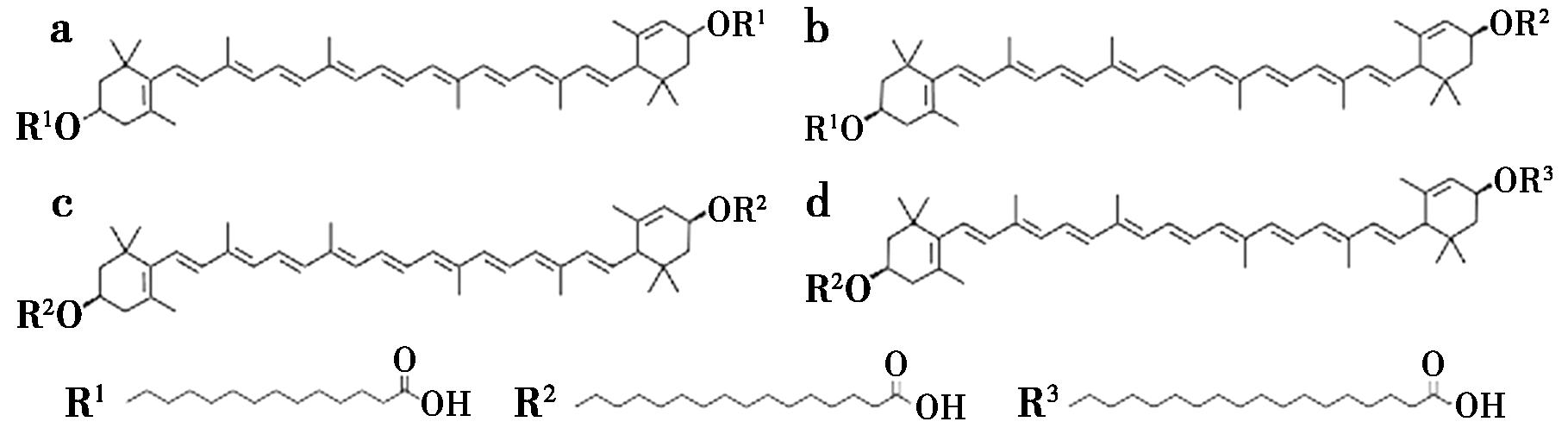
a.叶黄素二肉豆蔻酸酯;b.叶黄素肉豆蔻酸-棕榈酸酯;c.叶黄素二棕榈酸酯;d.叶黄素棕榈酸-硬脂酸酯
图1 4种叶黄素酯结构及相对分子质量[5]
Fig.1 Structure and relative molecular mass of four lutein esters[5]
叶黄素具有极强的着色力,早期被大量用于家禽饲料中,以给蛋黄和鸡肉皮着色[6]。经过研究发现,叶黄素可有效预防和治疗癌症、冠状动脉疾病,尤其可治疗和与年龄相关的眼部疾病[7-10]。然而关于叶黄素酯的抗癌活性研究未见报道。
目前,工厂中使用有机溶剂提取万寿菊花中叶黄素酯[11],然后对叶黄素酯进行皂化获得叶黄素。虽然该方法效率较高,但对有机试剂的需求量大,处理温度也较高,易引起环境问题和叶黄素氧化。此外,超临界流体萃取[12]、超声辅助提取[13]和微波辅助提取[14]等也被多次报道研究,但这些方法所需要的高价设备和复杂操作限制了其在规模化生产中使用[15]。超速破碎提取法还未见用于万寿菊提取。超速破碎提取法是一种通过内刃高速转动带动外刃破碎植物组织的提取技术,通过快速机械切割对药材进行破碎,使植物组织内的化学物质短时间溶解于提取试剂中[16]。相比其他提取方式,超速破碎提取法具有提取时间短、安全节能、规模可调、提取效率高等优点,此外操作简单、设备成本低也成为许多物质新提取方法的选择原因[17,18]。目前,有大量研究报道超速破碎提取法提取植物中有效成分,其中包括莲子中多酚提取[19]、沙棘总黄酮提取[20]、代代花黄酮提取[21]、西洋参花多糖提取[22]、麦冬皂苷提取[23]等。有研究表明,超速破碎提取法的提取时间远低于煎煮法,提取率高于煎煮法,其耗电量仅为煎煮法的1%[24];超声提取虽然几十分钟提取植物中约80%的有效成分,但是超速破碎提取法可以在数秒或者几分钟提取至少70%有效成分[25]。本研究以万寿菊中主要的4种叶黄素酯(叶黄素二肉豆蔻酸酯、叶黄素肉豆蔻酸-棕榈酸酯、叶黄素二棕榈酸酯、叶黄素棕榈酸-硬脂酸酯)总收率(以下简称“收率”)为提取指标,采用响应面法优化超速破碎提取法提取万寿菊中叶黄素酯工艺条件,并探讨了叶黄素酯对癌细胞生长影响,以期为开发具有抗肿瘤成分提供理论依据。
1 实验部分
1.1 主要仪器与试剂
SORVALL ST16R型离心机(美国赛默飞世尔科技有限公司);JHBE-20A型超速破碎提取器(河南苌益生物公司);TR-3L型旋转蒸发仪(提坦科技(上海)有限公司);LC-3020型高效液相色谱仪、LC-3060型制备色谱仪(北京秦方科技有限公司);Aria Ⅲ型流式细胞仪(美国BD公司);BioTek型96孔酶标仪(美国BioTek仪器有限公司)。
乙酸乙酯(分析纯)、丙酮(分析纯)、无水乙醇(分析纯)、正己烷(分析纯)、乙酸乙酯(色谱纯)、乙腈(色谱纯)、甲醇(色谱纯)(上海迈瑞达有限公司);人宫颈癌细胞株HeLa细胞(ATCC细胞库);RPMI-1640培养液(武汉普诺赛生物科技有限公司);胰蛋白消化酶(北京索莱宝科技有限公司);胎牛血清(Biowest分装,产地南美)、CCK-8试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物科技有限公司);HyClone Dulbecco磷酸盐缓冲盐水(pH 7.0,6×500 mL,思拓凡生物科技(杭州)有限公司);万寿菊(产地河南、安徽、云南)为市场采购;叶黄素二棕榈酸酯对照品(HPLC>98%,上海罗恩有限公司);叶黄素二肉豆蔻酸酯、叶黄素肉豆蔻酸-棕榈酸酯、叶黄素二棕榈酸-硬脂酸酯均为本实验室自制。
1.2 万寿菊提取物处理及叶黄素酯制备
精密称取8.000 g万寿菊粉末置于50 mL烧杯中,按料液比1∶5、1∶10、1∶20、1∶30、1∶40 (g/mL)加入乙酸乙酯,在超速破碎提取法转速为3 000 r/min下提取。抽滤,滤液倒入50 mL离心管中,6 000 r/min离心3 min,将上清液移至圆底烧瓶,蒸除溶剂,加10 mL流动相溶解,过0.22 μm滤膜,待HPLC分析。通过制备色谱仪,从提取物中分离纯化出4种叶黄素酯。
1.3 4种叶黄素酯对照品标准曲线
分别精密称取1.000 g叶黄素二肉豆蔻酸酯、叶黄素肉豆蔻酸-棕榈酸酯、叶黄素二棕榈酸酯、叶黄素棕榈酸-硬脂酸酯,分别于2 mL容量瓶中用流动相溶解,配成0.500 0 mg/mL储备液;再精密量取不同体积储备液,加流动相依次稀释成500.0、250.0、125.0、62.50、31.25、15.63 μg/mL对照品溶液。以对照品溶液浓度为横坐标,以色谱峰面积为纵坐标绘制标准曲线,在15.63~500.0 μg/mL范围内每种叶黄素酯的线性关系良好,如表1所示。
表1 4种叶黄素酯的标准曲线
Tab.1 Calibration curve of four Lutein esters
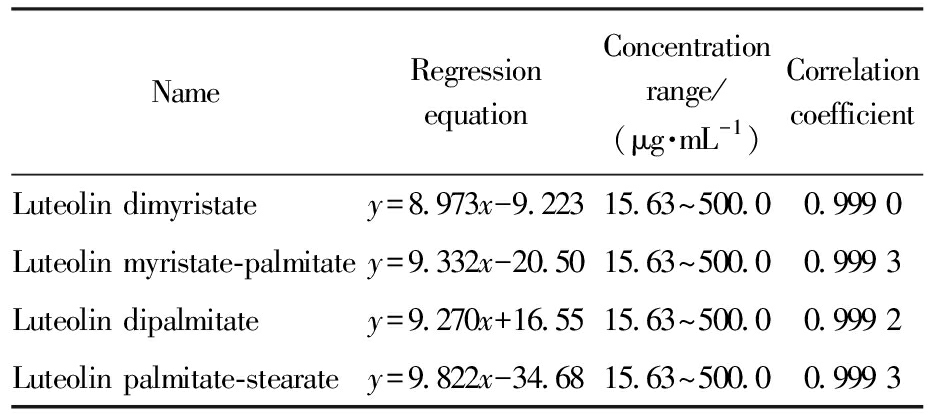
NameRegression equationConcentration range/(μg·mL-1)Correlation coefficientLuteolin dimyristatey=8.973x-9.22315.63~500.00.999 0Luteolin myristate-palmitatey=9.332x-20.5015.63~500.00.999 3Luteolin dipalmitatey=9.270x+16.5515.63~500.00.999 2Luteolin palmitate-stearatey=9.822x-34.6815.63~500.00.999 3
1.4 色谱检测条件
采用Welchrom XB C18(4.6 mm×250 mm,5 μm)分析色谱柱,流速为0.4 mL/min,波长为445 nm,在25 ℃检测,流动相为V(乙酸乙酯)∶V(乙腈)∶V(甲醇)=49∶21∶30,进样量为10 μL,每个样品检测时间为90 min,连续进样3次。采用Welchrom ultimate XB C18(21.2 mm×250 mm,5 μm)制备色谱柱,流速为7 mL/min,波长为 445 nm,流动相为V(乙酸乙酯)∶V(乙腈)∶V(甲醇)=49∶21∶30。
1.5 单因素实验
通过单因素实验探究提取次数(1、2、3、5、7、9)、提取时间(3、6、9、12、15 min)、料液比(1∶5、1∶10、1∶20、1∶30、1∶40(g/mL)),提取转速(2 000、2 500、3 000、3 500、4 000 r/min)对叶黄素酯收率影响[26,27]。确定各参数范围,为优化超速破碎提取法提取叶黄素酯的工艺参数提供依据。
1.6 响应面实验
在单因素实验基础上,根据Box-Behnken-design实验设计原理[28],选取提取次数(A)、提取时间(B)、液料比(C)为独立变量,以万寿菊中叶黄素酯收率(Y)为响应值,利用Design-Expert13.0进行响应面实验模拟,优化超速破碎提取法提取叶黄素酯的工艺参数,表2为实验因素水平和编码表。
表2 影响因素和水平设计
Tab.2 Design of influencing factors and their levels
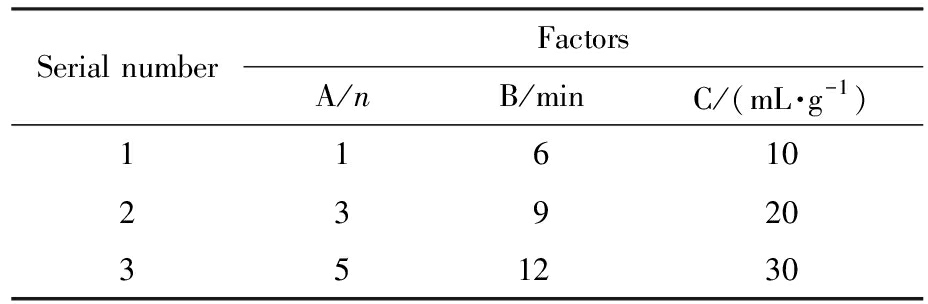
Serial numberFactorsA/nB/minC/(mL·g-1)1161023920351230
1.7 叶黄素酯收率计算
采用外标法分别测定各叶黄素酯浓度:将1.2中叶黄素酯样品稀释一定倍数,通过高效液相色谱检测样品中4种叶黄素酯峰面积,代入对照品曲线公式(1),计算各叶黄素酯对应浓度。
x=(y-b)/a
(1)
式中,x为各叶黄素酯浓度,μg/mL;y为色谱峰面积;b为对照品标准曲线截距;a为对照品标准曲线斜率。
将获取的稀释后样品中各叶黄素酯浓度,通过质量计算公式(2),计算1.3样品中各叶黄素酯质量。
mi=(x×V×n)/1 000
(2)
式中,mi为原样品中各叶黄素酯质量,mg;n为稀释倍数;V为进样体积,μL。
叶黄素二肉豆蔻酸酯、叶黄素肉豆蔻酸-棕榈酸酯、叶黄素二棕榈酸酯、叶黄素棕榈酸-硬脂酸酯的质量分别为mdm、mmp、mdp、mps,并将这4种叶黄素酯质量进行求和,获取4种叶黄素酯总质量,如公式(3)所示。
M=(mdm+mmp+mdp+mps)/1 000
(3)
式中,mdm、mmp、mdp、mps分别为4种叶黄素酯质量,mg;M为4种叶黄素酯总质量,g。
叶黄素酯收率:4种叶黄素酯总质量占对应万寿菊粉末质量的百分比如公式(4)所示。
Y=(M/Mt)×100%
(4)
式中,Mt为万寿菊粉末质量,g;M为4种叶黄素酯总质量,g;Y为叶黄素酯收率。
1.8 抗癌活性研究
1.8.1 细胞培养与分组
用RPMI-1640培养液体外培养人宫颈癌 HeLa细胞,于37 ℃、5% CO2培养箱中培养,万寿菊提取液真空旋蒸,培养液溶解;根据万寿菊提取液中提取的4种叶黄素酯的浓度,将细胞分为20、40、80 μg/mL万寿菊提取物组,溶剂组作为对照组,不含细胞的培养基为空白组。
1.8.2 CCK-8实验
取对数生长期人宫颈癌HeLa细胞,接种于96孔板中,待细胞贴壁后,加入不同浓度的叶黄素酯,至终浓度为20、40、80 μg/mL,对照组加入同体积的溶剂,每组设置3个平行实验。继续培养24 h后,吸弃孔内培养基,将RPMI-1640培养基与CCK-8按照体积比10∶1均匀混合后,加入96孔板中,每孔10 μL,37 ℃避光孵育30 min后,在酶标仪450 nm处按照公式(5)测量吸光值OD[29]。
细胞增殖活性(%)=[(OD处理组-OD空白)/
(OD对照-OD空白)]×100%
(5)
1.8.3 流式细胞实验
取对数生长期人宫颈癌HeLa细胞,接种于6孔板中,待细胞贴壁后,加入不同浓度的叶黄素酯,至终浓度为20、40、80 μg/mL,对照组加入同体积的溶剂。37 ℃避光处理24 h后,用不含 EDTA的胰酶消化收集细胞,离心。PBS润洗细胞2遍,弃上清液,加入500 μL Binding Buffer重悬细胞,加入Annexin V-FITC溶液和PI溶液各 5 μL,移液枪混匀,室温条件避光孵育15 min,染色完成上机检测[30]。每组设置3个平行实验。
2 结果与讨论
2.1 单因素实验结果
2.1.1 提取次数对收率的影响
在提取时间为6 min,料液比为1∶10条件下,随着提取次数的增加,叶黄素酯溶出量增多,但是收率呈现先升高再逐渐趋于平衡最后降低的趋势。当提取次数为3次时,收率为13.12%,达到峰值。当提取次数>3次后,叶黄素酯溶出量不再随提取次数而增加。考虑提取成本选择3次提取为宜,如图2a所示。实验中,对提取2次进行了提取率计算,发现2次提取率低于3次,实验设计中选择了1、3、5次作为提取次数因素研究水平,最终获得相同的最佳提取次数。
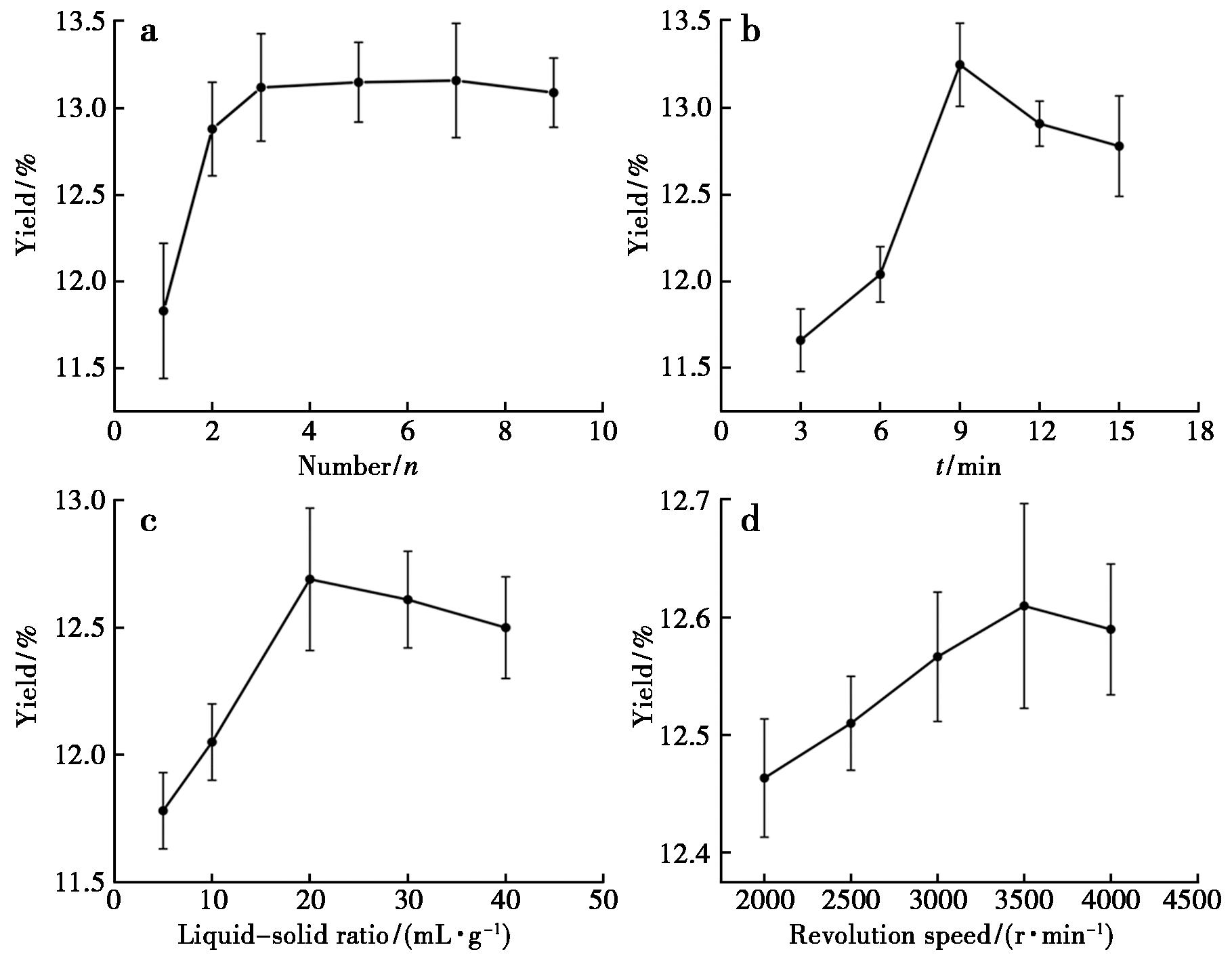
a.提取次数图;b.提取时间图;c.液料比图;d.提取转速
图2 不同工艺参数对叶黄素酯收率影响(n=3)
Fig.2 Effect of different process parameters on the yield of lutein esters(n=3)
2.1.2 提取时间对收率的影响
在提取次数为1次,料液比为1∶10 (g/mL)条件下,随着提取时间的延长,叶黄素酯溶出量增多,但是收率呈现先升高后降低趋势。当提取 9 min时,收率为13.25%,达到峰值。再延长提取时间,超速破碎提取器变热可能引起部分叶黄素酯分解,导致收率降低,因此,最佳提取时间选择9 min,如图2b所示。
2.1.3 料液比对收率的影响
在提取次数为1次,提取时间为6 min条件下,随着料液比的降低,收率也呈现先升高后有下降趋势。料液比为1∶20 (g/mL)时,收率为12.69%,达到峰值。开始随着料液比降低,有利于叶黄素酯逐渐溶出,但当料液比降低至1∶20(g/mL)时,叶黄素酯溶出量降低,最佳提取料液比为1∶20(g/mL),如图2c所示。
2.1.4 提取转速对收率的影响
在提取次数为1次、提取时间为6 min、提取料液比为1∶20(g/mL)条件下,随着料液比的增加,收率也呈现先升高后有下降趋势。提取转速在3 500 r/min时,收率为12.61%,达到峰值。开始随着提取转速增加,有利于叶黄素酯逐渐溶出,但当提取转速超过3 500 r/min时,仪器产热过多,影响叶黄素酯的稳定性,最佳提取转速为 3 500 r/min。结果显示,提取转速对叶黄素酯的收率影响较小,如图2d所示。
2.2 响应面实验结果分析
按照上述设计的响应面实验进行结果检测,把不同的提取次数(A)、提取时间(B)、液料比(C)的实验收率(Y)列在表3中。应用Design-Expert 13.0软件对设计的3因素3水平的实验结果进行多项式拟合计算,响应面优化的分析结果和方差分析列在表4中。
表3 响应面实验设计与结果
Tab.3 Response surface experimental design and results
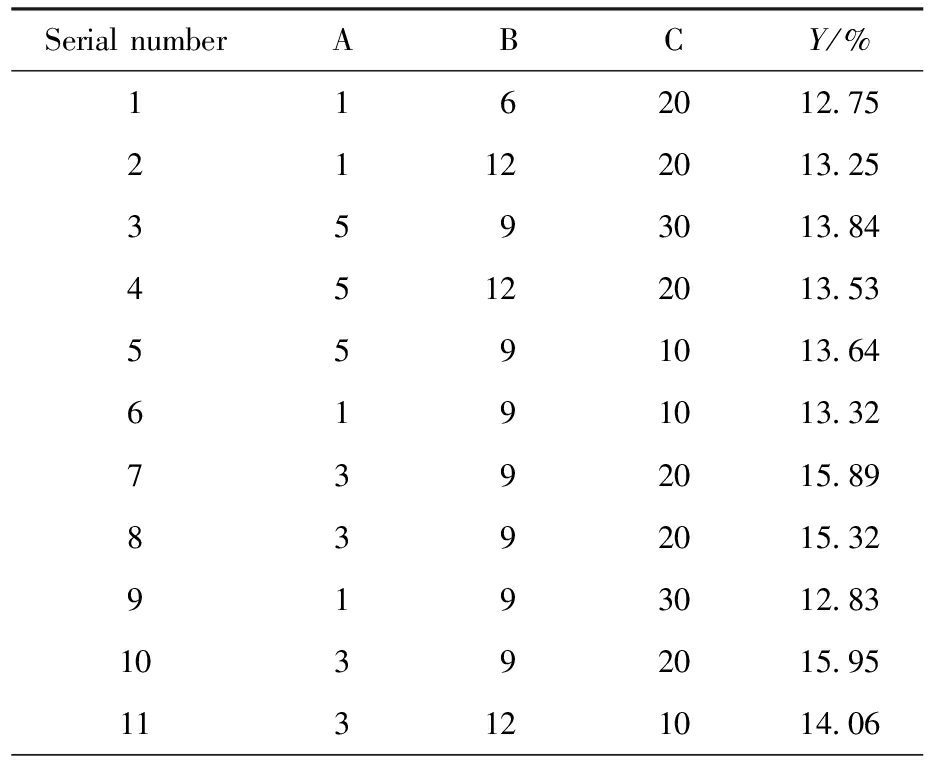
Serial numberABCY/%1162012.7521122013.253593013.8445122013.535591013.646191013.327392015.898392015.329193012.8310392015.95113121014.06
续表
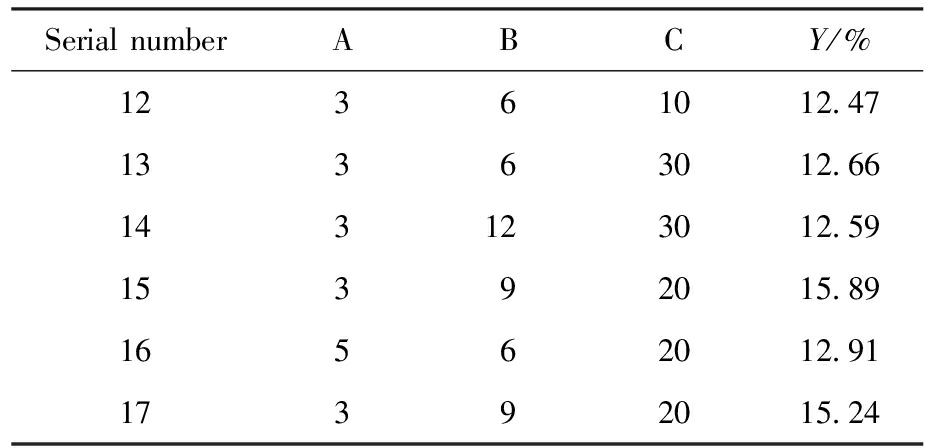
Serial numberABCY/%12361012.4713363012.66143123012.5915392015.8916562012.9117392015.24
表4 方差分析结果注
Tab.4 Analysis of variance (ANOVA) results
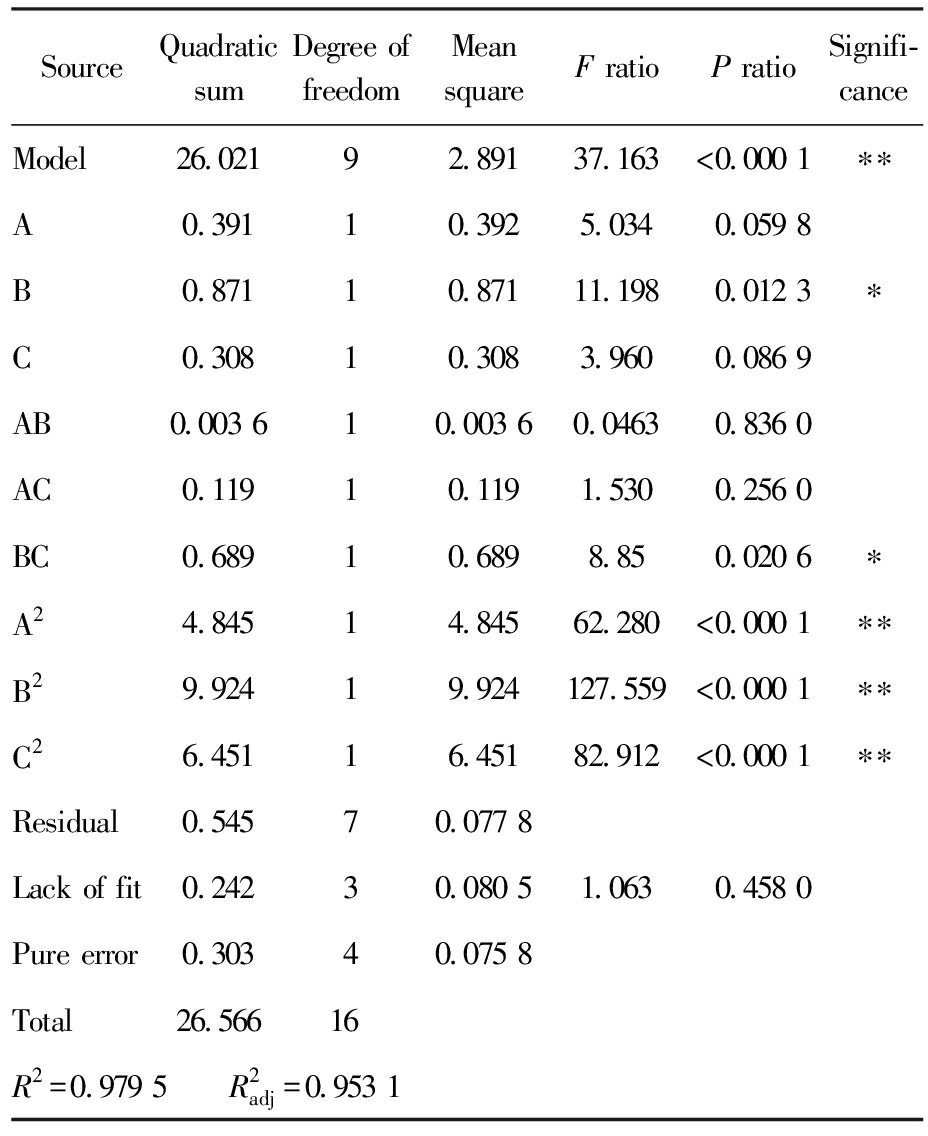
SourceQuadratic sumDegree of freedomMean squareF ratioP ratioSignifi-canceModel26.02192.89137.163<0.000 1∗∗A0.39110.3925.0340.059 8 B0.87110.87111.1980.012 3∗C0.30810.3083.9600.086 9 AB0.003 610.003 60.04630.836 0 AC0.11910.1191.5300.256 0 BC0.68910.6898.850.020 6∗A24.84514.84562.280<0.000 1∗∗B29.92419.924127.559<0.000 1∗∗C26.45116.45182.912<0.000 1∗∗Residual0.54570.077 8 Lack of fit0.24230.080 51.0630.458 0 Pure error0.30340.075 8 Total26.56616 R2=0.979 5 R2adj=0.953 1
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。
利用Design-Expert 13.0软件对表3数据进行分析,采用Quadratic模型对实验数据进行多元回归拟合,得到收率回归方程:
Y=15.72+0.221 2A+0.330 0B-0.196 3C+0.030 00AB+0.172 5AC-0.415 0BC-1.070A2-1.540B2-1.240C2
由表4可知,计算结果显示回归模型的P<0.000 1,极显著;决定系数R2=0.979 5,调整决定系数![]() 两者差值<0.2;失拟项P=0.242>0.05,不显著,以上说明得到的回归模型方程拟合程度良好,可用于超速破碎提取法提取叶黄素酯收率的理论预测。由F值可知对超速破碎提取法提取叶黄素酯收率的影响最大为提取时间(B),其次为提取次数(A),最小的是液料比(C)。
两者差值<0.2;失拟项P=0.242>0.05,不显著,以上说明得到的回归模型方程拟合程度良好,可用于超速破碎提取法提取叶黄素酯收率的理论预测。由F值可知对超速破碎提取法提取叶黄素酯收率的影响最大为提取时间(B),其次为提取次数(A),最小的是液料比(C)。
根据Design-Expert 13.0软件拟合结果,绘制双因素对收率的影响响应面图和等高线图。曲面分析的结果表明液料比和提取时间的交互作用对收率影响最大,液料比和提取次数次之,提取次数和提取时间的交互作用影响最小,可见双因素影响结果与方差分析结果一致,如图3所示。
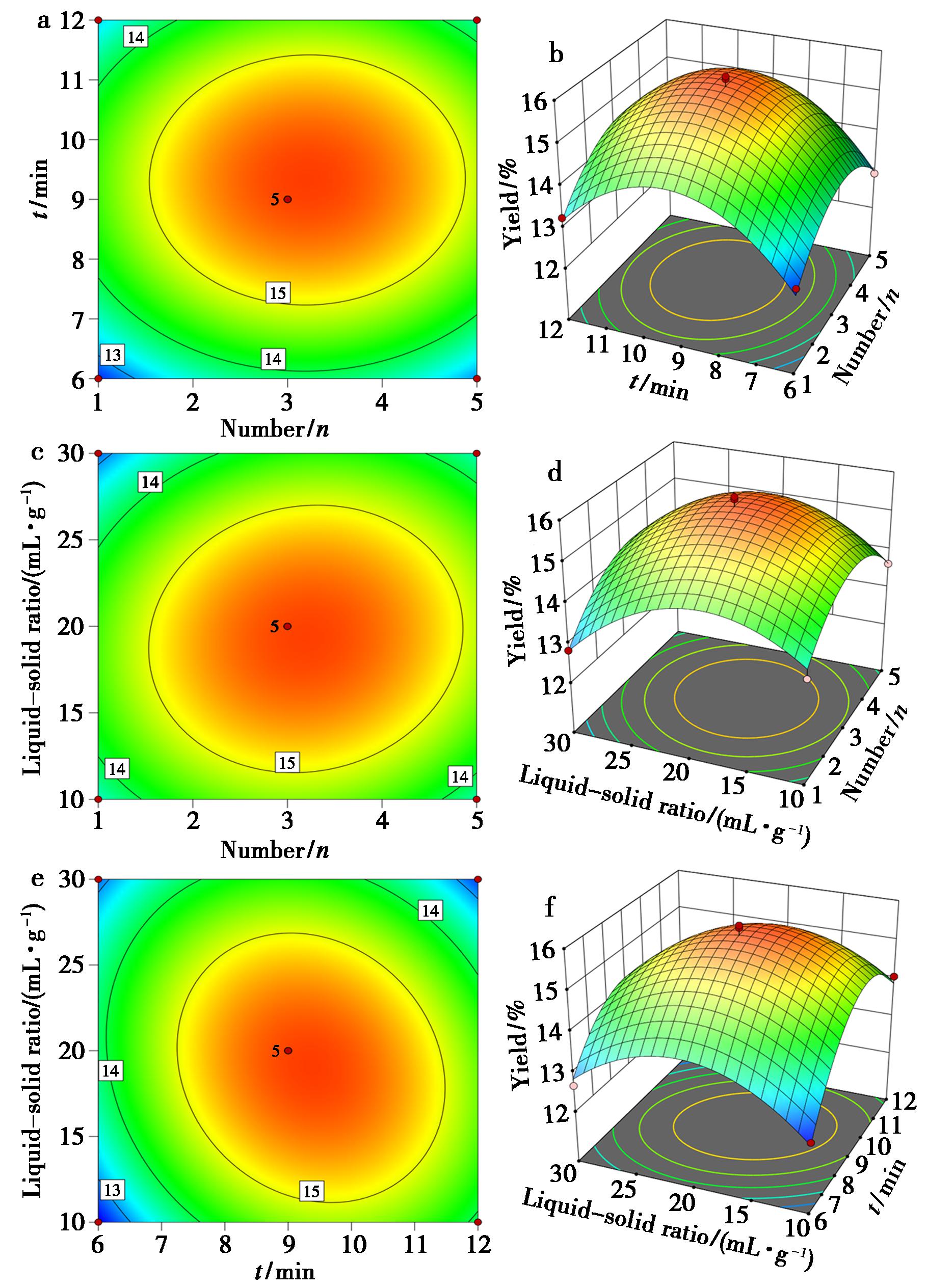
a、b为提取时间与提取次数交互作用;c、d为提取次数与液料比交互作用;e、f为提取时间与液料比交互作用
图3 各因素交互作用对收率影响的响应面图及等高线图
Fig.3 Response surface and contour map illustrating the interactive effects of various factors on the yield
2.3 验证实验
根据响应面模型方程回归计算,能够确定超速破碎提取法提取叶黄素酯的最优提取条件为提取3.2次,每次提取9.4 min,采用1∶19.1(g/mL)的料液比,叶黄素酯理论收率可以达到15.76%。最终选择提取3次,每次提取9 min和1∶19(g/mL)的料液比进行实际验证实验,3次平行验证实验的结果给出收率为(15.66±0.072)%,与理论值误差相差0.63%,说明响应面设计模型稳定可靠。
2.4 叶黄素酯对HeLa细胞存活率影响
与对照组(0 μg/mL)细胞存活率(96.67±1.53)%相比,浓度为20、40、80 μg/mL的叶黄素酯均可降低HeLa细胞存活率,其细胞存活率分别为(86.15±6.67)%、(70.82±6.75)%、(56.15±7.81)%,3组实验结果均具有统计学意义(P<0.05),如图4所示。
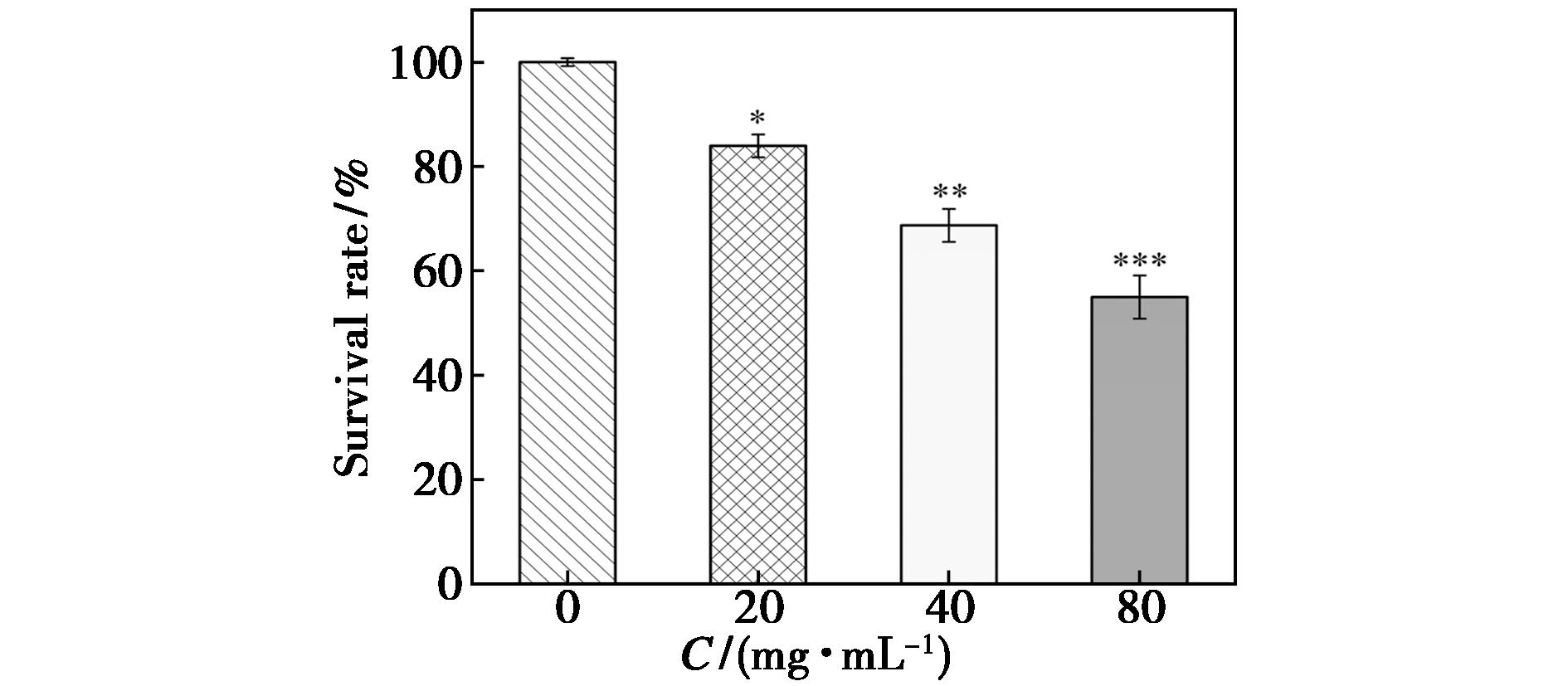
与对照组(0 μg/mL)比较,*P<0.05,**P<0.01,***P<0.001
图4 不同浓度叶黄素酯作用于HeLa细胞24 h各组细胞存活率
Fig.4 Cell survival rate of Hela cells treated with different concentrations of lutein ester for 24 h
2.5 各组细胞凋亡率比较
不同浓度的叶黄素酯作用于HeLa细胞后,细胞凋亡数量随着浓度的增加而增加,20、40、80 μg/mL组细胞凋亡率分别为(9.92±1.78)%、(23.77±1.48)%、(41.03±2.20)%,与对照组(1.28±0.10)%比较,差异具有统计学意义(P<0.05),如图5所示。
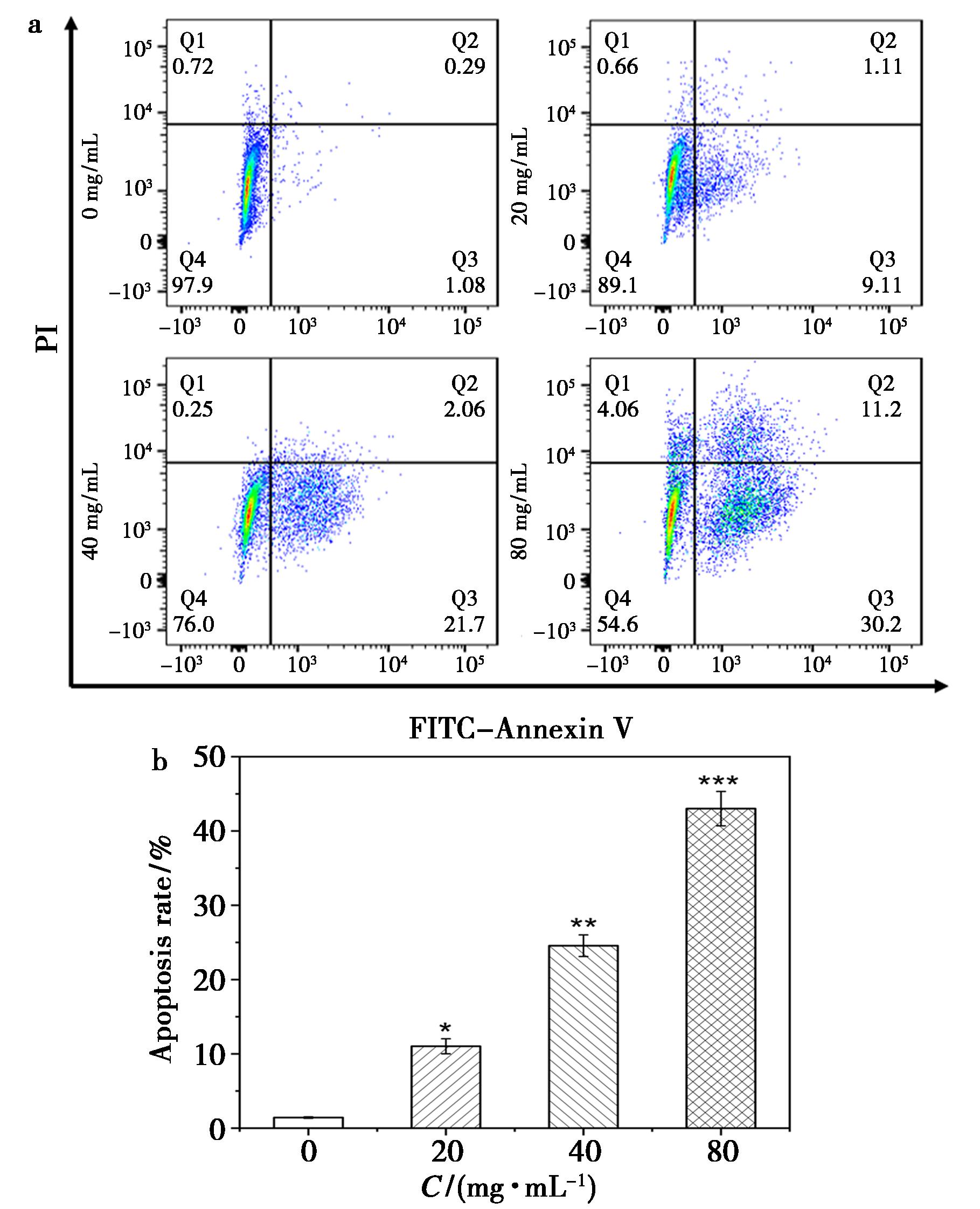
与对照组(0 μg/mL)比较,*P<0.05,**P<0.01,***P<0.001a.不同浓度叶黄素酯作用于HeLa细胞24 h后的流式图;b.不同浓度叶黄素酯作用于HeLa细胞24 h后细胞凋亡数量柱状图
图5 各组细胞凋亡率
Fig.5 Apoptosis rate of each group
3 结论
叶黄素作为食用添加和护眼产品主要成分广泛使用,但是容易被氧化而失去作用。而叶黄素酯化学性质稳定,直接用于护眼产品中能够避免叶黄素的氧化。本研究通过超速破碎提取法高效、常温地提取了万寿菊中叶黄素酯。优化了提取时间、料液比、提取次数等条件,采用Design-expert设计分析得到提取叶黄素酯最佳提取率为15.66%时的工艺参数:提取3次,每次提取9 min和1∶19(g/mL)的料液比。与实际实验结果相符。此外,发现从万寿菊提取物中提取出的叶黄素酯,不同浓度对HeLa细胞生长均具有抑制作用,随着浓度的增加,促凋亡作用增强。上述实验结果为叶黄素酯的规模化生产提供的技术支撑,也初步为叶黄素酯在抑制肿瘤细胞生长研究提供的数据参考。
[1]Xin H B,Ji F F,Wu J,Zhang S Y,Yi C J,Zhao S W,Cong R C,Zhao L J,Zhang H,Zhang Z.Hortic.Plant J.,2023,9(6):1 119-1 130.
[2]Saini R K,Ahn H Y,Park G W,Shin J W,Lee J H,Yu J W.Foods,2023,12(19):3 549.
[3]Akshaya H R,Namita K P S,Saha S,Panwar S,Bharadwaj C.Indian J.Agric.Sci.,2017,87:390-396.
[4]Van B,Richard B,Dong L,Natasa D,Pajkovic N D.Int.J.Mass Spectrom.,2012,312:163-172.
[5]Saini R K,Ahn H Y,Park G W,Shin J W,Lee J H,Yu J W,Song M H,Keum Y S.Foods,2023,12:3 549.
[6]Bhattacharyya S,Datta S,Mallick B,Dhar P,Ghosh S.J.Agric.Food Chem.,2010,58(14):8 259-8 264.
[7]Buscemi S,Corleo D,Di P F,Petroni M L,Satriano A,Marchesini G.Nutrients,2018,10(9):1 321.
[8]Becerra M O,Contreras L M,Lo M H,Díaz J M,Herrera G C.J.Funct.Foods,2020,66:103 771.
[9]Han L,Song X.J.Biochem.Mol.Toxicol.,2022,36(2):e22 958.
[10]Bilgi S,Akta
S,Akta
![]() A.Tissue and Cell,2024,1:102 609.
A.Tissue and Cell,2024,1:102 609.
[11]Strati I F,Oreopoulou V.Food Chem.,2011,129(3):747-752.
[12]Mehariya S,Iovine A,Di S G,Larocca V,Martino M,Leone G P,Molino A.Molecules,2019,24(7):1 324.
[13]Wang L,Lu W,Li J,Hu J,Ding R,Lv M,Wang Q.Molecules,2019,24(16):2 994.
[14]Low K L,Idris A,Yusof N M.Process Biochem.,2022,121:87-99.
[15]Belwal T,Chemat F,Venskutonis P R,Cravotto G,Jaiswal D K,Bhatt I D,Luo Z.Trends Anal.Chem.,2020,127:115 895.
[16]Cheng Z,Song H,Yang Y,Zhou H,Liu Y,Liu Z.J.Chromatogr.Sci.,2016,54(2):246-256.
[17]Guo J H,Qian C W,Zhang K.Chin.J.Exp.Tradit.Med.Formulae,2012,18(11):13-15.
[18]Huang W C,Li Z,Li X J,Gong L M,Liu X Q,Kwon O K,Lee H K.Environ.Toxicol.Pharmacol.2014,38(2):406-411.
[19]Yang D.Cereals Oils,2023,36(9):96-100.杨端.粮食与油脂,2023,36(9):96-100.
[20]Ran L M,Pan X,Zhao H P,Zhou H L.Cereals Oils,2023,36(1):110-114.冉丽梅,樊旭,赵鹤鹏,周鸿立.粮食与油脂,2023,36(1):110-114.
[21]Sui Z F,Gao Y J,Qing L X.Cereals Oils,2022,35(3):127-131.隋志方,高愿军,秦令祥.粮食与油脂,2022,35(3):127-131.
[22]Kang Z Y,Zhao D Q,Yao J J,Zhao L M,Huang B T,Liu L,Qi B.Sci.Technol.Food Ind.,2024,45(7):184-190.康忠禹,赵大庆,姚佳婧,赵丽明,黄宝泰,刘莉,齐滨.食品工业科技,2024,45(7):184-190.
[23]Wang J,Ma C M,Wang D.China Food Addit.,2023,34(6):160-167.王娟,马春梅,王丹.中国食品添加剂,2023,34(6):160-167.
[24]Wang Y,Du S Y,Wu Q,Xiao Y,Wu K,Yuan H,Li H Y,Li Y,Zhao J Y.J.Beijing Univ.Tradit.Chin.Med.,2012,35(10):699-701.王玥,杜守颖,吴清,肖瑶,戎堃,袁航,李慧云,黎迎,赵静宜.北京中医药大学学报,2012,35(10):699-701.
[25]Zhao L,Tang H,Dong Q,Yuan T R,Zhao X M.Res.Pract.Chin.Med.,2014,28(3):74-76.赵蕾,唐辉,董琼,袁天荣,赵雪梅.现代中药研究与实践,2014,28(3):74-76.
[26]Zhao M R,Xin M Y,Ren X L.Chin.Med.Pharm.,2020,10(19):83-86;139.赵明蕊,辛梦雨,任相莲.中国医药科学,2020,10(19):83-86;139.
[27]Zhou G J,Feng X H.China Oils Fats,2019,44(8):14-17.周光姣,冯学花.中国油脂,2019,44(8):14-17.
[28]Sun L Q,Gao Y X,Teng M H.Chem.Reagents,2023,45(12):48-53.孙立权,郜玉欣,滕茂浩.化学试剂,2023,45(12):48-53.
[29]Li M,Wang R B,Xing J H,Tang Y X.Phytomedicine,2021,93:153 773.
[30]Kuo C S,Chen S Y,Tsai J C.Molecules,2023,28(21):7 445.