癌症是威胁人类健康的重大疾病,其治疗和诊断主要依赖于手术切除、化疗、放疗、靶向治疗、激素治疗及免疫治疗等常规方法。其中,化疗和放疗虽然通过细胞毒性和细胞抑制作用能有效对抗肿瘤的生长,但这些方法常伴随明显的毒副作用,并存在较高的复发风险。为了克服传统癌症治疗和诊断方法的局限性,纳米医学在可控条件下为癌症的诊断、监测和治疗提供了新的可能性。近年来,纳米技术在药物输送、诊断工具及疾病治疗策略等方面的应用取得了显著进步,研究人员合成的尺寸在100 nm范围内的多种形状(如球体、立方体、胶囊和丁香形等)的颗粒和材料(如聚合物、脂质体、金属和金属氧化物等),在生物医学领域得到了广泛应用[1-5]。其中,纳米靶向给药载体不仅具有优越的体内药代动力学特性和肿瘤归巢能力,还能在病灶处选择性地控制药物释放,从而实现高效且副作用最小的特异性治疗。
近年来,氮化硼(BN)纳米材料因其卓越的力学性能和优异的导热性而受到广泛关注[6-8]。BN纳米材料具有等电子特性,并拥有类似石墨的稳定六边形结构[9,10]。相较于碳纳米管,BN纳米材料表现出更高的化学惰性和结构稳定性,这使其具有更优异的生物相容性和更低的细胞毒性,在生物医学领域展现出广阔的应用前景。特别值得注意的是,BN纳米材料的高比表面积(SSA)特性使其具备出色的药物负载能力,同时有利于实现药物的靶向递送。此外,BN纳米材料的形状、深度、尺寸和表面特性的可调性,为生物和制药应用提供了广泛的选择。因此,探索BN纳米材料在肿瘤治疗中的应用具有重要的研究价值。本文综述了近年来有关BN纳米材料用于药物靶向递送的研究成果,介绍了BN纳米材料(如BN纳米管、BN纳米片和多孔BN,图1)的合成及其在药物递送领域的最新进展,以期为新型纳米药物递送系统的开发提供参考。
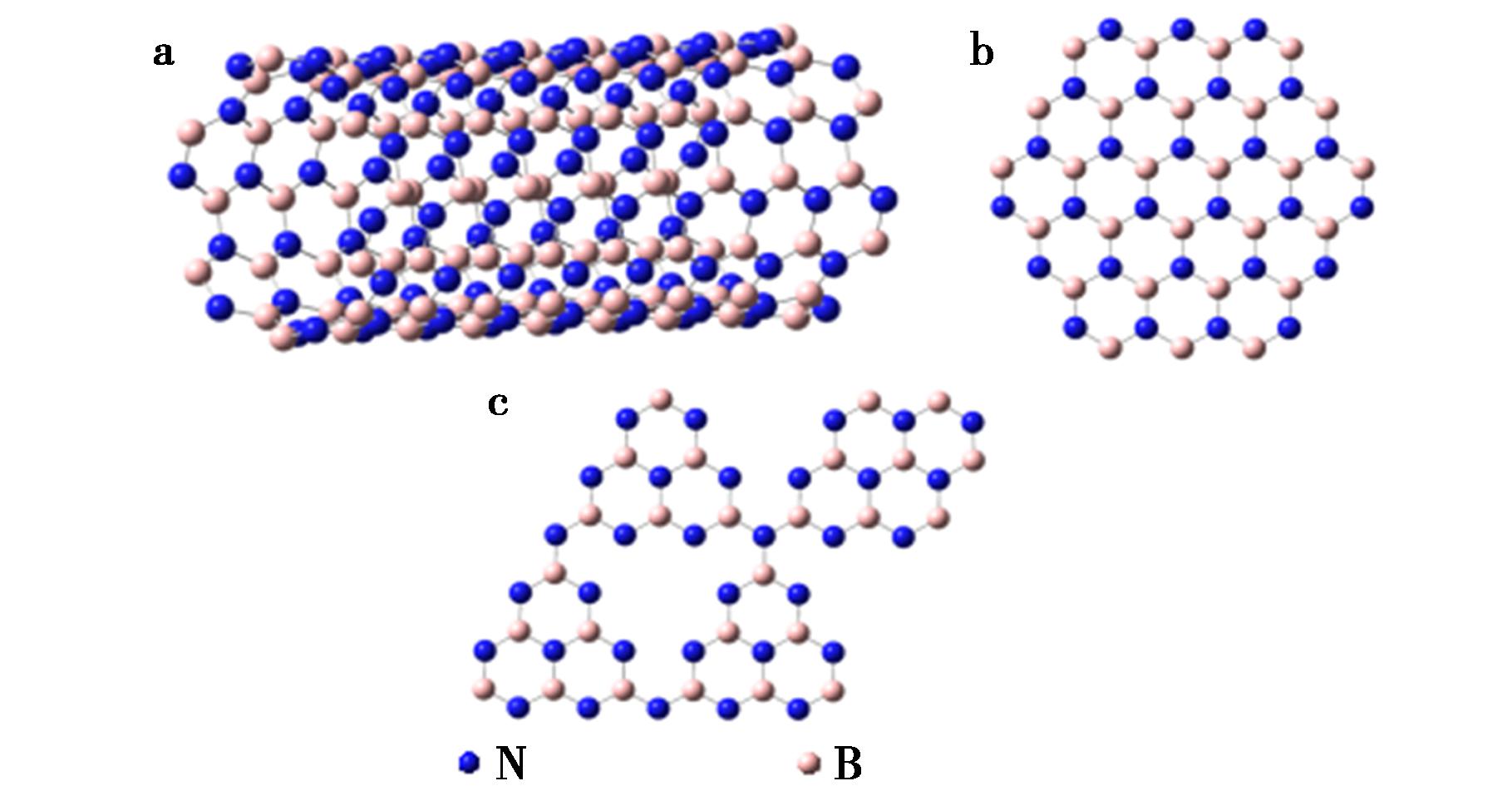
a.氮化硼纳米管;b.氮化硼纳米片;c.多孔氮化硼
图1 氮化硼纳米材料结构模型图
Fig.1 Structural model diagram of boron nitride nanomaterials
1 BN纳米材料的合成方法
BN是一种人工合成的晶体化合物,其结构特征与石墨相似,其中硼和氮原子以交替排列的方式取代了碳原子的位置。BN能够在多种晶格结构中与碳形成同构体,其形态包括零维笼状结构、一维纳米管、二维纳米片以及三维类金刚石晶体结构。在BN的合成领域,研究人员已开发出多种制备方法,其中包括高温加压法、化学剥离法、冷冻干燥法、化学气相沉积法、硼墨法、微流化法以及液相剥离法等[11]。这些方法为BN的多样化应用提供了坚实的材料基础。以下总结概括了BN纳米管(BNNT)、BN纳米片(BNNS)和多孔BN(PBN)的主要合成方法,如表1所示。
表1 BN纳米材料的主要合成方法及特点
Tab.1 Main synthetic methods and characteristics of BN nanomaterials
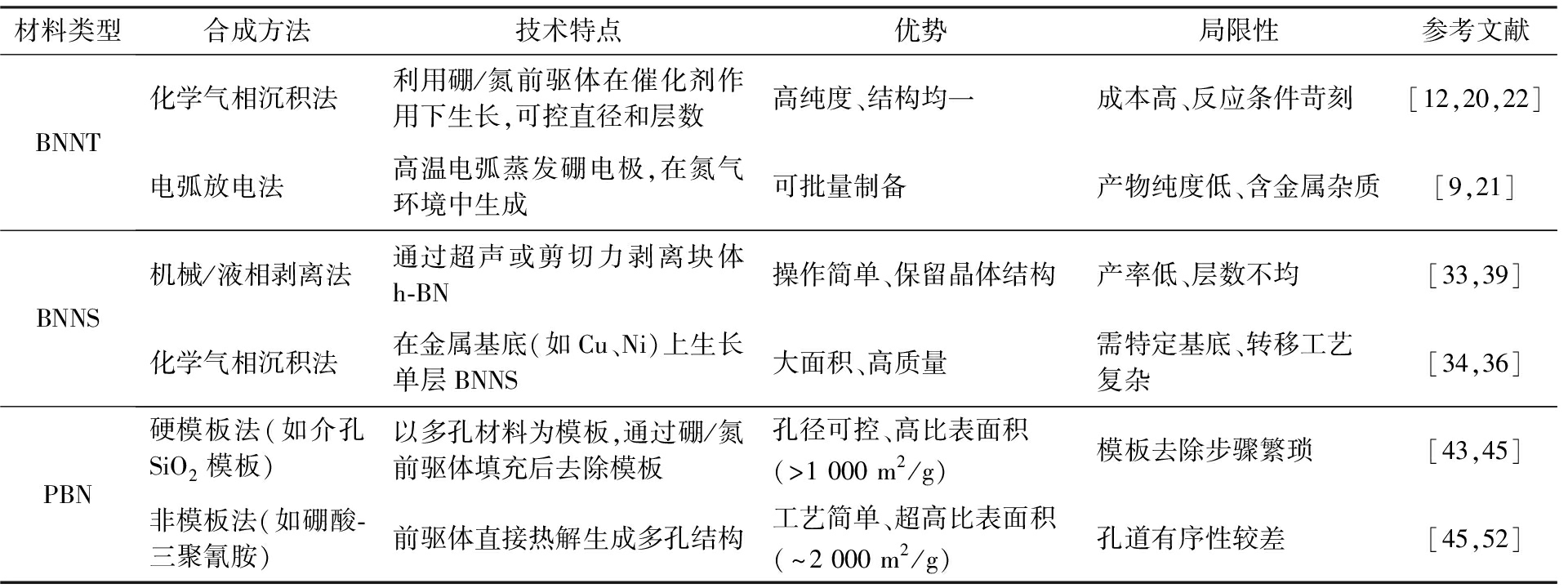
材料类型合成方法技术特点优势局限性参考文献BNNT化学气相沉积法利用硼/氮前驱体在催化剂作用下生长,可控直径和层数高纯度、结构均一成本高、反应条件苛刻[12,20,22]电弧放电法高温电弧蒸发硼电极,在氮气环境中生成可批量制备产物纯度低、含金属杂质[9,21]BNNS机械/液相剥离法通过超声或剪切力剥离块体h-BN操作简单、保留晶体结构产率低、层数不均[33,39]化学气相沉积法在金属基底(如Cu、Ni)上生长单层BNNS大面积、高质量需特定基底、转移工艺复杂[34,36]PBN硬模板法(如介孔SiO2模板)以多孔材料为模板,通过硼/氮前驱体填充后去除模板孔径可控、高比表面积(>1 000 m2/g)模板去除步骤繁琐[43,45]非模板法(如硼酸-三聚氰胺)前驱体直接热解生成多孔结构工艺简单、超高比表面积(~2 000 m2/g)孔道有序性较差[45,52]
1.1 BNNT的合成
BNNT呈现出与碳纳米管相似的管状结构,其显著特征在于碳原子被硼和氮原子完全取代,形成六边形晶格排列。鉴于结构的相似性,BNNT与碳纳米管共享若干内在特性,包括卓越的机械性能和高导热性[12]。实验研究通过质构仪测量了BNNT的杨氏模量,并预测其在高温条件下具有热力学稳定性[13,14]。此外,BNNT展现出与碳纳米管相当的导热性[15,16]和抗氧化性(可达 900 ℃)[17]。BNNT相对于碳纳米管来说,它的电特性不受纳米管的直径和螺旋度的影响[18]。BNNT的合成方法主要包括电弧放电法、球磨法、化学气相沉积法(CVD)、激光烧蚀法和热等离子体喷射法[19]。其中,CVD法因其易于控制实验装置、前驱体变量、温度、催化剂类型和生长机理等生长参数,而被视为合成BNNT的最佳方法之一,该方法利用金属催化剂和气态前体,实现固态BN纳米管的生长[20]。
Chopra等[9]首次报道了通过电弧放电工艺成功制备BNNT的方法,该工艺采用铜作为阴极,填充BN粉末的钨作为阳极,合成了尖端带有金属纳米颗粒的BNNT。Loiseau等[21]使用高纯度热压硼化铪(HfB2)电极合成BNNT,观察到大量层数减少且端部扁平的纳米管,该方法适用于BNNT的生产。2002年,硼(B)和氧化镁(MgO)首次被应用于通过CVD法制备BNNT[22,23],随后B与氧化铁、B与氧化锂或B与水的组合也被用于BNNT的生长[24-26]。等离子体辅助CVD技术被应用于在各种衬底上生长BNNT阵列[27]。通过无催化剂的受激热等离子体法,以碳氮化硼(BC4N)、BN或B与H2-N2混合气体、H2或N2为原料,实现了BNNT的直接大规模合成[28,29]。此外,通过在N2环境下加热B2O3,可以制备出具有与原始碳纳米管相似直径的BNNT[30-32]。
1.2 BNNS的合成
BNNS是六方氮化硼(h-BN)的二维结晶形式,其结构与石墨烯相似。以h-BN粉末作为前驱体,可通过多种方法大量制备BNNS。BNNS在纳米尺度上具有有限的厚度,而在其他两个维度上则展现出无限的延展性。BNNS的制备方法主要分为自上而下和自下而上两种策略。自上而下的方法通常涉及微波机械解离和超声辅助剥离技术,而自下而上的方法则通过基底或无基底工艺实现BNNS的生长。Nagashima等[33]首次利用镍、钯、钌和铂等过渡金属作为基底成功制备了单层h-BN纳米片。随后,铜和镍薄膜也被广泛用作BNNS制备的基底[34,35]。Corso等[36]在超高真空条件下,将原子级清洁的金属铑表面暴露于环硼氮烷(B3H6N3)蒸气中,并在800 ℃下处理,随后冷却至室温,通过扫描隧道显微镜观察到了 h-BN的有序插层结构。此外,等离子体CVD和催化剂辅助CVD也被用于BNNS的制备[37]。Yu等[38]采用微波等离子体CVD技术,以BF3、N2和H2为混合气体,在N型硅单晶衬底上成功制备了垂直排列的BNNS。通过调控生长条件,可以有效控制BNNS的尺寸、形貌、厚度、密度和排列方式。Wang等[39]在氨气环境下,通过对硼酸铵氢氧化物水合物前体进行高温退火,实现了无基底和无催化剂的BNNS制备。此外,无基底条件下,通过尿素和硼酸的直接化学反应也可制备BNNS[40]。高温CVD方法可以通过以B2O3、N2和三聚氰胺为原料,合成大量具有独特尺寸分布的h-BN纳米片[41],如图2所示。该合成路线具有无模板、低温简便和高产率等优点。“化学吹制”路线法也被用于高效制备BNNS,其特点是横向面积大且产量高[42]。
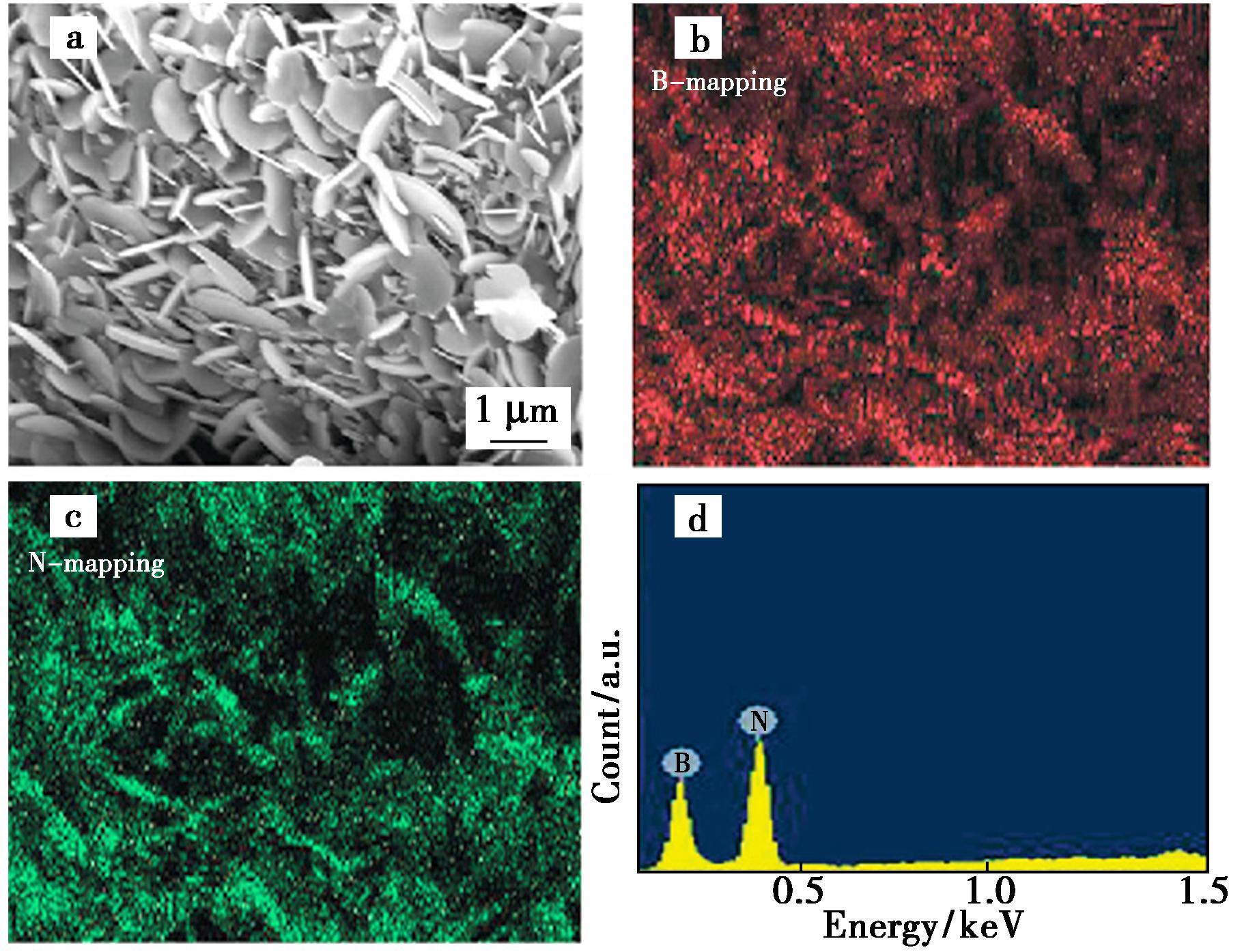
a.1 200 ℃下获得的BN纳米片的扫描电镜图像;b.对应的B元素图谱;c.对应的N元素图谱;d.能量色散X射线光谱
图2 高温CVD方法获得的纳米片相关图像[41]
Fig.2 Images related to the nanosheets obtained by the high-temperature CVD method[41]
1.3 PBN的合成
PBN作为三维BN材料领域的研究热点,其三维空间结构的精确调控显著影响着材料的吸附性能、分离效率及催化活性。PBN的合成主要依赖于硬模板法和非模板法两种策略。在硬模板法中,研究人员通过在多孔二氧化硅、沸石或碳材料上进行纳米铸造,可以获得与硬模板互补的孔隙结构;而通过元素取代多孔碳或石墨烯气凝胶,则可实现类似的孔隙调控[43],如图3a~3c所示。通过这种方法制备的纳米PBN的SSA通常在100~950 m2/g范围内。由于硼化学的复杂性,适用于纳米多孔碳合成的软模板方法尚未在BN体系中得到广泛应用,仅见于一种特殊的嵌段共聚物(聚茂烯-十茂烷基),其与硼结合嵌段兼具硼前体和软模板的双重功能[44]。

a.通过纳米铸造从有序介孔碳CMK-3中模板制备的有序介孔BN的透射电子显微镜(TEM)图像;b.通过元素置换从介孔碳中模板制备的介孔BN的TEM和SEM图像;c.通过元素置换从石墨烯气凝胶模板制备的BN气凝胶的TEM图像和照片;d.通过2B-M的非模板反应制备的PBN的TEM和SEM图像;e.通过B2O3和盐酸胍的非模板反应制备的PBN的高分辨率透射电子显微镜(HRTEM)和SEM图像;f.通过硼酸和双氰胺 的非引发反应制备的PBN微海绵的HRTEM和SEM图像
图3 用硬模板法(a~c)[43]和非模板法(d~f)[45]制备的纳米PBN Fig.3 Nanoporous BN prepared by the hard template method (a~c)[43] and the non-template method (d~f)[45]
最近,非模板化策略取得了显著进展,如图3d~3f所示,采用硼酸-三聚氰胺(2B-M)前驱体的无模板法制备了SSA>1 000 m2/g的BN材料[45]。所得微带状PBN结构的SSA达到了前所未有的1 488 m2/g。采用B2O3-胍盐酸盐前体制备SSA为1 427 m2/g的纳米PBN,进一步证明了非模板化的可行性。用H3BO3-二氰酰胺和2B-M前体分别将SSA提高到约2 000 m2/g。理论模型表明,纳米PBN结构的SSA可达4 800 m2/g,这意味着提高PBN的SSA仍有很大的潜力和挑战。
2 BN纳米材料用于药物靶向递送
纳米生物技术的革新推动了抗癌药物递送系统的快速发展,其中多种纳米载体被广泛应用,包括纳米片、纳米球、纳米管、纳米载体、微针、纳米胶囊、基于树枝状聚合物的脂质纳米颗粒以及胶束等。在众多生物医学应用的纳米系统中,碳基材料和BN基材料因其独特的物理化学性质,在过去几年中已成为药物递送领域的研究热点。本文将系统综述BNNT、BNNS以及PBN纳米材料在药物递送中的应用进展,如表2所示。
表2 BN纳米材料在药物靶向递送中的应用
Tab.2 Application of BN nanomaterials in targeted drug delivery
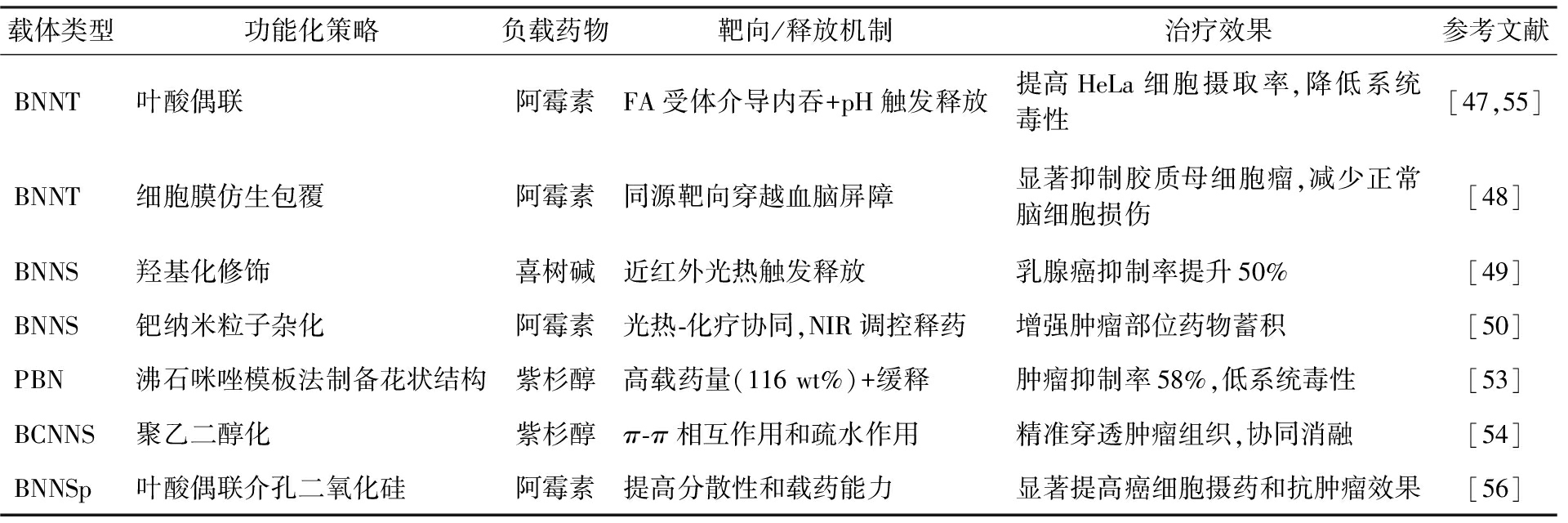
载体类型功能化策略负载药物靶向/释放机制治疗效果参考文献BNNT叶酸偶联阿霉素FA受体介导内吞+pH触发释放提高HeLa细胞摄取率,降低系统毒性[47,55]BNNT细胞膜仿生包覆阿霉素同源靶向穿越血脑屏障显著抑制胶质母细胞瘤,减少正常脑细胞损伤[48]BNNS羟基化修饰喜树碱近红外光热触发释放乳腺癌抑制率提升50%[49]BNNS钯纳米粒子杂化阿霉素光热-化疗协同,NIR调控释药增强肿瘤部位药物蓄积[50]PBN沸石咪唑模板法制备花状结构紫杉醇高载药量(116 wt%)+缓释肿瘤抑制率58%,低系统毒性[53]BCNNS聚乙二醇化紫杉醇π-π相互作用和疏水作用精准穿透肿瘤组织,协同消融[54]BNNSp叶酸偶联介孔二氧化硅阿霉素提高分散性和载药能力显著提高癌细胞摄药和抗肿瘤效果[56]
2.1 BNNT的药物递送特性及其应用
BNNT作为纳米材料中最具潜力的药物递送载体之一,因其独特的结构特征而备受关注。其显著优势在于:(1)具有较大的内部空腔,可高效包封药物分子;(2)内外表面可进行差异化功能修饰,同时其化学惰性和结构稳定性确保了材料对生物体和环境的安全性,这为其在医疗领域的应用,特别是系统性的药物递送过程提供了重要保障。Ciofani等[46]首次揭示BNNT具有典型的超顺磁性特征,同时进行了体外实验,结果表明活细胞吸收BNNT可以通过外部磁场来调节,验证了BNNT的超顺磁性。因此,BNNT有潜力作为磁性药物靶向的纳米载体,使其在外部磁场的影响下能够将所需浓度的药物递送到靶点。Emanet等[47]对比研究了BNNT与h-BN作为新型纳米载体的潜力。体外实验结果表明,与h-BN相比,BNNT可负载更高浓度的阿霉素(DOX),并且在中性和碱性pH下达到最佳负载量,是酸性pH下的3倍。此外,DOX-BNNT与叶酸(FA)结合有助于有效靶向癌细胞。Pasquale等[48]开发出一种基于胶质母细胞瘤(GBM)细胞同型识别的新型载药系统。该系统由负载DOX的BNNT组成,BNNT负载DOX并包被从GBM细胞中提取的细胞膜(CM,图4)[48]。体外实验表明,该系统(Dox-CM-BNNT)能够成功穿越血脑屏障模型,并靶向性地杀伤GBM细胞,大大减少了对健康脑细胞的损伤。
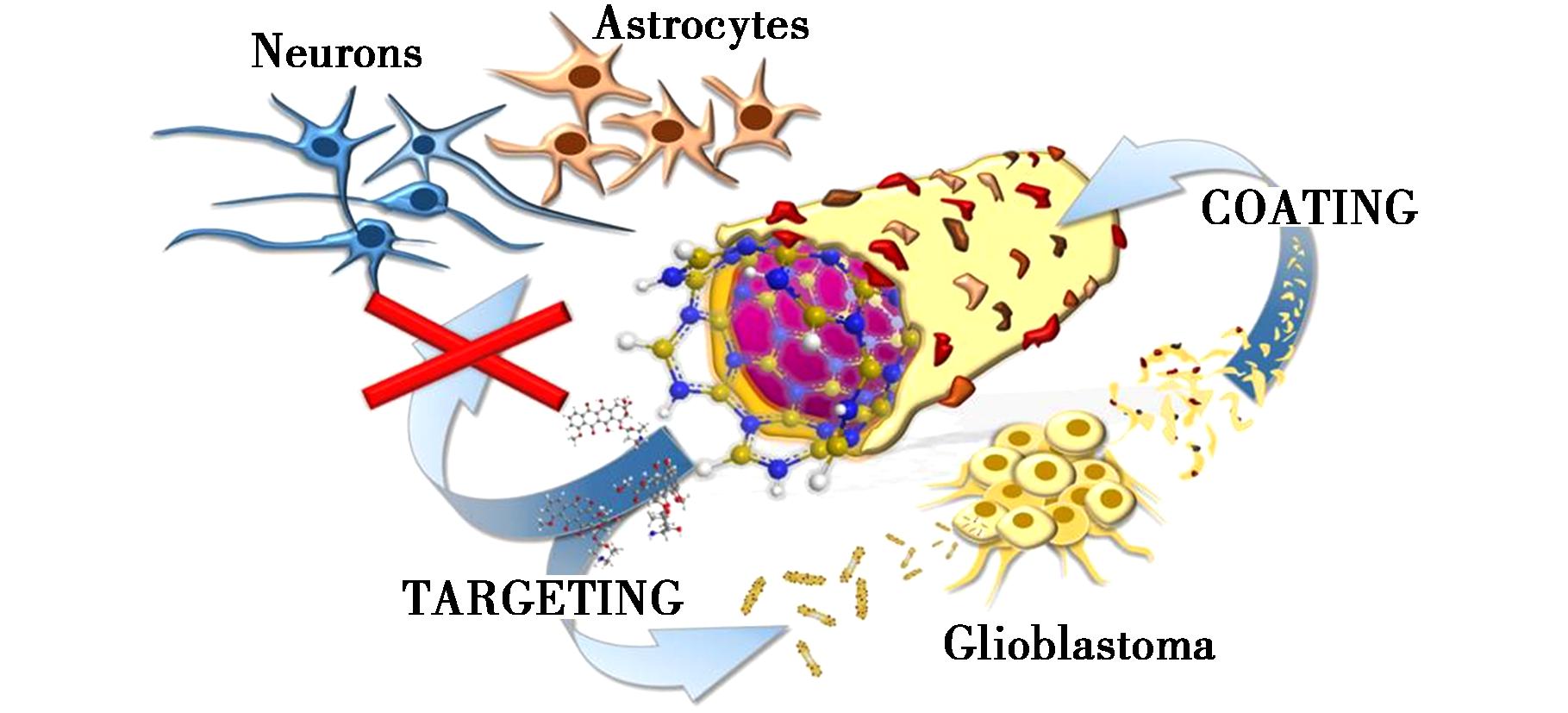
图4 纳米药物Dox-CM-BNNT的结构及其靶向作用机制示意图[48]
Fig.4 Schematic diagram of the structure and targeting mechanism of the nano-drug Dox-CM-BNNT[48]
2.2 BNNS的药物递送特性及其应用
BNNS具有高导热系数、宽带隙、优异的机械强度、理想的结构稳定性、大SSA、高耐氧化性以及良好的化学惰性等显著特点。这些优异的性能,使BNNS在药物递送系统中的应用引起了研究者的关注。如图5所示,Cheng等[49]基于氯化钠模板反应的新方法,成功合成了高纯度和结晶度的BNNS。经羟基化修饰后,获得高分散性和稳定性的羟基化BN纳米片(OH-BNNS),用于抗癌药物喜树碱(CPT)的递送。体内和体外实验结果表明,高生物相容性的OH-BNNS在体内和体外都能有效的装载和递送CPT,并对乳腺癌具有显著的抑制效果。Zhang等[50]设计了一种多刺激响应型递药载体——OH-BNNS与钯(Pd)纳米杂化体(Pd@OH-BNNS)。在纳米片表面原位形成Pd纳米粒子后,Pd@OH-BNNS被赋予光热性质,在近红外光照射下会触发负载药物的快速释放。Pd@OH-BNNS作为一种递药载体,不仅对DOX表现出很高的负载能力,而且细胞摄取实验表明在近红外光照射下能够快速释放DOX。Cheng等[51]通过改变腺嘌呤功能化大分子A-PPG与BNNSs的质量比,成功调节了BNNS的层数,并且所得的BNNS具有优异的温度/pH响应性、生物相容性和载药能力。体外释药研究表明,负载药物的BNNS在正常生理条件下具有优异的稳定性和药物包封性;而将环境温度提高至40 ℃或降低至pH 5.5,则会引发包封药物从载药纳米片中快速释放,这表明其可以在肿瘤等特定的微环境下释放药物,从而实现可控释药。
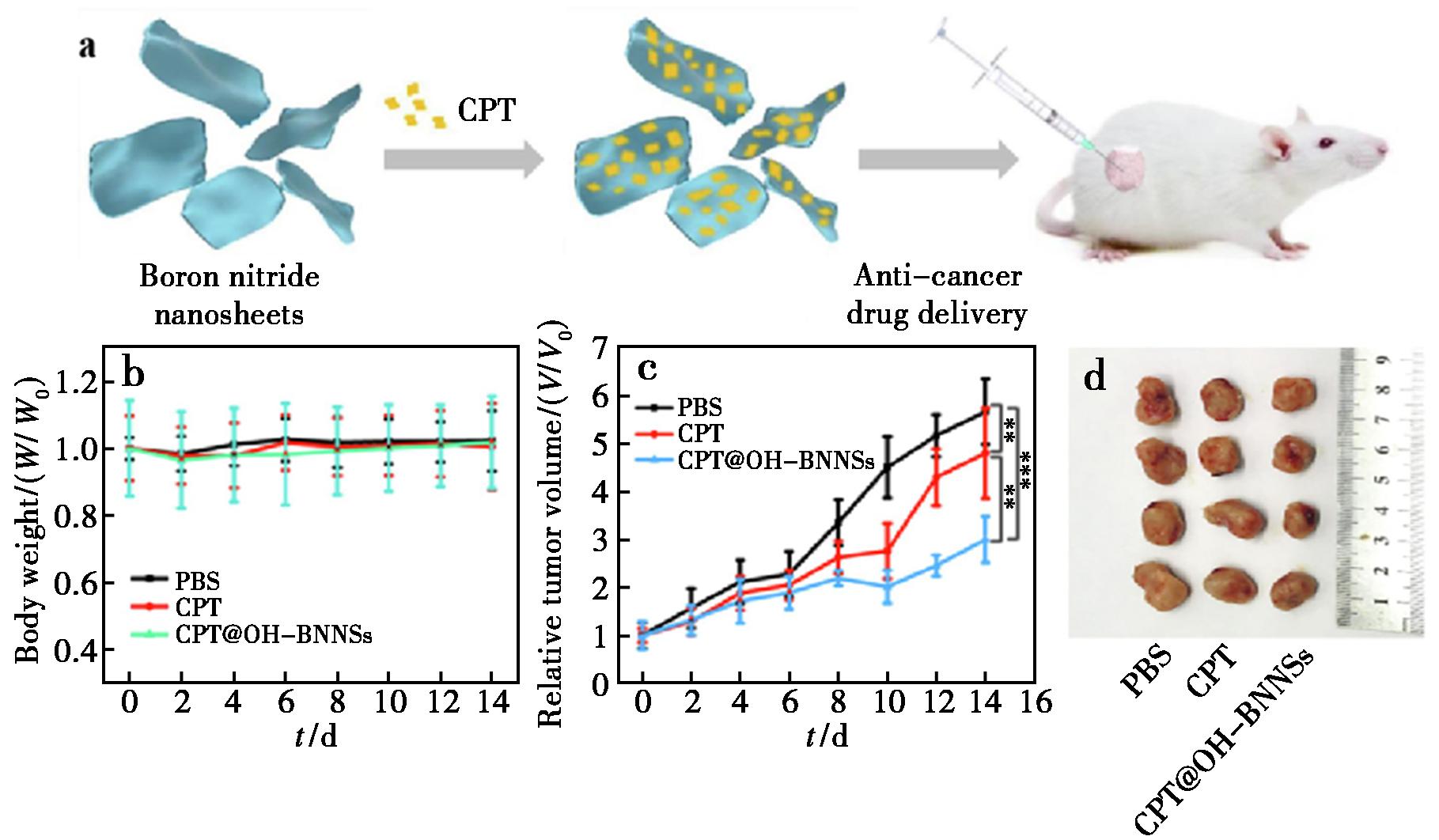
a.体内评估示意图;b.不同条件下各治疗组小鼠的体重;c.BALB/c小鼠的肿瘤生长曲线;d.各组实验动物的肿瘤组织照片
图5 CPT@OH-BNNSs抑制乳腺癌的体内实验[49]
Fig.5 In vivo experiments of CPT@OH-BNNSs inhibiting breast cancer[49]
2.3 PBN的药物递送特性及应用
PBN在结构上与活性炭相似,呈现乱层至无定形特征,由交替排列的硼和氮原子组成的六元环构成。其独特的物理化学性质,包括优异的热稳定性、丰富的表面化学特性以及高SSA,使其成为癌症治疗中极具潜力的药物递送载体。Weng等[52]通过碳原子在石墨碳氮化物中的热取代反应直接合成了高水溶性的PBN,通过各种显微和光谱技术对所得PBN的结构和化学成分进行分析,证实了所得产物具有高羟基化度;并通过细胞实验,证实了这种高水溶性的PBN具有良好的生物相容性和抗癌药物装载、释放和递送的性能。Wang等[53]以沸石咪唑骨架结构(ZIF-L)为模板,成功制备了具有花状结构的PBN碳(ZBCN)纳米材料(图6),该材料表面丰富的羟基使其在水溶液中表现出优异的分散性和稳定性,独特的花状结构赋予材料高达340 m2/g的SSA和1.03 cm3/g的孔隙体积,丰富的介孔结构使其对紫杉醇(PTX)的负载能力达到116 wt%。体内抗肿瘤实验结果表明,ZBCN肿瘤抑制率达到58%,而且表现出低系统毒性和高生物安全性。
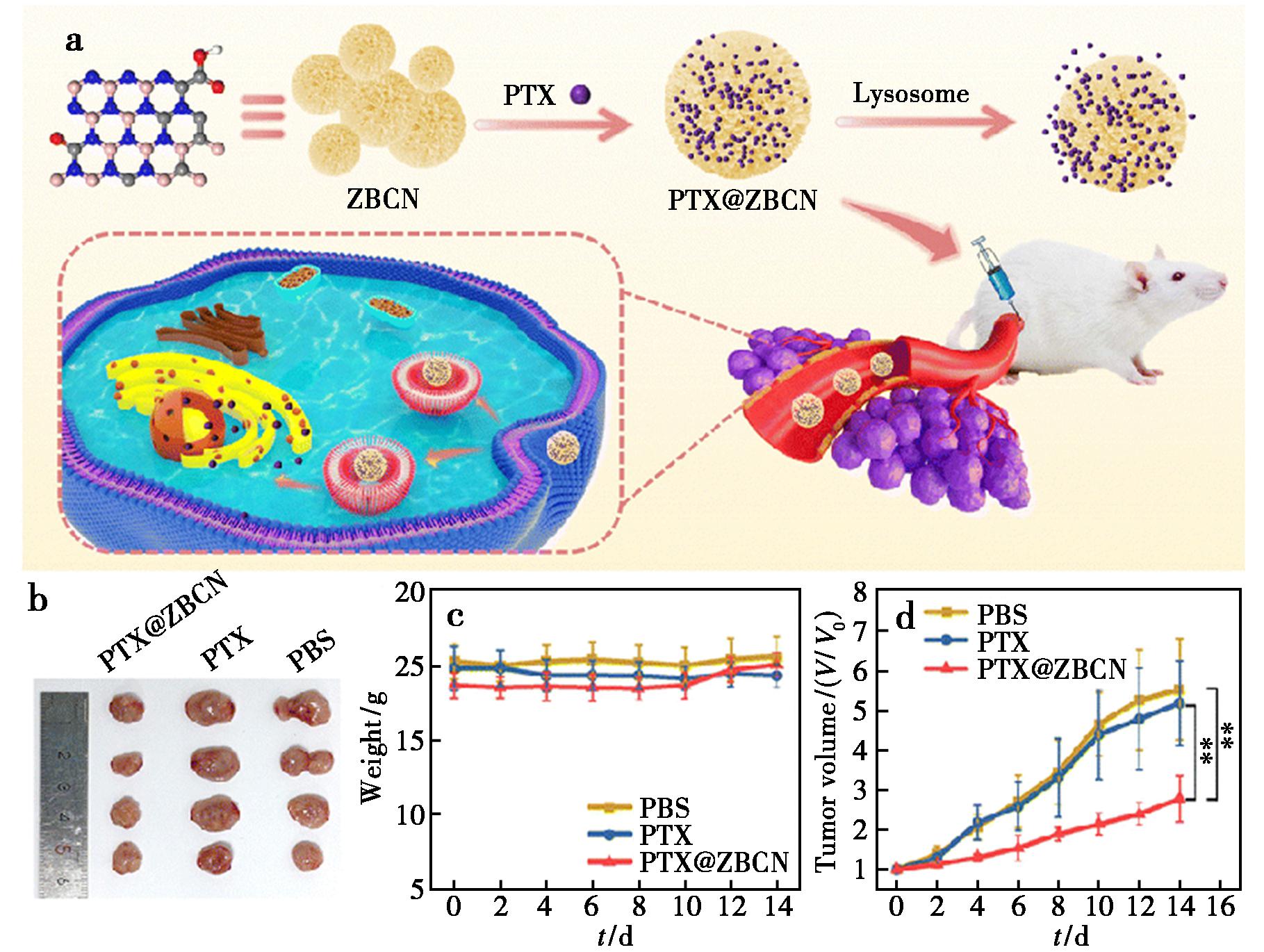
a.靶向抗肿瘤机制示意图;b.各组实验动物的肿瘤组织照片;c.不同条件下各治疗组小鼠的体重;d.BALB/c小鼠的肿瘤生长曲线
图6 纳米药物PTX@ZBCN的作用机制及其体内抗肿瘤活性[53]
Fig.6 Mechanism of action and in vivo anti-tumor activity of the nano-drug PTX@ZBCN[53]
2.4 功能化BN纳米材料用于药物递送
尽管BN纳米材料因其优异的化学惰性和稳定性,在生物医学领域展现出潜在的应用价值,其高度稳定的表面特性导致其在液相体系中分散性较差,并难以与其他材料有效复合。此外,原始BN纳米材料表面缺乏活性官能团,限制了其载药效率和药物负载量,同时不具备主动靶向能力。通过对BN纳米材料表面功能化修饰,可显著提升其生物相容性、载药效率以及靶向性,为解决传统递药系统的局限性提供了新思路。
Yang等[54]通过改进的固相反应法结合超声剥离法合成了六方碳氮化硼(BCNNS),并利用二硬脂酰磷脂酰乙酰胺-甲氧基聚乙二醇5000(DSPE-mPEG-5000)对BCNNS进行非共价修饰,提高了其在水中的分散性。细胞实验表明,聚乙二醇化的BCNNS通过π-π相互作用和疏水相互作用负载PTX,形成的BCNNSs-PEG-PTX纳米复合物可被MDA-MB-231乳腺癌细胞有效吸收,与游离PTX相比具有更高的细胞毒性。Zhang等[55]通过酯化反应将FA接枝到BN上,成功构建了一种基于叶酸偶联的BN纳米球BNNSp-FA,并将DOX包载到BNNSp-FA复合物上。该载药纳米颗粒在pH 7.4时结构稳定,而当pH降低到5.0时包载的DOX则被有效释放,表现出了良好的pH敏感性和缓释效果。细胞实验表明,BNNSp-FA浓度达到100 μg/mL时对HeLa细胞无毒性,表现出良好的安全性;由于FA受体介导的细胞摄取,DOX@BNNSp-FA比游离DOX和DOX@BNNSp对HeLa细胞表现出更强的细胞毒性。Feng等[56]开发了一种基于FA偶联介孔二氧化硅(MS)的功能化BN纳米球BNMSp-FA(图7)。通过MS修饰,BN纳米球的分散性和载药能力得到了极大的提高。细胞实验表明,通过FA受体介导的内吞作用DOX@BNMSp-FA被HeLa和MCB-7细胞特异性内化,表现出比游离DOX和DOX@BNMSp更好的药物摄取和抗肿瘤效果。
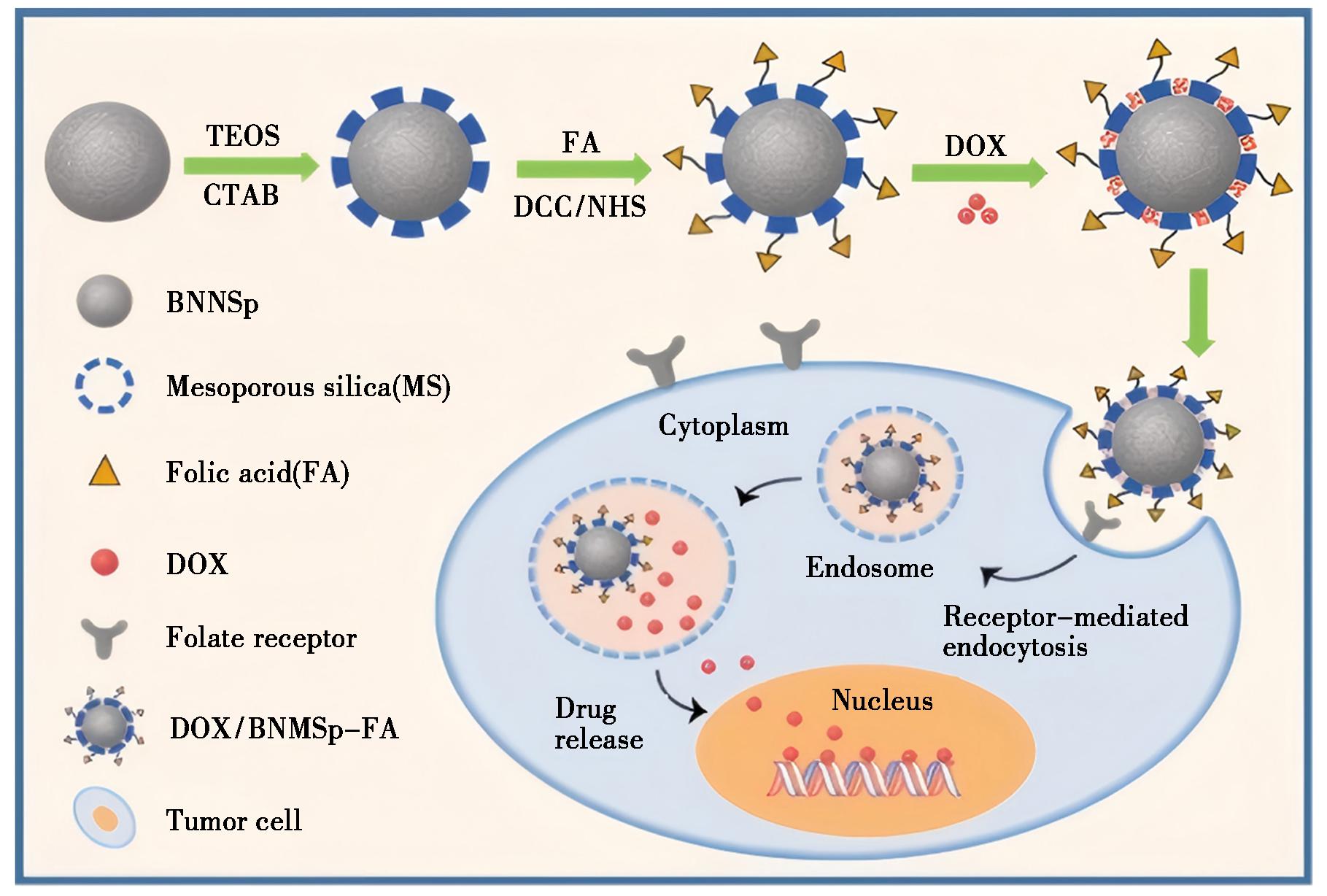
图7 载药纳米颗粒DOX@BNMSp-FA的制备和靶向抗肿瘤作用机制示意图[56]
Fig.7 Schematic diagram of the preparation of drug-loaded nanoparticles DOX@BNMSp-FA and its targeted anti-tumor mechanism[56]
Carrera等[57]设计了一种新型递送系统MNP-BNN-PEG用于负载DOX,该系统由复合磁性纳米颗粒(MNP)和BN纳米片相结合,同时BN纳米片表面涂覆pH响应性聚合物聚乙二醇(PEG)。体外和体内实验表明,与游离DOX相比,MNP-BNN-PEG-DOX对HepG2细胞具有更高的抑制作用,其治疗组的动物肿瘤体积显著减小;尤其是MNP-BNN-PEG-DOX系统在赋予DOX肿瘤靶向作用的同时,有效避免了对正常组织的毒副作用。Li等[58]开发出一种高效的双靶向癌细胞膜仿生纳米递送系统CM-BIDdT,用于协同递送DOX和吲哚菁绿(ICG)。该纳米颗粒表现出对肿瘤细胞的高效同源靶向能力,通过进一步修饰酸化TAT肽,纳米颗粒的细胞内积累能力得到显著增强。CM-BIDdT纳米颗粒能够响应酸性肿瘤微环境,通过氨键断裂激活跨膜穿透功能,从而在肿瘤部位实现高效积累和精准靶向。此外,在激光照射下,该纳米颗粒的光热效应不仅通过热消融作用直接杀伤肿瘤细胞,还能通过破坏纳米颗粒表面的膜结构,促进DOX的释放,从而实现协同治疗的效果。
3 总结及展望
BN纳米材料因其高比表面积、优异的生物相容性及可调控的物理化学性质,在药物递送领域展现出显著优势。本文系统综述了BNNT、BNNS及PBN的合成策略及其在肿瘤靶向治疗中的应用进展。研究表明,BNNT可通过外磁场调控实现药物的精准递送;BNNS因其pH/温度双重响应性,可有效适配肿瘤微环境;而PBN则凭借其高孔隙率及大比表面积,显著提升了载药效率。通过表面功能化修饰(如聚乙二醇化、叶酸或靶向肽偶联等),可进一步优化材料的分散性、载药性能及肿瘤靶向能力,从而降低对正常组织的毒副作用并增强治疗效果。
尽管BN纳米材料作为药物载体已取得重要突破,但其临床转化仍面临以下挑战:(1)规模化制备与成本控制:现有合成方法(如CVD)成本较高,需开发经济、高效的规模化制备技术,并建立材料性能的标准化评价体系;(2)长期生物安全性评估:需通过系统的体内外实验验证其长期毒性及代谢途径,以确保临床应用的安全性;(3)靶向递送效率的优化:需进一步探索表面修饰策略(如抗体或特异性配体偶联),以提高肿瘤组织富集效率并减少脱靶效应,推动从动物实验向临床研究的转化。未来研究方向应聚焦于:(1)开发多功能BN基纳米平台,如结合光热疗法、基因递送或免疫调节功能的“诊疗一体化”系统;(2)探索BN材料与其他治疗手段(如近红外光热治疗)的协同效应,以增强抗肿瘤疗效。总之,BN纳米材料作为一种极具潜力的药物载体,其应用前景广阔。随着合成技术、安全性评价及靶向策略的不断完善,BN纳米材料有望为高效低毒的抗肿瘤药物开发提供新的解决方案。
[1]Lewisoscar F,Mubarakali D,Nithya C,Priyanka R,Gopinath V,Alharbi N S,Thajuddin N.Biofouling,2015,31(4):379-391.
[2]Lewisoscar F,Vismaya S,Arunkumar M,Thajuddin N,Dhanasekaran D,Nithya C.Algal Nanoparticles:Synthesis and Biotechnological Potentials.Rijeka:InTech,2016.
[3]Chari N,Felix L O,Davoodbasha M A,Alharbi S A,Nooruddin T.Biocatal.Agric.Biotechnol.,2017,10:336-341.
[4]Sathiyavimal S,Vasantharaj S,Lewisoscar F,Selvaraj R,Brindhadevi K,Pugazhendhi A.Prog.Org.Coat.,2020,147:105 858.
[5]Lewisoscar F,Chari N,Vismaya S,Arunkumar M,Pugazhendhi A,Nguyentri P,Alharbi S A,Alharbi N S,Thajuddin N.Prog.Org.Coat.,2021,151:106 058.
[6]Golberg D,Bando Y,Huang Y,Terao T,Mitome M,Tang C C,Zhi C Y.ACS Nano,2010,4(6):2 979-2 993.
[7]Zhi C Y,Bando Y,Terao T,Tang C C,Kuwahara H,Golberg D.Chem.-Asian J.,2009,4(10):1 536-1 540.
[8]Pakdel A,Bando Y,Golberg D.Chem.Soc.Rev.,2014,43(3):934-959.
[9]Chopra N G,Luyken R J,Cherrey K,Crespi V H,Cohen M L,Louie S G,Zettl A.Science,1995,269(5 226):966-967.
[10]Golberg D,Bando Y,Tang C C,Zhi C Y.Adv.Mater.,2007,19(18):2 413-2 432.
[11]Joy J,George E,Haritha P,Thomas S,Anas S.J.Polym.Sci.,2020,58(22):3 115-3 141.
[12]Ruoff R S,Lorents D C.Carbon,1995,33(7):925-930.
[13]Hern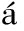 ndez E,Goze C,Bernier P,Rubio A.Phys.Rev.Lett.,1998,80(20):4 502-4 505.
ndez E,Goze C,Bernier P,Rubio A.Phys.Rev.Lett.,1998,80(20):4 502-4 505.
[14]Dumitric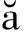 T,Yakobson B I.Phys.Rev.B,2005,72(3):035 418.
T,Yakobson B I.Phys.Rev.B,2005,72(3):035 418.
[15]Chang C W,Fennimore A M,Afanasiev A,Okawa D,Ikuno T,Garcia H,Li D,Majumdar A,Zettl A.Phys.Rev.Lett.,2006,97(8):085 901.
[16]Stewart D A,Savi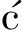 I,Mingo N.Nano Lett.,2009,9(1):81-84.
I,Mingo N.Nano Lett.,2009,9(1):81-84.
[17]Chen Y,Zou J,Campbell S J,Le C G.Appl.Phys.Lett.,2004,84(13):2 430-2 432.
[18]Peyab R,Hosseini S,Esrafili M D.J.Mol.Liq.,2022,361:119 662.
[19]Kim J H,Pham T V,Hwang J H,Kim C S,Kim M J.Nano Converg.,2018,5(1):17.
[20]Lourie O R,Jones C R,Bartlett B M,Gibbons P C,Ruoff R S,Buhro W E.Chem.Mater.,2000,12(7):1 808-1 810.
[21]Loiseau A,Willaime F,Demoncy N,Hug G,Pascard H.Phys.Rev.Lett.,1996,76(25):4 737-4 740.
[22]Rodgers P.Nanoscience and Technology:A Collection of Reviews from Nature Journals.London:Macmillan Publishers Ltd,2009.
[23]Tang C C,Bando Y,Sato T,Kurashima K.Chem.Commun.,2002,(12):1 290-1 291.
[24]Li J,Li J B,Yin Y C,Chen Y J,Bi X F.Nanotechnology,2013,24(36):365 605.
[25]Pakdel A,Zhi C,Bando Y,Nakayama T,Golberg D.Nanotechnology,2012,23(21):215 601.
[26]Huang Y,Lin J,Tang C C,Bando Y,Zhi C Y,Zhai T Y,Dierre B,Sekiguchi T,Golberg D.Nanotechnology,2011,22(14):145 602.
[27]Wang J S,Lee C H,Yap Y K.Nanoscale,2010,2(10):2 028.
[28]Fathalizadeh A,Pham T,Mickelson W,Zettl A.Nano Lett.,2014,14(8):4 881-4 886.
[29]Kim K S,Kingston C T,Hrdina A,Jakubinek M B,Guan J,Plunkett M,Simard B.ACS Nano,2014,8(6):6 211-6 220.
[30]Golberg D,Bando Y.Appl.Phys.Lett.,2001,79(3):415-417.
[31]Han W Q,Todd P J,Strongin M.Appl.Phys.Lett.,2006,89(17):173 103.
[32]Golberg D,Han W,Bando Y,Bourgeois L,Kurashima K,Sato T.J.Appl.Phys.,1999,86(4):2 364-2 366.
[33]Nagashima A,Tejima N,Gamou Y,Kawai T,Oshima C.Phys.Rev.Lett.,1995,75(21):3 918-3 921.
[34]Kim K K,Hsu A,Jia X T,Kim S M,Shi Y M,Hofmann M,Nezich D,Rodriguez-nieva J F,Dresselhaus M,Palacios T,Kong J.Nano Lett.,2012,12(1):161-166.
[35]Shi Y M,Hamsen C,Jia X,Kim K K,Reina A,Hofmann M,Hsu A L,Zhang K,Li H N,Juang Z Y,Dresselhaus M S,Li L J,Kong J.Nano Lett.,2010,10(10):4 134-4 139.
[36]Corso M,Auwärter W,Muntwiler M,Tamai A,Greber T,Osterwalder J.Science,2004,303(5 655):217-220.
[37]Pakdel A,Wang X,Zhi C,Bando Y,Watanabe K,Sekiguchi T,Nakayama T,Golberg D.J.Mater.Chem.,2012,22(11):4 818-4 824.
[38]Yu J,Qin L,Hao Y F,Kuang S Y,Bai X D,Chong Y M,Zhang W J,Wang E G.ACS Nano,2010,4(1):414-422.
[39]Wang H,Xu M,Ping H,Fu Z Y.J.Eur.Ceram.Soc.,2020,40(15):5 324-5 331.
[40]Nag A,Raidongia K,Hembram K P S S,Datta R,Waghmare U V,Rao C N R.ACS Nano,2010,4(3):1 539-1 544.
[41]Gao R,Yin L W,Wang C X,Qi Y X,Lun N,Zhang L Y,Liu Y X,Kang L,Wang X F.J.Phys.Chem.C,2009,113(34):15 160-15 165.
[42]Wang X B,Zhi C Y,Li L,Zeng H B,Li C,Mitome M,Golberg D,Bando Y.Adv.Mater.,2011,23(35):4 072-4 076.
[43]Malenfant P R L,Wan J,Taylor S T,Manoharan M.Nat.Nanotechnol.,2007,2(1):43-46.
[44]Rousseas M,Goldstein A P,Mickelson W,Worsley M A,Woo L,Zettl A.ACS Nano,2013,7(10):8 540-8 546.
[45]Jiang X F,Weng Q H,Wang X B,Li X,Zhang J,Golberg D,Bando Y.J.Mater.Sci.Technol.,2015,31(6):589-598.
[46]Ciofani G,Raffa V,Yu J,Chen Y,Obata Y,Takeoka S,Menciassi A,Cuschieri A.Curr.Nanosci.,2009,5(1):33-38.
[47]Emanet M, en Ö,
en Ö, ulha M.Nanomedicine,2017,12(7):797-810.
ulha M.Nanomedicine,2017,12(7):797-810.
[48]Pasquale D,Marino A,Tapeinos C,Pucci C,Rocchiccioli S,Michelucci E,Finamore F,Mcdonnell L,Scarpellini A,Lauciello S,Prato M,Larra aga A,Drago F,Ciofani G.Mater.Des.,2020,192:108 742.
aga A,Drago F,Ciofani G.Mater.Des.,2020,192:108 742.
[49]Cheng Y M,Han Y X,Zhang W,Zeng L,Long Y Y,Wang S Y,Weng Q H.Chem.Eng.J.,2022,437:135 304.
[50]Zhang Y,Guo R,Wang D,Sun X T,Xu Z R.Colloid.Surface.B,2019,176:300-308.
[51]Cheng C C,Muhabie A A,Huang S Y,Wu C Y,Gebeyehu B T,Lee A W,Lai J Y,Lee D J.Nanoscale,2019,11(21):10 393-10 401.
[52]Weng Q H,Wang B J,Wang X B,Hanagata N,Li X,Liu D Q,Wang X,Jiang X F,Bando Y,Golberg D.ACS Nano,2014,8(6):6 123-6 130.
[53]Wang H Y,Wang C L,Deng Y X,Han Y X,Xiang S,Xiao H N,Weng Q H.Chem.Commun.,2023,59(80):11 995-11 998.
[54]Yang H,Gu S D,Li J X,Jin L,Xie X,Luo L J,Xiao J X,Li J B,Li C J,Chen Y J.Colloid.Surface.B,2021,198:111 479.
[55]Zhang H J,Feng S N,Yan T,Huang D D,Zhi C Y,Nakanishi H,Gao X D.Int.J.Nanomed.,2016,11:4 573-4 582.
[56]Feng S N,Zhang H J,Xu S,Zhi C Y,Nakanishi H,Gao X D.Mater.Sci.Eng.C-Mater.Biol.Appl.,2019,96:552-560.
[57]Carrera M J,Lin K S,Weng M T,Kunene S C,Lin Y S,Liu S Y.Colloid.Surface.B,2023,222:113 129.
[58]Li H,Fan Y,Shen Y Z,Xu H S,Zhang H J,Chen F X,Feng S N.ACS Appl.Mater.Inter.,2024,16(19):25 101-25 112.