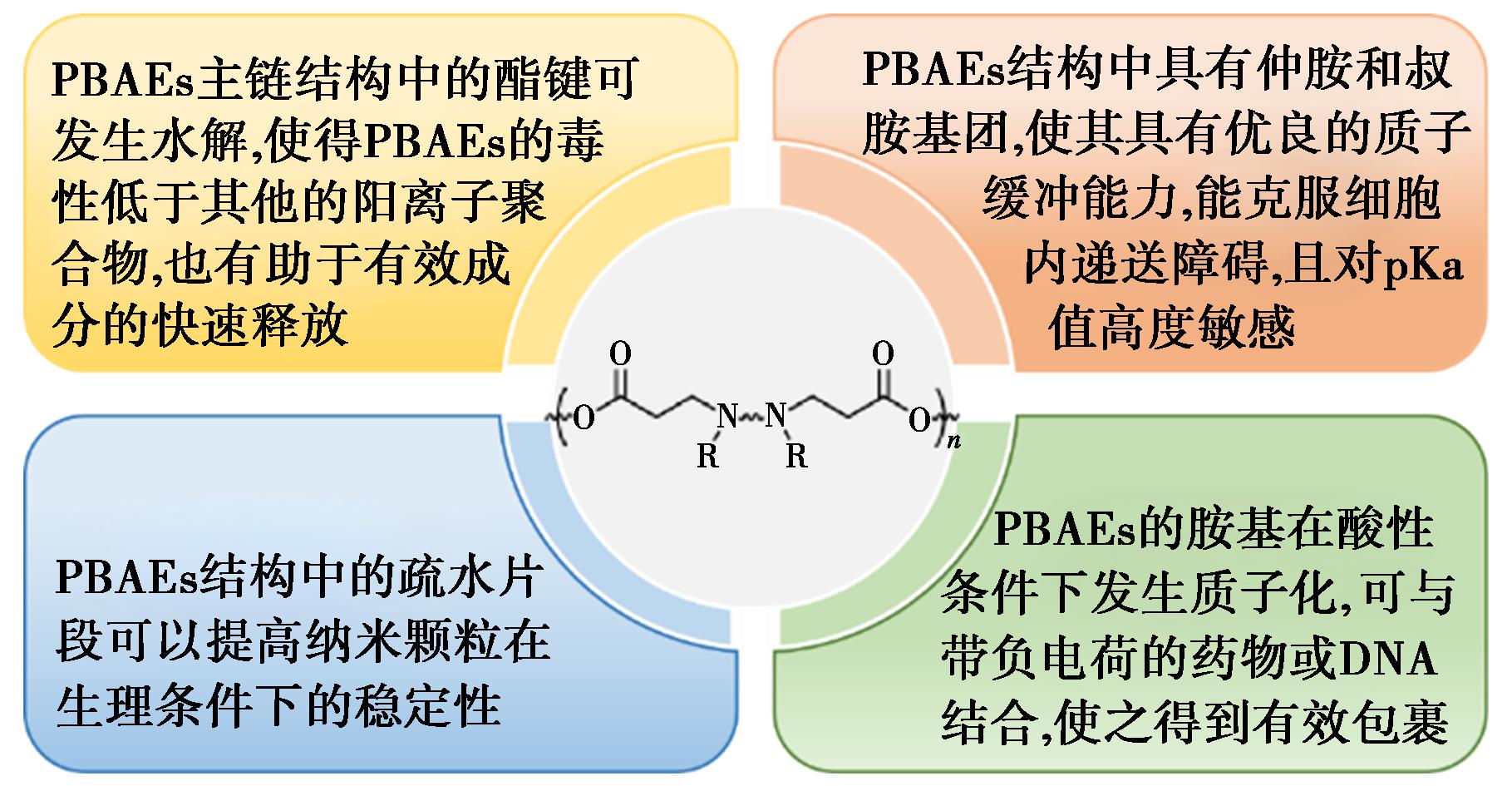
图1 PBAEs的分子结构与基因载体功能关系[10]
Fig.1 Relationship between the molecular structure of PBAEs and the function of the gene vector[10]
生化与药用试剂
迄今为止,治疗疾病的措施和方法主要是手术治疗和其他药物治疗,但是在治疗过程中会出现诸多问题,如生物耐药性、需多次给药、对正常细胞损害大等。由于大多数疾病是因为基因发生突变或缺失造成的,采用基因治疗的方法有望从源头上解决这些问题。基因治疗是一种利用正常的外源基因来替换异常基因或补偿缺失基因的方法,通过将这些基因导入细胞中,以生成治疗性蛋白质或阻断有害DNA的转录、翻译和表达,从而达到治疗疾病的目的[1]。在基因治疗领域,基因载体起着关键作用。当前,主要的基因载体可分为病毒类和非病毒类两大类型。在临床治疗中,转染基因最有效的载体是病毒类载体,但由于其整体安全性较低、制备困难和具有免疫应答反应等缺点,大大限制了它在基因治疗中的应用[2]。与之相比,非病毒类载体展现出高可控性、强稳定性、低免疫原性、高转染效率、低成本和可重复性等优点,使其在基因治疗领域具有广阔的应用前景。非病毒类基因载体包括阳离子脂质体、阳离子聚合物、树枝状高分子及其衍生物、多肽等多种类型,其中研究较多的是阳离子脂质体与阳离子聚合物[3]。
在基因转染研究中,聚赖氨酸(PLL)是最先使用的阳离子聚合物之一,但是它的转染效率相对其他聚阳离子聚合物较低,因此不太可能应用于临床实践。大分子的PLL和DNA形成复合物增加了细胞的毒性和减低了细胞稳定性[4]。聚乙烯亚氨(PEI)是目前研究最有效的基因传递聚合物之一,拥有非常强的质子海绵效应,转染能力比大多数非病毒基因载体好,但是PEI是一种现成的材料,它的缓冲能力对于基因传递来说并非最优,且高分子量的PEI生物可降解能力较差,细胞毒性也较大[5]。聚酰胺胺(PAMAM)是一类树型结构的聚合物,具有低分散度、高密度的终端基团提供连接位点等优点,但是其合成过程相对复杂,且未经修饰的PAMAM缺乏靶向性,随着分子量的增加,其细胞毒性也随之增大[6,7]。
与其他非病毒类载体相比,聚β-氨基酯兼具胺和酯的特性,使其具有良好的生物降解性能、高转染效率和低细胞毒性等优点。1970年,Danusso等[8]首次合成并报道了以二胺和二丙烯酸酯单体为原料,经过迈克尔(Michael)共轭加成反应一步得到的线形聚β-氨基酯(LPBAEs)。随着对聚β-氨基酯性能要求的不断提升,为了更好地满足需求,研究者对线形聚β-氨基酯开展了大量的改性研究工作。据文献研究表明,不同的单体结合产生不同结构的PBAEs,具有不同的基因转染效率[9]。PBAEs的分子结构与基因载体的功能有密切的关联,如图1所示[10]。Zugates等[11]对含羟基、酯基等亲水性胺基和含烷基、芳香基等疏水性胺基封端进行了研究,发现封端基团的亲疏水性不同会导致聚合物有不同的转染效果。尽管聚β-氨基酯改性已取得一定的进展,但目前关于聚β-氨基酯改性的综述文献仍相对较少。基于此,本文从枝化、封端、侧链修饰、末端修饰以及嵌段修饰5个方面对聚β-氨基酯的改性研究进行了综述,为探究聚β-氨基酯转染效率与结构的关系以及设计开发高转染效率、低细胞毒性的聚β-氨基酯基因载体提供参考。

图1 PBAEs的分子结构与基因载体功能关系[10]
Fig.1 Relationship between the molecular structure of PBAEs and the function of the gene vector[10]
1.1 线形聚β-氨基酯
1970年,Danusso等[8]首次公开了向双丙烯酰胺中加入等量的胺或其典型衍生物,如图2所示,合成主链含有叔胺的线性聚酰胺基胺,为聚β-氨基酯的开发奠定了理论基础。2000年,Lynn等[12]以1,4-丁二醇二丙烯酸酯(C2)单体分别与3种胺单体N,N-二甲基乙二胺、4,4-三甲基二哌啶和哌嗪,通过Michael加成反应合成聚β-氨基酯1-3(PBAEs 1-3),如图2所示。PBAEs 1-3主链中含有叔胺和酯基,这种化学结构使其易被水解而降解。通过琼脂凝胶电泳、准弹性动态光散射和ζ电位测量,发现其能将DNA浓缩成较小的颗粒,同时细胞毒性降低。2001年,Lynn等[13]利用7种丙烯酸酯单体和20种胺单体,合成了1个具有140种不同结构的PBAEs库。对其基因转染效率进行筛选,发现粒径<250 nm且缓冲电位>10 mV的复合物转染效率最佳,这一成果为阐明PBAEs的结构/活性关系奠定了基础。
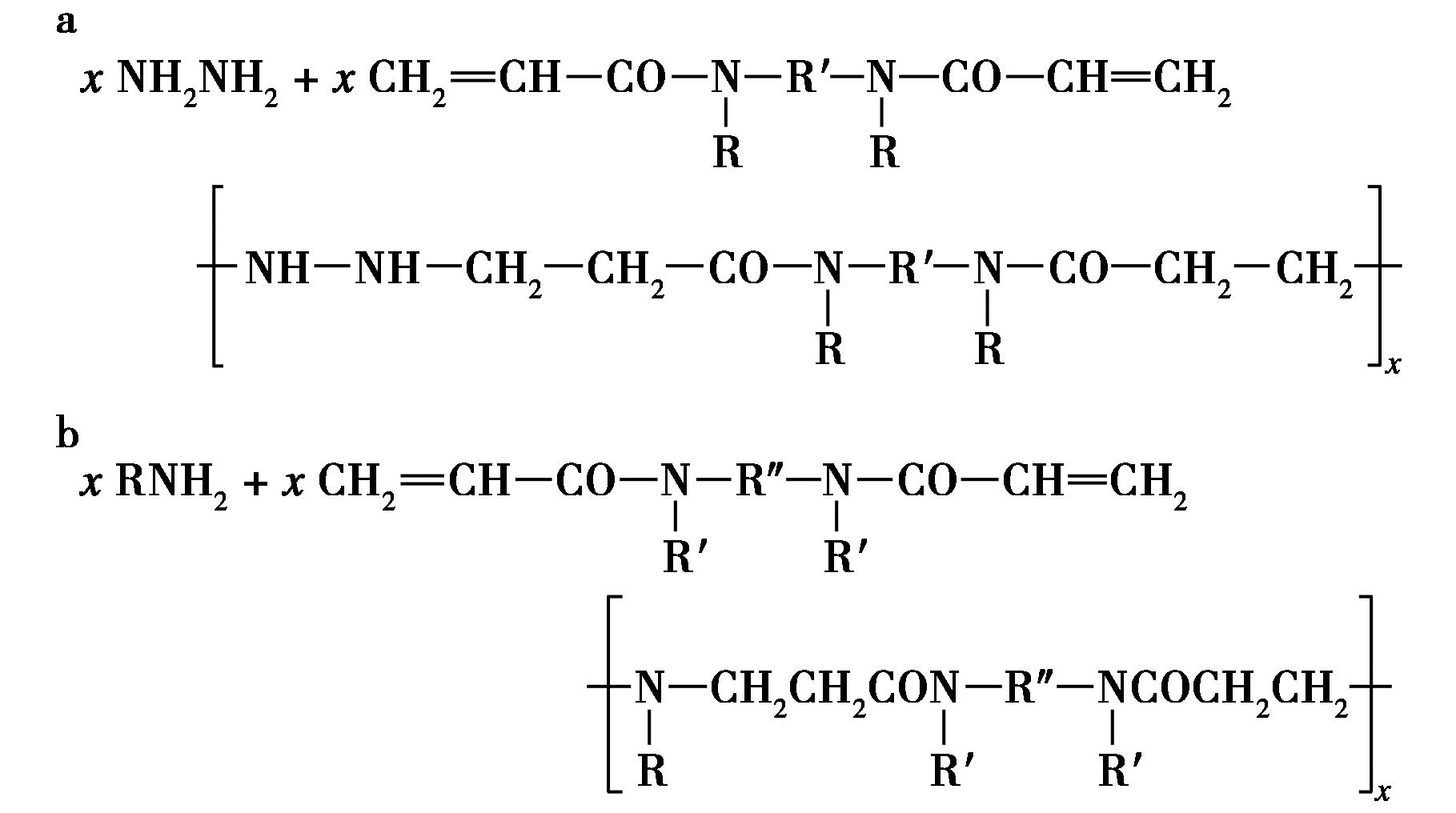
a.肼与等物质的量的双丙烯酰胺反应;b.伯胺与双丙烯酰胺反应
图2 双丙烯酰胺与等量的胺或其典型衍生物
反应方程式[12]
Fig.2 Reaction of bis-acrylamide with an equal amount of amine or its typical derivatives[12]
根据已有的文献综合分析,线形聚β-氨基酯聚合物与其他阳离子聚合物相比,具有制备简单、高转染效率、低细胞毒性、可降解性等优点。然而,线形结构的聚β-氨基酯聚合物只允许有2个端基,这限制了聚β-氨基酯性能的进一步提高。因此,对线形聚β-氨基酯聚合物的深入研究可为未来基于基础聚合物进行修饰的聚β-氨基酯的设计和开发提供了理论支撑。
1.2 枝化修饰
与LPBAEs相似,枝化修饰仍以β-氨基酯为主链重复单元,具有可降解酯键和质子缓冲能力,枝化结构通过拓扑优化增强了LPBAEs的固有特性,提高了转染效率。Che等[14]采用“A2+B4+C2”Michael加成反应策略,如图3所示,使用单体1,4-丁二胺(B4)与4-氨基-1-丁醇(A2)和C2共聚,制备了新型的支化PBAEs(HPBAEs)。在肥大细胞(MCs)中,相比于LPBAEs和商业的转染试剂PEI25k、jet PEI和Lipofectamine 3000,HPBAEs的基因转染效率高出80倍,显著提高了基因转染率,且明显无细胞毒性。Zhou等[15]采用“A2+B3+C2”Michael加成反应策略,使用单体C2和5-氨基-1戊醇(32)、三羟甲基丙烷三甲基丙烯酸酯(TMPTA)制备了分支(HC32)聚合物。通过表征发现HC32的基因转染效率显著优于LC32。Zeng等[16]采用Ⅶ型胶原蛋白(COL7A1)缺失小鼠模型和隐性营养不良性大疱性表皮松解症(RDEB)的鼠移植模型进行体内试验,对高度支化的PBAEs在相关临床疾病中的治疗效力进行了评估,研究发现PBAEs分别在COL 7A 1缺失小鼠模型和异种移植RDEB小鼠模型中成功地恢复了沿着皮肤BMZ的长期重组Ⅶ型胶原(C7)表达,C7成功修复。Yong等[17]采用“A2+B3+C2”Michael加成反应,合成了具有不同主链结构、末端基团和支化度的219种HPBAEs的组合库,用于有效的器官选择性mRNA递送。HPBAEs的分支拓扑结构可增强血清抵抗力并显著提高体内mRNA表达,其末端胺结构决定了全身给药后mRNA递送的器官选择性。Cutlar等[18]采用“A2+B3/B2”策略,以双酚A乙氧基酸酯和4-氨基-1-丁醇为功能单体,TMPTA为支链单体,合成了高支化HPBAEs。作为非病毒基因传递载体,HPBAEs的性能优于研究充分的线性对应物以及领先的商业试剂Superect。Liu等[19]使用4-氨基-1-丁醇和双酚A-乙氧基二丙烯酸酯为基础原料,改变支化单体TMPTA与总体含量的比例,制备了5种具有相似分子量的HPBAEs,通过商业上 3种使用最广泛的试剂作为对照评价其转染效率,结果表明,中等枝化程度的HPBAE-3转化能力较高。Wang等[20]通过两步线性寡聚物组合和支化策略,合成了一系列具有不同分子量和支化结构的高支链线性聚β-氨基酯(H-LPAEs),并评估了其在悬浮细胞中的基因转染效率。研究结果表明,分子量和支化结构显著影响H-LPAEs的DNA结合能力、聚复合物的粒径和表面电位,进而影响其细胞摄取和内质网逃逸能力。特别是分子量为11.5 kDa的H-LPAE,在多种贴壁细胞和悬浮细胞中展现出较高的基因转染效率,同时保持了良好的生物相容性。Li等[21]在HPBAEs经典化学组成的基础上,采用一种新的骨干阳离子化策略,在不改变其聚合物拓扑结构和分支度的情况下,将阳离子部分加入HPBAEs聚合物主链中,合成具有高度分支结构的HPBAEs。当负载治疗性质粒时,HPBAEs成功地恢复了CFTR蛋白在cfbe410-疾病模型中的表达,达到了比正常HBE细胞高出20~23倍的水平,其治疗效果明显超过商业载体Xfect和Lipofectamine 3000。Zhao等[22]通过独特的低聚物分支策略开发了一系列高度支链的聚β-氨基酯(H-LPBAEs)。其线性片段和分支单位分布更加均匀,使得H-LPBAEs/DNA多聚物具有优异的DNA凝聚性和良好的物理化学性质。肿瘤细胞凋亡结果表明,优化后的H-LPBAEs在人肝癌细胞(HepG2)中转染效率高达58%,并且能够在体外诱导肿瘤细胞凋亡,体内抑制肿瘤生长。Zeng等[23]通过一种新的线性低聚物组合策略,将线性聚β-氨基酯低聚物通过分支单元连接,形成一种新型多功能 LPBAEs。在人原代真皮成纤维细胞(HPDFs)和小鼠胚胎成纤维细胞(3t3)中,LPBAEs实现了超高的转基因表达,绿色荧光蛋白的表达几乎达到100%,具有高效的成纤维细胞基因转染功能和生物相容性。Ooi等[24]采用TMPTA与双丙烯酸酯单体合成了超支化PBAEs,它具有良好的siRNA浓缩能力,低细胞毒性和高细胞摄取效率。在聚合物/siRNA重量比为30 nmol/L和30 nmol/L siRNA剂量时,与商业试剂Lipofectamine 2000相比,超支化PBAEs在宫颈癌(HeLa)细胞中具有更低的细胞毒性,且siRNA沉默效率更高。Bo等[25]采用线性低聚物组合接枝策略,合成了多端星形结构PBAEs库,具有较好的转染效果,能够高效地将Nod2 DNA传递到难以转染的小鼠单核巨噬细胞白血病细胞,转染效率高达33.9%。Yong等[26]通过迈克尔加成、开环和亲核取代反应合成了60种具有不同分支结构和化学组成的高支链聚β-氨基酯(O-LhPAEs),经整合脂质纳米颗粒(LNPs)的关键成分,实现了高效的mRNA传递和雾化治疗矽肺病。实验结果表明,O-LhPAEs在多种细胞类型中展现出高达93.1%的mRNA转染效率,并且在系统给药后主要在脾脏富集。此外,通过雾化给药,O-LhPAEs能够有效将Tbx2 mRNA传递至矽肺病小鼠的肺部,显著恢复其肺功能。
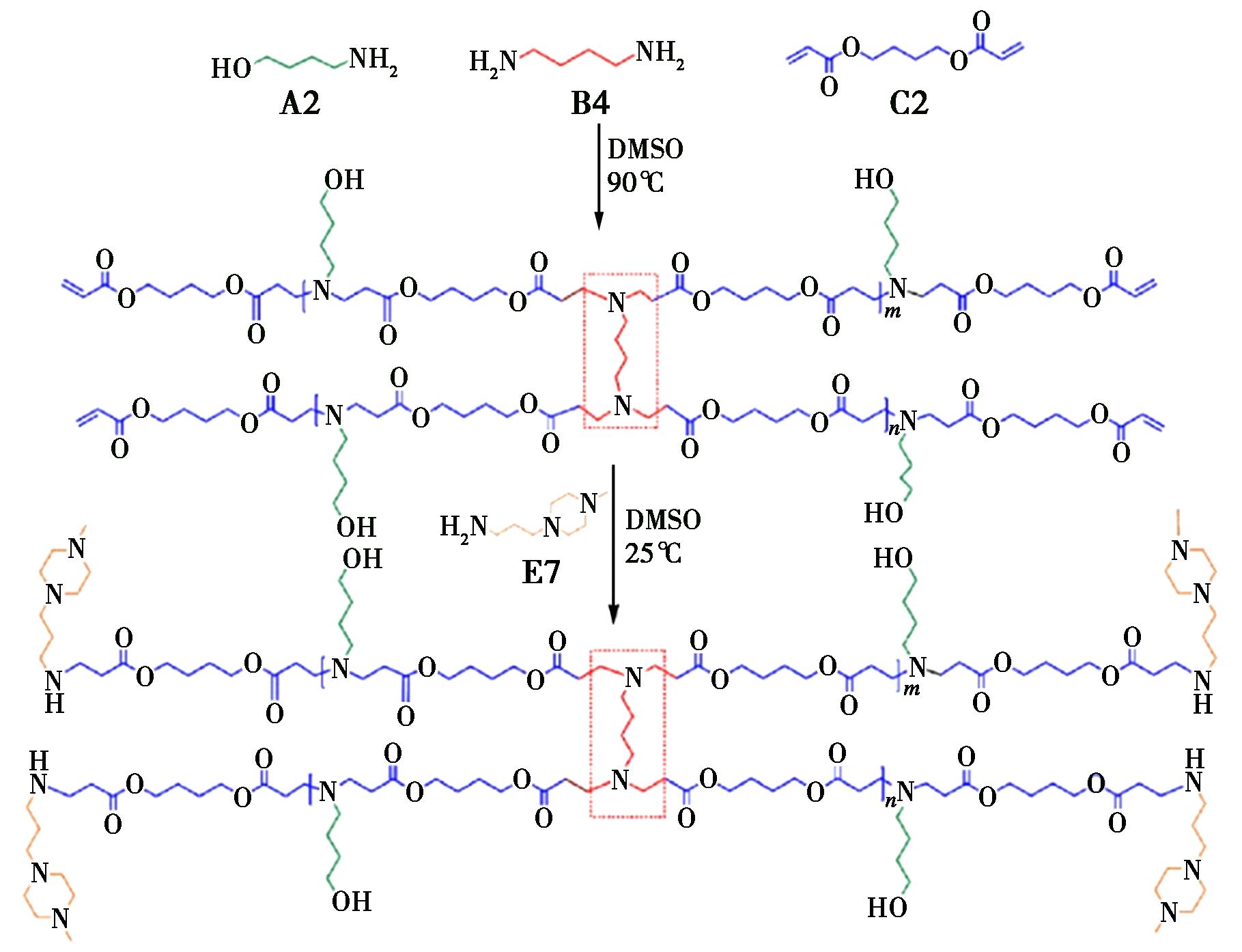
图3 采用“A2+B4+C2”Michael加成策略制备HPBAEs[14]
Fig.3 HPBAEs synthesized via “A2+B4+C2” Michael addition strategy[14]
综上可知,枝化后的聚β-氨基酯表现出三维结构,有更大的化学空间,且含有多个端基,可以同时实现高基因转染效率和低细胞毒性。然而,并不是枝化度越高,其转染效率就会越高,所以如何实现最佳枝化度聚合物的合成对转染效率的影响是一项重大的挑战。
1.3 封端
Akinc等[27]将1-氨基-丁醇分别与1,4-己二醇二丙烯酸酯、1,6-丁二醇二丙烯酸酯发生反应,产生两种聚合物,采用4种胺或丙烯酸酯对PBAEs进行封端处理。结果发现,丙烯酸酯封端的聚合物未能明显提高基因的转染率,而胺封端的PBAEs表现出高基因转染率,表明了胺封端的PBAEs更适用于基因转染。张思培[28]首先通过Michael加成策略合成含二硫键的聚β-氨基酯(ssPBAEs),而后采用单体二乙烯三胺对ssPBAEs进行封端得到胺基化的ssPBAEs(NH-ssPBAEs),如图4所示。在与纳米载体结合递送水溶性抗癌药物阿霉素(DOX)中显示出高效共载、靶向递送与可控释放的能力。刘玉成[29]将2-羟乙基二硫化物与丙烯酸异氰基乙酯进行反应,制备了具有不同结构、不同交联度且结构上含二硫键官能团的双丙烯酸酯,将它们在不同的条件下分别与4种胺经过Michael加成进行封端,生成64个样品。对样品进行基因转染效率和细胞毒性实验,结果显示S7-1、S7-2、S7-3和S7-4的转染效率都相对较高,且显示低细胞毒性。Jin等[30]采用精胺和1,4-丁二醇二丙烯酸酯分别与LPBAEs通过Michael加成法进行封端,合成了氨基保护的聚β-氨基酯[P(BSPBAEs)]。体外增强绿色荧光蛋白(eGFP)敲除实验表明,P(BSPBAEs)多聚体在体外实现了60%的eGFP敲除率,表明了胺基保护可以提高PBAEs的siRNA传递。邹晨明[31]在PBAEs链上引入疏水性单体硬脂胺(SA),合成了无规共聚物PBAEs-S,然后甘露糖对其进行封端修饰,得到聚合物man-PBAEs-S。小鼠黑色素瘤模型实验发现甘露糖的引入使得聚合物有良好的细胞靶向性,通过刺激靶向细胞的熟化,从而增强杀伤性细胞的增殖分化。刘颖诗[32]以基础单体1,4-丁二醇二丙烯酸酯(C4)和侧链单体5-氨基-1-戊醇(S5)与支化单元三羟甲基丙烷三丙烯酸酯(TMPTA)和2-甲基-1,5-戊二胺(MPMD)反应后,用精胺(SPE)或2-甲基戊二胺MPMD作为封端剂,通过Michael加成反应后成功合成了4种聚合物MPMD-SPE、MPMD-MPMD、TMPTA-SPE和TMPTA-MPMD。基因转染效率和细胞毒性实验发现,4种聚合物都具有良好的理化性质和较低的细胞毒性。其中聚合物MPMD-SPE、MPMD-MPMD、TMPTA-SPE都具有一定的转染能力。Yong等[33]研究了一种“自上而下”氨解策略,用于合成具有高效mRNA传递性能的高支链聚β-氨基酯(aHPAEs)。通过精确调控端基胺的种类、浓度和反应时间,实现了对HPAEs的酯基团进行不同程度的酰胺解,从而在聚合物中引入了额外的酰胺和胺基团。实验结果表明,适度酰胺解的aHPAEs(如122-2)在体外展现出比未酰胺解的HPAEs高出2.41倍的 mRNA转染效率,并且形成的聚复合物具有更高的Zeta电位和更小的粒径。此外,优化后的 aHPAEs(如122-2-S3)在体内表现出靶向脾脏的mRNA传递能力,且未观察到明显的体内毒性。
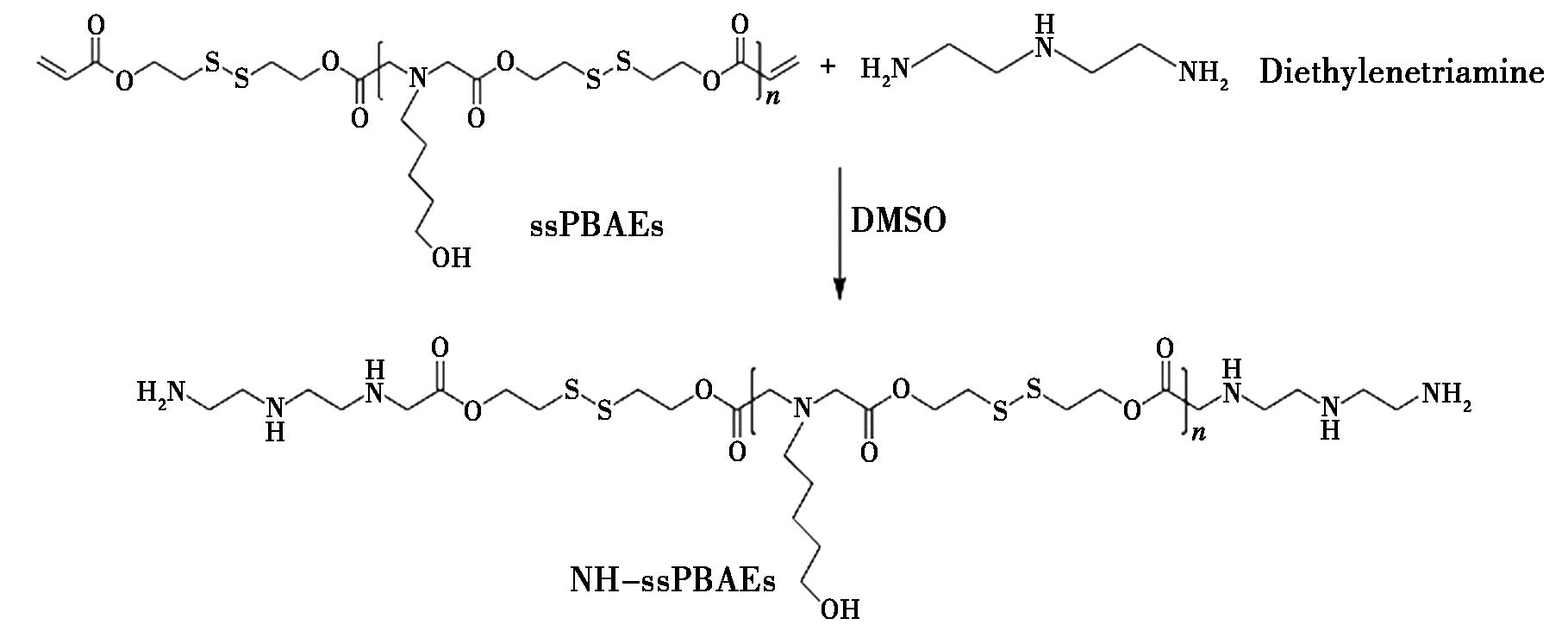
图4 二乙烯三胺对ssPBAEs进行封端得到NH-ssPBAEs反应方程式[28]
Fig.4 Reaction for the end-capping of ssPBAEs with diethylenetriamine to obtain NH-ssPBAEs[28]
通过对封端处理的聚β-氨基酯文献的总结发现,相比于未经封端处理的聚合物,以胺单体封端的聚合物,其结构中含有伯胺或仲胺基团,显示出更优异的细胞摄取率和转染效率。这主要是因为封端基团的引入可以有效增加聚β-氨基酯的正电荷,能够更好的与DNA结合,表现出更高的基因传递效率。因此,探究具有高转染效率且低细胞毒性的封端聚β-氨基酯,将其作用于特定的细胞中是未来该领域的重要研究方向之一。
1.4 侧链修饰
通过调整亲疏水性或引入靶向基团对PBAEs进行侧链修饰,能够增强其生物相容性和靶向性。Anderson等[34]报道了1个PBAEs库,通过基因转染效率和细胞毒性来探究结构与活性的关系,汇总了一些具有优选结构的PBAEs,发现含有羟基结构的氨基醇更有利于其他试剂进行修饰。Cherng等[35]以1,4-丁二醇二丙烯酸酯和3-(二甲氨基)-1-丙胺为原料合成PBAEs,采用物理共混法与聚乙烯亚胺(PEI),制备含有支链PEI25K的聚β-氨基酯(PEDP-PEI25K)。通过表征分析发现随着PEI25K浓度的提高,ζ电位逐渐增加,细胞活性逐渐下降,使其具有较高的细胞摄取率和低细胞毒性。蔡晓青[36]使用二乙烯三胺五乙酸(DTPA)、钆(Gd)与普朗尼克聚β-氨基酯(P123-PBAEs)反应,形成侧链中含有DTPA-Gd的P123-PAE-DTPA-Gd嵌段聚合物。对其进行表征可得,DNA与嵌段共聚物结合形成复合物的方式可以明显增加细胞的转染效率、降低细胞毒性。Eltoukhy等[37]使用8种二丙烯酸酯、10种亲水胺、1种疏水胺(十二胺)和1种封端二胺(3,6,9-三氧杂十亚甲基二胺122),在DMSO溶剂的条件下进行Michael加成反应,产生1个具有80个胺端改性的PBAEs库。通过表征共聚物,发现结合了疏水烷基侧链的PBAEs三聚体表现出较强的基因转染能力。Shi等[38]使用亲水性胺2-吗啉乙胺(90)和疏水性胺十二烷基胺(C12)对聚β-氨基酯侧链分别进行修饰,加入封端剂122,合成了疏水聚合物(DD-C12-122)和亲水聚合物(DD-90-122),以7∶3的投料比合成了130种LPBAEs三元聚合物,结合DNA,见图5。研究发现,疏水链DD-C12-122的修饰,增强基因的包装能力,提高多聚体的稳定性,使多聚体更有效地穿透细胞膜,最终实现高转染效率。Deng等[39]采用 Michael加成反应合成PBAEs聚合物骨架,在其疏水的骨架上用亲水性旋盖剂覆盖,形成两亲性的PBAEs聚合物链,对侧链进行氟化修饰,开发了具有特定结构设计和氟化修饰的PBAEs纳米颗粒。经静脉给药后,氟化修饰后的PBAEs纳米颗粒能够特异性地将非整合性DNA质粒输送到肺微血管内皮细胞。Deng等[40]通过引入含氟胺单体1H-十一氟己胺,对聚β-氨基酯侧链进行氟化修饰,合成了含氟聚β-氨基酯(FPBAEs)。对于难转染、黏附的HepG2肝细胞和悬浮的人急性淋巴母细胞性白血病细胞(Molt-4)中达到了87%和55%的高转染效率。Jin等[41]采用疏水性油胺对基于精胺的聚β-氨基酯P(BSpBAE)侧链进行修饰,合成了疏水P(SpBAE)多聚体,提高了其疏水程度。在细胞敲除实验中,疏水P(SpBAE)多聚体实现了90%以上的GFP敲除,且基因沉默效果随着疏水性的增加而增加。Gonz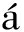 lez-ríos等[42]对寡肽端PBAEs的侧链进行甘露糖功能化修饰,提供了功能化的分支,有助于甘露糖受体的特异性和选择性靶向。临床前水平证明,mRNA携带者在体外和体内优先靶向和转染抗原递呈细胞(APCs),甘露糖功能化能够更有选择性地靶向APCs。
lez-ríos等[42]对寡肽端PBAEs的侧链进行甘露糖功能化修饰,提供了功能化的分支,有助于甘露糖受体的特异性和选择性靶向。临床前水平证明,mRNA携带者在体外和体内优先靶向和转染抗原递呈细胞(APCs),甘露糖功能化能够更有选择性地靶向APCs。
图5 LPBAEs/DNA两亲性的模块化操作[38]
Fig.5 Modular manipulation of the amphiphilicity of the LPBAEs/DNA[38]
诸多研究表明,在聚β-氨基酯中引入疏水性侧链,能够显著提升其转染性能、提高聚合物与DNA复合体在生理条件下的稳定性。通过调控侧链含量或长度,能够有效控制聚β-氨基酯的有效直径,进而使其具有适宜的颗粒大小。这种调控方法简单易行且效果显著,不仅提高了聚合物转染效率,增强制剂稳定性,还有利于开发适应体内转染应用的多功能基因传递载体。
1.5 末端修饰
除了侧链修饰,可对PBAEs进行末端修饰,末端修饰是PBAEs两端连接靶向分子,基本不改变主链固有性质。Zhou等[15]通过胍基化将胍部分结合到聚合物LC32和HC32的末端胺上,与DNA形成复合物,发现胍基化促进了细胞的摄取,进而改善基因的转染性能。Liu等[43]在PBAEs的末端加入甘露糖,它们与APCs的甘露糖受体有特异的相互作用,有利于促进基因载体的摄取。当PBAEs中存在甘露糖且分子量较低时,具有较高的APCs细胞传递效率。Wang等[44]采用苯基胍作为PBAEs的末端封顶,增强了PBAEs与蛋白质之间的相互作用,在不破坏生物活性的情况下可以高效地传递蛋白质,富含胍基的PBAEs对具有不同等电点和大小的功能性细胞质蛋白具有强大的细胞内递送能力和生物相容性。Puigmal等[45]使用寡肽链通过Michael加成反应对PBAEs进行封端,生成寡肽链修饰PBAEs。随后在其末端加入甘露糖,用于靶向转染APCs细胞。发现靶向配体的添加可以产生累加效应,并增加转染水平。Nú ez-toldr
ez-toldr 等[46]采用单体C2与32共轭加成得到C32中间聚合物。随后,在DMSO溶剂中使用寡肽对C32进行末端修饰,得到寡肽链修饰的PBAEs,基因转染实验发现,其在基因转染到牙髓细胞的过程中能够促进siRNA的成骨分化,且具有最小细胞毒性。Wang等[47]开发了一种富含胍酰基修饰的高支链聚β-氨基酯(HPAE-PG),用于高效传递CRISPR/Cas9核糖核蛋白(RNP)以实现大段DNA片段的删除。研究中通过调整分支单元和分支比例,优化了HPAE-PG的结构,使其在细胞摄取、蛋白传递效率以及基因编辑效率方面表现出色。实验结果表明,HPAE-PG能够成功诱导人类COL7A1基因中与营养不良性大疱性表皮松懈症(DEB)相关的第80号外显子的删除。在HEK细胞和DEB患者来源的角质形成细胞中,HPAE-PG介导的双sgRNA引导的CRISPR/Cas9 RNP传递实现了高达32%的外显子80删除效率。
等[46]采用单体C2与32共轭加成得到C32中间聚合物。随后,在DMSO溶剂中使用寡肽对C32进行末端修饰,得到寡肽链修饰的PBAEs,基因转染实验发现,其在基因转染到牙髓细胞的过程中能够促进siRNA的成骨分化,且具有最小细胞毒性。Wang等[47]开发了一种富含胍酰基修饰的高支链聚β-氨基酯(HPAE-PG),用于高效传递CRISPR/Cas9核糖核蛋白(RNP)以实现大段DNA片段的删除。研究中通过调整分支单元和分支比例,优化了HPAE-PG的结构,使其在细胞摄取、蛋白传递效率以及基因编辑效率方面表现出色。实验结果表明,HPAE-PG能够成功诱导人类COL7A1基因中与营养不良性大疱性表皮松懈症(DEB)相关的第80号外显子的删除。在HEK细胞和DEB患者来源的角质形成细胞中,HPAE-PG介导的双sgRNA引导的CRISPR/Cas9 RNP传递实现了高达32%的外显子80删除效率。
通过对文献的总结可知,当前对聚β-氨基酯进行末端修饰这一方面的研究报道相对较少。从已知的研究成果来看,适度的胍基化及寡肽链修饰改性能够有效地提升细胞的转染效率,同时降低细胞毒性。因此,末端修饰的研究对于进一步扩展聚β-氨基酯在基因载体领域的应用有一定的推动作用。
1.6 嵌段修饰
除前述修饰方法之外,还可以采用嵌段修饰对PBAEs进行改性,能显著提升PBAEs的靶向递送能力、载体稳定性及生物相容性。在连接聚β-氨基酯与聚乙二醇(PEG)方面,目前主要有两种方法。其一,是在PEG的一端引入羧基,与PBAEs中的羟基发生酯化反应相连接;其二,是先用丙酰氯将PEG进行丙烯酰化处理,进而与PBAEs中的胺基发生Michael加成反应相连接。在实际应用中,第二种方法更常用。Gao等[48]首先将PEG丙烯酰化,然后分别与4,4-三亚甲基二哌啶、1,6-己二醇二丙烯酸酯反应,最后将咪唑作为短链引入到嵌段共聚物中,如图6所示。以人体血清白蛋白(HAS)为模型,制备封装HAS的胶束聚合物。Li等[49]采用Michael型分步聚合法合成了pH敏感的PEG-PBAE嵌段共聚物,并将Thz负载到具有pH敏感特性的PEG-PBAEs自组装胶束中,得到载药胶束Thz/PPM。在MCF-7(人乳腺癌细胞)荷瘤裸鼠体内的抗肿瘤试验中,发现Thz/PPM具有显著的抗肿瘤效果,表现出P<0.05的肿瘤量,具有良好的肿瘤靶向性,是一种理想的靶向治疗乳腺癌的药物载体。王亮亮[50]以类似的方式,通过使用不同的单体或改变单体的配比等方式,合成MPEG-PBAE聚合物,显示出低细胞毒性和较高的转染效率。杜林娇[51]先用PEG和丙交酯生成PEG-PLLA二嵌段共聚物,再对该二嵌段共聚物用丙酰氯进行丙烯酰化,最后与PBAEs经过Michael加成反应形成三嵌段共聚物。酸碱缓冲能力测试发现其具有明显的酸碱度敏感性,在弱酸环境下,可以增强细胞的靶向性。张冉[52]以4,4-三亚甲基二哌啶和1,4-丁二醇二丙烯酸酯为原料,通过Michael共轭加成反应与PEG-A合成嵌段共聚物PEG-PAEs,包载DOX制成胶束。载药性能实验结果表明该嵌段共聚物的包封率和载药率较高,且其药物释放率随pH的下降而增加。Lu等[53]以哌嗪、4,4-三甲基萘二哌啶胺、聚乙二醇二丙烯酸酯为原料,通过Michael共轭加成反应合成PBAEs,将甲醚-聚乙二醇(MPEG)与PBAEs反应生成了带有亲水基和疏水基的MPEG-PBAE两亲性嵌段共聚物,自组装形成胶束纳米颗粒,将DOX低温装入自组装纳米颗粒中。在弱酸的环境条件下,纳米颗粒能快速释放细胞内的药物。Bohananimia等[54]采用透明质酸-聚β-氨基酯(HA-PBAEs)双嵌段共聚物制备了含有DOX的靶向pH敏感聚合体。在纳米沉淀过程中将亲水性DOX装载到HA-PBAEs聚合体结构的水室中,所制备的DOX-HA-PBAEs平台具有更高的治疗效果、有利的肿瘤积累和较低的细胞毒性。Farahpour等[55]将1,4-丁二醇二丙烯酸酯-乙醇胺单体和1,4-丁二醇二丙烯酸酯-乙二胺为原料合成PBAEs,与PEI进行改性,并与普鲁兰偶联,合成PBAEs-PEI-pullanan聚合物。凝胶阻滞结果表明,在PBAEs中加入普鲁兰能够有效地降低聚合物的毒性,并且还能增强细胞反应,提高基因转染效率。Kim等[56]将1,4-丁二醇二丙烯酸酯(B4)与辛胺(S8m)通过Michael加成反应得到端接丙烯酸酯的PBAEs基疏水聚合物(B4S8m)。与PEG进行Michael加成反应得到PEG-PBAEs-PEG三嵌段两亲共聚物。小鼠巨噬细胞实验结果发现,与球形胶束相比,丝状胶束的细胞摄取百分比下降了89%,且对小细胞肺癌细胞有明显的治疗效果,能有效地杀死肺癌细胞。Kasza等[57]采用可逆加成碎片链转移聚合合成四氮端官能团P(MAG-co-HEMA),采用Michael反应合成降冰片烯端官能团PBAEs。通过混合四氮和降冰片烯进行反电子需求反应,得到两亲性嵌段共聚物[P(MAG-co-HEMA)-b-PBAEs]。P(MAG-co-HEMA)-b-PBAEs在生理pH 7.4时可形成稳定的胶束,并在pH 5.5左右的肿瘤微环境中表现出对pH敏感的疏水/亲水性转变[58]。在弱酸环境下,P(MAG-co-HEMA)-b-PBAEs胶束逐渐破裂,释放包被药物。因此,这种具有PBAEs段的pH敏感嵌段共聚物是抗癌药物载体的良好候选者。
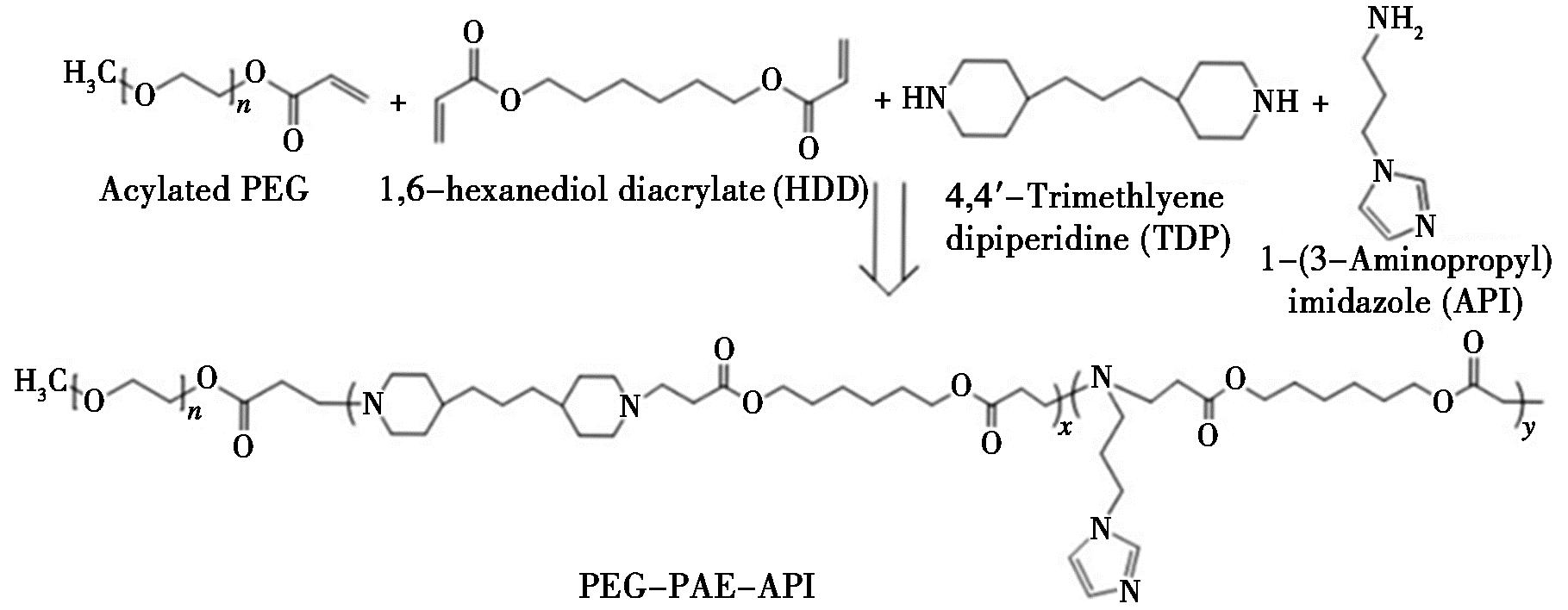
图6 PEG-PAE-API嵌段共聚物的合成[48]
Fig.6 Synthesis of PEG-PAE-API block copolymer[48]
从上述几种嵌段共聚物的合成可以看出,两亲性嵌段共聚物通常由亲水基材料和疏水基材料组成。通过控制它们的物质的量比,能够有效调控嵌段共聚物的分子量;同时,调节亲水端和疏水端的长度,还可以控制二嵌段、三嵌段甚至多嵌段共聚物的合成。此外,酸碱度对嵌段共聚物很敏感,能够显著增加细胞的转染效率。然而,目前嵌段共聚物大多是作为药物载体使用,在其他方面仍存在诸多不足,例如需要探究该嵌段共聚物除了在一种细胞中应用外,是否还可以应用到其他细胞中。
1.7 人工智能(AI)方法在PBAEs载体设计的应用
随着科技的迅速发展,AI逐渐被引入在基因载体设计中,Li等[59]采用人工智能(AI)分析来破译聚合物组分分布(PCD)与基因转染性能之间的关系。在此分析的指导下,开发了一系列优于当前的商业试剂,如jet PEI和Lipo 3000的高效聚合物载体。在基因载体中,PBAEs作为非病毒基因递送载体,其设计过程深度整合计算模拟与AI方法,以解决结构-功能关系复杂、合成优化困难等问题。尽管当前文献未直接报道针对PBAEs的分子动力学(MD)模拟案例,但相关载体设计中的计算模拟逻辑可被借鉴。Ma等[60]采用迭代指数增长策略(IEG)合成建立含10种精确结构的化合物库的研究为AI驱动的“结构-活性”定量模型提供了数据基础。通过模拟PBAEs酯键水解路径,结合量子力学计算,可预测聚β-氨基酯降解产物的细胞毒性[61]。脑靶向PBAEs载体通过双位点选择性功能化(DSSF)引入线粒体靶向基团,计算模拟可预筛选与线粒体膜电位匹配的基团,指导实验合成[62]。
对PBAEs进行功能化改性修饰,枝化、封端、侧链修饰、末端修饰以及嵌段修饰这5种改性方法的优缺点,如表1所示。
表1 不同改性方法的优缺点
Tab.1 Advantages and disadvantages of different modification methods

改性方法优点缺点枝化 具有可降解酯键和质子缓冲能力,增强转染效率和细胞摄取率,降低细胞毒性高枝化度易出现支链长度不均一,枝化结构过度复杂导致纳米颗粒稳定性下降封端 有效增加PBAEs的正电荷,能够更好的与DNA结合,表现出更高的基因转染效率封端率需严格控制,残留的封端剂单体可能引起细胞毒性侧链修饰调整亲疏水性或引入靶向基团可以增强生物相容性,且通过调控侧链长度或含量能够控制PBAEs的有效直径,使其具有适宜的颗粒大小存在适宜的疏水性,过强的疏水性可能会导致转染效率降低末端修饰在不改变主链结构与性质的基础上,促进了细胞的摄取,有效地提升细胞转染效率,同时降低细胞毒性末端基团的空间位阻效应可能导致修饰不完全嵌段修饰能显著提升PBAEs的靶向递送能力、载体稳定性及生物相容性引入大体积嵌段(如聚乙二醇PEG)可能物理阻碍胺基质子化,削弱内涵体逃逸效率
PBAEs作为一种合成的阳离子聚合物,其单体具有易于合成、结构多样和可生物降解等优势,因而在基因传递领域中得到了广泛应用。但PBAEs原料的多样性造成其结构复杂,使得PBAEs缺乏统一的规范,这给PBAEs的临床应用带来了一定挑战。研究人员采用了众多方法对PBAEs进行改性,相较于线性PBAEs,经枝化、封端、侧链修饰、末端修饰以及嵌段修饰的PBAEs,不仅可以实现高效的转染效率,还能显著地降低细胞毒性,并且与生物体具有良好的相容性,满足了不同的应用需求。因此,深入理解PBAEs结构-功能之间的关系,有助于加强PBAEs材料性能的优化,加速PBAEs材料改性的发展,为开发具有更高转染效率、更低细胞毒性的PBAEs提供了清晰的思路。
PBAEs在临床转化面临的主要挑战为:1)开发合适的剂型,如外用剂型(基因水凝胶)治疗皮肤创面将会是具有前景的应用手段,在创面处外用涂抹是一种无创、便捷的给药方式,避免了皮内注射和移植疗法等侵袭性操作;对于呼吸系统疾病如囊性肺纤维化,可以选择雾化给药的方式;2)目前PBAEs主要应用于遗传性疾病,大都属于罕见疾病,不像常见疾病更易获得众多的医疗和社会资源投入。
近年来,PBAEs在基因编辑领域(尤其是CRISPR系统递送)展现出显著潜力。PBAEs可通过静电作用高效结合带负电的CRISPR组分(如质粒DNA、mRNA或核糖核蛋白RNP),形成稳定的纳米复合物。PBAEs的合成属于一锅法,其合成与改性的方法较为简单,实验室合成的质量能满足临床前试验的需求,但目前尚无工业化生产的文献报道,大规模工业化生产和长期储存面临多重挑战,如反应温度、配比的控制精度要求高,生产工艺条件的波动将造成反应热力学和传质效率的差异,进而导致分子量分布变宽,影响载体性能一致性,这是未来大规模生产需要解决的主要问题。
[1]Miller A D.Nature,1992,357(6 378):455-460.
[2]Yin H,Kanasty R L,Eltoukhy A A,Vegas A J,Dorkin J R,Anderson D G.Nat.Rev.Genet,2014,15(8):541-555.
[3]Li J Y,Wang X.Shandong Med.J.,2019,59(12):111-114.
李剑怡,王晞.山东医药,2019,59(12):111-114.
[4]Liu G,Molas M,Grossmann G A,Pasumarthy M,Perales J C,Cooper M J,Hanson R W.J.Biol.Chem,2001,276:34 379-34 387.
[5]Song J,Wang D L,Wang J,Shen Q,Xie C,Lu W Y,Wang R F.Eur.Polym.J.,2020,140:110 017.
[6]Wang Y,Miao X Y,Gu Z,Nie J S.Chem.Life,2019,39(4):727-735.
王杨,苗向阳,顾准,聂锦山.生命的化学,2019,39(4):727-735.
[7]Lee Y,Lee J,Kim M,Kim G Y,Choi J S,Lee M.J.Control.Release,2020,330:907-919.
[8]Danusso F,Ferruti P.Polymer,1970,11(2):88-113.
[9]Li W N,Xu Q,Wang Y H,Chen D W.Acta Pharm.Sin.,2015,50(4):434-439.
李伟男,徐琪,王艳宏,陈大为.药学学报,2015,50(4):434-439.
[10]Karlsson J,Rhodes K R,Green J J,Tzeng S Y.Expert.Opin.Drug Deliv.,2020,17(10):1 395-1 410.
[11]Zugates G T,Tedford N C,Zumbuehl A,Jhunjhunwala S,Kang C S,Griffith L G,Lauffenburger D A,Langer R,Anderson D G.Bioconjug.Chem.,2007,18(6):1 887-1 896.
[12]Lynn D M,Langer R.J.Am.Chem.Soc.,2000,122(44):10 761-10 768.
[13]Lynn D M,Anderson D G,Putnam D,Langer R.J.Am.Chem.Soc.,2001,123(33):8 155-8 156.
[14]Che D L,Wang C F,Li Z,Wang K X,Sun S W,Zhang X Y,Li Y,Chen Z J,Guo L,Hou Y J,Zhou D Z,Geng S M.Chin.Chem.Lett,2023,34(7):108 066.
[15]Zhou D Z,GAO Y S,O′keeffe-ahern J,Xu Q,Huang X B,Greiser U,Wang W X.ACS Appl.Mater.Interfaces,2016,8:34 218-34 226.
[16]Zeng M,Xu Q,Zhou D Z,Sigen A,Alshehri F,Lara-s ez I,Zheng Y,Li M,Wang W X.Adv.Drug Deliver.Rev.,2021,176:113 842.
ez I,Zheng Y,Li M,Wang W X.Adv.Drug Deliver.Rev.,2021,176:113 842.
[17]Yong H Y,Lin L X,Li Z L,Guo R,Wang C F,Liu S,Zhou D Z.Nano Lett.,2024,24(30):9 368-9 376.
[18]Cutlar L,Zhou D Z,Gao Y S,Zhao T Y,Greiser U,Wang W,Wang W X.Biomacromolecules,2015,16(9):2 609-2 617.
[19]Liu S,Gao Y S,Zhou D Z,Zeng M,Alshehri F,Newland B,Lyu J,O′keeffe-ahern J,Greiser U,Guo T Y,Zhang F Z,Wang W X.Nat.Commun.,2019,10(1):1 094-1 096.
[20]Wang C F,Bo T,Wu C,Wang F F,Wang N D,Guo R,Zhao Y T,Pan C L,Zhang Y H,Yao D J,Zhou X,Zhang S,Zeng M,Li M,Zhou D Z.J.Control.Release,2025,382:113 668.
[21]Li Y G,Qiu B,Li Z S,Wang X Q,He Z L,Sandoval D M,Song R J,A S,Zhao C Y,Hohnson M,Lyu J,Lara-s ez I,Wang W X.J.Control.Release,2024,367:327-338.
ez I,Wang W X.J.Control.Release,2024,367:327-338.
[22]Zhao Y T,Bo T,Wang C F,Yao D J,Pan C L,Xu W Y,Zhao H,Li M,Zhang S.J.Nanobiotechnol.,2023,21(1):394.
[23]Zeng M,Zhou D Z,Alshehri F,Lara-s ez I,Lyu Y N,Creach-flynn J,Xu Q,Zhang J,Wang W X.Nano Lett.,2018,19(1):381-391.
ez I,Lyu Y N,Creach-flynn J,Xu Q,Zhang J,Wang W X.Nano Lett.,2018,19(1):381-391.
[24]Ooi Y J,Huang C Q,Lau H K,Chew S Y,Park J G,Chan-park M B.ACS Appl.Mater.Interfaces,2024,16(11):14 093-14 112.
[25]Bo T,Wang C F,Yao D J,Zhao Y T,Wang F F,He W,Xu W Y,Zhao H,Li M,Zhang S,Xue R Y.J.Control.Release,2024,368:157-169.
[26]Yong H Y,Tian Y Z,Li Z L,Wang C F,Zhou D Z,Liu J Z,Huang X B,Li J Z.Adv.Mater.,2025,37(20):2 414 991.
[27]Akinc A,Anderson D G,Lynn D M,Langer R.Bioconjug.Chem.,2003,14(5):979-988.
[28]Zhang S P.Construction of Smart Nanocarriers Based on Poly(β-amino ester) and Their Application in Tumor Combination Therapy.Tianjin:Tianjin Medical University,2020.
张思培.基于聚(β-氨基酯)的智能纳米载体的构建及其用于肿瘤联合治疗的研究.天津:天津医科大学,2020.
[29]Liu Y C.Design,Synthesis and Gene Transfection Performance of Polymers Containing S-S.Nanjing:Nanjing University of Science and Technology,2016.
刘玉成.含S-S聚合物的设计、合成及基因转染性能研究.南京:南京理工大学,2016.
[30]Jin Y,Adams F,Isert L,Baldassi D,Merkel O M.Mol.Pharm.,2023,20(9):4 505-4 516.
[31]Zou C M.Preparation and Evaluation of Poly(β-amino ester) Nano-vaccines Loaded with Tumor Antigen Polypeptides.Wuhan:Huazhong University of Science and Technology,2019.
邹晨明.装载肿瘤抗原多肽的聚(β-氨基酯)纳米疫苗的制备及评价.武汉:华中科技大学,2019.
[32]Liu Y S.Construction of Poly(β-amino ester) Gene Delivery System and Evaluation of Its Biological Properties.Guangzhou:Guangdong Pharmaceutical University,2022.
刘颖诗.聚(β-氨基酯)基因递送系统的构建及其生物性能评价.广州:广东药科大学,2022.
[33]Yong H Y,Li Z L,Lin L X,Liu S,Feng C,Geng S M,Fu T,Chen Z J,Zhou D J.Chem.Mater.,2025,37(8):2 827-2 835.
[34]Anderson D G,Akinc A,Hossain N,Langer R.Mol.Ther.,2005,11(3):426-434.
[35]Cherng J Y,Lee Y P,Lin C H,Chang K H,Chang W Y,Shau M D.J.Mater.Sci.,2010,21:1 543-1 551.
[36]Cai X Q.Studies On Multifunctional Nano-systems Based on Pluronic P123-Poly(β-amino ester).Jinan:Shandong University,2016.
蔡晓青.基于普朗尼克P123-聚(β-氨基酯)多功能纳米系统的研究.济南:山东大学,2016.
[37]Eltoukhy A A,Chen D,Alabi C A,Langer R,Anderson D A.Adv.Mater.,2013,25(10):1 487-1 493.
[38]Shi J,Zhang Y,Ma B,Yong H Y,Che D L,Pan C L,He W,Zhou D Z,Li M.ACS Appl.Mater.Interfaces,2023,15(36):42 130-42 138.
[39]Deng Z C,Gao W,Kohram F,Li E H,Kalin T V,Shi D L,Kalinichenko V V.Bioact.Mater.,2024,31:1-17.
[40]Deng Y H,Zhang J,Sun X M,Li L T,Zhou M D,Liu S,Chen F Y,Pan C L,Yu Z Y,Li M,Zhong W B,Zeng M.J.Control.Release,2023,363:597-605.
[41]Jin Y,Wang X X,Kromer A P,Müller J T,Zimmermann C,Xu Z H,Hartschuh A,Adams F,Merkel O M.Biomacromolecule,2024,25(7):4 177-4 191.
[42]Gonz lez-ríos N,Artigues M,Gurra-rebollo M,Planas A,Borrós S,Faijes M,Fornaguera C.J.Mate.Chem.B,2023,11(27):6 412-6 427.
lez-ríos N,Artigues M,Gurra-rebollo M,Planas A,Borrós S,Faijes M,Fornaguera C.J.Mate.Chem.B,2023,11(27):6 412-6 427.
[43]Liu Y,Li Y F,Keskin D,Shi L Q.Adv.Healthc.Mater.,2019,8(2):1 801 359.
[44]Wang X Q,Li Y H,Sigen A,Lyu J,Wang X,He Z L,Lara-s ez I,Li M,Wang W X.J.Control.Release,2024,368:444-452.
ez I,Li M,Wang W X.J.Control.Release,2024,368:444-452.
[45]Puigmal N,Ramos V,Artzi N,Borrós S.Pharmaceutics,2023,15(4):1 262.
[46]Nú ez-toldr
ez-toldr R,Dosta P,Montori S,Ramos V,Atari M,Borrós S.Acta Biomater.,2017,53:152-164.
R,Dosta P,Montori S,Ramos V,Atari M,Borrós S.Acta Biomater.,2017,53:152-164.
[47]Wang X Q,Li Y H,Friess D N,Yao L,Wang X,He Z L,He W,Li M,Wang W X.J.Control.Release,2025,379:549-557.
[48]Gao G H,Park M J,Li Y,Im G H,Kim H N,Lee J W,Jeon P,Bang O Y,Lee J H,Lee D S.Biomaterials,2012,33(35):9 157-9 164.
[49]Li W N,Sun J L,Zhang X Y,Jia L,Qiao M X,Zhao X L,Hu H Y,Chen D W,Wang Y H.Pharmaceutics,2020,12(2):111.
[50]Wang L L.Synthesis and Properties of Amphiphilic Block Copolymer of Polyethylene Glycol(Poly β-Amino Ester).Tianjin:Tianjin University,2013.
王亮亮.聚乙二醇(聚β-氨基酯)双亲性嵌段共聚物的合成及性能研究.天津:天津大学,2013.
[51]Du L J.Study on The Properties of pH-Sensitive Polyethylene Glycol-Polylactic Acid-Poly(β-Amino Ester) Polymer Micelles Loaded with Paclitaxel.Beijing:Chinese Academy of Traditional Chinese Medicine,2015.
杜林娇.pH敏感聚乙二醇-聚乳酸-聚(β-氨基酯)聚合物胶束载紫杉醇性能硏究.北京:中国中医科学院,2015.
[52]Zhang R.PEG-PAEs Polymer Micelle Co-Loading Adriamycin and Aptamer for Targeted Cancer Therapy.Fuzhou:Huaqiao University,2016.
张冉.PEG-PAEs聚合物胶束共载阿霉素与适配体用于癌症的靶向治疗.福州:华侨大学,2016.
[53]Lu X J,Yang X Y,Meng Y,Li S Z.Chin.J.Polym.Sci.,2017,35(4):534-546.
[54]Bohananimia M,Zahiri M,Abnous K,Taghdisi S M,Ramezani M,Alibolandi M.Int.J.Biol.Macromol.,2023,248:125 882.
[55]Farahpour A,Ramezanian N,Gholami L,Askarian S,Banisadr A,Oskuee R K.Pharm.Dev.Technol.,2022,27(5):606-614.
[56]Kim J,Shamul J G,Shah S R,Shin B J,Quinones-hinojosa A,Green J J.Biomacromolecules,2018,19(8):3 361-3 370.
[57]Kasza K,Elsherbeny A,Moloney C,Hardie K R,C mara M,Alexander C,Gurnani P.Macromol.Chem.Phys.,2023,224(24):2 300 262.
mara M,Alexander C,Gurnani P.Macromol.Chem.Phys.,2023,224(24):2 300 262.
[58]Kahveci E L S,Kahveci M U,Celebi A,Avsar T,Derman S.Biomacromolecules,2022,23(11):4 896-4 908.
[59]Li Y H,He Z L,Sigen A,Wang X Q,Li Z H,Johnson M,Foley R,Lara-s ez I,Wang W X.ACS Appl.Mater.Interfaces,2023,15:36 667-36 675.
ez I,Wang W X.ACS Appl.Mater.Interfaces,2023,15:36 667-36 675.
[60]Ma R,Chang Y,Chen Q M X,Li J F,Qiao B.Chem.Rxiv.,2025,64(19):e202 422 134.
[61]Yong H Y,Li Z L,Guo R,Zhou D Z.Chem.J.Chin.Univ.,2024,45(2):133-138.
雍海洋,李智立,郭蕊,周德重.高等学校化学学报,2024,45(2):133-138.
[62]Zhang L Z,Yao K,Wang Y Q,Zhou Y L,Fu Z X,Li G C,Ling J,Yang Y M.Nano Lett.,2021,21(7):3 007-3 015.