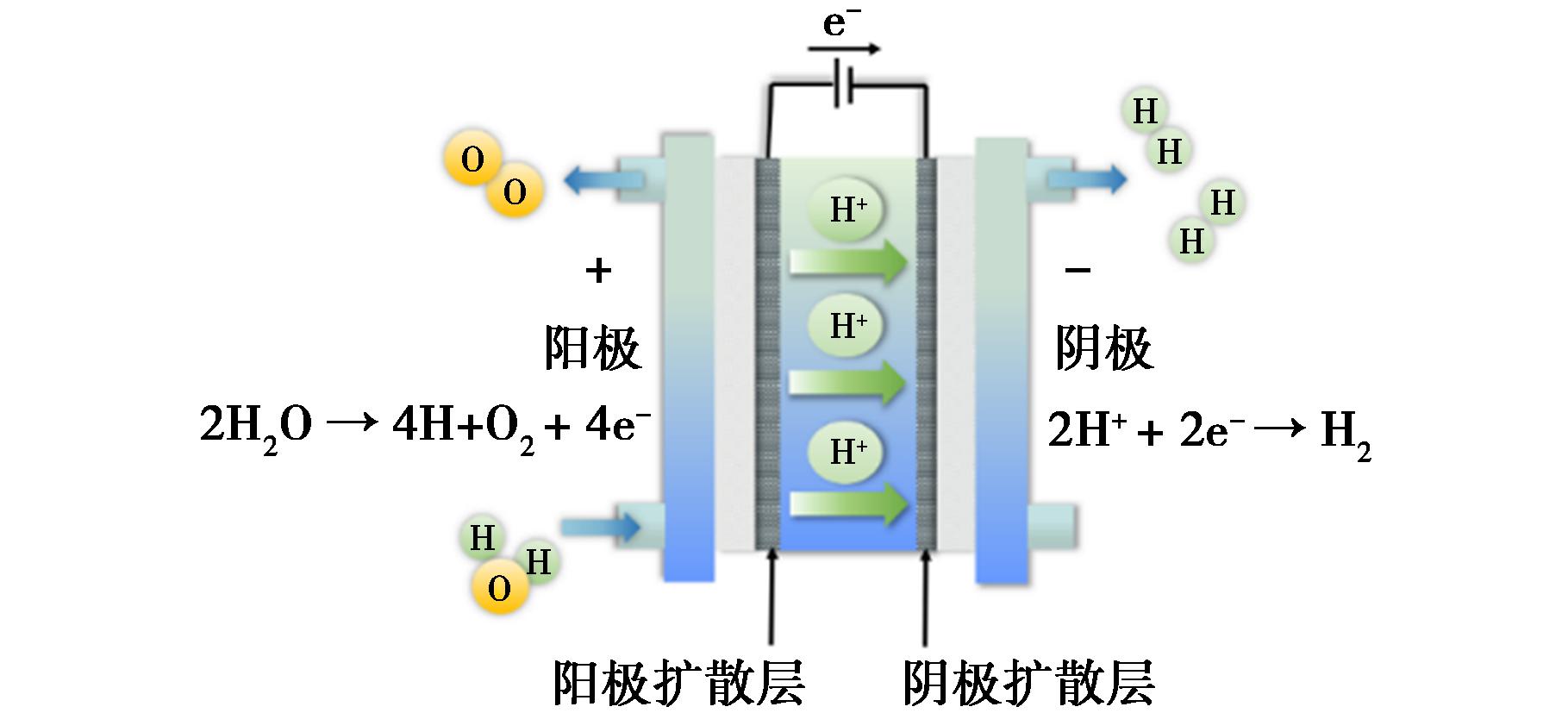
图1 PEM电解槽
Fig.1 Proton exchange membrane electrolyzer
21世纪的可持续发展道路正面临着两大挑战:气候问题与环境保护,新一轮能源革命加速推进。中国作为能源消耗大国,提出了“双碳目标”。《中国能源发展报告2023》显示,我国新型能源体系建设步伐加快,能源低碳转型稳步推进,非化石能源实现新突破[1]。在众多可再生能源中,氢能由于发热值高且碳含量为零,被认为是理想能源载体[2],但其制取能耗高,效率低下,因此寻求大规模低成本制氢技术成为关键问题。常见的工业产氢来源有:化石燃料制灰氢、副产气制蓝氢以及可再生能源制绿氢等[3]。其中蓝氢与灰氢均无法缓解当前的问题,所以大力发展清洁高效绿氢制取技术是大势所趋。可再生能源驱动的电解水技术由于条件温和,清洁高效,且产氢纯度高而备受关注。随着可再生清洁能源如太阳能、风力发电等应用领域的不断扩展,电解技术也得到了大力推广,在今后的几十年中,电解水技术的比重有望大幅提高。
电解水技术于1789年被发现,在20世纪20年代由于合成氨需要氢气而得到迅速发展,而20世纪70年代氢经济的提出使其变得更具现实意义。以电解池中电解质溶液的pH为划分依据,电解水技术可分为碱性、酸性以及中性。碱性电解水技术结构简单,技术成熟,但负荷较低,电解液内阻较大,且产品中有其他物质需通过净化除去[4]。质子交换膜电解槽(PEMWE)会造成酸性环境,氢气纯度高,安全性强,更适合实际应用。但大多数成熟的电催化剂在酸性条件下易氧化腐蚀,因此,需要在不降低催化剂的活性前提下,提高其稳定性。开发高效的酸性电解水催化剂仍然是一个巨大的挑战。
用于酸性OER的贵金属催化剂多与铱(Ir)和钌(Ru)基材料有关。例如RuO2和IrO2由于其较高的活性和在酸性介质中良好的稳定性,常用作OER的基准[5]。相比于Ru基催化剂,Ir基的催化性能相对较低,具有较高的氧化电位,因此具有相对较好的耐溶解性,被用作质子交换膜电解槽(PEMWE)的商用催化剂。介于Ir基材料的价格高昂与不可替代,需要通过特定手段来降量提效,减少制备成本。
在本文中,首先讨论了酸性电解水的作用机理,对目前公认的酸性析氧反应途径加以说明,其次从形貌结构优化,界面工程,以及反应路径设计出发,系统总结了目前Ir基材料作为酸性电解水催化剂的最新研究进展,最后讨论了酸性电解水制氢发展面临的挑战和前景。
电解水反应包含两个半反应,阴极上发生析氢反应(HER),阳极上发生析氧反应(OER)。HER是双电子转移,其理论热力学电压为0 V。OER反应是4电子转移,通过一系列质子-电子耦合产生O2分子,其理论热力学电压为1.23 V[6]。OER反应在实际过程中增加了过电位。因此,需要高效电催化剂来克服高能势垒,从而降低过电位,提高反应动力,提高电解水效率。电解质的pH不同,产生O2的反应途径也完全不同。碱性溶液中的羟基(OH-)被氧化并转化为H2O和O2。酸性介质中的两个水分子(H2O)被氧化,产生4个质子(H+)和O2[7]。质子交换膜(PEM)是一种酸性固体聚合物电解质膜,气体交叉度小,可以有效避免形成H2/O2混合物,从而保证电解槽有更大的负载范围。质子交换膜电解槽(PEMWE)具有更宽的工作温度和更小的电池面积,有利于更紧凑的系统设计和更低的开发成本。此外,PEMWE可以提供较高的质子导电性,降低欧姆损耗提高电流密度。

图1 PEM电解槽
Fig.1 Proton exchange membrane electrolyzer
酸性水氧化过程复杂,涉及到多电子/质子转移。对于酸性OER,一般认为其反应机制可能经过3种途径:吸附质反应机理(AEM)、晶格氧反应机理(LOM)[8]以及最新报道的氧化路径机制(OPM)。在AEM过程中,氧气产物主要来源于吸附的水分子,在LOM过程中,氧气在晶格氧的参与下释放,OPM可以使吸附的氧(*O-O*)直接耦合释放O2[9]。图2说明了酸性OER的3种不同反应途径。AEM途径的水分子经单电子氧化后,在M位上吸附 *OH,随后被氧化为 *O。通过吸附其他的水分子,生成中间体 *OOH,最终 *OOH化合物进行单电子传递,被氧化释放O2,得到初始的M活性位点[10]。LOM机制的前两步与AEM一致,*O可与晶格氧离子耦合释放氧分子,并在晶体中形成空位。这些空位中的水分子形成了 *OH物种,利用单一的电子氧化步骤去除质子[11]。根据参与反应的晶格氧的数量,可将LOM细化为两种机制:单氧空位机制(SOVM)与双氧空位机制(DOVM)[12]。当OER反应遵循AEM机制时,氧-氧成键非常难;当遵循LOM机制时,去质子化过程缓慢,这些局限性直接制约着OER催化剂进一步的发展。Norskov等[13]的理论分析表明,与AEM相比,LOM的反应势垒可能更低,AEM的最小过电位一般维持在0.37 V左右,但在LOM中,晶格氧键经常发生断裂或形成,导致稳定性差。最新报道的OER的氧化路径机制(OPM)有效地克服了结构关系的限制,抑制了晶格氧的参与,保持了完整的热稳定结构,但其潜在结构特征仍不明确,有待进一步研究[14]。

图2 酸性OER的反应途径:吸附质反应机理(AEM)、晶格氧反应机理(LOM)和氧化路径机制(OPM)[9]
Fig.2 Reaction pathways of acid OER:adsorbent reaction mechanism (AEM),lattice oxygen reaction mechanism (LOM) and oxide path mechanism (OPM)[9]
目前可用氧吸附能ΔGO*来描述催化剂活性与电子结构之间的关系,研究表明,与氧相关的中间体(OH*、O*、OOH*)对OER的吸附能之间呈线性比例关系[15]。一个中间体吸附能的变化会导致其他中间体的变化。一个反应步骤的增强,可能会导致另一个反应被抑制。OER活性仅与一种中间体的吸附能有关,这也抑制了电催化剂的活性优化。根据萨巴蒂尔原理,反应中间体的结合能应当适中。OER活度与含氧中间体结合能差之间的关系形成了火山趋势(图3)[16],IrO2具有较高的OER催化活性。

图3 金属氧化物的OER火山图[16]
Fig.3 OER volcanic map of metal oxides[16]
贵金属纳米材料在酸性介质中具有良好的稳定性,例如钌(Ru)、铱(Ir)、铂(Pt)、钯(Pd)等。IrO2在电解水反应中具有极高的活性,但其资源相对稀缺,且在高阳极电位下不稳定,严重影响了实际操作,可对催化剂特定拓扑和电子结构进行合理设计,通过形貌结构优化,界面工程,以及反应路径设计等手段来进行调控以实现其活性、稳定性的双重提高。
2.1 形貌结构优化
首先是通过相位与形态控制,对表面积进行最大化处理,调节晶体的形貌结构。超小的尺寸和大的表面体积比会暴露更多的活性位点,提高贵金属利用率,对催化剂的性能产生影响。人们设计了各种纳米材料,获得了比商用IrO2(320~380 mV@10 mA/cm2)更好的性能[17]。目前的制备方法已有熔盐法[18]、湿化学法[19]、模板法[20]等。
空心纳米结构可提供丰富的活性位点,有效提高原子利用率。目前已被开发的有中空Ir纳米管(Ir NTs)[21]、介孔Ir纳米片(Ir NSs)[22]、Ir多孔纳米空心(Ir p-NHs)[23]等,Ir NTs采用诱导自模板水热还原法合成,Ir晶体自发在HEDP纳米棒表面有序聚集,形成了粗糙多孔的一维结构,在过电位为245 mV时,可达到10 mA/cm2的电流密度[21]。Ir NSs可以在过电位为240 mV的情况下获得高活性[22]。也可使用过渡金属(例如Ni、Fe、Co)选择性刻蚀,通过调节局部电子环境来控制O*和OH*中间体的表面吸附能。利用Kirkendall效应对水热反应形成的固体Ir球进行原位蚀刻。不含刻蚀剂Co的样品与Ir p-NHs仅有几何形状的区别,均无配位效应[23]。Kirkendall效应是固体扩散过程由于扩散系数不均等出现的空位介导机制,可以控制边界区域产生空隙,从而促进导电,在脱合金过程中也有类似情况[24]。大多数过渡金属在酸性OER电解过程中不稳定,发生浸出与持续溶解,这种现象被称为脱合金。研究人员认为合金催化剂的实际催化结构是衍生的多孔骨架[23],DFT计算说明孔隙度可促进OER活性的提高。广义配位数(GCN)可用于解释缺陷型Ir基催化剂的表面活性,将局部几何结构(包括形状、结晶度、孔隙度等)与吸附能量学结合,从而对Ir基材料的结构工程进行指导。
由于Ir比Ru具有更高的稳定性,Ru比Ir具有更优越的OER活性,因此通常将Ru和Ir合金化形成双金属纳米结构[24]。块状材料由于表面能低而表现出良好的稳定性,而纳米颗粒的高活性则来源于大量的协同不饱和位点[25]。因此将二者优点整合到“宏观纳米”催化剂中,可能为活性和稳定性的平衡问题提供新的有效策略。Fan等[26]通过自组装工程和Ru3Ir纳米晶体的相位调节合成了具有非常规面心立方相(fcc)的二维纳米晶体(2D fcc-Ru3Ir,图4)。这种催化剂在电流密度为10 mA/cm2时的过电位低至190 mV,并且在400 h内无明显活性衰减。多种光谱表征表明,fcc-Ru3Ir在OER过程中通过自构建形成的表面Ru3IrOx是OER的实际活性物种。自组装结构可以抑制其过度溶解,从而保证了良好的酸性OER稳定性[26,27]。另一种可行的策略是通过将RuIr与Ni、Co和Fe等过渡金属合金化来设计三元合金,优化了局部电子环境,增加活性物质。Ling团队[28]据此设计了M-RuIr(M=Co,Fe,Ni),在0.1 mol/L HClO4介质中,Co-RuIr的OER的过电位为235 mV(@10 mA/cm2),并且可在1.52 V的电池电压下实现全水解。Co浸出导致OI-浓度升高,显著提高了催化活性。Zhang等[29]采用低温定向共热解法在工业钛箔上制备了沿低能(110)面具有晶体明确取向的RuIrAgMnO2,将Ir引入RuO2的晶格中,Ag与Mn组分的协同作用使得在10 mA/cm2的电流密度下过电位仅为 171 mV,这可归因于(110)面的出现导致了晶体取向面上发生了局部应变,迁移能垒的增加阻止了活性金属离子的扩散。除此之外,还可将RuIr与类金属元素复合,例如Wang等[30]采用Te纳米线(NWs)取代反应合成了三元RuIrTe纳米管(NTs)作为双功能电催化剂,在酸性环境下实现了全水解。国际伊比利亚纳米实验室的Liu团队[31]用一锅水热法合成了IrRu@Te。得益于 IrRu簇具有较大的活性表面以及IrRu与Te载体之间的强电子耦合,IrRu@Te在强酸性电解质(即0.5 mol/L H2SO4)中表现出良好的OER催化性能,只需要220和303 mV的过电位就可以提供10和100 mA/cm2的电流密度。Ir还可与其他贵金属结合,Kim等[32]合成了负载在碳支架上的扁平的纳米立方(Pd@Ir f-nc)和凹形的纳米立方(Pd@Ir c-nc),通过对比测试发现Pd@Ir c-nc对酸性OER的比活性更高。在长期OER试验中,Pd和Ir在具有高指数位面的Pd@Ir c-nc中溶解更多,这说明阳离子溶解可以促进氧化过程,导致催化剂的进一步活化。DFT计算也表明,Ir(553)等高折射率表面在OER条件下有利于氧原子吸附和氧化物的形成,从而解释了凹形Ir表面具有更高的活性。Qin等[33]报道了一种新型催化剂——PtIr CCM(IUCCM),这种材料是通过在催化剂包覆膜上(CCM)原位生长有序PtIr纳米花阵列形成的,其在1.77 V时可达到2 A/cm2的高电流密度,在0.5 A/cm2电解300 h时,降解率约为44.4 μV/h。IUCCM的优异性能来源于d段中心的下移与PtIr CL的高ECSA。这一报道为新一代电化学原件(PEMWEs)CCM的综合设计提供了一种指导性方法。

图4 二维fcc-Ru3Ir生长过程示意图(a);二维fcc-Ru3Ir的原子分辨率HAADF-STEM图像(b);二维fcc-Ru3Ir、二维hcp-Ru3Ir的XRD图谱(c);分别在0和1.23 V (vs RHE)作用下fcc@Ru3IrOx和hcp@Ru3IrOx的OER自由能图(d)[25]
Fig.4 Scheme of the growth process of 2D fcc-Ru3Ir(a),Atomic-resolution HAADF-STEM images of 2D fcc-Ru3Ir(b),XRD patterns(c) of 2D fcc-Ru3Ir and 2D hcp-Ru3Ir;OER free energy diagrams(d) of the fcc@Ru3IrOx and the hcp@Ru3IrOx under the applied potentials of 0 and 1.23 V (vs RHE),respectively[25]
无定形水合IrOx型电催化剂被认为具有高催化能力[34],通常可以通过Ir氧化物的动态表面重构获得,与其他杂元素混合有助于降低Ir价态,削弱Ir—O的结合[35]。IrOx型催化剂具有丰富的亲电氧缺陷,有利于水的亲核攻击,导致催化性能显著增强[36]。含有Hf、Re、W、Ta等高价过渡金属元素掺杂可以得到电子来调节活性中心的电子结构,而且其强金属-O键可以起到稳定作用[37]。Zhang等[37]合成了具有微观纳米颗粒形貌和丰富氧空位的电催化剂350-Ta@IrOx,在 10 mA/cm2的过电位为223 mV,可投入运行长达 500 h。在1.55 V下的质量活性是商用IrO2的147.7倍。这一工作为高价金属掺杂工程提供了有效的设计原则。目前已有理论研究表明可通过降低Ir—O配位数来降低速率决定步骤的能垒。受此启发,Wang等[38]合成了低配位IrOx纳米颗粒,其过电位为231 mV@10 mA/cm2,并通过等离子体缺陷工程对商用金红石IrO2进行了模型研究,结合原位X射线吸收光谱分析和计算,阐明了配位数下降会增加催化活性的深层原因,配位数会改变氧中间体的吸附能,显著降低反应能垒。Guo等[39]通过使用金属间IrVMn纳米颗粒诱导原位形成超薄IrOx层(O-IrVMn/IrOx),有序原子排列产生的强电子作用可抑制过渡金属的过度浸出,最大限度的减少氧配位的空缺。Chen等[40]将高度分散的IrOx纳米颗粒制备在涂覆Ti网的MoO3薄片上,合成了c-IrOx-MoO3-Ti,其电化学性能为200 mV@10 mA/cm2,且在100 mA/cm2的电流密度下稳定运行130 h。通过电沉积形成的MoO3有效促进了IrOx的均匀分布。理论计算表明,IrOx-MoO3的非均相界面上的电子调制优化了催化剂活性Ir位点的氧中间体吸附能。
Bajdich等[41]通过主动学习(AL)加速算法,对电化学稳定的氧化铱多晶型进行识别,证实了金红石结构的整体稳定性。该研究还发现α-IrO3取代了金红石型IrO2,成为了在酸性OER条件下最稳定的固相。理论OER表面活性的计算表明,OER中间体在α-IrO3上的结合弱于任何其他氧化铱,但是这种高价Ir6+结构尚未在以往实验中得到证明[42]。日本理化所通过MnO2锚定合成了原子级分散的六价Ir氧化物(IrⅥ-ado,图5),证实了这一理论的现实可行性,负载率量为0.08 mgIr/cm2时,在2.0 V的电压下即可达到4.0 A/cm2的电流密度。这种材料在PEMWE中所表现出的性能优于迄今为止报道的其他Ir氧化物,具有里程碑意义[43]。

图5 基于K2IrCl6与氧化锰的氧化配体取代反应合成IrⅥ(a);HERFD-XANES光谱在IrⅥ-ado和参考样品的Ir L3边缘(b);IrⅥ-ado(绿色圆圈)和参考样本(黑色方块)的WL峰强度随d波段空穴数的变化曲线(c)[43]
Fig.5 Synthetic preparation of IrⅥ based on an oxidative ligand substitution reaction of K2IrCl6 with manganese oxide(a);HERFD-XANES spectra at the Ir L3-edge of IrⅥ-ado and the reference samples(b);Integrated WL peak intensity of IrⅥ-ado(green circle) and the reference samples (black squares) as a function of the d-band hole count(c)[43]
2.2 界面工程
界面工程常将贵金属元素与其他组分相结合,制成具有异质结构的复合材料,不同组分间的协同效应与电化学表面积的增加对提高催化剂的性能具有重要作用。通过形成杂原子键,可改变晶格参数和电荷分布,从而调节关键氧中间体(如OH*、O*和OOH*)的电子结构和吸附,提高OER活性和持久性。
非贵金属过渡金属,常见的有Ni、Co、Fe、Cu、Mn等,经常被用于与Ir合金形成双金属催化剂,以改善酸性OER性能。Wen等[44]报道了一种高性能催化剂,高价Mn通过形成Mn-O-Ir配位,驱动Ir在MnO2基质上强锚定,在电流密度为 10 mA/cm2时的过电位低至181 mV,可以保持180 h,当与低价MnO2反应时,Ir聚集成IrOx纳米颗粒,导致OER稳定性差。DFT计算表明,Mn-O-Ir配位结构可以优化 *OOH中间体吸附强度。Ir通常会与Ti等材料混合,随着不同程度的氧化,Ti会转变成半导体相甚至绝缘相。然而,混合Ir-TiOx催化剂的电子性质尚未得到系统研究。Van等[45]将混合Ir-TiOx催化剂的性能与表面层的电子结构联系起来。70 at.% Ir时,Ir-TiOx的OER活性与纯金属Ir相近,但Ir的溶出率比纯金属Ir低71%,这证明了Ti的稳定作用。该方法阐明了一种可行的Ir/Ti比例,适用于进一步的催化剂开发策略。Joo等[46]合成了一种仙人掌状纳米颗粒——Mn-RuIr NCT,通过引入微量锰掺杂剂,形成了Ru/IrO2异质界面。界面上的电子转移使得催化剂表现出优异的活性,在连续测试180 h后仍能保持良好的稳定性。核壳结构暴露了更多的活性位点,提高了Ir的利用率。Xie等[47]将α-Ni(OH)2引入酸性电解水领域,将其与Ir结合,形成核壳异质界面,在10 mA/cm2时,其析氧过电位为238 mV,析氢过电位为20mV,催化活性的提高来源于超薄的Ir外壳(约为1 nm)。XPS结果显示,α-Ni(OH)2与Ir之间存在较强的电子相互作用,激发了Ir在d带中心的下移,使其对OER的催化性能提高。
贵金属氧化物的稳定性在很大程度上取决于催化剂载体。目前已有利用抗酸性腐蚀的氧化物将IrO2合金化的研究。通过选择合适的金属元素,可以修改电子结构,暴露出更多活性位点。Zhen等[48]将7种不同的金属元素M(M=V、Mn、Fe、Ni、Cu、Nb、W)以相同的物质的量比(M/Ti)掺杂锐钛矿TiO2与IrO2纳米颗粒相结合,形成电催化剂M-TiO2@IrO2。W-TiO2@IrO2在调节TiO2电导率和IrO2性能方面表现最好,W掺杂获得了合适的能带结构,优化了载体固有的电导率以及金属氧化物与载体之间的界面电子结构。Yang等[49]通过对载体表面羟基化来调控动态变化高价Irx+(HVI),在富含OH的IrO2/TiO2界面上加速了HVI的形成,高浓度OH配体降低了Ir5+的形成电位,有利于削弱中间体吸附自由能。Shi等[50]以Nb2O5-x负载的铱(Ir/Nb2O5-x)作为模型催化剂,揭示了OER过程中氧在IrOx和Nb2O5-x之间的动态迁移,原位光谱结合理论计算表明,这种迁移不仅调节了原位Ir结构,还通过自发地将过量氧气运输到Nb2O5-x来抑制过度氧化,该催化剂在电解槽中仅需要1.839 V即可达到3 A/cm2,且在2 A/cm2下的2 000 h内没有活性衰减。Liu等[51]通过等离子辅助球磨(PABM)-水热技术,成功的合成了具有独特氧空位结构的IrO2/Nb2O5-x,通过对电子结构的操纵有效的增强了氧化物-载体的相互作用,氧空位对Ir原子周围氧原子配位产生影响,导致Ir—O键收缩,Nb向Ir发生电荷转移,防止了Ir的过度氧化,d带中心上移增强了Ir中心与吸附质之间的结合力(图6)。Jiang等[52]也借助缺陷工程与单原子吸附,增强了金属-载体的相互作用,合成了等离子体处理的TiO2纳米线,其上生长Ir纳米粒子与Sr单原子,Ir@Sr-p-TiO2 NWs仅需250 mV的过电位便可驱动 10 mA/cm2的OER,高活性主要来源于等离子体上生成氧缺陷与Sr的吸附增强了金属-载体相互作用。

图6 IrO2/Nb2O5-x合成工艺示意图(a);IrO2/Nb2O5-x和IrO2/Nb2O5中Ir d波段、Nb d波段和O 2p波段的DOS图(b);pH为0时IrO2/Nb2O5-x和IrO2/Nb2O5上OER的自由能图(c)[51]
Fig.6 a.Schematic representation of the synthesis process for IrO2/Nb2O5-x;b.DOS plots of Ir d band,Nb d band and O 2p band in IrO2/Nb2O5-x and IrO2/Nb2O5;Free energy diagrams of OER on IrO2/Nb2O5-x and IrO2/Nb2O5 at pH 0(c)[51]
碳基支撑材料具有高导电性,易被腐蚀,而耐腐蚀过渡金属氧化物导电性差[53]。作为支撑材料最稳定的Ti和Zr基氮化物和碳化物,过渡金属氮化物(TMNs)和碳化物(TMCs)在酸性OER环境下,会逐渐氧化和相变为氮氧化物和氧化物,失去优良的电子导电性能[54]。为了打破这种平衡关系,Kim等[55]以Zr2ON2作为支撑材料,以尿素为氮源,采用溶胶-凝胶法合成了IrOx/Zr2ON2电催化剂。在10 mA/cm2的电流密度下其过电位为255 mV,明显低于IrOx/ZrN(283 mV)与IrOx/ZrO2(290 mV)。其出色的电化学性能可以归因于IrOx与Zr2ON2纳米粒子之间的强相互作用以及从载体到催化剂的电荷转移,这些电子降低了IrOx并活化了Ir—O键,导致反应途径由传统的吸附物质演化机制转变为晶格氧参与机制,为催化剂同时具有活性与稳定性提供了一种新的策略。
单原子(SA)催化剂是将孤立的金属位点固定在合适的载体上,具有优异的原子经济性,独特的电子性能以及超低的贵金属用量等特性。但单原子还存在与载体相互作用弱,原子空间性差,单原子-载体键由于增强的晶格氧参与而极易腐蚀失活等问题[56,57]。Su等[58]通过水热-快速热解策略,将Ir单原子锚定在MnO2上,合成的TS-Ir/MnO2晶格中产生拉伸应力,调节了Ir位点的吸附,加速了 *OH在表面氧空位处的去质子化,有效防止Ir位点的局部氧化,在10 mA/cm2的电流密度下,其过电位为198 mV,其质量活性高达1025 A/gIr。利用原位同步辐射技术可以观察到表面局部氧空位的产生以及晶格氧参与反应,实现了活性与稳定性的双重提升。Liu等[59]将Ir原子结合到尖晶石Co3O4,成功制备了Ir1-Co3O4-NS-350,该催化剂在10 mA/cm2下,过电位降至226 mV,使用寿命可达500 h。计算表明,*OOH中间体可以通过形成氢键与Ir活性位点配位,调节了OER过程的限速步骤,降低了激活自由能。这项工作展示了一种提高Ir基催化剂OER活性的策略,并为反应机理的调控提供了见解。目前已经通过一系列测试表征证实了贵金属可通过孤立单原子形态存在于载体表面。然而人们对催化过程中单原子活性位点的具体位置以及动态结构变化仍然缺乏清晰的认识,且争议巨大。在反应条件下对单原子活性位点进行原位表征以及实验与模拟的系统性研究仍然面临着巨大挑战。
2.3 反应路径设计
微观反应路径对电化学性能起着至关重要的作用。AEM在吸附能与 *OH和 *OOH活性中间体之间固有的线性关系限制了高效电催化剂的发展。动力学有利的LOM机制避免了 *OOH中间体的产生,但它形成的晶格氧空位破坏了热稳定的晶体结构[60]。AEM的理论局限性和LOM的结构不稳定性导致活性和稳定性较差,限制了Ir基电催化剂在酸性介质中的实际应用[61]。OER的氧化路径机制(OPM)可以使吸附的氧(*O-O*)直接耦合释放O2,有效的克服了以上缺点[62]。OPM对金属活性位排列有严格要求,具有适当原子距离的对称双金属位可以有效降低O*-O*自由基的耦合能垒。Ashwani等[63]将短程相关的Ir单原子簇(SAE)锚定在Mn掺杂的尖晶石氧化物中(CMO),Mn掺杂降低了Co3O4表面Ir单原子的迁移能垒,通过精确调节氧化物载体的表面能,实现了对单原子簇-载体的配位环境优化,抑制了晶格氧的参与,增强了直接O*-O*自由基偶联,改变了反应路径(图7)。

图7 短程相关Ir位点的IrSAE尺寸分布图(a);Co3O4表面IrSA和CMO从初始状态迁移到末态的迁移能垒(b);Co3O4和CMO表面IrSA/IrSAE的结合能比较(c);IrSA-Co3O4的晶格氧介导机制(LOM)过程和IrSAE-CMO的氧化路径机制(OPM)过程的示意图(d)[63]
Fig.7 IrSAE size distribution graph for short-range correlated Ir sites(a);Calculated migration energy barriers for IrSA on the surface of Co3O4 and CMO migrating from the initial to the final state(b);Comparison of the binding energies of IrSA/IrSAE on the surface of Co3O4 and CMO(c);Schematic illustration of lattice oxygen-mediated mechanism (LOM) process for IrSA-Co3O4 and oxide path mechanism (OPM) process for IrSAE-CMO(d)[63]
亚稳相具有更高的能量结构,比稳定的金红石IrO2具有更好的催化性能,然而,1T-IrO2的原子距离只允许遵循传统AEM机制,Yu等[64]通过碱辅助机械热法将CeO2加载到1T相IrO2,调节了压缩应变,降低了化学反应障碍,CeO2诱导1T-IrO2通过OPM途径产氢,这一工作表明应变工程在改变机理途径和改善OER性能方面展现出巨大潜力。Liu等[65]报道了一种热力学自限制离子交换法合成的Ir-Mn双原子电催化剂(Ir-SrMnO3),原位红外光谱证实了OER过程中O*-O*中间物种的形成,DFT计算表明Ir-Mn双原子之间具有较短的原子间距,可诱导吸附的O自由基自旋方向相同,有利于通过氧-氧自由基耦合机制(ORCM)直接生成O2。这些工作为合理设计高活性,强酸性OER催化剂提供了一种有效策略。
IrO2作为不可替代的质子交换膜电解槽(PEMWE)的商用催化剂,具有高催化活性与稳定性,但其价格昂贵限制了实际应用,因此研究低Ir催化剂的改性方法具有重要意义。本文综述了Ir基OER电催化剂的3种反应机理:AEM、LOM与OPM,由机理出发讨论了3种改性策略的最新应用进展:形貌结构优化,界面工程与反应路径设计。随着电解水技术的不断深入发展,开发新型Ir基酸性OER催化剂也面临众多挑战,包括以下:
3.1 目前报道多采用计算与各种表征手段证明活性物质的存在与价态,而缺少对实时动态催化过程的检测。实际的OER氧化是一个电化学活化过程,不仅包括成核和生长形成的Ir氧化物,还包括不稳定的金属Ir形成的Ir氢氧根或Ir溶解物。原始的OER电催化剂不一定是反应过程中真正的活性相。基于原位表征技术可以捕捉反应中间体,确定真实活性相,DFT计算可对真实反应过程进行模拟和分析,二者的结合可以深入研究反应机理,寻找表面重建机制的检测证据。
3.2 三电极半反应的测试可快速高效筛选材料,得到优异的Ir基电催化剂应当在电解槽装置上进行高电流密度测试。目前的研究多停留在实验室内少量催化剂的性能优化,忽略了规模化生产的可行性,仍需开发简单易批量的合成方法来用于小型工业级测试。
3.3 电解水技术目前一般要求电力输入稳定,具有波动性的可再生能源无法完全应用于制氢。PEMWE具有一定的波动性负荷能力(0%~150%),优于碱性(20%~120%)。波动电力测试包括以下3种:固定时间范围内增加电流密度;采用特征不同的纹波电流作为电力来源以及风电(光电)耦合。其中风电(光电)耦合的性能损失最小,这种方法将输入(风速、太阳能功率)转化为电解槽电位,进行建模,保持上下及平均电位相同。但需要注意的是,波动性电源对PEMWE会造成一定影响,例如PEM与膜电极被阳离子污染,加速降解;双极板表面镀层被反复氧化还原,导致配位溶解,隔膜发生降解产生F-;催化剂受波动性与循环工况影响,发生原子脱落,催化层分离与不可逆烧结等情况。目前低铱基催化剂在波动性电力工况下的应用工艺报道较少,有待进一步探索开发。
随着氢能应用领域的不断拓展,以及材料科学的深入发展,未来一定会有更多的机会与商业利用相关能源系统结合,从而有效缓解现有的诸多问题。
[1]Electric Power Planning Institute &Engineering Institute.Annual Report on China′s Energy Development (2023).Beijing:People′s Daily Press,2023.
电力规划设计总院.中国能源发展报告(2023).北京:人民日报出版社,2023.
[2]Chu S,Majumdar A.Nature,2012,488(7 411):294-303.
[3]Nie J B,Deng J Y.Technol.Dev.Chem.Ind.,2021,50(8):46-50.
聂家波,邓建悦.化工技术与开发,2021,50(8):46-50.
[4]Liu T K,Deng C M,Zhang Y P.Mater.Res.Appl.,2019,13(4):339-346.
刘太楷,邓春明,张亚鹏.材料研究与应用,2019,13(4):339-346.
[5]Shan J Q,Zheng Y,Shi B Y,Davey K,Qiao S Z.ACS Energy lett.,2019,4(11):2 719-2 730.
[6]Suen N T,Hung S F,Quan Q.Chem.Soc.Rev.,2017,46:337-365.
[7]Zhang C L,Wang B W,Shen X C,Liu J W,Kong X K Chuang S S C,Yang D,Dong A G,Peng Z M.Nano Energy,2016,(30):503-510.
[8]Feng J R,Lv F,Zhang W Y,Li P H,Wang K,Yang C,Wang B,Yang Y,Zhou J H,Lin F,Wang G C.Adv.Mater.,2017,29(47):1 703 798.
[9]Qian Q,Tang B,Zhang X L,Wang C,Tan H,Zhao J,Liu R Q,Sun M,Liu H J,Jiang C,Zeng J R,Cai X K,Yan W S.Nat.Commun.,2024,15:8 089.
[10]Rong X,Parolin J,Kolpak A M.ACS Catal.,2016,6(2):1 153-1 158.
[11]Liu P F,Han H L,Zhang Z W,Wang L L.Jiangxi Chem.Ind.,2020,5(14):44-46.
刘培芳,韩会丽,张宗文,王玲玲.江西化工,2020,5(14):44-46.
[12]Rabiee H,Ge L,Zhang X Q,Hu S H,Li M R,Yuan Z G.Energy Environ.Sci.,2021,14(4):1 959-2 008.
[13]Montoya J H,Seitz L C,Chakthranont P,Vojvodic A,Jaramillo T F,Norskov J K.Nat Mater,2017,16(1):70-81.
[14]Lang C C,Li J Y,Yang K R,Wang Y X,He D,Thorne J E,Croslow S,Dong Q,Zhao Y Y,Prostko G.Chem,2021,7(8):2 101-2 117.
[15]Man I C,Su H Y,Calle V F,Hansen H A,Martinez J I,Inoglu N G,Kitchin J,Jaramilo T F,Norskov J K,Rossmeisl J.Chemcatchem,2011,3(7):1 159-1 165.
[16]Paoli E A,Masini F,Frydendal R,Deiana D,Schlaup C,Malizia M,Hansen T W,Horch S,Stephens I E L,Chorkendorff I.Chem.Sci.,2015,6(1):190-196.
[17]Wu H X,Wang Y B,Shi Z P,Wang X,Yang J H,Xiao M L,Ge J J,Xing W,Liu C P.J.Mater.Chem.A,2022,10(25):13 170-13 189.
[18]Cai C,Han S B,Tang Y L.Sustainable Energy Fuels,2020,4(5):2 462-2 468.
[19]Deng Q,Sun Y,Wang J,Chang S D,Ji M W,Qu Y T,Zhang K,Li B.Dalton T.,2021,50(18):6 083-6 087.
[20]Baik C,Lee S W,Pak C.Micropor.Mesopor.Mater,2020,309:110 567.
[21]Zhu J Y,Xue Q,Xue Y Y,Ding Y,Li F M,Jin P J,Chen P,Chen Y.ACS Appl.Mater.Int.,2020,12(12):14 064-14 070.
[22]Jiang B,Guo Y N,Kim J,Whitten A E,Wood K,Kani K,Rowan A E,Henzie J,Yamauchi Y.J.Am.Chem.Soc.,2018,140(39):12 434-12 441.
[23]Bao X B,Li S J,Hao C T.J.Mater.Chem.A,2022,10(37):20 005-20 010.
[24]Wang X,Wang Y B,Wang X,Zhu J B,Ge J J,Liu C P,Xing W.Chin.J.Appl.Chem.,2022,39(4):616-628.
王雪,王意波,王显,祝建兵,葛军杰,刘长鹏,刑巍.应用化学,2022,39(4):616-628.
[25]Cherevko S,Zeradjanin A R,Topalov A A,Kulyk N,Katsounaros I,Mayrhofer K J J.Chem.Cat.Chem.,2014,6:2 219-2 223.
[26]Fan J C,Mu Y J,Ge X,Zhang L,Li W W,Dong H L,Wang D W,Zhang W,Ma J Y,Zheng W T,Cui X Q.ACS Catal.,2023,13(7):4 120-4 126.
[27]Tian J R,Tian H,Dai J W,Yang M M,Zhang G X.Chem.Reagents,2023,45(6):78-87.
田锦锐,田浩,戴佳玮,杨淼淼,张国新.化学试剂,2023,45(6):78-87.
[28]Shan J Q,Ling T,Davey K,Zheng Y,Qiao S Z.Adv.Mater.,2019,31(17):1 900 510.
[29]Zhang M,Sun Y H,Liu F,Gan J,Gao S X,Liu J J.Adv Funct Mater,2024,34(48):11 766.
[30]Liu M,Liu S L,Mao Q Q,Yin S L,Wang Z Q,Xu Y,Li X N,Wang L,Wang H J.J.Mater.Chem.A,2021,10(4):2 021-2 026.
[31]Xu J Y,Lian Z,Wei B,Li Y,Bondarchuk O,Araujo A,Amorim I,Wang Z C,Li B,Liu L F.ACS Catal.,2020,10(6):3 571-3 579.
[32]Kim M,Park J,Wang M Y,Wang Q X,Kim M J,Kim J Y,Cho H S,Kim C H,Feng Z X,Kim B H,Lee S W.Appl.Catal.B-Environ.Energy,2022,302:120 834.
[33]Qin J Q,Lv Y,Han G Q,Liu H Y,Li Y P,Zhang H Y,Zhou X Y,Xing K R,Li T T,Sun C Y,Wang C X,Zhou Q,Wu R A,Wang D Q,Song Y J.Chem.Eng.J.,2024,479:147 913.
[34]Yang L,Yu G T,Ai X,Yan W S,Duan H L,Chen W,Li X T,Wang T,Zhang C H,Huang X R,Chen J S,Zou X X.Nat.Commun.,2018,9:5 236.
[35]Nong H N,Reier T,Oh H S,Gliech M,Paciok P,Vu T H T,Teschner D,Heggen M,Petkov P,Schlogl R,Jones T,Strasser P.Nat.Catal.,2018,1(11):841-851.
[36]Loncar A,Scalera-lopez D,Cherevko S,Hodnik N.Angew.Chem.Int.Ed.,2022,61(14):14 437.
[37]Zhang N,Du J Y,Zhou N,Wang D P,Bao D,Zhong H X,Zhang X B.Chin.J.Catal.,2023,53:134-142.
[38]Gao H M,Xiao Z H,Du S Q,Liu T Y,Huang Y C,Shi J Q,Zhu Y W,Huang G,Zhou B,He Y M,Dong C L,Li Y F,Chen R,Wang S Y.Angew.Chem.Int.Ed.,2023,62(49):e202 313 954.
[39]Luo H,Lin F X,Zhang Q H,Wang D W,Wang K,Gu L,Luo M C,Lv F,Guo S J.J.Am.Chem.Soc,2024,146(28):19 327-19 336.
[40]Chen Y R,Liu D N,Zhao Q Q,Long X,Wang J,Zhang J J,Fu X Z,Luo J L.Chem.Eng.J.,2023,475:146 255.
[41]Flores R A,Paolucci C,Winther K T,Jain A,Torres J A G,Aykol M,Montoya J,Norskov J K,Bajdich M,Bligaard T.Chem.Mater.,2020,32(13):5 854-5 863.
[42]Seitz L C,Dickens C F,Nishio K,Hikita Y,Montoya J,Doyle A,Krik C,Vojvodic A,Hwang H Y,Norskov J K,MJaramilla T F.Science,2016,353(6 303):1 011-1 014.
[43]Li A L,Kong S,Adachi K,Ooka H,Fushimi K,Jiang Q K,Ofuchi H,Hamamoto S,Oura M,Higashi K,Kaneko T,Uruga T,Kawamura N,Hashizume D,Nakamura R.Science,2024,384(6 696):666-670.
[44]Wen Y X,Wang K Y,Li S Y,Wang Y X,Lei L F,Zhuang L Z,Xu Z.Adv.Sci.,2023,10(8):2 205 920.
[45]Van D M M,Garcia-diez R,Lahn L,Wibowo R E,Frisch J,Gorgoi M,Yang W L,Ueda S,Wilks R G,Kasian O,Bar M.ACS Catal.,2023,13(23):15 427-15 438.
[46]Joo J,Park Y,Kim J,Kwon T,Jun W,Ahn D,Baik H,Jang J H,Kim J Y,Lee K.Small Methods,2022,6(1):2 101 236.
[47]Xie Y H,Yu X X,Li X W,Long X,Chang C F,Yang Z H.Chem.Eng.J.,2021,424:130 337.
[48]Zhen F,Tang Z M,Lin S M,Li R H,Chen X M,Tian J K,Liu L J,Peng J H,Liu S,Fu B W,Deng T,Wu J B.Crystengcomm,2024,26(4):475-483.
[49]Yang C L,Ling W H,Zhu Y P,Yuan Y X,Dong S,Wu C Y,Wang Z R,Yang S,Li J,Wang G L,Huang Y F,Yang B,Cheng Q Q,Liu Z,Yang H.Appl.Catal.B:Environ.Energy,2024,358:124 462.
[50]Shi Z P,Li J,Jiang J D,Wang Y B,Wang X,Li Y,Yang L T,Chu Y Y,Bai J S,Yang J H,Ni J,Wang Y,Zhang L J,Jiang Z,Liu C P,Ge J J,Xing W.Angew.Chem.Int.Ed.,2022,61(12):12 341.
[51]Wu Y,Guo C M,Yao R,Zhang K Y,Li J P,Liu G.Adv.Funct.Mater.,2024,34(51):10 193.
[52]Zhu H,Wang Y J,Jiang Z Q,Deng B L,Xin Y,Jiang Z J.Adv.Energy Mater.,2024,14(14):03 987.
[53]Abbou S,Chattot R,Martin V,Claudel F,Sola-hernandez L,Beauger C,Dubau L,Maillard F.ACS Catal.,2020,10(13):7 283-7 294.
[54]Kimmel Y C,Xu X G,Yu W T,Yang X D,Chen J G G.ACS Catal.,2014,4(5):1 558-1 562.
[55]Lee C,Shin K,Park Y,Yun Y H,Doo G,Jung G H,Kim M,Cho W C,Kim C H,Lee H M,Kim H Y,Lee S,Henkelman G,Cho H S.Adv.Funct.Mater.,2023,33(25):01 557.
[56]Yang S N,Wan J,Deng B J,Zhou P,Xue Y Y,Yao M,Yang H Y.Chem.Reagents,2019,41( 12): 1 254-1 259.
杨守宁,万佳,邓宝娟,周萍,薛雨燕,姚明,杨嬅嬿.化学试剂,2019,41(12):1 254-1 259.
[57]Ma H,Song L,Yu Y L,Li L.Chem.Reagents,2023,45(8):17-24.
马惠,宋利,于彦龙,李雷.化学试剂,2023,45(8):17-24.
[58]Su H,Yang C Y,Liu M H,Zhang X,Zhou W L,Zhang Y H,Zheng K,Lian S X,Liu Q H.Nat.Commun.,2024,15(1):95.
[59]Liu Y,Chen Y W,Mu X L,Wu Z Y,Jin X,Li J M,Xu Y Z,Yang L,Xi K K,Jang H,Lei Z W,Liu Q H,Jiao S H,Yan P F,Li X Y,Gao R G.ACS Catal.,2023,13(6):3 757-3 767.
[60]Man I C,Su H Y,Calle-vallejo F,Hansen H A,Martinez J I,Inoglu N G,Kitchin J,Jaramillo T F,Norskov J K,Rossmeisl J.Chem.Cat.Chem.,2011,3(7):1 159-1 165.
[61]Wang K,Wang Y L,Yang B,Li Z J,Qi X T,Zhang Q H,Lei L C,Qiu M,Wu G,Hou Y.Energy Environ.Sci.,2022,15(6):2 356-2 365.
[62]Lin C,Li J L,Li X P,Yang S,Luo W,Zhang Y J,Kim S H,Kim D H,Shinde S S,Li Y F,Liu Z P,Jiang Z,Lee J H.Nat.Catal.,2021,4(12):1 012-1 023.
[63]Ashwani K,Marcos G S,Jin S L.Adv.Mater.,2024,36(46):2 401 648.
[64]Yu H,Ji Y J,Li C C,Zhu W X,Wang Y,Hu Z W,Zhou J,Pao C W,Huang W H,Li Y Y,Huang X Q,Shao Q.J.Am.Chem.Soc.,2024,146(29):20 251-20 262.
[65]Liu W B,Long G F,Xiang Z P,Piao J H,Wan K,Fu Z Y,Liang Z X.Angew.Chem.Int.Ed.,2024,63:e202 411 014.