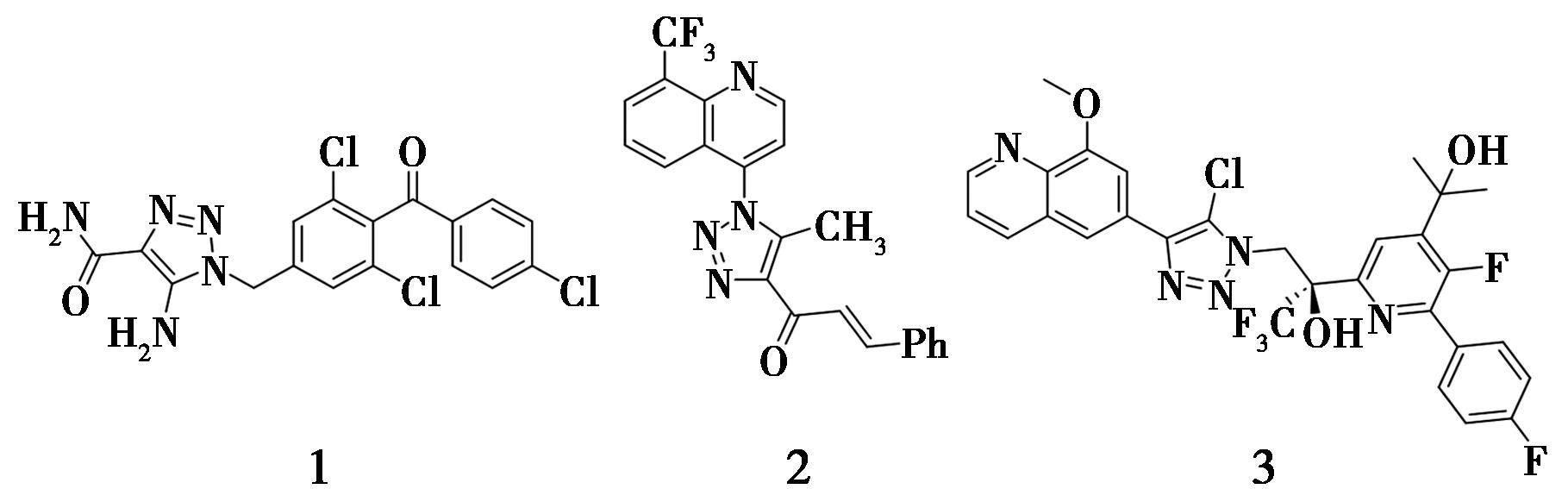
图1 含有全取代1,2,3-三氮唑片段的化合物
Fig.1 Compounds containing full substituted 1,2,3-triazole moieties
1,2,3-三氮唑是一类具有芳香性的五元氮杂环化合物,由3个连续的氮原子和两个碳原子组成。这类化合物具有较强的稳定性,耐酸、耐碱,在生物体内不易被氧化还原反应破坏化学结构,并且具有广谱的抗病毒、抗菌、抗肿瘤活性等,在有机化学、药物合成和高分子化学等领域具有广泛的应用。例如,羧酰胺三唑(CAI)(1)可促进甘油-3-磷酸在人体内的生物合成,缓解线粒体疾病,同时也具有治疗视神经萎缩的作用[1];喹啉三唑衍生物(2)具有抗菌的活性[2];氟苯喹啉三唑衍生物(3)为美国强生公司研发的抗病毒活性化合物,具有抑制呼吸道合胞病毒(Respiratory Syncytial Virus,简称RSV)复制活性的能力,可用于治疗呼吸道感染[3]。
传统合成三氮唑的方法,在1963年由德国慕尼黑大学Huisgen教授[4,5]报道,该方法采用叠氮类化合物作为1,3-偶极子,炔烃作为亲偶极体,在强热条件下发生1,3-偶极环加成反应,得到 1,2,3-三氮唑(图2)。该反应的缺点很明显,需要在强热条件下回流很长时间,并且产物为两种等比例1,4和1,5-取代的异构体混合物,难以分离,区域选择性极低。这些缺点限制了Huisgen环加成反应的应用。
2002年,美国斯克利普斯研究所Sharpless课题组[6]和丹麦哥本哈根大学Meldal课题组[7]独立报道了改良版的Huisgen环加成反应,即:铜催化的叠氮-炔烃环加成反应(Copper-Aatalyzed Azide Alkyne Cycloaddtion,简称为CuAAC),反应条件简单,操作简便,能够实现产物的区域选择性控制,只得到1,4-二取代-1,2,3-三氮唑。
一般认为,CuAAC反应的机理如图3所示[6]:首先,端炔(8)在碱的存在下脱去一个氢质子并与一价铜配合物相结合,得到炔基铜配合物(M1);然后,与叠氮化合物的带负电的氮原子结合,同时另一分子的一价铜配合物与炔烃配位得到二铜酸盐(M2);随后,经过六元环中间过渡态(M3),得到5-铜-三氮唑中间体(M4);最后,通过质子化得到1,4-二取代-1,2,3-三氮唑(10),离去的一价铜将继续参与催化循环。
2007年,美国斯坦福大学Bertozzi课题组[8]进一步开发了一种无铜点击反应,以克服CuAAC反应中铜离子可能带来的细胞毒性。该反应不使用Cu(Ⅰ)来活化炔烃,而是使用具有环张力的偕二氟辛炔(DIFO),其中吸电子的偕二氟基团与八元环的环张力共同作用,这种不稳定性提供了反应驱动力(图4)。
由于CuAAC的反应速率快(是传统Huisgen环加成反应的指数级倍率)、区域选择性高、底物普适性广,引起了众多科研工作者的研究兴趣。经过数十年的发展,该方法已经成为构建五元杂环的重要手段之一。随着人们对CuAAC反应的深入理解,在合成传统的二取代三氮唑基础上,通过内炔参与的环加成反应或多组分反应,制备出一系列标题化合物。
2005年,荷兰拉德堡德大学Rutjes课题组[9]报道了首例铜催化内炔与叠氮的[3+2]环加成反应(图5)。采用溴代丙炔酸甲酯(14)和对硝基苄基叠氮(15),以高产率和高区域选择性的方式合成了5-溴代-1,2,3-三氮唑(16)。反应采用一价铜(卤化亚铜)和二价铜(乙酸铜)共同催化,并且报道了两类合成方法。方法A采用碘化亚铜和乙酸铜(各5 mol%)进行催化,所需时间为 16 h,就可以得到99%转化率的5-溴代-1,2,3-三氮唑;反应的缺点是产物混合了5%的5-碘代-1,2,3-三氮唑。方法B采用溴化亚铜和乙酸铜(各20 mol%)进行催化,反应时间需要70 h以上,转化率同样为99%,但不存在副产物。两种方法均可使得溴代的炔丙基甘氨酸衍生物(17)与叠氮基半乳糖(18)发生CuAAC反应,以良好的产率得到了糖苷氨基酸衍生物(19)(方法A,85%;方法B,65%)。
2009年,美国斯克利普斯研究所Fokin等[10]采用碘化亚铜催化有机叠氮化合物(21)与1-碘代内炔(20)发生CuAAC反应,在反应中加入了2 equiv的三乙胺作为配体,以四氢呋喃为溶剂,室温条件下反应6 h,以高产率(93%)得到5-碘代-1,2,3-三氮唑(22)(图6)。作者在进一步筛选配体时发现,当加入5 mol%的TTTA(三[(1-叔丁基-1H-1,2,3-三氮唑-4-基)甲基]胺)后,反应时间可缩短为45 min,并且产率不受影响(93%)。
之后,基于1-碘代内炔的CuAAC反应被陆续改良。为了简化添加剂的数量,美国佛罗里达州立大学的Zhu课题组[11],采用1-碘代内炔23与2-(叠氮基甲基)吡啶(24)反应,在不添加额外配体的情况下(例如上文提到的三乙胺或者 TTTA),仅用催化量的铜,在四氢呋喃溶剂中反应4 h,即可得到5-碘代三氮唑(25)(产率90%)。根据作者的解释,可能是吡啶上的氮原子充当了内置配体的角色,使得反应顺利进行(图7)。
2017年,郑州大学Chang等[12]从3-溴炔丙酸乙酯(26)和β-脱氧核糖基叠氮(27)出发,以良好的收率(60%)制备了相应的5-溴代-1,2,3-三氮唑(28),该化合物是一种具有抗病毒、抗肿瘤活性的氮杂贝壳杉烷类似物(图8)。
2019年,新加坡材料工程研究所Beer等[13]报道,将碘化亚铜替换为六氟磷酸四乙腈铜,可将CuAAC反应用于构建大环烷烃类复杂结构(图9)。通过1-碘代内炔(29)生成的折叠体受体(31),由于其含有的卤键,可用于识别水中的阴离子。
除了使用1-卤代内炔之外,也可以使用1-金属基内炔与叠氮类化合物反应构建标题化合物。2009年,美国凯斯西储大学Gray课题组[14]报道了N-杂环卡宾配合的1-金(Ⅰ)内炔(32)与苄基叠氮反应(图10a),使用10 mol%的六氟磷酸四乙腈铜作催化剂,在乙腈溶剂中室温反应12 h,即可得到5-金代-1,2,3-三氮唑(34)(产率23%~96%)。2010年,法国巴黎笛卡尔大学Micouin课题组[15]从1-二甲基铝内炔(35)出发,使用碘化亚铜作催化剂,PMDETA(五甲基二乙烯三胺)作为碱,在甲苯中室温反应48 h,得到了5-铝代-1,2,3-三氮唑(36)(产率92%)。再加入亲电试剂如NCS、NBS、或碘单质后,可将三氮唑5号位取代基转换为卤原子,进而得到一系列5-卤代三氮唑(图10b)。

图1 含有全取代1,2,3-三氮唑片段的化合物
Fig.1 Compounds containing full substituted 1,2,3-triazole moieties
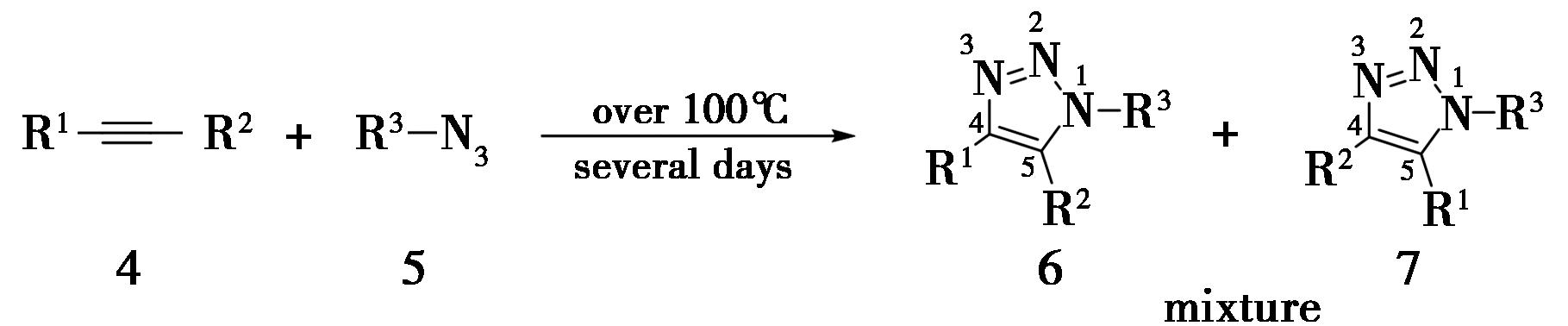
图2 Huisgen环加成反应
Fig.2 Huisgen cycloaddition reaction
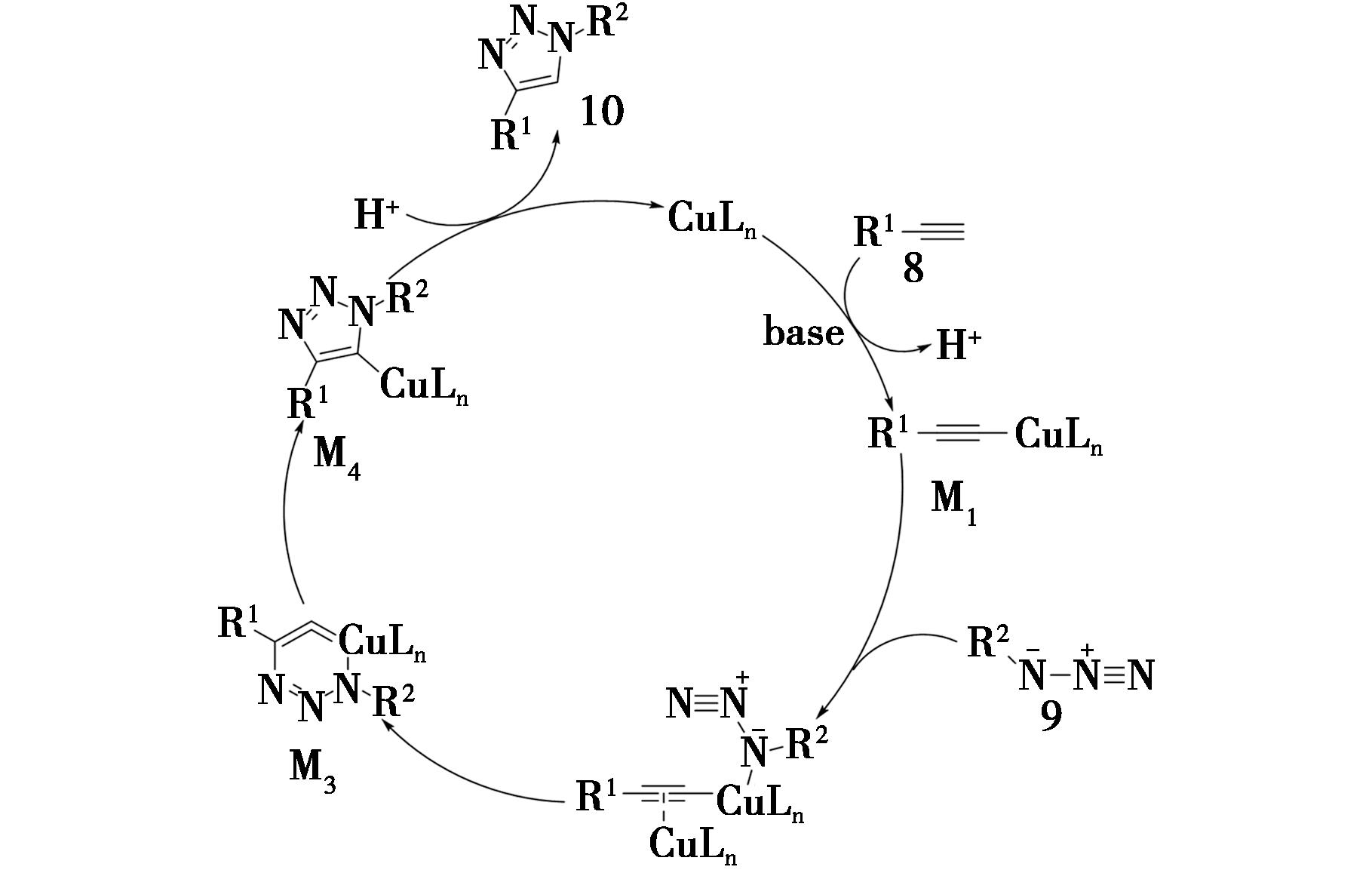
图3 CuAAC反应机理
Fig.3 CuAAC reaction mechanism
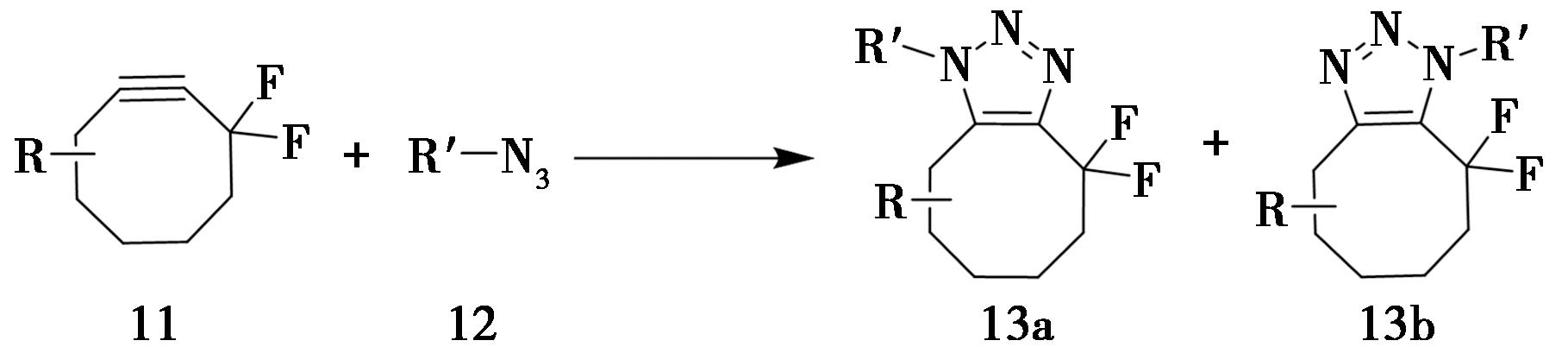
图4 环状炔烃参与的无金属催化环加成反应
Fig.4 Metal-free cycloaddition reactions involving cyclic alkynes
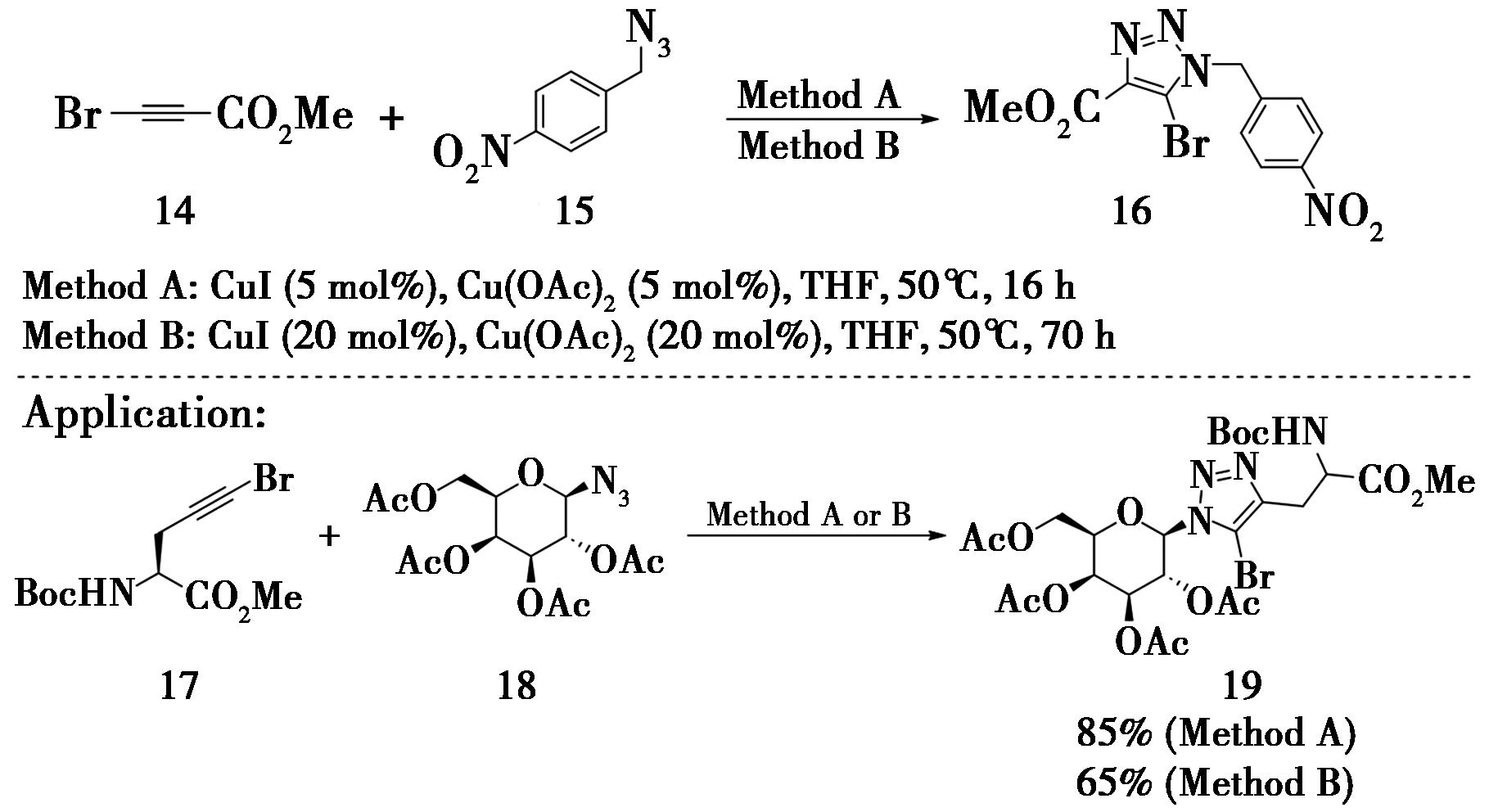
图5 溴代丙炔酸甲酯构建5-溴代-1,2,3-三氮唑
Fig.5 Construction of 5-bromo-1,2,3-triazole by methyl bromopropioate
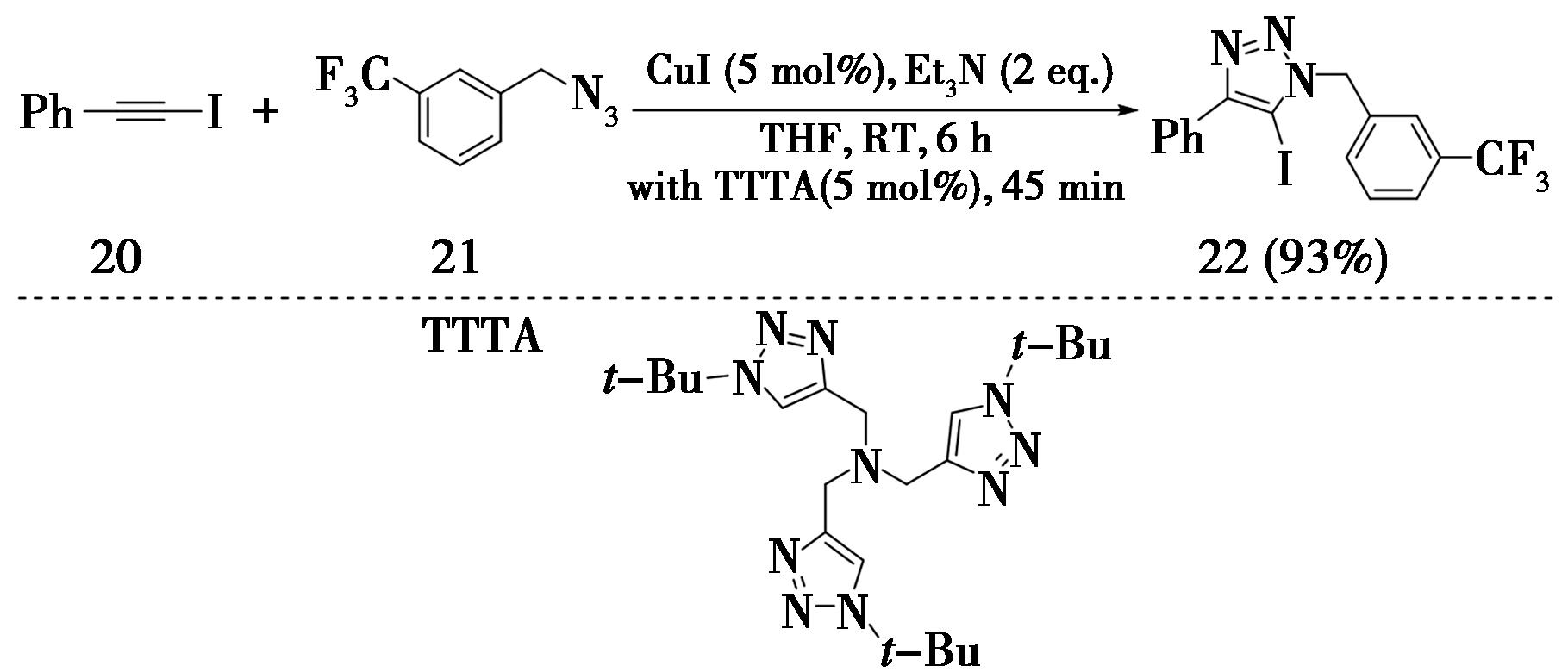
图6 1-碘代内炔合成5-碘代-1,2,3-三氮唑
Fig.6 Synthesis of 5-iodo-1,2,3-triazoles from 1-iodo-enynes
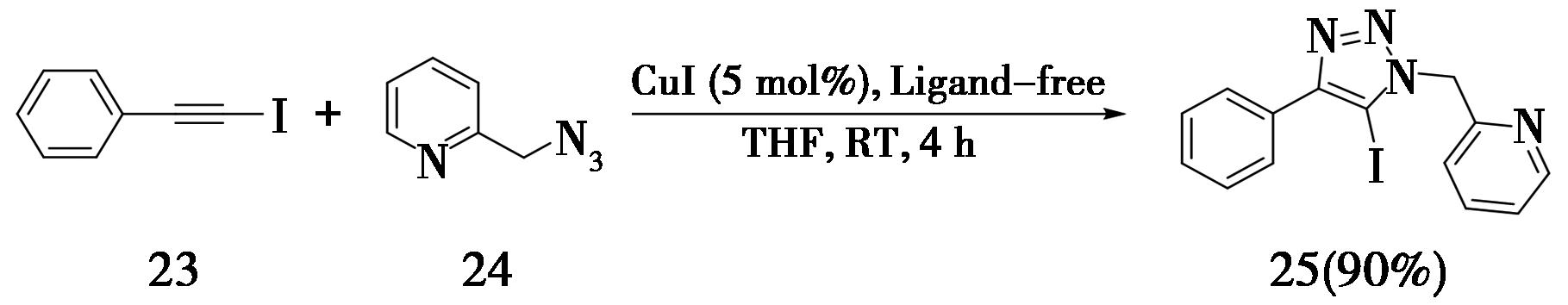
图7 无配体合成5-碘代三氮唑
Fig.7 Ligand-free synthesis of 5-iodotriazole
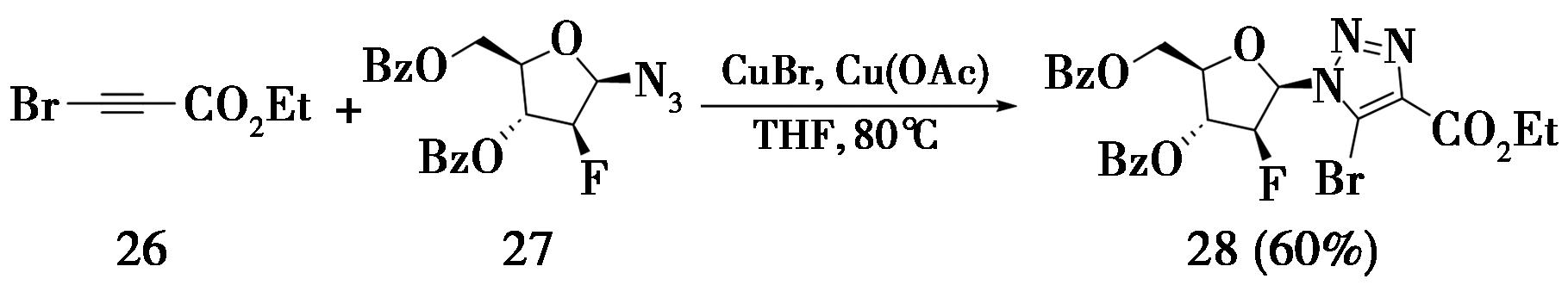
图8 β-糖基叠氮和3-溴炔丙酸乙酯反应
Fig.8 Reaction of β-glycosyl azide with ethyl 3-bromopropionate
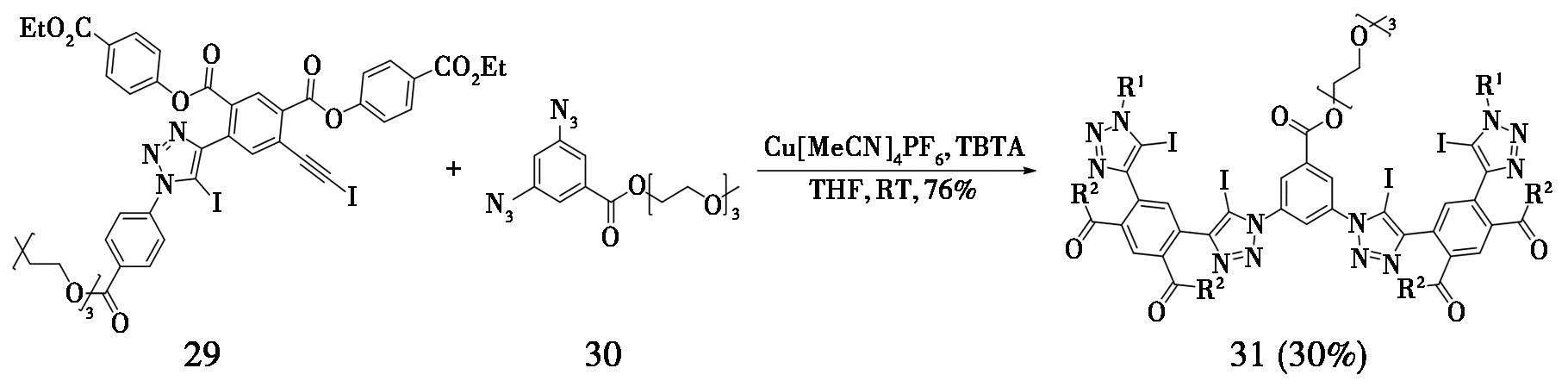
图9 碘代内炔合成折叠体受体
Fig.9 Synthesis of folding receptor by iodoalkynes
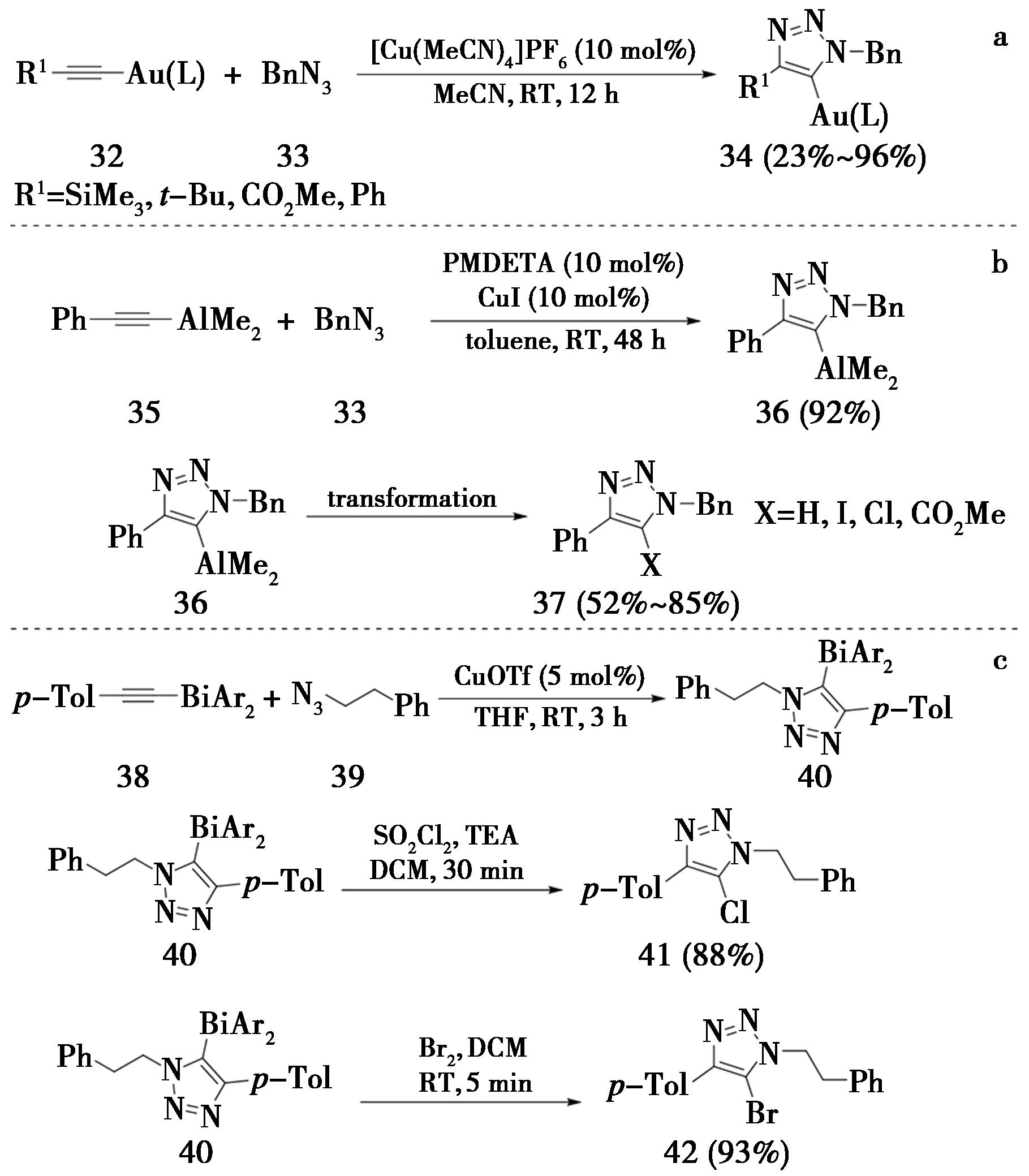
图10 1-金属内炔发生CuAAC反应
Fig.10 CuAAC reaction of 1-metallated internal alkynes
2013年,美国斯克利普斯研究所Fokin课题组[16],从稳定易得的1-铋(Ⅲ)内炔(38)出发,采用三氟甲磺酸亚铜作催化剂,在四氢呋喃溶剂中室温反应3 h,得到了5-铋代-1,2,3-三氮唑(40)。该方法条件简单且不需要复杂配体,并且后续可与二氯亚砜或者液溴反应,得到5-卤代-1,2,3-三氮唑(图10c)。
某些类金属内炔也可以在铜的催化下发生CuAAC反应。2013年,巴西圣保罗大学Stefani课题组[17]报道了1-碲代内炔(43)和叠氮类化合物在碘化亚铜的催化下,以PMDETA为配体,在四氢呋喃溶剂中室温反应20 min,即可得到5-碲代-1,4,5-三取代-1,2,3-三氮唑(44)(产率83%)。并且化合物44可以继续发生Sonogashira偶联,将三氮唑5号位取代基转换为炔基(图11)。
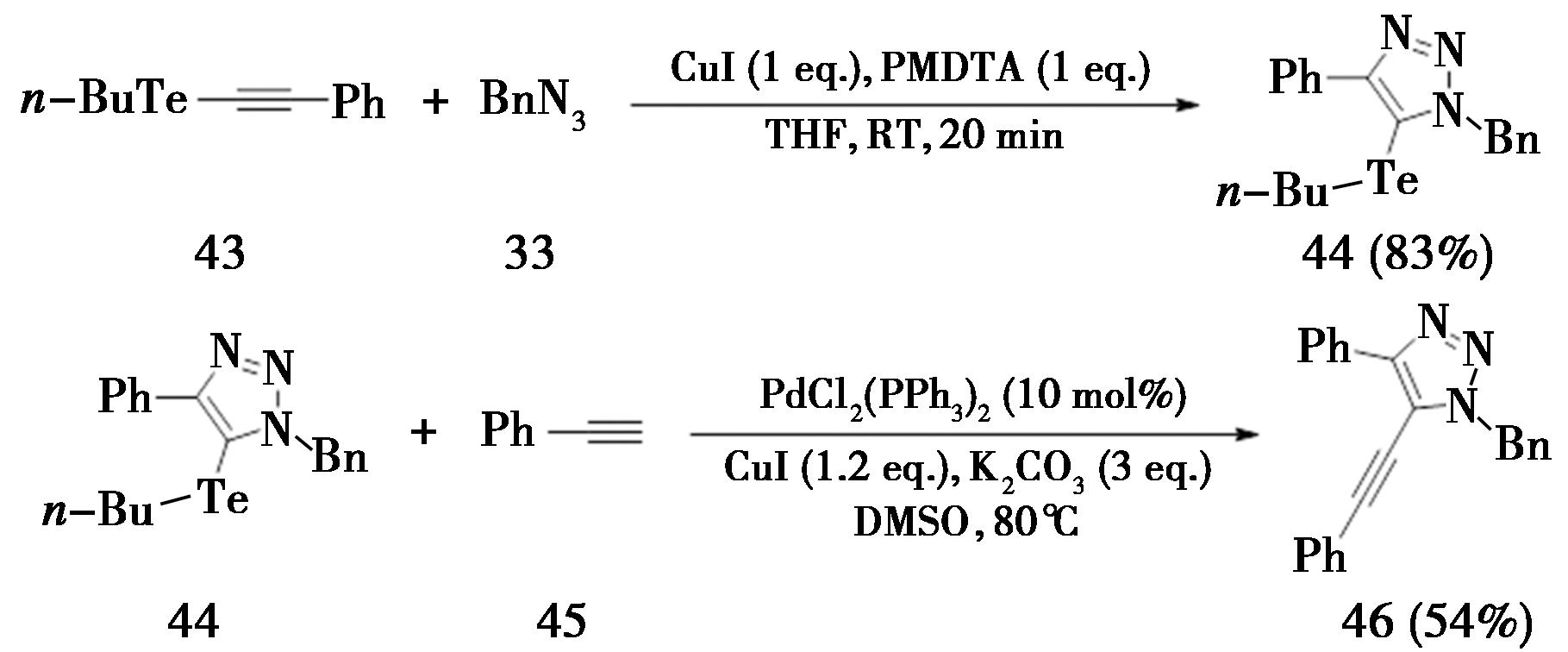
图11 CuAAC合成5-碲代-1,2,3-三氮唑
Fig.11 Synthesis of 5-tellurium-1,2,3-triazole by CuAAC
2016年,日本爱知学院大学Yasuike课题组[18]报道了1-锑代内炔(48)与叠氮类化合物的CuAAC反应,使用5 mol%的溴化亚铜的催化,在四氢呋喃溶剂中60 ℃反应5 h,即可得到5-锑代-1,2,3-三氮唑(49)(图12)。此外,该课题组[19]进一步在体系中加入苯基锂,通过锑(Sb)-锂(Li)交换反应,原位生成5-锂代三氮唑,再与 1,2-二碘乙烷反应得到5-碘代三氮唑(49)。
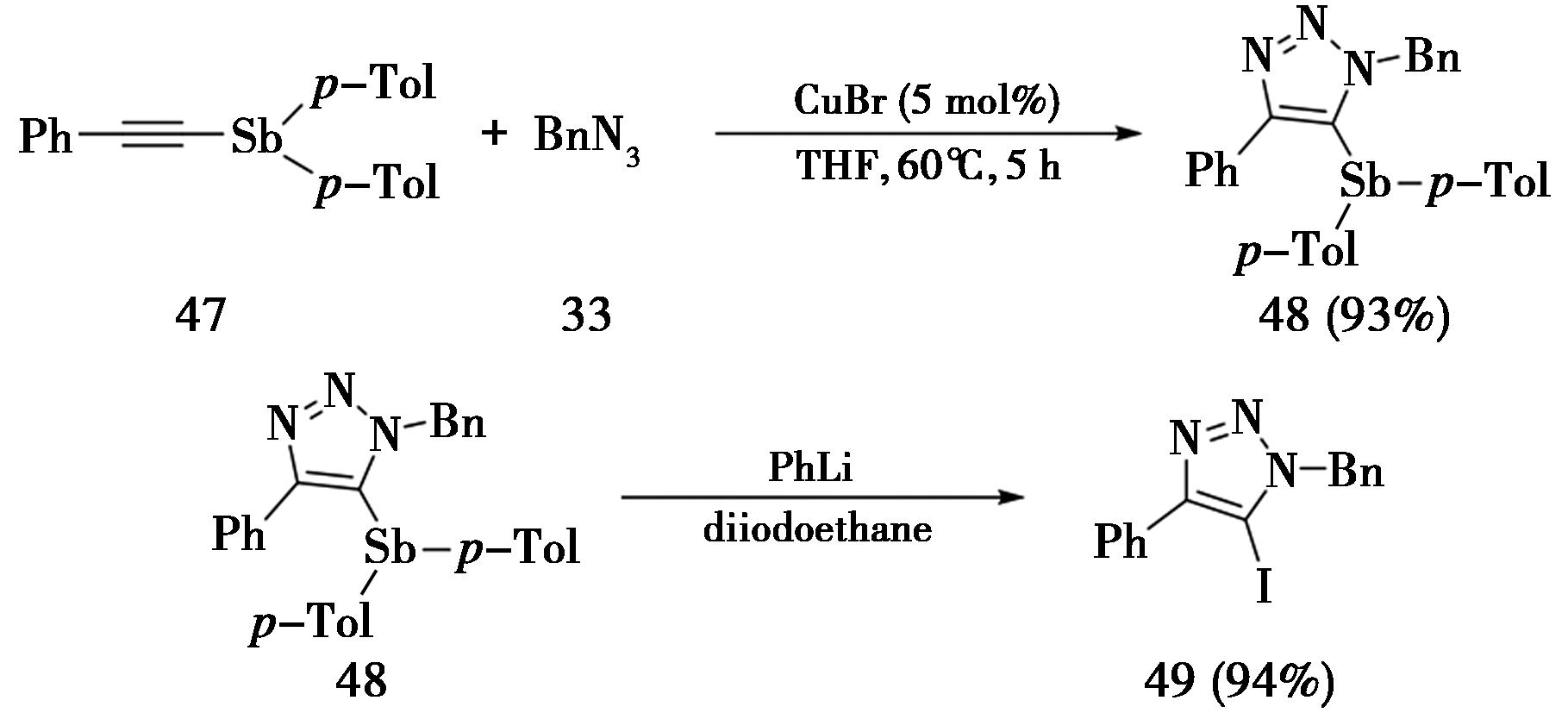
图12 CuAAC合成5-锑代-1,2,3-三氮唑
Fig.12 Synthesis of 5-stibano-1,2,3-triazole by CuAAC
1.2.1 钌催化叠氮-炔烃环加成反应
2005年,由香港科技大学贾国成和美国斯克利普斯研究所Fokin课题组[20]报道使用过渡金属钌催化内炔合成三氮唑,即钌催化叠氮-炔烃环加成反应(Ruthenium-catalyzed Azide Alkyne Cycloaddition,简称RuAAC),如图13所示。以 1 mol%的Cp*Ru(PPh3)2Cl作为催化剂,苯为溶剂,使二苯基乙炔(50)与苄基叠氮(33)在回流条件下反应2 h,即得到标题化合物(51)。如若不使用钌催化剂,该反应几乎不发生。
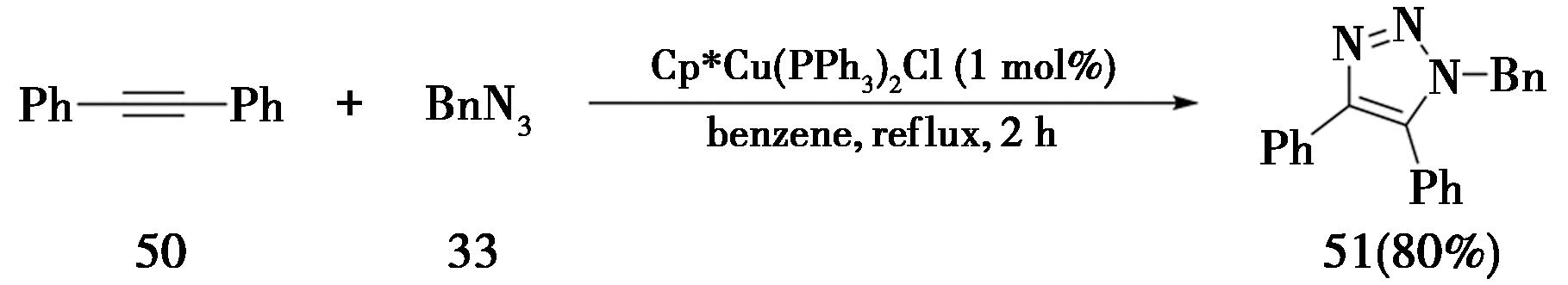
图13 钌催化内炔合成三氮唑
Fig.13 Ruthenium-catalyzed synthesis of triazole from internal alkynes
2014年,美国斯克利普斯研究所Fokin课题组[21]报道了钌催化1-卤代内炔和烷基叠氮化合物之间的RuAAC反应,高区域选择性地生成5-卤代-三氮唑(图14)。该反应可以在室温有氧条件下进行。
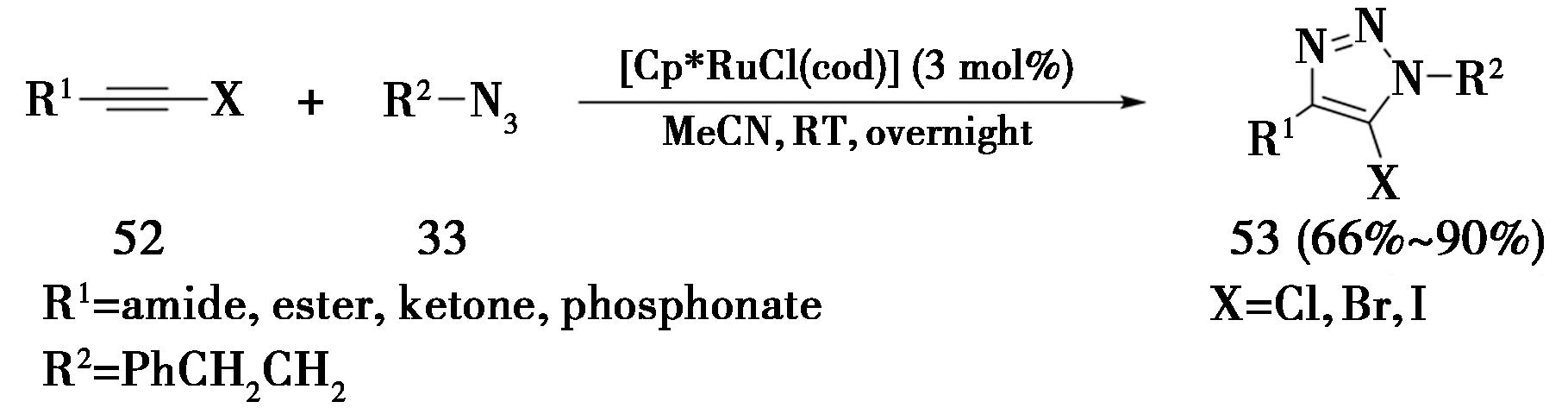
图14 钌催化1-卤代内炔合成1,4,5-三取代-
1,2,3-三氮唑
Fig.14 Ruthenium-catalyzed synthesis of 1,4,5-
trisubstituted-1,2,3-triazoles from 1-halogenated internal alkynes
2015年,意大利锡耶纳大学Taddei课题组[22]报道了在[Cp*RuCl]4的催化下,N-Boc-炔基酰胺(55)可以与叠氮化合物发生RuAAC反应,以绝对区域选择性生成了5-氨基-4-羧酸酯基-1,2,3-三氮唑(56),其可用于制备基于三氮唑骨架的拟肽分子。此外,4号位的羧酸酯基和5号位的Boc基团都能进一步转化为相应的酰胺基团(图15)。
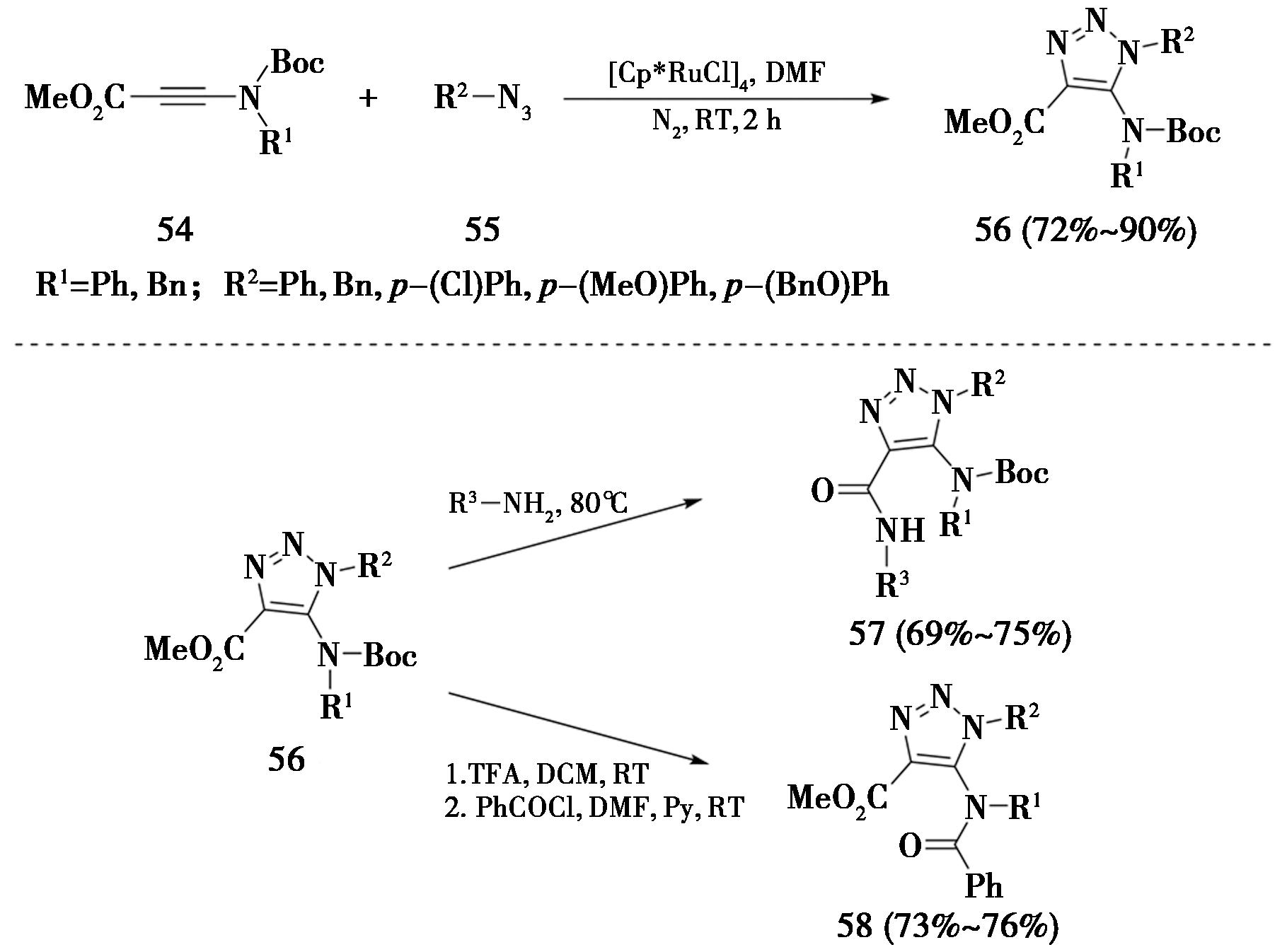
图15 RuAAC合成5-氨基-4-羧酸酯基-1,2,3-三氮唑
Fig.15 Synthesis of 5-amino-4-carboxylate-1,2,3-triazole by RuAAC
2019年,大连理工大学Song课题组[23]报道了硫氰基内炔与叠氮类化合物的RuAAC反应,采用Cp*Ru(COD)Cl为催化剂,在四氢呋喃溶液中室温反应12~24 h,得到5-硫氰基-1,4,5-三取代-1,2,3-三氮唑(61a),区域选择性>20∶1。得到的产物可以进一步与格氏试剂反应,转化为各种5-硫代-三氮唑(62);此外可以将硫原子氧化为亚砜类化合物(图16)。
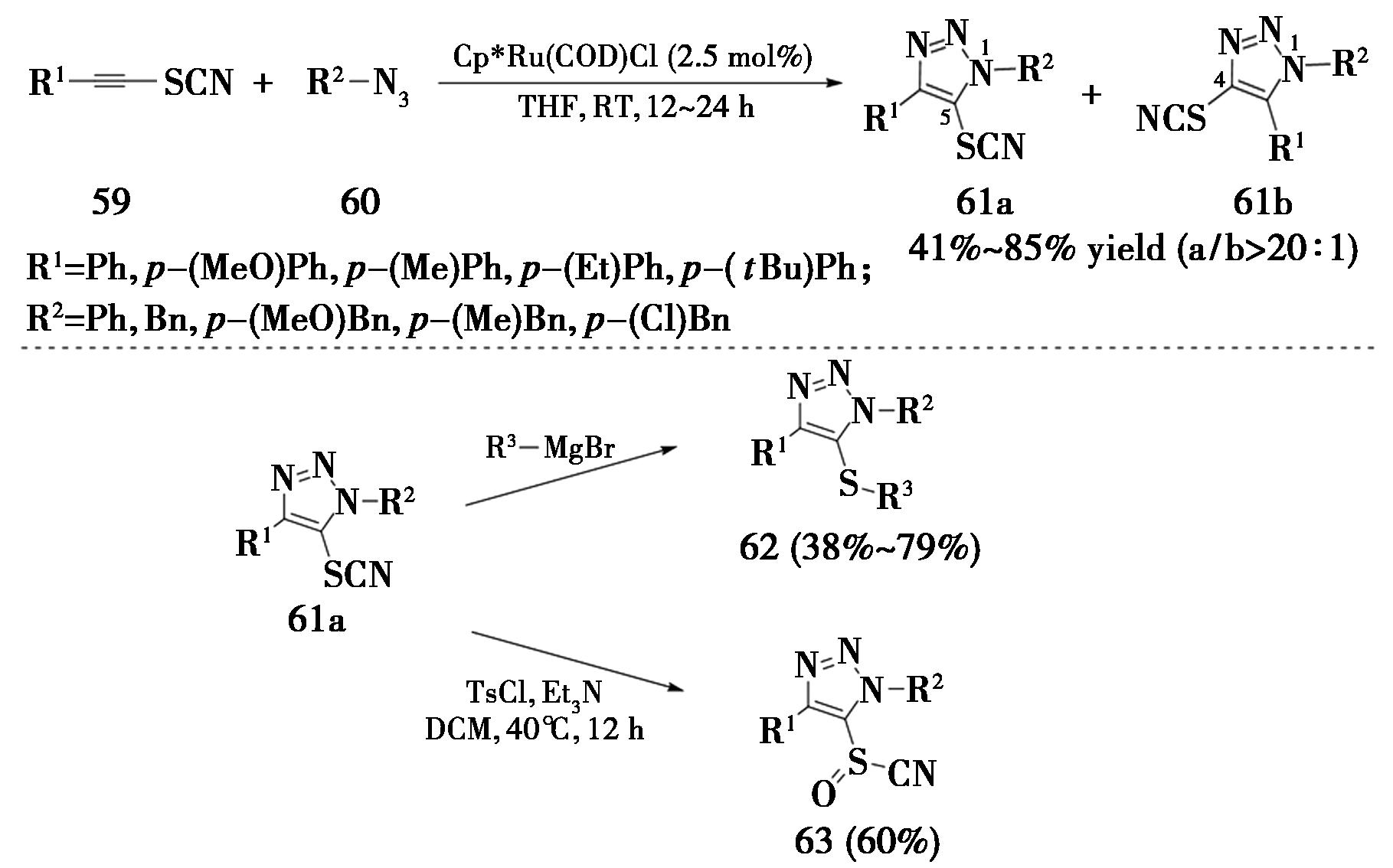
图16 硫氰基内炔发生RuAAC反应
Fig.16 RuAAC reaction of thiocyanoalkynes
1.2.2 铱催化叠氮-炔烃环加成反应
2013年,法国原子能委员会Taran课题组[24]中,首次报道了铱催化的1-溴代内炔与叠氮化合物的环加成反应,高区域选择性地合成了4-溴代-1,4,5-三取代-1,2,3-三氮唑,即铱催化叠氮-炔烃环加成反应(Iridium-catalyzed Azide Alkyne Cycloaddtion,简称IrAAC)。该方法采用[Ir(cod)OMe]2作为催化剂,二氯甲烷为溶剂,在室温条件下反应15 h,产率为20%~94%。该方法的得到的产物66可以进一步发生Suzuki偶联反应,制备4-芳基-1,2,3-三氮唑(图17)。值得注意的是,在上述条件下,1-碘代内炔不参与反应,1-氯代内炔的反应活性很低,只有使用含有给电子取代基的溴代炔烃能得到较好的结果。
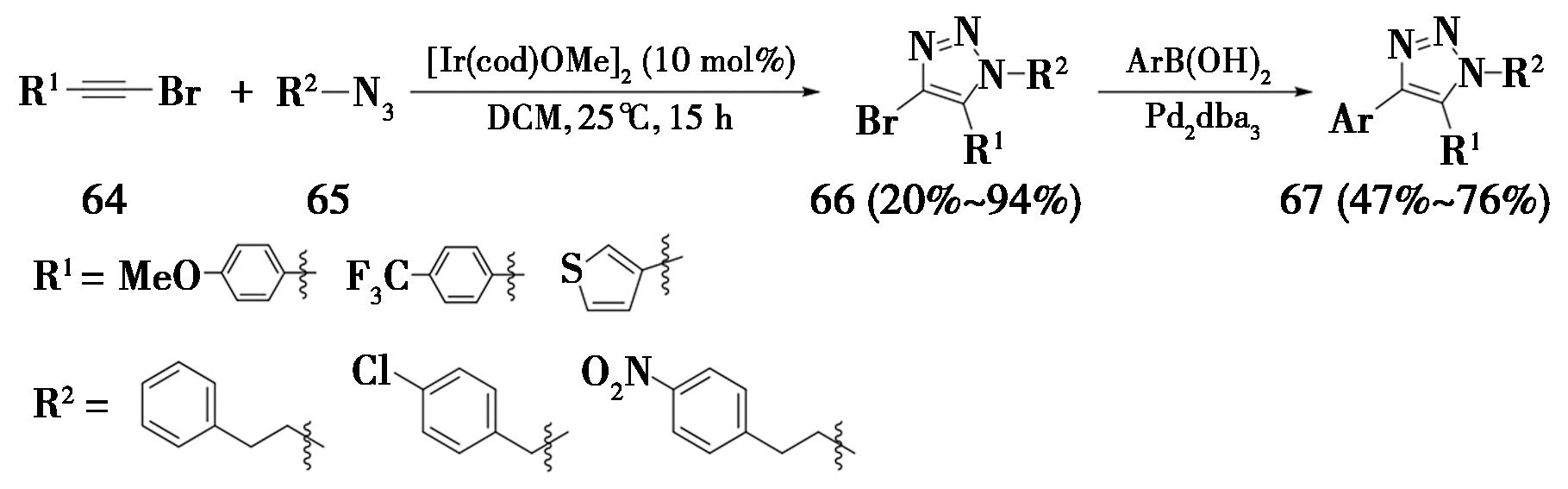
图17 1-溴内炔发生IrAAC反应
Fig.17 IrAAC reaction of 1-bromoalkynes
2014年,香港科技大学Sun课题组[25]报道了一种铱催化的富电子内炔的叠氮-炔烃环加成反应,高效实现1-硫代内炔与叠氮化合物的分子间环加成反应。采用[Ir(cod)Cl]2作为催化剂,二氯甲烷作为溶剂,在氮气保护下室温反应,产率为22%~99%(图18)。
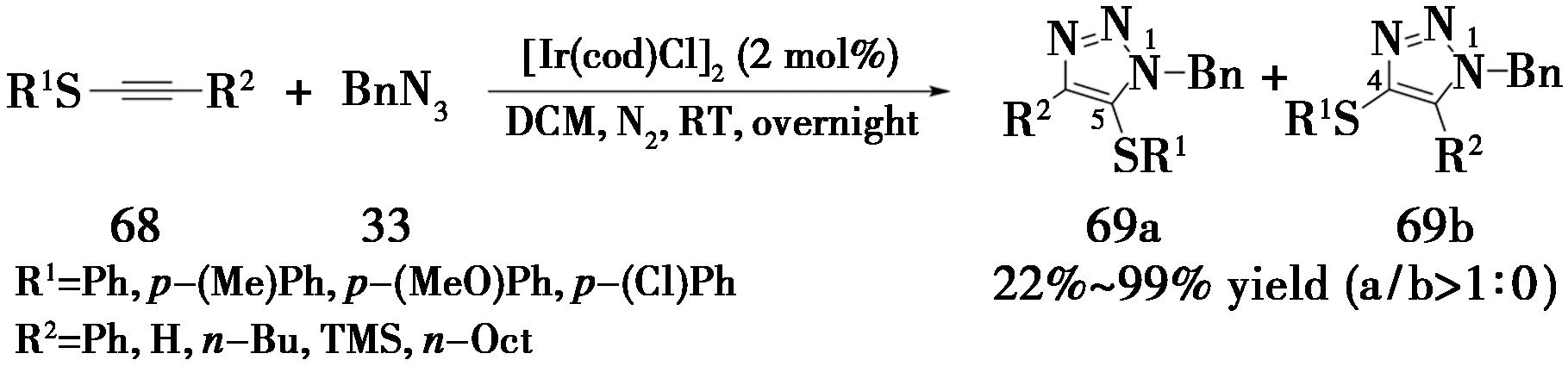
图18 硫代内炔发生IrAAC反应
Fig.18 IrAAC reaction of thio-alkynes
2017年,大连理工大学Song课题组[26]报道了一种在温和条件下,通过铱催化的叠氮-内炔胺环加成反应高区域选择性地合成5-酰胺基-1,2,3-三氮唑的方法。反应条件为,采用[Ir(cod)Cl]2作为催化剂,室温下在二氯甲烷或者水中反应 12 h即可实现该反应。由于铱离子对水氧不敏感,该方法可在水中和有氧条件下进行(图19a)。在此基础上,2020年,该课题组[27]报道了在水相中,铱催化二硫基内炔与叠氮化合物的IrAAC反应。催化剂仍然是[Ir(cod)Cl]2,在室温和有氧条件下,以水为溶剂反应12~24 h,高区域选择性地得到了5-二硫基-1,2,3-三氮唑(图19b)。
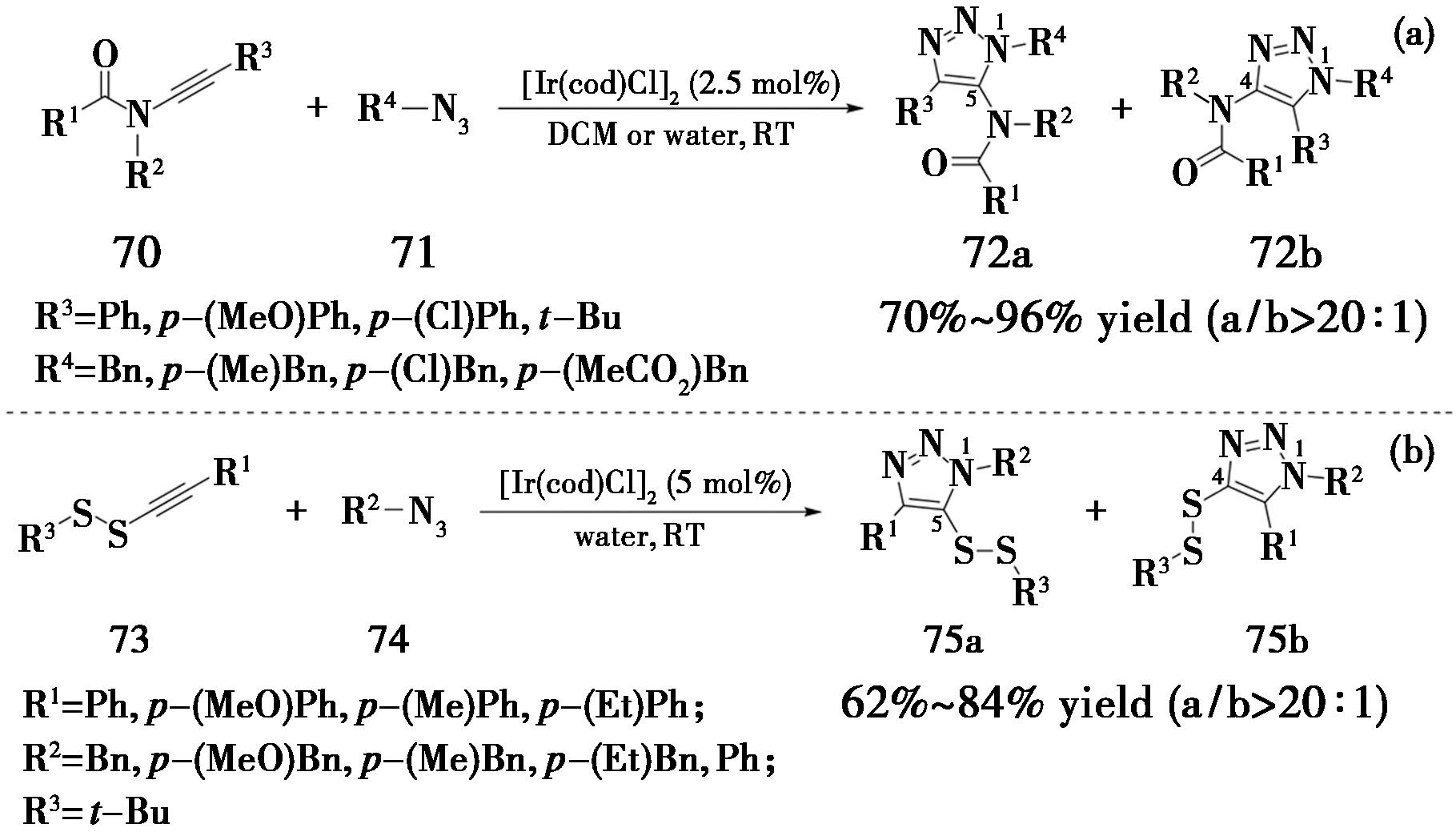
图19 内炔酰胺或二硫基内炔的IrAAC反应
Fig.19 IrAAC reaction of internal ynamides or dithio-alkynes
1.2.3 铑催化叠氮-炔烃环加成反应
2017年,中国科学院福建物质结构研究所Huang课题组[28]报道了铑催化内炔胺与苄基叠氮的环加成反应(图20),即铑催化叠氮-炔烃环加成反应(Rhodium-catalyzed Azide Alkyne Cycloaddtion,简称RhAAC)。该方法采用[Rh(CO)2Cl]2为催化剂,乙腈为溶剂,在敞口反应瓶中室温反应,可得到5-氨基三氮唑(产率80%~95%)。
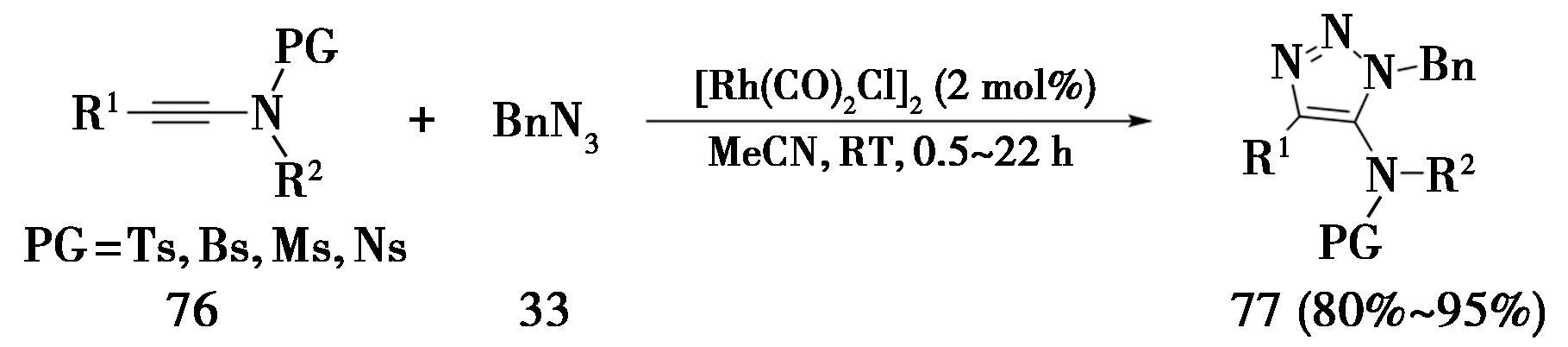
图20 内炔酰胺发生RhAAC反应
Fig.20 RhAAC reaction of ynamides
2018年,大连理工大学Song课题组[29]报道了一种在温和条件下,铑(Ⅰ)催化的叠氮-炔烃环加成反应,以炔基膦酸酯为原料高区域选择性地合成了4-膦酸酯基-1,2,3-三氮唑。该方法采用[Rh(CO)2Cl]2作为催化剂,以二氯甲烷为溶剂,在40 ℃条件下反应12 h,产率高达94%,区域选择性>20∶1。该方法具有底物适用范围广、官能团耐受性好、产率高和区域选择性好等优点(图21a)。同年,该课题组报道了区域多样性导向的铑(Ⅰ)催化的叠氮-炔烃环加成反应,在温和条件下高区域选择性制备4-磺酰基-或5-磺酰基-1,2,3-三氮唑[30]。该方法通过控制不同化学价的硫(Ⅱ)或硫(Ⅵ),可以有效地控制RhAAC反应的区域选择性,以优异的1,4或1,5区域选择性得到了相应的磺酰基三氮唑(图21b)。随后,该课题组发展了一种在铑(Ⅰ)催化下,以内炔基三氟甲基硫醚或内炔基硫/硒醚为原料,以优异区域选择性得到全取代的5-三氟甲硫基-1,2,3-三氮唑或5-硫/硒代-1,2,3-三氮唑化合物的方法[31](图21c)。
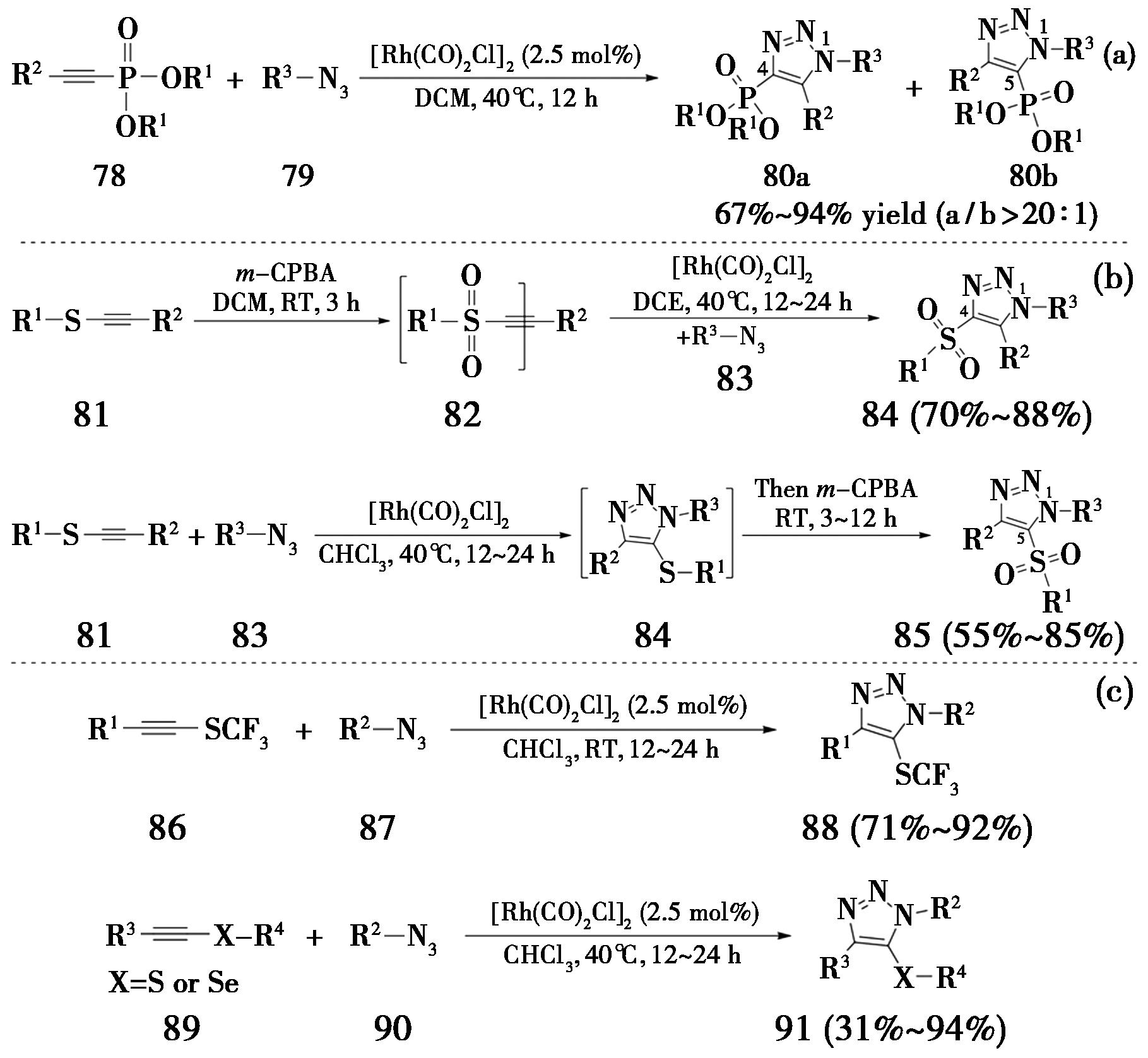
图21 内炔基膦酸酯或硫/硒代内炔的RhAAC反应
Fig.21 RhAAC reactions of internal alkynylphosphonates or thio-/seleno-internal alkynes
2005年,中国科学院上海有机化学研究所Wu课题组[32]报道了通过引入亲电试剂制备5-碘代三氮唑化合物(95)的方法(图22)。最佳反应条件为,CuI为催化剂,ICl为亲电试剂,三乙胺为碱,在四氢呋喃溶剂中室温反应20 h,即可得到5-碘代-1,4,5-三取代-1,2,3-三氮唑。除了ICl作为亲电试剂,还采用了烯丙基溴、苯甲酰氯、乙酰氯作为亲电试剂,得到5-烯丙基或酰基取代的三氮唑。该方法存在的缺点是使用了1 equiv的CuI,因为在反应过程中产生的H+与其他亲电试剂发生竞争反应,为了生成足够的5-铜-三氮唑中间体,需要加入化学计量的一价铜催化剂。
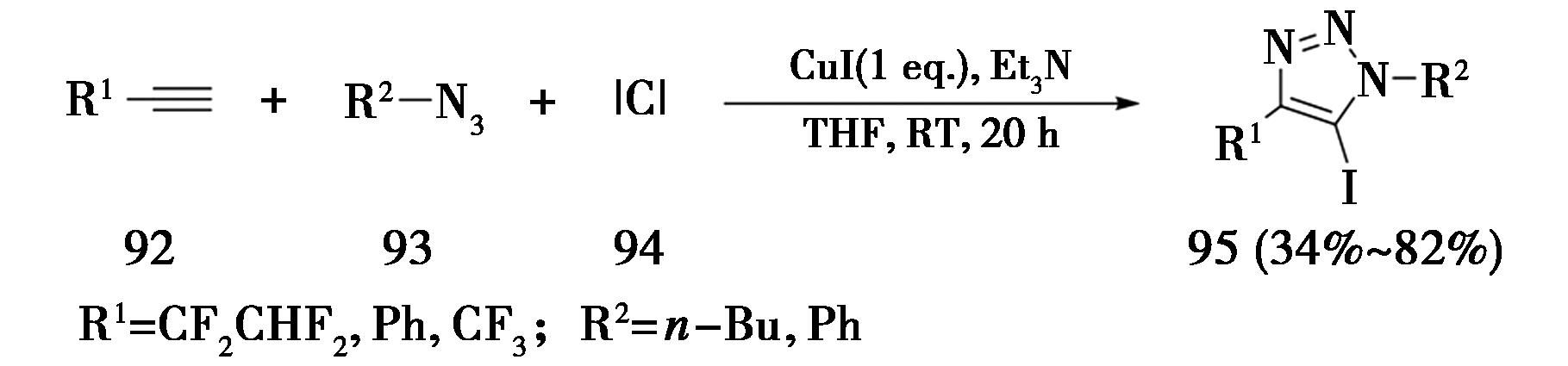
图22 端炔构建5-碘代三氮唑
Fig.22 Construction of 5-iodotriazole by terminal alkynes
2010年,美国得克萨斯克里斯汀大学Dzyuba课题组[33]报道了化学计量的CuI促进的端炔与叠氮化合物的CuAAC反应,得到5-碘代-三氮唑(图23a)。经过条件筛选,DMAP(N,N-二甲基吡啶)为最佳碱,在乙腈溶剂中室温反应20 h即可得到5-碘代三氮唑。该反应的炔烃浓度必须保持低浓度(3.5 mmol/L)。随后,该方法被法国里昂第一大学Vidal课题组[34]用于合成糖原磷酸化酶抑制剂。在卤化亚铜(CuI或CuBr)催化下,端炔与乙酰化的β-D-葡萄糖基叠氮化合物发生CuAAC反应,得到相应5-溴代-和5-碘代-1-葡萄糖基-1,2,3-三氮唑。但是当使用CuCl时,并不能得到相应的5-氯代-1-葡萄糖基-1,2,3-三氮唑(图23b)。
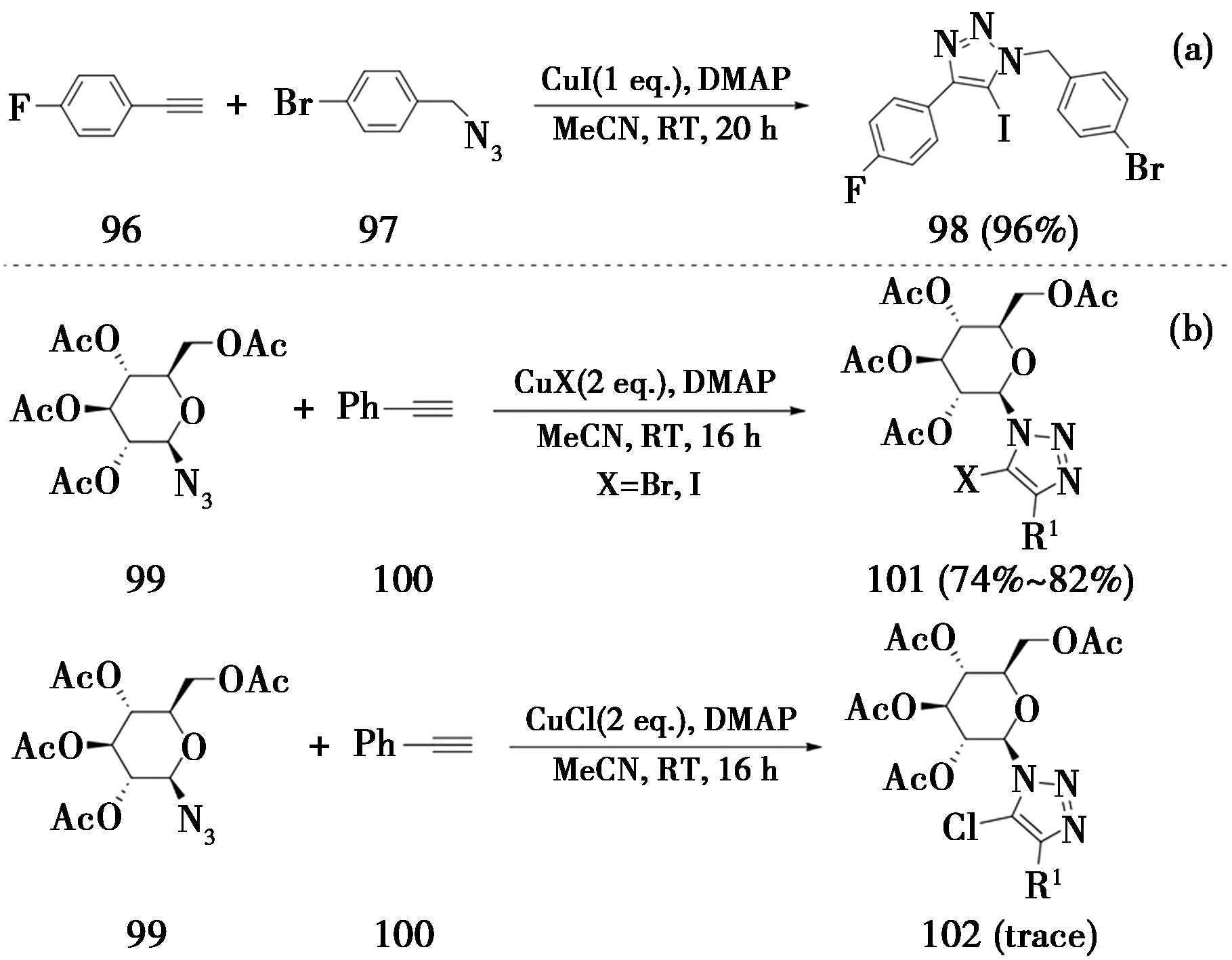
图23 卤化亚铜催化端炔发生CuAAC反应
Fig.23 Copper halide catalyzed CuAAC reaction of terminal alkynes
2008年,河南师范大学Zhang课题组[35]报道了一种通过CuI与NBS发生氧化还原反应原位生成I+,随后得到5-碘代-三氮唑的策略(图24)。经过条件优化,当端炔、CuI与NBS的投料物质的量比例为1∶1.1∶1.2时,DIPEA为碱,在四氢呋喃中室温反应3 h为最佳反应条件。CuI既可以提供一价铜离子催化CuAAC反应,产生的I-离子也可以与NBS发生氧化还原反应生成I+,因此加入的CuI与NBS都需要是化学计量的。
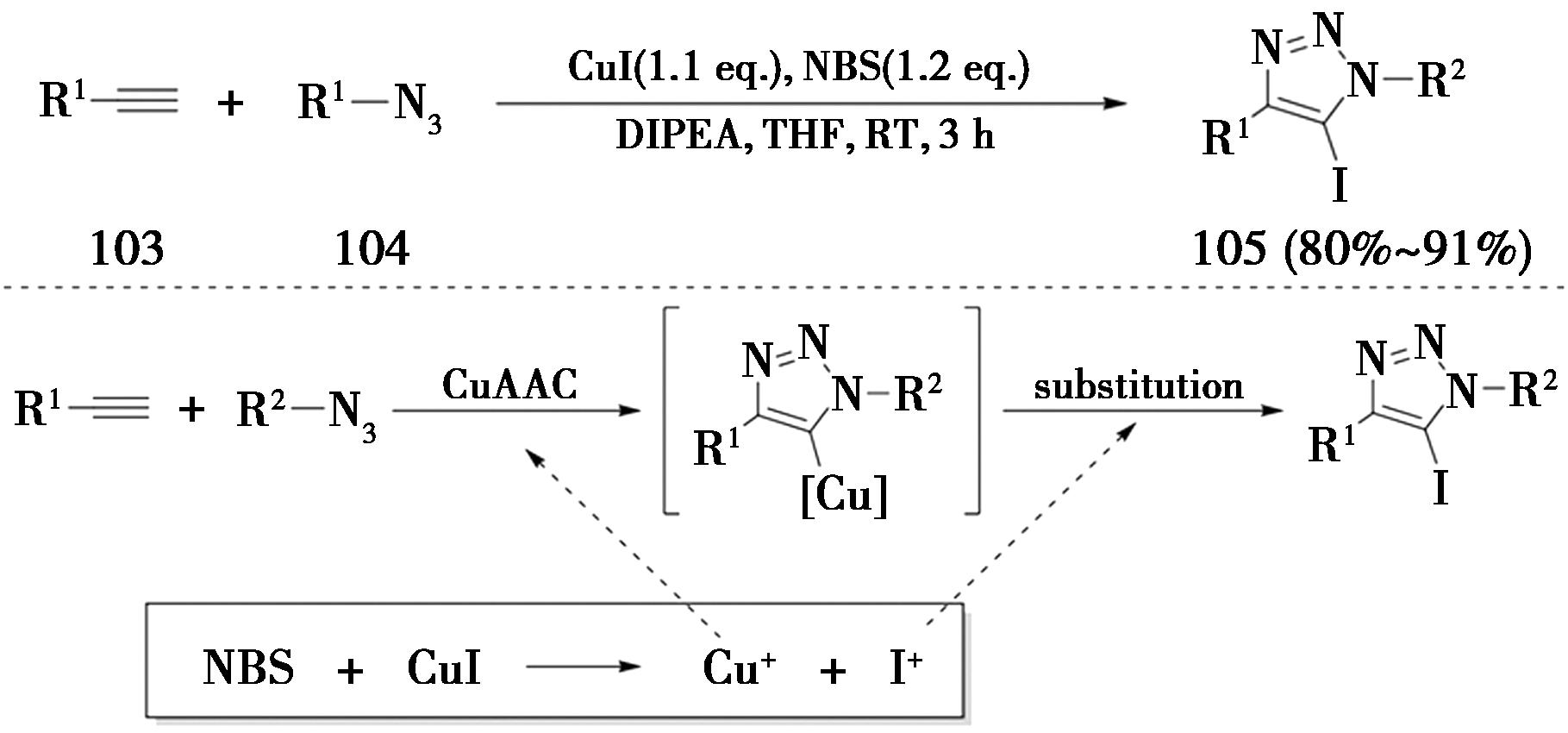
图24 氧化还原策略合成5-碘代三氮唑
Fig.24 Synthesis of 5-iodotriazole by redox strategy
随后,2013年,该课题组[36]报道了使用叔丁基二甲基氯硅烷(TBDMSCl)活化的氧化卤代反应(图25)。CuX(X=Br或I)和TBDMSCl在室温有氧条件下氧化生成了卤单质(I2、Br2),随后与5-铜-三氮唑中间体反应,得到了5-卤代三氮唑。
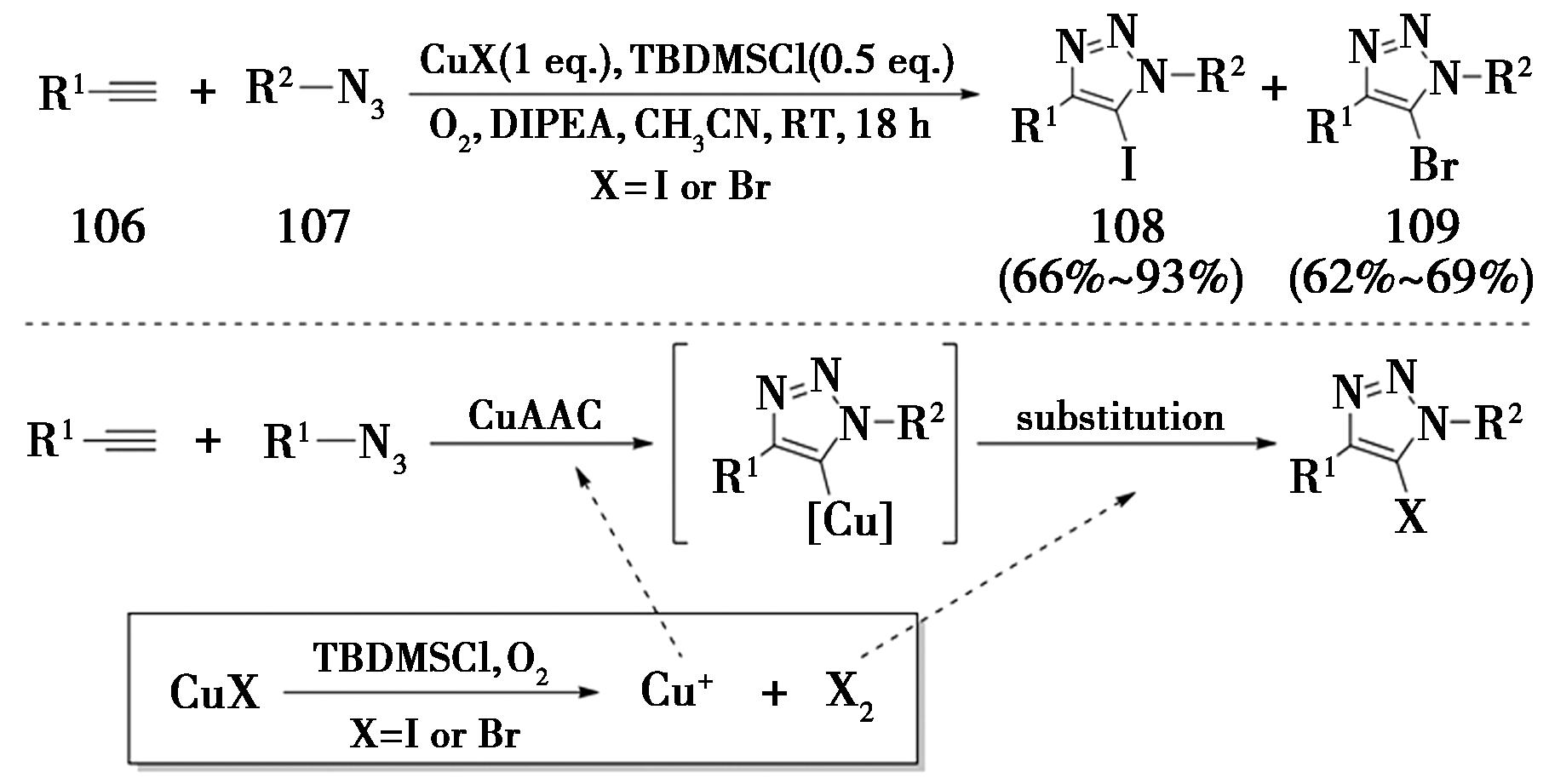
图25 氧化-卤代策略合成5-卤代三氮唑
Fig.25 Oxidative-halogenation reaction strategy for the synthesis of 5-halotriazoles
2006年,美国斯克利普斯研究所Fokin课题组[37]报道了端炔与磺酰基叠氮发生的CuAAC反应,生成的5-铜-三氮唑中间体可以被烯丙基碘捕获,生成5-烯丙基-1,2,3-三氮唑(图26)。该反应需要使用化学计量的CuBr,以2,6-二甲基吡啶为碱,在乙腈溶剂中室温反应48 h,最终产率为51%。2007年,美国威斯康辛大学麦迪逊分校Hsung等[38]也报道了类似的反应制备生成5-烯丙基-1,2,3-三氮唑。
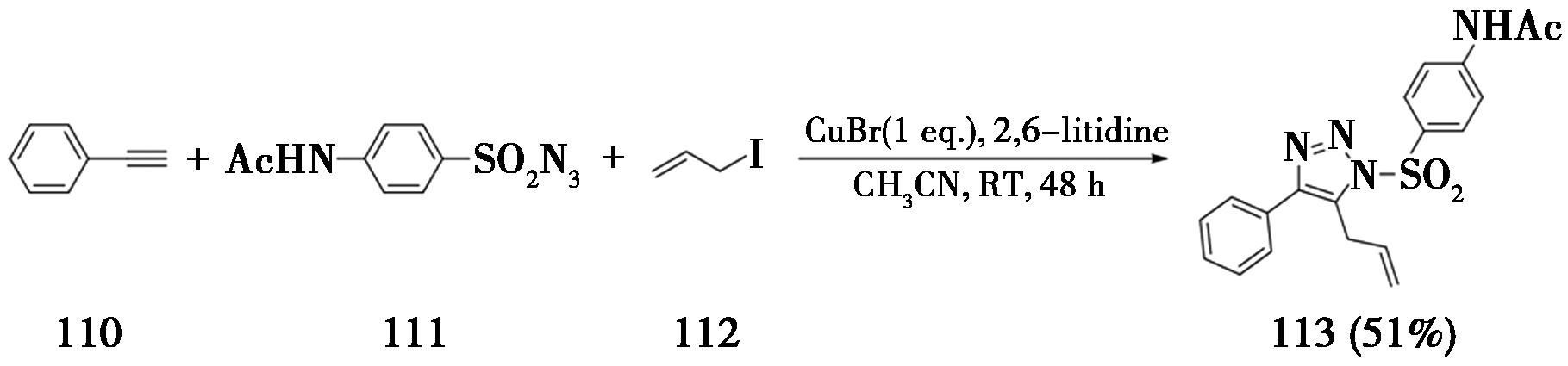
图26 通过端炔合成5-烯丙基-1,2,3-三氮唑
Fig.26 Synthesis of 5-allyl-1,2,3-triazole from terminal alkynes
2008年,德国哥廷根大学Ackermann课题组[39]报道了一锅法四组分反应合成5-芳基-1,2,3-三氮唑(图27)。该反应第一步加入的卤代烃与NaN3反应原位生成了烷基叠氮或者芳基叠氮,随后与端炔发生CuAAC反应,生成5-H-三氮唑;第二步在高温条件下,发生铜催化三氮唑的C—H键与芳基碘的偶联反应,得到5-芳基-1,2,3-三氮唑。
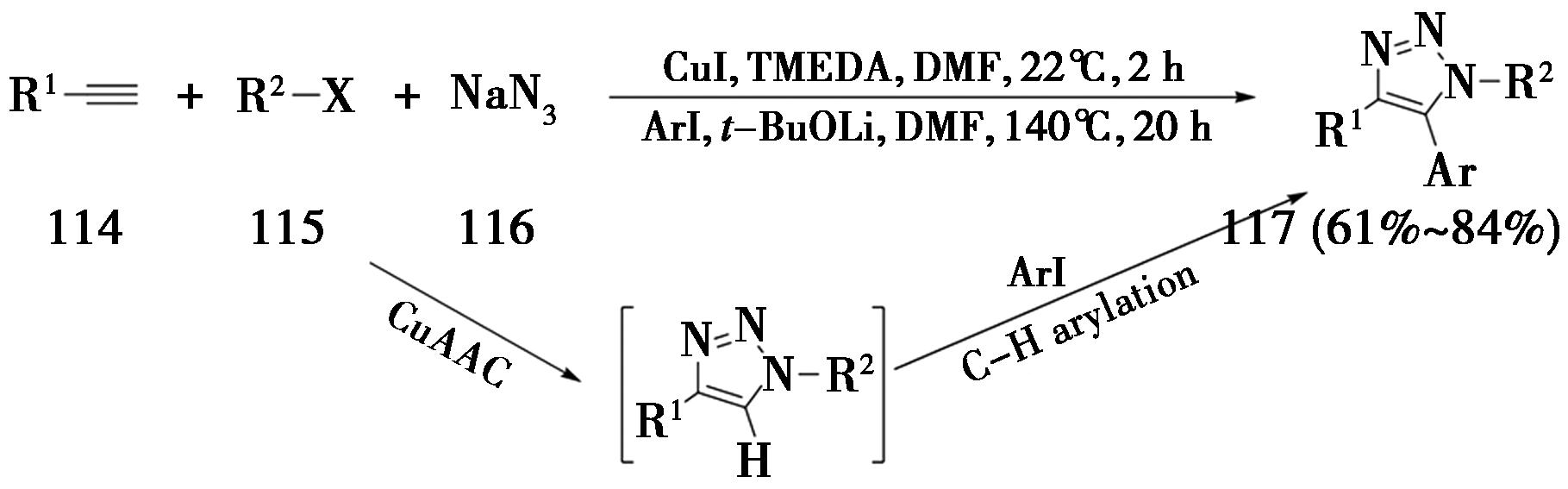
图27 一锅法四组分反应合成5-芳基-1,2,3-三氮唑
Fig.27 One-pot four-component reaction for the synthesis of 5-aryl-1,2,3-triazoles
2015年,北京大学Wang课题组[40]报道了铜催化炔烃、叠氮与磺酰腙的三组分反应(图28)。通过磺酰腙和叔丁醇锂原位生成重氮化合物,能够与5-铜-三氮唑中间体反应生成铜卡宾中间体,最后经过对铜卡宾的迁移插入和质子化反应生成标题化合物。
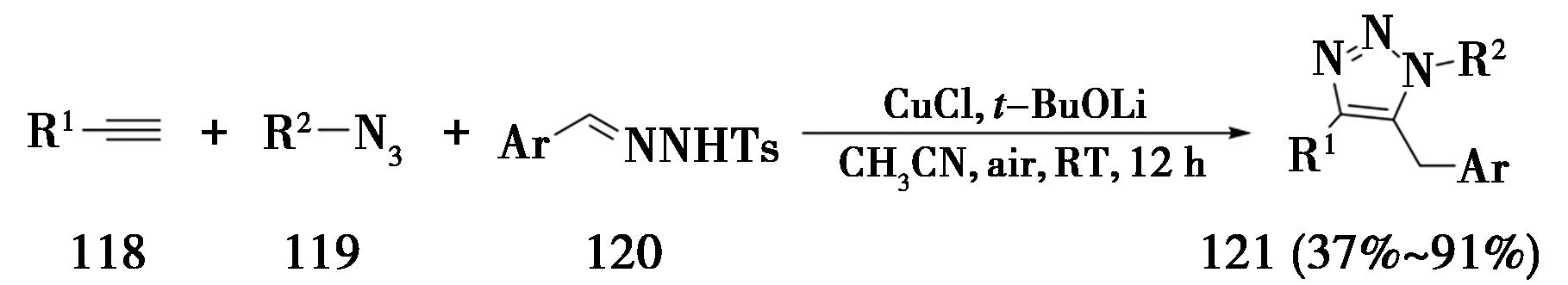
图28 炔烃、叠氮与磺酰腙的三组分CuAAC反应
Fig.28 Three-component CuAAC reactions of alkynes,azides and sulfonyl hydrazones
2017年,山东大学Xu课题组[41]报道了使用炔基溴化合物与5-铜-三氮唑中间体发生反应的策略,制备5-炔基-1,2,3-三氮唑(图29)。该反应需要在氮气保护下,以CuCl作为催化剂,叔丁醇锂作为碱,在1,2-二氯乙烷中室温反应12 h。
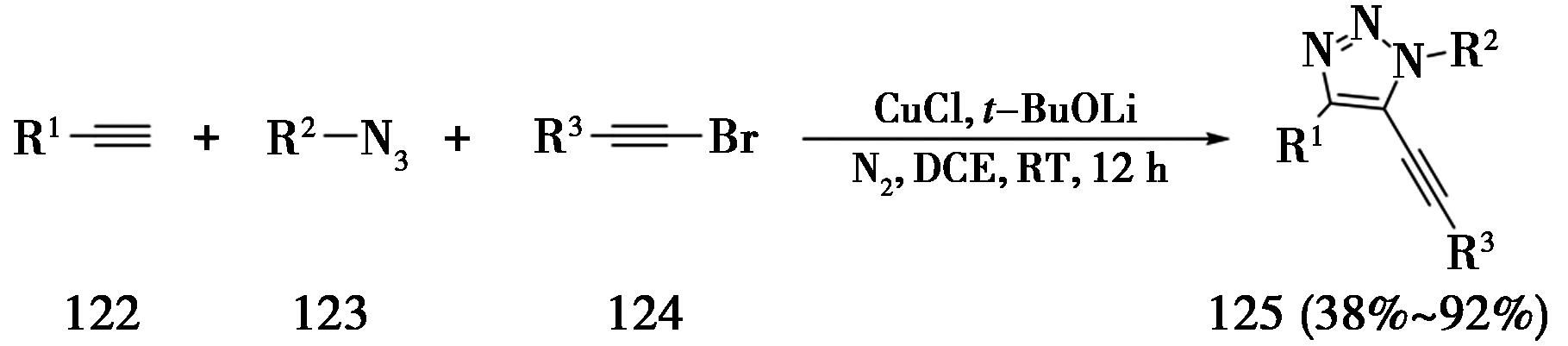
图29 炔烃、叠氮与炔基溴化物的三组分CuAAC反应
Fig.29 Three-component CuAAC reaction of alkynes,azides and alkynyl bromides
2017年,香港中文大学Tsui课题组[42]报道了炔烃、叠氮化合物与(三氟甲基)三甲基硅烷发生的三组分CuAAC反应(图30)。该策略在氩气保护下,使用CuI作为催化剂,1,10-邻菲罗啉作为配体,碳酸银作为氧化剂,三乙胺作为碱,在DMF溶剂中室温反应15 h,即可得到5-三氟甲基-1,2,3-三氮唑(129)。作者推测,碳酸银将三氟甲基负离子氧化成三氟甲基正离子,然后与5-铜三氮唑中间体发生反应生成化合物129。
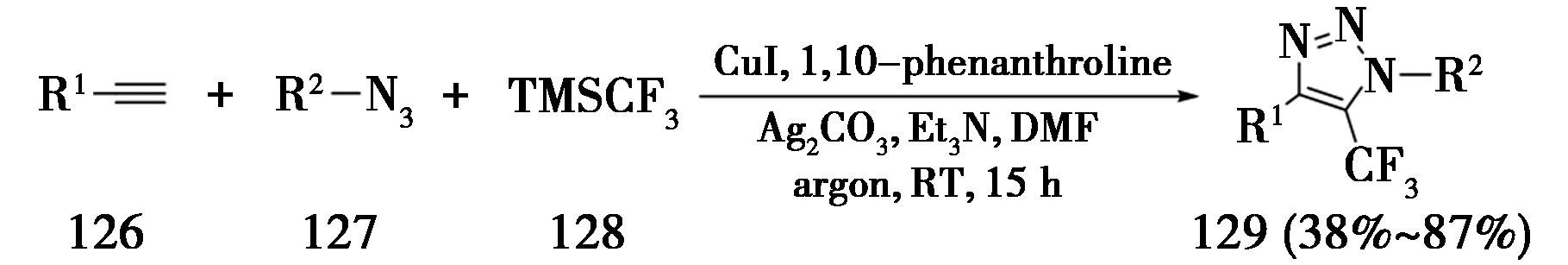
图30 炔烃、叠氮化合物与TMSCF3的三组分CuAAC反应
Fig.30 Three-component CuAAC reaction of alkynes,azides and TMSCF3
2016年,山东大学Xu课题组[43]通过中断点击反应策略,以硫代磺酸酯或苯甲酰二苄基羟胺作为亲电试剂,通过与5-铜三氮唑中间体反应,制备5-位硫原子或氮原子取代的标题化合物(图31)。
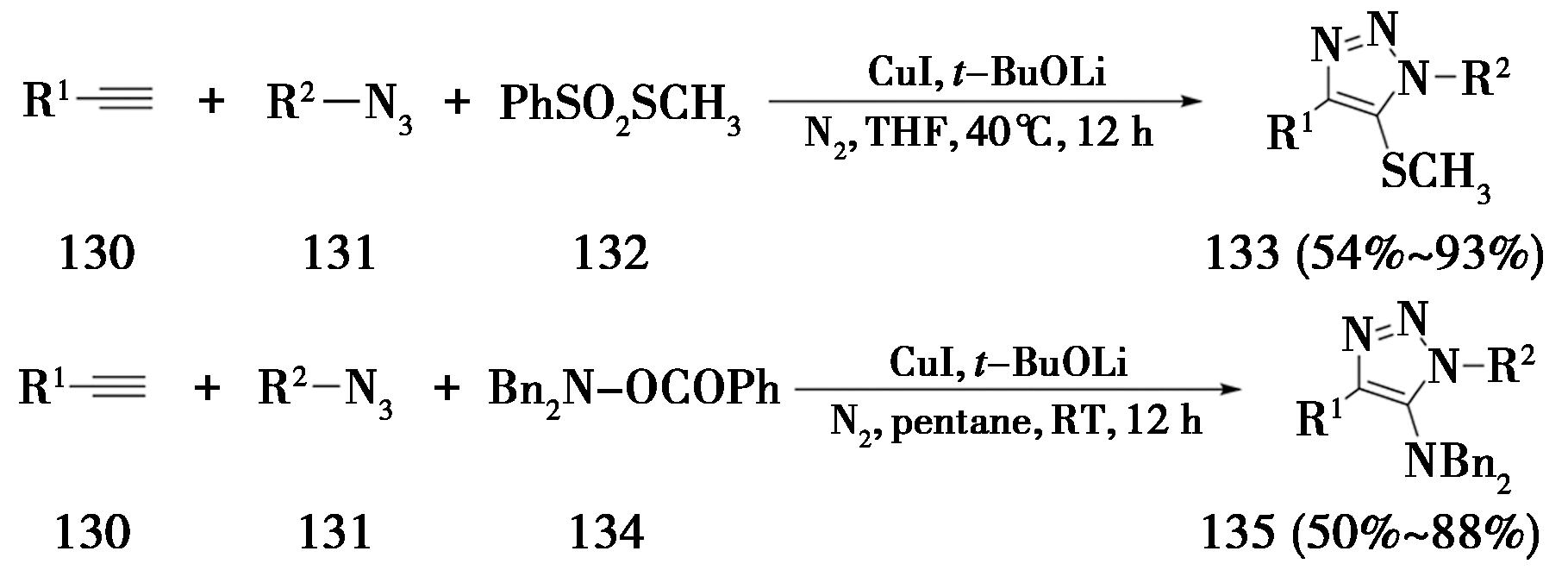
图31 中断点击反应合成5-硫/5-氨基三氮唑
Fig.31 Synthesis of 5-sulfur / 5-amino-triazoles by interruptted click reaction
2018年,该课题组[44]以对甲苯磺酰基作为离去基团,通过中断点击反应策略合成了5-二硫基-1,2,3-三氮唑。此外,该课题组通过分子内的中断点击反应,合成了5-硫代的稠杂环三氮唑类化合物[45,46](图32)。
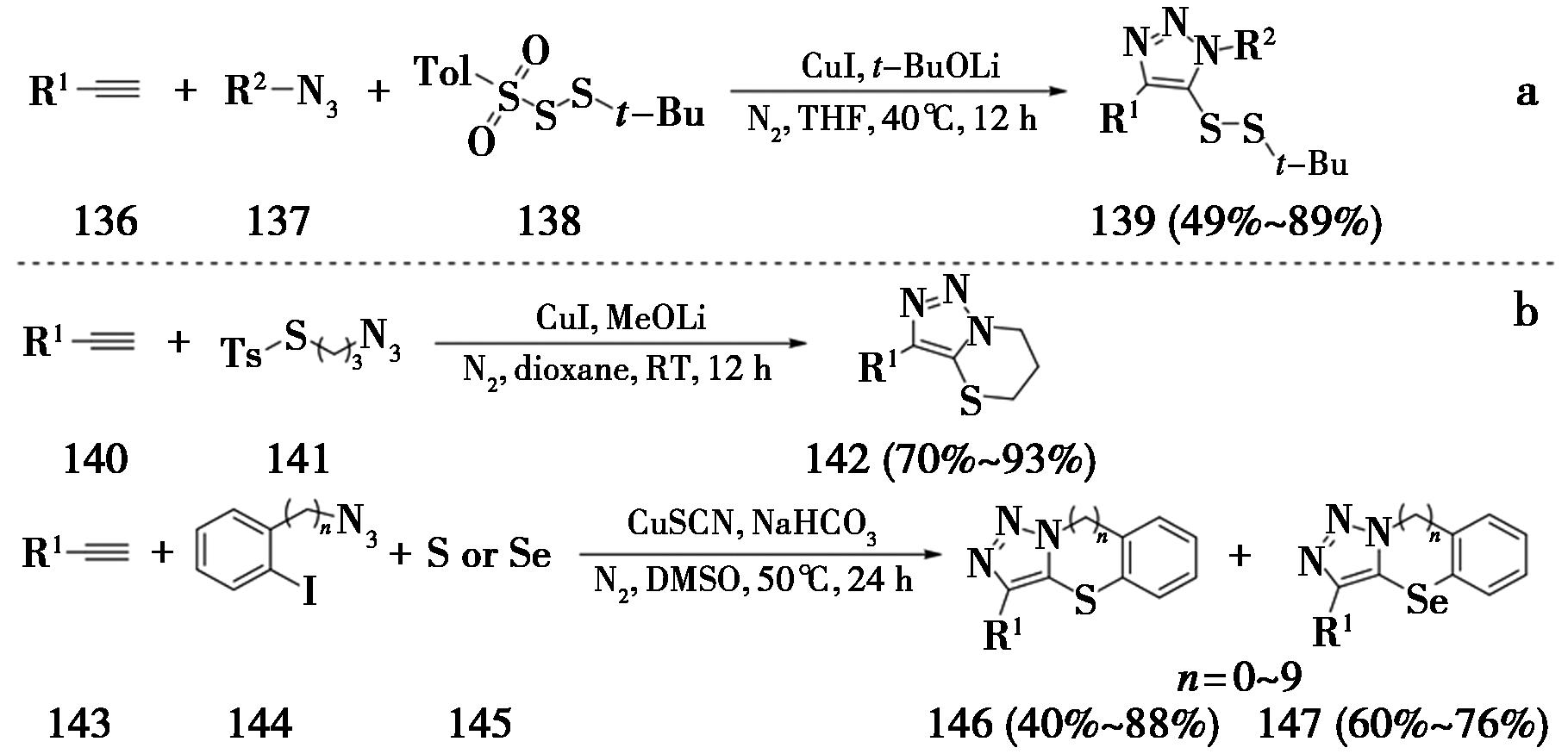
图32 中断点击反应合成5-硫代三氮唑
Fig.32 Synthesis of 5-thiotriazoles by interrupted click reaction
2017年,浙江大学Chen课题组[47]使用2H-氮杂丙烯啶作为亲电试剂,制备一系列5位烯胺功能化的1,2,3-三氮唑(图33)。该反应的最优条件为:在氮气保护下,以CuI作为催化剂,DIPEA作为碱,温度从0 ℃~室温,在二氯甲烷中反应12 h得到5-烯胺取代的标题化合物。
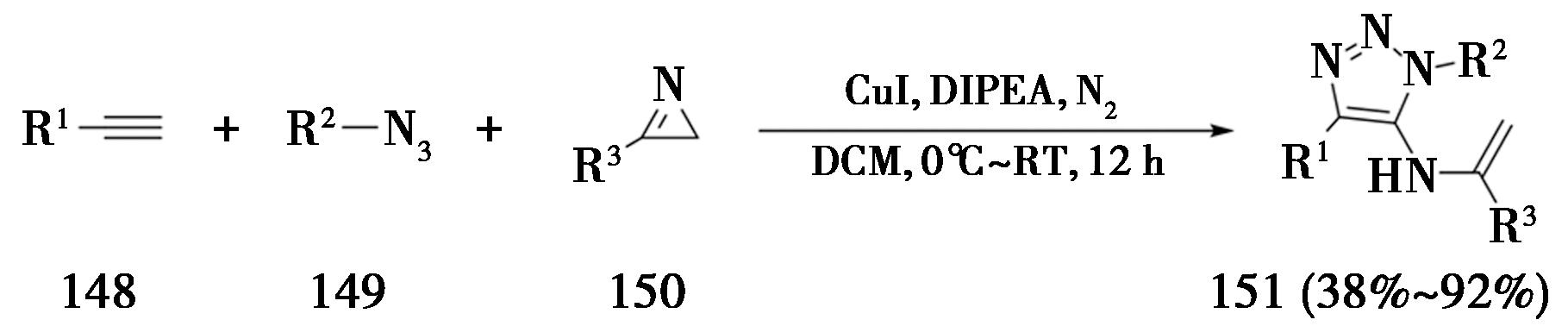
图33 炔烃、叠氮与氮杂丙烯啶的三组分CuAAC反应
Fig.33 Three-component CuAAC reaction of alkynes,azides and aziridines
2022年,大连理工大学Song课题组[48]发展了炔烃、N-甲基苯胺、叠氮化合物和2H-氮杂丙烯啶的新型四组分反应,通过一步形成4个C—N键,得到具有分子多样性的多官能团化三氮唑类化合物(图34)。
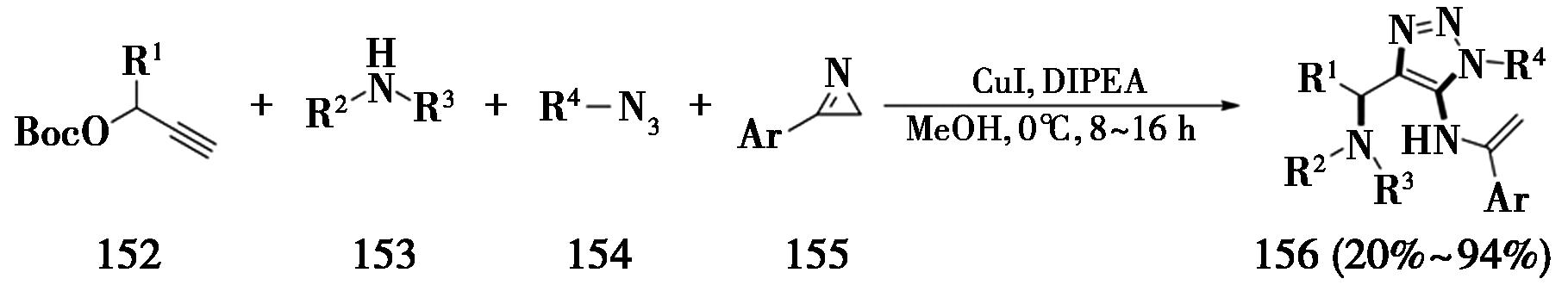
图34 炔烃、N-甲基苯胺、叠氮化合物和氮杂丙烯啶的四组分CuAAC反应
Fig.34 Four-component CuAAC reaction of alkynes,N-methylaniline,azides and aziridines
2024年,山东大学Xu课题组[49]报道了一种通过自由基接力的中断点击反应(图35),在该方法中,1,4-二氮杂双环[2.2.2]辛烷-1,4-二鎓-1,4-二亚磺酸(DABSO)与芳香重氮盐生成的对甲苯磺酰基自由基,能够顺利与5-铜三氮唑中间体反应,进而生成5-砜基-1,2,3-三氮唑。
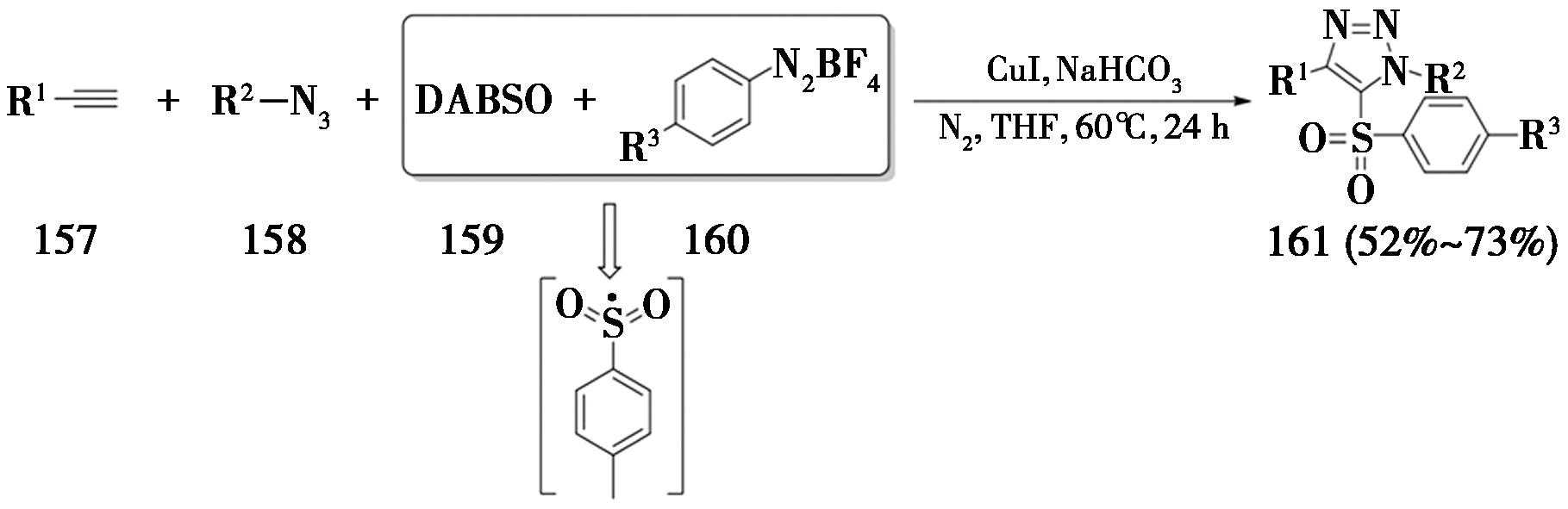
图35 自由基接力的中断点击反应
Fig.35 Interrupted click reaction of radical relay
发展1,4,5-三取代-1,2,3-三氮唑类化合物的合成新方法在有机合成化学、药物化学以及功能高分子材料科学等领域具有重要的理论意义和应用价值。近年来,基于内炔和端炔的合成策略,特别是对铜催化叠氮-炔烃环加成反应(CuAAC)的进一步研究,为高效构筑这类具有生物活性的杂环化合物提供了合成工具。随着研究的深入,该领域未来的发展方向将聚焦于新型催化体系的开发、反应选择性的精准调控以及拓展底物适用范围,以满足药物研发、材料科学等领域的多样化需求。同时,深入探究新型反应机理,开发绿色合成工艺等也是该领域的重要研究方向之一。
[1]Danne A B,Lathi K,Sangshetti J N,Khedkar V M,Khalse L D,Shingate B B.J.Mol.Struct.,2024,1 299:13 729.
[2]Holla B S,Mahalinga M,Karthikeyan M S,Poojary B,Akberali P M,Kumari N S.Eur.J.Med.Chem.,2005,40:1 173-1 178.
[3]WO2023237732.Grosse S C.2023-12-14.
[4]Huisgen R.Angew.Chem.Int.Ed.,1963,2:633-645.
[5]Huisgen R.Angew.Chem.Int.Ed.,1963,2:565-598.
[6]Rostovtsev V V,Green L G,Fokin V V,Sharpless K B.Angew.Chem.Int.Ed.,2002,41:2 596-2 599.
[7]Tornoe C W,Christensen C,Meldal M.J.Am.Chem.Soc.,2002,67:3 057-3 064.
[8]Baskin J M,Prescher J A,Laughlin S T,Agard N J,Chang P V,Miller I A,Lo A,Codelli J A,Bertozzi C R.P.Natl.Acad.Sci.USA,2007,104:16 793-16 797.
[9]Kuijpers B H M,Dijkmans G C T,Groothuys S,Quaedflieg P,Blaauw R H,Delft F L,Rutjes F.Synlett,2005,20:3 059-3 062.
[10]Hein J E,Tripp J C,Krasnova L B,Sharpless K B,Fokin V V.Angew.Chem.Int.Ed.,2009,48:8 018-8 021.
[11]Brotherton W S,Clark R J,Zhu L.J.Org.Chem.,2012,77:6 443-6 455.
[12]Yang W,Ma H R,Yang Q,Wang J W,Liu Y,Yang Q H,Wu J,Song C J,Chang J B.Org.Biomol.Chem.,2017,15:379-386.
[13]Borissov A,Marques I,Lim J Y C,Félix V,Smith M D,Beer P D.J.Am.Chem.Soc.,2019,141:4 119-4 129.
[14]Partyka D V,Gao L,Teets T S,Updegraff J B,Deligonul N,Gray T G.Organometallics,2009,28:6 171-6 182.
[15]Zhou Y H,Lecourt T,Micouin L.Angew.Chem.Int.Ed.,2010,49:2 607-2 610.
[16]Worrell B T,Ellery S P,Fokin V V.Angew.Chem.Int.Ed.,2013,52:13 037-13 041.
[17]Stefani H A,Vasconcelos S N S,Manarin F,Leal D M,Souza F B,Madureira L S,Zukerman-schpector J,Eberlin M N,Godoi M N,Galaverna R D.Eur.J.Org.Chem.,2013,18:3 780-3 785.
[18]Yamada M,Matsumura M,Uchida Y,Kawahata M,Murata Y,Kakusawa N,Yamaguchi K,Yasuike S.J.Org.Chem.,2016,12:1 309-1 313.
[19]Yamada M,Matsumura M,Kawahata M,Murata Y,Kakusawa N,Yamaguchi K,Yasuike S.J.Org.Chem.,2017,834:83-87.
[20]Zhang L,Chen X G,Xue P,Sun H H Y,Williams I D,Sharpless K B,Fokin V V,Jia G C.J.Am.Chem.Soc.,2005,127:15 998-15 999.
[21]Oakdale J S,Sit R K,Fokin V V.Chem.Eur.J.,2014,20:11 101-11 110.
[22]Ferrini S,Chandanshive J Z,Lena S,Franchini M C,Giannini G,Tafi A,Taddei M.J.Org.Chem.,2015,80:2 562-2 572.
[23]Song W Z,Li M,Dong K,Zheng Y B.Adv.Synth.Catal.,2019,361:5 258-5 263.
[24]Rasolofonjatovo E,Theeramunkong S,Bouriaud A,Kolodych S,Chaumontet M,Taran F.Org.Lett.,2013,15:4 698-4 701.
[25]Ding S T,Jia G C,Sun J W.Angew.Chem.Int.Ed.,2014,53:1 877-1 880.
[26]Song W Z,Zheng N.Org.Lett.,2017,19:6 200-6 203.
[27]Li M,Zheng N,Li J H,Zheng Y B,Song W Z.Green.Chem.,2020,22:2 394-2 398.
[28]Liao Y,Lu Q Q,Chen G,Yu Y H,Li C S,Huang X L.ACS.Catal.,2017,7:7 529-7 534.
[29]Song W Z,Zheng N,Li M,Ullah K,Zheng Y B.Adv.Synth.Catal.,2018,360:2 429-2 434.
[30]Song W Z,Zheng N,Li M,Dong K,Li J H,Ullah K,Zheng Y B.Org.Lett.,2018,20:6 705-6 709.
[31]Song W Z,Zheng N,Li M,He J N,Li J H,Dong K,Ullah K,Zheng Y B.Adv.Synth.Catal.,2019,361:469-475.
[32]Wu Y M,Deng J,Li Y,Chen Q Y.Synthesis(Stuttg),2005,8:1 314-1 318.
[33]Smith N W,Polenz B P,Johnson S B,Dzyuba S V.Tetrahedron Lett.,2010,51:550-553.
[34]Goyard D,Praly J P,Vidal S.Carbohydr.Res.,2012,362:79-83.
[35]Li L J,Zhang G S,Zhu A L,Zhang L H.J.Org.Chem.,2008,73:3 630-3 633.
[36]Li L J,Hao G L,Zhu A L,Liu S G,Zhang G S.Tetrahedron Lett.,2013,54:6 057-6 060.
[37]Cassidy M P,Raushel J,Fokin V V.Angew.Chem.Int.Ed.,2006,45:3 154-3 157.
[38]Zhang X J,Hsung R P,Li H Y.Chem.Commun.,2007,23:2 420-2 422.
[39]Ackermann L,Potukuchi H K,Landsberg D,Vicente R.Org.Lett.,2008,10:3 081-3 084.
[40]Zhang Z K,Zhou Q,Ye F,Xia Y,Wu G J,Hossain M L,Zhang Y,Wang J B.Adv.Synth.Catal.,2015,357:2 277-2 286.
[41]Wang W G,Wei F,Ma Y D,Tung C H,Xu Z H.Org.Lett.,2017,19:2 881-2 884.
[42]Cheung K P S,Tsui G C.Org.Lett.,2017,19:2 881-2 884.
[43]Wang W G,Peng X L,Wei F,Tung C H,Xu Z H.Angew.Chem.Int.Ed.,2016,55:649-653.
[44]Wang W G,Lin Y Z,Ma Y D,Tung C H,Xu Z H.Org.Lett.,2018,20:2 956-2 959.
[45]Wang W G,Huang S,Yan S K,Sun X J,Tung C H,Xu Z H.Chin.J.Chem.,2020,38:445-448.
[46]Sun P F,Wang W G,Lai J L,Yan H,Tung C H,Xu Z H.Org.Chem.Front.,2023,10:1 890-1 896.
[47]Zhou W,Zhang M,Li H H,Chen W Z.Org.Lett.,2017,19:10-13.
[48]Duan X L,Zheng N,Liu G B,Li M,Wu Q M,Sun X H,Song W Z,Sun P F,Wei F,Tung C H, Xu Z H.Org.Lett.,2022,24:6 006-6 012.
[49]Sun P F,Wei F,Tung C H,Xu Z H.Chin.Chem.Lett.,2024,35:108 478.