表1 海藻多糖的分类和来源
Tab.1 Classification and sources of seaweed polysaccharides

海藻类型多糖红藻 角叉菜胶、纤维素、琼脂、琼脂糖蛋白、木聚糖、甘露聚糖绿藻 石莼、淀粉、木葡聚糖、纤维素、半纤维素、吡喃木糖棕色海藻岩藻糖胶、海带多糖、海藻酸盐、纤维素
海洋中生活着超过20余万种生物,占据了整个生物物种的80%。丰富的海洋资源为人类的生存和发展提供强有力支撑,这些海洋生物资源是开发医药、食品、化工产品等领域的巨大宝库[1]。海藻作为海洋中的一种丰富资源,大约83%的大型藻类能够供人类食用,不仅可作为食品、动物饲料或添加剂,还可以用于海藻多糖的提取、生物技术等,在食品加工、生物医药等领域展现出广阔的发展前景[2]。
藻类是一类广泛分布于海洋和淡水生态系统的低等自养生物,具有极高的物种多样性和生态适应性,迄今已知的藻类有10 000多种,可食用水生大型藻类可分为3类:红藻、褐藻和绿藻[3]。红藻中获得的琼脂和角叉菜胶是具有线性结构和功能特性的突出多糖。从褐藻中提取出的石莼是硫酸化多糖,具有多种生物作用。海带多糖、海藻酸盐、岩藻糖胶则大多存在于棕色海藻中[4](表1)。由于大多数海洋大型藻类生活在高压、高盐、低温、缺乏光照的自然条件下,它们能通过产生包括多糖在内的独特次生代谢物来适应不断变化的极端海洋环境。这些大型藻类多糖,被证明具有抗炎、抗凝血、抗氧化、抗病毒、抗肿瘤、抗细胞凋亡、抗增殖和免疫刺激等良好的生物活性和药用功能[5]。
表1 海藻多糖的分类和来源
Tab.1 Classification and sources of seaweed polysaccharides

海藻类型多糖红藻 角叉菜胶、纤维素、琼脂、琼脂糖蛋白、木聚糖、甘露聚糖绿藻 石莼、淀粉、木葡聚糖、纤维素、半纤维素、吡喃木糖棕色海藻岩藻糖胶、海带多糖、海藻酸盐、纤维素
多糖类物质广泛存在于动植物和微生物的细胞壁中,是生命有机体的主要组成部分,在控制细胞分裂分化、调节细胞生长衰老以及维持生命有机体正常代谢等方面发挥重要作用[6]。海藻衍生的多糖具有抗病毒、抗癌、抗粘附、抗血管生成、抗神经退行性和抗炎等潜在的治疗作用[7]。但采用不同的提取方式对其结构影响较大,进而影响其生物活性,因此海藻多糖的提取技术至关重要。一般来说,常规的海藻多糖提取技术(如热水抽提、弱酸提取、弱碱提取)虽然工艺简单、操作方便,但存在提取产量低、时间长、活性损失大等局限性。先进的海藻多糖提取技术,如微波辅助提取(MAE)、超声辅助提取(UAE)、加压液体提取(PLE)、酶辅助提取(EAE)可有效改善提取过程中对多糖的影响。
海藻酸盐、角叉菜胶、岩藻多糖和石莼等海藻多糖因其生物相容性和可用性而成为生物和生物医学应用中常用的海洋来源多糖,近年来,大量关于海藻衍生多糖用于生物和生物医学领域的研究被发表。例如,富含岩藻糖的多糖在体外和体内都能够激活免疫细胞,从而减少肿瘤生长和肿瘤相关的血管生成[8]。石莼在胶体制剂中具有稳定和乳化特性,以及化学、物理和流变特性,这将成为食品、化妆品的理想原材料[9]。此外,不同的提取方法会显著影响海藻多糖的提取产量、化学结构和生物活性。例如,利用微波辅助提取可用于从海藻中提取各种化合物(多糖、酚类等),Yuan等[10]发现,微波提取的4种褐藻提取物均表现出比常规方法更高的提取率、DPPH、ABTS自由基清除能力和还原能力。而在Kadam等[11]的研究中,使用超声波提取的海带多糖具有更高的产量和抗氧化特性。Hifney等[12]通过对海藻Cytosmear triodes进行酶促预处理,显著提升了岩藻多糖和海藻酸盐的抗氧化性能。
综上,海藻多糖因其独特的结构特性、丰富的生物活性以及广泛的应用前景而成为了研究热点。系统总结海藻多糖的结构特性、先进提取技术以及其生物活性,可以为进一步挖掘海藻多糖的潜在价值提供理论依据和技术支持。
海藻是多糖的丰富来源,作为细胞壁结构和能量储备的主要成分,多糖占海藻干重的50%以上[13]。从海藻中提取的多糖在组成和结构上与其他植物来源的多糖不同,由于此类聚合物的复杂性,海藻多糖具有许多特定的生物学功能[14,15]。近年的许多研究中讨论了关于海藻产生的各种多糖的特性,包括它们的组成和结构,发现这些多糖中的大多数是高度支化的杂聚物,在其主链和侧链成分的各种碳中具有不同的取代基。
不同种类的海藻(红藻、绿藻、褐藻),具有不同水平的多糖,其中,红海藻的多糖浓度最高(38%~74%,表2)。
表2 不同种类海藻的多糖浓度
Tab.2 Polysaccharide concentrations in different species of seaweeds

藻类属多糖浓度(%,以干重计)棕色海藻Ascophyllum(水蕨)墨角藻属海带属马尾藻属裙带菜42~7062~6638~6849~6235~46绿藻 石莼15~65红藻 软骨紫菜江蓠棕榈属55~6640~5436~6338~74
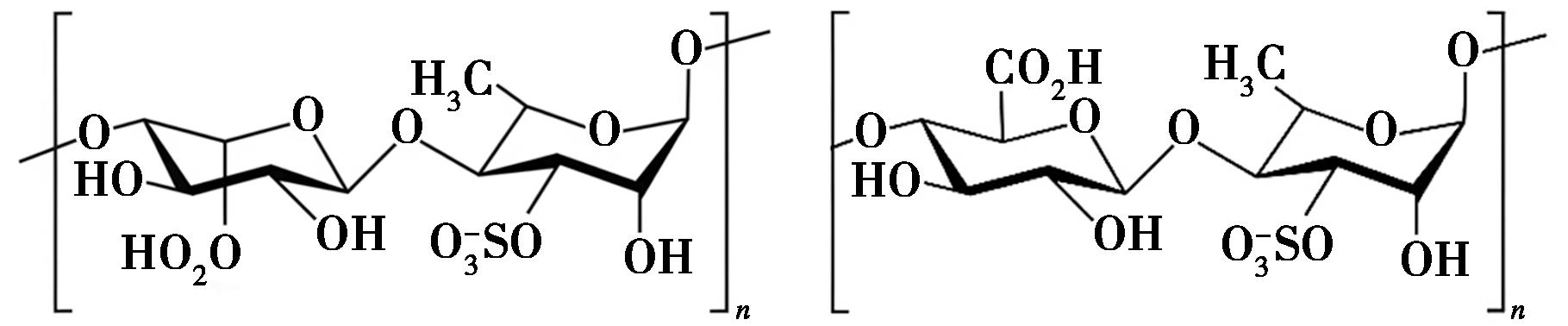
海带多糖又称昆布多糖(Laminarin),是一种重要的无毒且可生物降解的水溶性线性多糖,提取自海洋褐藻的细胞壁中[16]。主要由β(1,3)和β(1,6)葡聚糖以3∶1的比例组成(图1)。海带多糖有两种类型的还原端不同的层流链(M或G),其中M链以甘露醇残基结束,而G链以葡萄糖残基结束。海带多糖主要富集于海带和海带属的叶状体中,少量存在于泡叶藻、墨角藻和裙带菜中[17]。在各种大型藻类中海带多糖干重约35%,但该数值会随着海藻种类、栖息地、收获季节和采用的提取方法等因素而改变[18]。与其他海藻多糖相比,海带多糖的分子量较低,纯化后的海带多糖的分子量通常在5.7~6.2 kDa之间[19]。

图1 海带多糖的结构
Fig.1 Structure of kelp polysaccharides
Rioux等[20]对Ascophyllum nodosum、Fucus vesiculosus和Saccharina Longacres进行了研究,从S.Longacres中提取的海带多糖占总糖含量的99.1%,而A.nodosum和F.vesiculosus的提取物分别占89.6%和84.1%。在Ummat等[21]的研究中,利用不同溶剂从新鲜墨角藻和泡叶藻(Ascophyllum nodosum)中提取海带多糖,对于墨角藻,利用食品级绿色萃取溶剂(GES)提取的海带多糖含量((35.57±1.9)%)高于HCl样品((25.38±0.1)%),而A.nodosum则相反,其中0.1 mol/L HCl样品的海带多糖含量((31.04±4.8)%)高于GES((25.11±3.4)%)。
角叉菜胶(Carrageenan),也被称为卡拉胶、石花菜胶,是一种源自许多红色海藻细胞壁的亲水胶体,其分子结构是由β-d-半乳糖和3,6-脱水-α-d-半乳糖通过α-(1-3)和β-(1-4)键以交替方式连接的重复二糖形成[22]。它是红海藻细胞壁的主要成分,占藻类干重的30%~75%,是研究最广泛的红藻多糖[23]。角叉菜胶作为从红海藻中分离的一组高分子量(>100 kDa)硫酸化多半乳聚糖,通常用于食品中的胶凝剂和增稠剂。它含有15%~40%的硫酸酯,是一种阴离子多糖,根据其硫酸盐含量和多半乳聚糖的化学成分,可以将其分为κ-、λ-、ι-、μ-、θ-、β-和ν-角叉菜胶[24](图2)。

图2 各种角叉菜胶的结构
Fig.2 Structure of various carrageenan
工业上最常利用的角叉菜胶是κ-、ι-和λ-形式。其中κ-角叉菜胶的结构由交替的3-β-d-半乳糖4-硫酸盐和4-连接的3,6-脱水-α-吡喃半乳糖组成。ι-角叉菜胶在3,6-脱水-α-d-半乳糖残基上有一个额外的硫酸盐基团,导致每个二糖重复单元产生两个硫酸盐。λ-角叉菜胶中每个二糖单元有3个硫酸盐基团,这种形式的第3个硫酸盐基团位于4-残基的C6位置,但4-残基上没有3,6-酸酐桥[25]。κ-、ι-、λ-角叉菜胶的每个二糖单位分别含有1、2和3硫酸盐,对应于约20%、33%和41%的硫酸盐化率[26],因此λ-角叉菜胶拥有较高的硫酸盐含量,λ-表现出的抗凝能力要优于ι-和κ-角叉菜胶。
岩藻多糖(Fucoidan),是具有良好水溶性的海洋硫酸化多糖,存在于褐藻细胞的细胞壁、细胞间隙及分泌的黏液中[27]。天然存在的岩藻多糖通常具有两种类型的链,其中Ⅰ型链由α(1→3)连接的岩藻糖组成,Ⅱ型链由α(1→3)和α(1→4)连接的岩藻糖组成[28](图3)。天然岩藻多糖通常是大分子结构,分子量范围约为10~2 000 kDa。不同来源的岩藻多糖在结构特征上存在差异,因此具有广泛的生物学效应。岩藻多糖的生物活性取决于单糖的类型、硫酸化的程度和位置、分子量、其他取代基团以及糖苷分支等结构参数[29]。

图3 Ⅰ型(a)、Ⅱ型(b)岩藻多糖的结构
Fig.3 Structure of type Ⅰ (a) and type Ⅱ (b) fucoidans
岩藻多糖以聚α-L-岩藻糖硫酸酯构成主链,不同比例的糖醛酸及多种单糖构成的侧链附着在主链上。侧链上主要由岩藻糖和少量的葡萄糖、半乳糖、甘露糖、阿拉伯糖、木糖、鼠李糖、糖醛酸等单糖以及较大比例的硫酸酯基团组成[30,31],具有抗肿瘤、抗病毒、提高免疫力等多种重要的生理活性。
石莼多糖(Ulva.Lactuca)是一种从绿藻中提取的硫酸化多糖,占据绿藻类干重的29%左右,均匀分布在细胞间隙和纤维壁中[32],主要由鼠李糖、木糖、葡萄糖醛酸和艾杜糖醛酸以及少量其他单糖(半乳糖、阿拉伯糖、甘露糖和葡萄糖等)组成。石莼多糖的结构组成复杂多变,因藻类种类、培养地点和提取方法而异,主要结构是A型(3-硫酸葡萄糖醛酸酯,A3s)和B型(3-硫酸艾杜罗汉糖,B3s)的重复二糖单元以线性方式排列[33](图4)。Yaich等[34]报道了不同提取条件下(pH:1.5~2、温度:80~90 ℃和时间:1~3 h)石莼多糖的提取产量,其中石莼中性糖成分的产量在43.12%~61.37%之间。Guidara等[35]利用酸萃取和酶化学萃取对突尼斯海岸采集的石莼进行研究,观察到在酶化学提取和酸萃取条件下的多糖产量分别为(17.95±0.86)%和(14.22±0.78)%。
A3s:(3-硫酸葡萄糖醛酸酯,A型);B3s:(3-硫酸艾杜罗汉糖,B型)
图4 石莼的化学结构
Fig.4 Chemical structure of Ulva
琼脂是一种亲水胶体,是在红海藻中发现的主要碳水化合物之一(约占干重的20%),以3,6-脱水-L-半乳糖和D-半乳糖作为重复单元,由α-(1,3)和β-(1,4)-糖苷键连接,多糖链主要由琼脂糖和琼脂糖蛋白两部分组成[36](图5)。琼脂的亲水胶体特性与其聚合物结构高度相关,例如,聚合物链上的α-(1→4)-连接的3,6-脱水-D-吡喃半乳糖残基能增强琼脂的亲水胶体特性[37]。此外,琼脂聚合物的阴离子电荷将根据其硫酸化程度而改变,因此,它可以形成更中性的琼脂糖,或硫酸化程度更高的琼脂糖素[38]。

图5 琼脂的化学结构
Fig.5 Chemical structure of agar
由于琼脂的稳定性、胶凝能力和在加热和冷却时具有独特的凝胶溶胶转变特性,现已被广泛用作食品添加剂、微生物培养基中的固化试剂以及电泳和各种色谱程序的辅助材料。
目前,最常用的海藻多糖提取方法包括热水提取法、酸提取法等。其中,热水提取法效率较低;酸碱提取法可能对多糖结构造成破坏;酶解法具有专一性强、条件温和等优点,但成本较高。因此许多先进的多糖提取技术(微波辅助提取、超声辅助提取、酶辅助提取和加压液体提取等)被广泛应用(表3),这些技术通常具有提取效率高、能耗低和生产周期短等优势,能够更高效地提取海藻多糖,同时保持其生物活性。
表3 超声波辅助提取、亚临界水萃取、酶辅助提取、微波辅助萃取海藻多糖的参数
Tab.3 Parameters of ultrasonic-assisted extraction,subcritical water extraction,enzyme-assisted extraction,and microwave-assisted extraction of algal polysaccharides
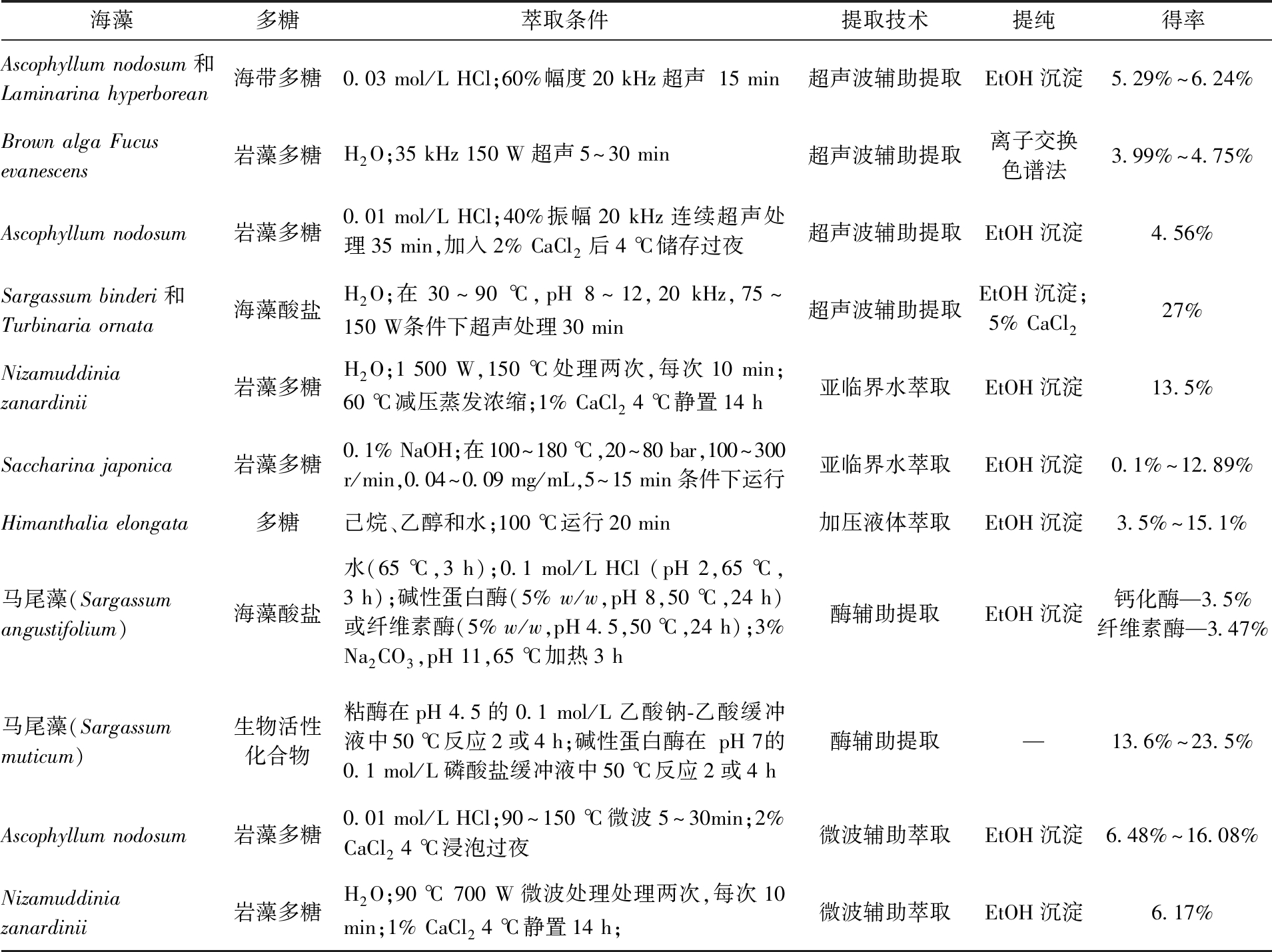
海藻多糖萃取条件提取技术提纯得率Ascophyllum nodosum和Laminarina hyperborean海带多糖0.03 mol/L HCl;60%幅度20 kHz超声 15 min超声波辅助提取EtOH沉淀5.29%~6.24%Brown alga Fucus evanescens岩藻多糖H2O;35 kHz 150 W超声5~30 min超声波辅助提取离子交换色谱法3.99%~4.75%Ascophyllum nodosum岩藻多糖0.01 mol/L HCl;40%振幅20 kHz连续超声处理35 min,加入2% CaCl2后4 ℃储存过夜超声波辅助提取EtOH沉淀4.56%Sargassum binderi和Turbinaria ornata海藻酸盐H2O;在30~90 ℃,pH 8~12,20 kHz,75~150 W条件下超声处理30 min超声波辅助提取EtOH沉淀;5% CaCl227%Nizamuddinia zanardinii岩藻多糖H2O;1 500 W,150 ℃处理两次,每次10 min;60 ℃减压蒸发浓缩;1% CaCl2 4 ℃静置14 h亚临界水萃取EtOH沉淀13.5%Saccharina japonica岩藻多糖0.1% NaOH;在100~180 ℃,20~80 bar,100~300 r/min,0.04~0.09 mg/mL,5~15 min条件下运行亚临界水萃取EtOH沉淀0.1%~12.89%Himanthalia elongata多糖己烷、乙醇和水;100 ℃运行20 min加压液体萃取EtOH沉淀3.5%~15.1%马尾藻(Sargassum angustifolium)海藻酸盐水(65 ℃,3 h);0.1 mol/L HCl (pH 2,65 ℃,3 h);碱性蛋白酶(5% w/w,pH 8,50 ℃,24 h)或纤维素酶(5% w/w,pH 4.5,50 ℃,24 h);3% Na2CO3,pH 11,65 ℃加热3 h酶辅助提取EtOH沉淀钙化酶—3.5%纤维素酶—3.47%马尾藻(Sargassum muticum)生物活性化合物粘酶在pH 4.5的0.1 mol/L乙酸钠-乙酸缓冲液中50 ℃反应2或4 h;碱性蛋白酶在 pH 7的0.1 mol/L磷酸盐缓冲液中50 ℃反应2或4 h酶辅助提取—13.6%~23.5%Ascophyllum nodosum岩藻多糖0.01 mol/L HCl;90~150 ℃微波5~30min;2% CaCl2 4 ℃浸泡过夜微波辅助萃取EtOH沉淀6.48%~16.08%Nizamuddinia zanardinii岩藻多糖H2O;90 ℃ 700 W微波处理处理两次,每次10 min;1% CaCl2 4 ℃静置14 h;微波辅助萃取EtOH沉淀6.17%
超声辅助提取是一种非热提取技术,其中声波在介质中迁移,引起压力变化和空化,这些变化和空化会增长和崩溃,将声波转化为机械能,从而破坏细胞壁,减小颗粒大小并增强溶剂与目标化合物之间的接触[39]。
超声辅助提取的声空化会产生物理力,如剪切力、冲击波、微射流和声流,导致细胞壁破裂、粒径减小以及溶剂和目标化合物之间更好的接触。在最新的提取技术中,超声辅助提取被用于与微波辅助提取技术相结合,提取棕色海藻(Alaria esculenta)中的有机酸和植物化学物质[40]。在马尾藻、裙带菜和结节性海带多糖的提取中[41],超声导致空化气泡在处理过的液体介质中迅速形成和崩溃,导致强烈的应力和不可逆的链分裂,在短的提取时间内提取到的多糖产量比常规萃取更高。另外,Hanjabam等[42]报道,使用超声辅助提取方法从马尾藻中得到的岩藻多糖产量比传统的水法高25.5%。
亚临界水萃取,即高压(通常为1 000~6 000 kPa)下使用热水(从100~374 ℃,后者是水的临界温度)进行的,以保持水处于液态,是从几种天然基质中提取生物活性化合物的有效的方法。其原理是在无氧和无光的环境中,利用高温和高压,短时间内从样品中提取化合物。高温提高了样品的溶解性和扩散速率;而高压使溶剂保持在沸点以下,减少溶剂的挥发和使用量。
与普通萃取工艺相比,亚临界水萃取工艺在酸、碱和酶反应方面具有多种优势。Hans等[43]对比了5种提取技术对岩藻多糖回收、结构特征及其生物活性的影响,发现亚临界水萃取的岩藻糖胶产量最高(13%);与传统酸法提取相比,亚临界水法能增加岩藻多糖30%的回收量。其中高硫酸盐含量(32.9%)和多酚化合物能提高岩藻多糖的生物活性,从而提高其抗氧化活性。Saravana等[44]研究发现,150 ℃、压力1 985 kPa、70%含水量和36.81 mL/g料液比是采用亚临界水萃取海藻酸盐(28.1%)和岩藻多糖(14.93%)的最佳条件,海藻酸盐和岩藻多糖的分子量分别为682.80和416.84 kDa。
酶辅助提取法可以利用酶的催化特性水解细胞壁,从而提高提取植物中生物活性化合物的效率。与常规提取技术相比,酶辅助提取效率高、能耗低,还有改善细胞破碎、选择性提取代谢物和加工条件温和等优势,但同时存在高成本、需对产物进行分离和纯化、加工环境要求高、可回收性和再利用性差、多次使用后酶活力下降等缺陷。常通过与超声辅助萃取、微波辅助萃取、超临界流体萃取、加压液体萃取等新型提取技术结合来弥补酶辅助提取法的缺陷。
Nguyen等[45]组合使用纤维素酶制剂(Cellic® CTec2)和藻酸盐裂解酶(Saly)提取Fucus evanescens和Saccharina latissima中岩藻糖胶,得到的岩藻糖胶产量与硫醚的化学提取产量相当。且与弱酸性萃取相比,通过酶法获得的岩藻糖胶分子量更高。Rostami等[46]发现碱性蛋白酶和纤维素酶处理产生的藻酸盐对蛋白质和多酚的化学污染最低,分子量最低,且海藻酸盐显示出更高的DPPH自由基清除活性和更高的还原能力。
微波辅助萃取已被成功用于从海藻和其他植物中分离各种生物活性化合物。在微波萃取过程中,将能量转移到溶液中,溶液在偶极子旋转和离子传导机制的共同作用下被加热,这种快速内部加热会导致细胞壁有效破裂,并将细胞内化合物释放到提取溶剂中。
Magnusson等[47]发现,与传统提取方法相比,微波技术使弯曲石叉菜多酚的产量提高了70%。Boulho等[48]发现微波辅助萃取使Solieria chordalis的角叉菜胶产量提高了20%。此外,微波辅助萃取获得的多糖具有较高的硫酸根浓度和较低的分子量。在Ren等[49]关于微波辅助提取马尾藻多糖及其抗氧化、降血糖活性的优化研究中,微波技术被用于提取Sargassum thunbergii多糖,在最佳提取条件下(23 min、547 W、80.0 ℃、料液比1∶27 (g/mL)),多糖(STP-1)的提取率为(2.84±0.09)%。微波辅助提取获得的多糖提取物显示出更高的抗氧化和羟基自由基清除活性以及潜在的降血糖活性,由于分子量较低,硫酸盐基含量较高,STP-1还表现出对α-葡萄糖苷酶很强的抑制活性,可显著提高HepG2细胞的葡萄糖消耗。
大型藻类多糖在体内和体外都已被证明具有广泛的生物学特性,例如抗炎、免疫刺激、抗氧化、抗凝血、抗病毒、抗增殖、抗细胞凋亡和抗肿瘤特性。
近年来,许多关于海藻多糖的抗癌活性报道被发表,揭示了海藻多糖在多种癌细胞系中出色的抗癌活性。其中,海藻多糖的化学特性,例如分子量、组成单糖亚基和糖苷键,与抗癌活性密切相关。海藻多糖主要通过抑制癌细胞增殖、诱导癌细胞凋亡和细胞周期停滞、抑制肿瘤组织中的血管生成和转移、清除活性氧、诱导免疫反应和调节肠道微生物群来发挥抗癌作用。
Imbs等[50]研究了褐藻(Coccophora langsdorfii)的一些多糖组分的化学结构和岩藻多糖组分的抗癌活性。研究发现,来自C.langsdorfii的岩藻多糖能够显著抑制SK-MEL-5和SK-MEL-28黑色素瘤细胞的集落形成(抑制率分别为28%和76%),而这种抗癌特性与多糖的独特结构有关,即岩藻多糖的化学结构定义、分子量、硫酸化程度和硫酸化基团的位置在一定程度上决定了海藻多糖的抗癌活性。海藻中膳食纤维的硫酸盐含量和分子量也是影响抗肿瘤和抗癌活性的关键因素,Shao等[51]比较了从绿海藻石莼、红海藻(Gloiopeltis furcata)和棕色海藻(Sargassum henslouianum)中分离的3种硫酸化多糖的抗癌活性,发现在硫酸盐基团和糖醛酸基团的协同效应作用下,硫酸盐含量最低的S.henslouianum对MKN45胃癌细胞和DLD肠癌细胞的生长表现出最高的抑制率(28.22%)。Suresh等[52]通过从马尾藻(Plagiophyllum C.Agardh)中提取、纯化水溶性硫酸化多糖并发现其在人肝癌(HepG2)和肺癌(A549)细胞系中发挥抗癌潜力,其中硫酸化基团主要通过与细胞表面的阳离子蛋白结合,在抑制癌细胞生长中发挥主要作用。
炎症是免疫系统对感染、损伤或刺激(如身体创伤、化学暴露和病毒感染)的第一生物反应,这一反应主要涉及免疫细胞(如巨噬细胞)和促炎细胞因子(如NO和TNF-α、IL-1β)的连续释放[53]。而促炎细胞因子的过度积累会导致各种疾病,例如过敏、动脉粥样硬化、糖尿病和癌症。因此,具有抗炎特性的海藻多糖是一种理想的、可作为促炎基因表达的天然调节因子。
根据Wang等[54]的研究,从发酵的梭形马尾藻中分离的岩藻多糖以浓度依赖性方式减少了脂多糖诱导的一氧化氮产生,提高了脂多糖刺激的RAW 264.7细胞的活力,并降低了细胞中的炎症分子(例如前列腺素E2、IL-6、NO、TNF-α、IL-1β)的产生。Pei等[55]证明,从红藻(Gelidium crinale)中提取的硫酸化多糖通过阻断丝裂原活化蛋白激酶/核因子-κB的信号通路,显著抑制了z脂多糖诱导的一氧化氮合酶和环氧合酶-2的表达以及促炎细胞因子的分泌。在Obluchinskaya等[56]的一项研究中,针对不同褐藻的岩藻多糖进行比较,发现岩藻多糖在抑制蛋白质变性和维持人类红细胞膜完整性方面具有抗炎活性,且硫酸盐和岩藻糖的含量越高,岩藻糖胶表现出的抗炎活性越强。这也反映了海藻多糖的结构特性对其抗炎活性的影响。
病毒一直是危害人类健康的罪魁祸首,从海藻中提取的硫酸化多糖对各种暴露和封闭的病毒表现出多种抗病毒特性。其抗病毒机制主要包括抑制病毒-宿主细胞粘附或内化、增强宿主的免疫功能、直接杀灭病毒以及蛋白质生物合成和抑制DNA复制等。
已有研究表明,海藻多糖对冠状病毒、疱疹病毒等具有较强的抗病毒活性。如来源于绿藻的石莼多糖对甲型流感病毒表现出显著的抑制作用,海藻中的硫酸化多糖可以通过阻断病原体表面受体的正电荷来干扰病毒的进入过程,以防止它们与宿主细胞表面的硫酸乙酰肝素蛋白多糖(HSPGs)结合[57]。Yim等[58]通过筛选6种海藻粗多糖的抗病毒活性发现:马尾藻粗多糖(CPSH)在体外抑制SARS-CoV-2病毒进入宿主细胞的活性最强。Wang等[59]的研究表明,褐藻(Kjellmaniella crassifolia)衍生的岩藻多糖能够与病毒神经氨酸酶结合并抑制病毒神经氨酸酶的活性以阻断甲型流感病毒的释放。Pliego等[60]研究发现采用酶辅助提取从墨西哥红藻(Halymenia floresii)得到的半精制硫酸多糖sr-SPs在体外显示出较强的抗单纯疱疹病毒HSV-1活性,同时此研究指出硫酸多糖的抗病毒活性与硫酸基团的结构特征、硫酸化程度和分布、分子量以及单糖组成有关。
海藻通过清除自由基、延迟或防止生物分子的氧化起到抗氧化剂的作用。近年来,海藻衍生色素(即藻红蛋白、藻蓝蛋白)、类黄酮和多酚化合物的抗氧化特性被广泛研究。这些天然活性成分在缓解氧化应激相关疾病方面展现出巨大潜力,为新型治疗策略的开发提供了重要研究方向。已有研究表明,海洋植物多糖(尤其是褐藻多糖)具有很高的抗氧化活性,在功能性食品和医药等领域应用广泛。
在Yang等[55]的研究中,从中国3个不同海域收获的红藻(Gelidium amansii)用于制备硫酸化多糖,这些硫酸化多糖,在体外实验中被证明对氧化和糖化过程具有双重作用。Hentati等[61]从突尼斯褐藻(Cystoseira compressa)中提取和纯化两种水溶性多糖(海藻酸盐和岩藻多糖)表现出一定的抗氧化特性,例如DPPH自由基清除活性、铁还原能力和亚铁离子的螯合能力。Huo等[62]通过纤维素DEAE-52和Sephadex G-100色谱分离法纯化降解海樟花,得到的3种硫酸多糖成分都具有显著的抗氧化活性,它们显著增强了RAW264.7细胞的增殖、吞噬能力和一氧化氮分泌。且这种多糖的抗氧化特性由大分子的纯度、结构特征和物理化学性质等多种相关因素综合作用决定。
巨噬细胞通过释放促炎细胞因子和炎症因子积极参与免疫反应,而海藻多糖可以通过激活效应细胞(如淋巴细胞、巨噬细胞和自然杀伤细胞)来启动免疫活性。近年来,许多关于海藻多糖的免疫调节作用被报道,Liu等[63]发现紫菜硫酸化多糖(PHPS)增加了BALB/c小鼠模型中RAW264.7巨噬细胞的吞噬作用,增强了白细胞介素(IL-6、IL-10和肿瘤坏死因子-α(TNF-α))的分泌。同时RAW264.7巨噬细胞中的JunN末端激酶(JNK)和Janus激酶(JAK2)信号通路诱导一氧化氮的产生并促进小鼠淋巴细胞增殖,诱导体内TNF-α和IL-10的产生,以及CD4+脾T淋巴细胞、DC和Tregs的亚群,这些结果表明,PHPS在免疫调节中起关键作用。还有学者对海藻多糖体内免疫调节作用进行了研究。Wang等[64]从红马尾藻中分离纯化出的SGF-2具有提高胸腺/脾脏指数、CD8+脾脏T淋巴细胞亚群和CD4+Foxp3+脾Tregs的作用。SGF-2给药显著增加了乳酸菌、异头孢菌、瘤胃球菌和阿克曼氏菌的相对丰度。此外,研究发现粪便发酵的SGF-2可以显著改善共培养系统中巨噬细胞的吞噬作用、NO和细胞因子(TNF-α、IL-6和IL-10)的产生。这些结果表明,SGFs有可能通过影响肠道菌群来调节免疫力和促进健康。
海藻多糖还具有抗凝血、抗肿瘤、改善肠道等广泛的生物学活性。Qin等[65]从绿藻(Chaetomorpha aerea)提取的硫酸化多糖可能是一种很有前途的抗凝剂,抗凝特性归因于肝素辅因子Ⅱ或抗凝血酶Ⅲ介导的强凝血酶抑制,对凝血因子Ⅸ、Ⅺ、Ⅻ、Ⅷ以及抗凝血酶Ⅲ介导的凝血因子Xa具有较强的抑制作用。Qiu等[66]研究发现石莼多糖主要通过抑制JNK、c-JUN、PI3K、Akt和Bcl-6的蛋白水平来促进活性氧的产生,从而延缓HepG2细胞的生长。Charoensiddhi等[68]研究报告石莼、G.fisheri红海藻(Gracilaria fisheri)及其多糖提取物具有促进短链脂肪酸产生和刺激有益肠道微生物生长的能力。
海藻多糖现在构成了一类新的食物资源,许多学者对其多样化的生理益处进行了广泛的研究和验证。因其良好的生物相容性、生物降解性、无毒、保水性、抗菌、抗氧化等优良性能而被广泛应用于食品加工和保鲜领域。了解多糖的化学结构,并借助化学反应为化学修饰提供新的反应基团,已应用于不同的食品应用,例如食品防腐剂、食品包装、食品抗氧化剂。然而,天然海藻多糖化学改性后衍生物的毒理学试验较少,因此对改性后的毒理学特性进行系统评价是一个亟待解决的问题,化学改性产品的构效关系也有待进一步研究。
作为一种天然高分子材料,海藻多糖具备抗肿瘤、抗细胞凋亡、抗凝血、抗氧化、抗病毒等多种独特的生物活性,这些特性使其在生物医学领域具有显著的应用潜力。尽管越来越多的研究发现了海洋多糖的功效和应用,但海洋多糖的开发仍是丰富的海洋资源中的一小部分,其功效机制有待进一步阐明。由于海洋多糖结构复杂、治疗效果差、提取合成困难、来源有限、作用机制模糊,其利用受到很大限制。一个有前途的策略是以天然海藻多糖为研究基础,通过研究构效关系,利用组学(如基因组学、蛋白质组学和代谢组学)监测多糖干预后与各种细胞系或动物/临床试验相关的基因、蛋白质和代谢物的变化,深入了解各种多糖的生物活性机制。
近年来,海藻多糖的提取技术取得了显著进展,包括超声波提取、酶解提取等多种方法的优化,这些技术不仅提高了提取效率,还有效保证了提取物的纯度和生物活性。此外,海藻多糖的加工技术,如分离、纯化、改性等也在不断进步,使得海藻多糖能够满足药物开发、食品添加剂等不同领域的需求。尽管先进的提取技术显示出更高的提取效率以及更少的时间、成本和能源消耗,但它们在海洋多糖提取中的应用迄今为止仅限于实验室研究,仍需进一步探索工业规模的研究,同时在考虑这些技术的大规模使用时,减少机械、酶和能源输入相关的高成本是重要因素。
[1]Zang L,Wang J X,Yang X Q,Wei Y,Yang S L.Food Ind.,2018,39(1):211-215.
张磊,王锦旭,杨贤庆,魏涯,杨少玲.食品工业,2018,39(1):211-215.
[2]Jahan A,Ahmad I Z,Fatima N,Ansari V A,Akhtar J.Phycologia,2017,56(4):410-422.
[3]Udo T,Mummaleti G,Mohan A,Singh R K,Kong F.Food Res.Int.,2023,173:113 369.
[4]Roy D,Sobuj M K A,Islam M S,Haque M M,Islam M A,Islam M M,Ali M Z,Rafiquzzaman S M.Algal Res.,2024,80:103 542.
[5]Wijesinghe W A J P,Jeon Y J.Carbohydr.Polym.,2012,88(1):13-20.
[6]Liu Y,Hou F,Yang L L.Anhui Agri Sci Bull.,2009,15(8):47-48;173.
刘妤,侯放,杨丽丽.安徽农学通报,2009,15(8):47-48;173.
[7]Pradhan B,Ki J.Phytother.Res.,2023,37(5):2 067-2 091.
[8]Mazepa E,Biscaia S M P,Bellan D,Trindade E,Simas F F.Carbohydr.Polym.,2022,289:119 436.
[9]Morelli A,Massironi A,Puppi D,Creti D,Domingo M E,Bonistalli C,Fabroni C,Morgenni F,Chiellini F.Flavour Fragr.J.,2019,34(6):411-425.
[10]Yuan Y,Zhang J,Fan J,Clark J,Shen P,Li Y,Zhang C.Food Res.Int.,2018,113:288-297.
[11]Kadam S U,Tiwari B K,Smyth T J,O′Donnell C P.Ultrason Sonochem.,2015,23:308-316.
[12]Hifney A F,Fawzy M A,Abdel G K M,Gomaa M.Food Chem.,2018,269:387-395.
[13]Lin W,Wang W,Liao D,Chen D,Zhu P,Cai G,Kiyoshi A.J Diabetes Res.,2015,2 015:1-12.
[14]De J R M,De Morais A,De M R.Mar Drugs,2015,13(5):2 967-3 028.
[15]Yao W,Qiu H M,Cheong K L,Zhong S.Int.J.Biol.Macromol.,2022,221:472-485.
[16]Naveen J,Baskaran R,Baskaran V.Algal Res.,2021,55:102 250.
[17]Kadam S U,Tiwari B K,O′Donnell C P.Int.J.Food Sci.Technol.,2015,50(1):24-31.
[18]Pramanik S,Singh A,Abualsoud B M,Deepak A,Nainwal P,Sargsyan A S,Bellucci S.RSC Adv.,2024,14(5):3 209-3 231.
[19]Rajauria G,Ravindran R,Garcia V M,Rai D K,Sweeney T,O′Doherty J.Food Hydrocoll.,2021,112:106 332.
[20]Rioux L E,Turgeon S L,Beaulieu M.Carbohydr.Polym.,2007,69(3):530-537.
[21]Ummat V,Sivagnanam S P,Rameshkumar S,Pednekar M,Fitzpatrick S,Rai D K,Padamati R B,O′Donnell C,Tiwari B K.Int.J.Biol.Macromol.,2024,256:128 195.
[22]Mccandless E L,Craigie J S,Walter J A.Planta,1973,112(3):201-212.
[23]Lahaye M.J Appl Phycol.,2001,13(2):173-184.
[24]Akter A,Sobuj M K A,Islam M S,Chakroborty K,Tasnim N,Ayon M H,Hossain M F,Rafiquzzaman S M.Future Foods,2024,10:100 440.
[25]Jiao G,Yu G,Zhang J,Ewart H S.Mar Drugs,2011,9(2):196-223.
[26]Hentati F,Tounsi L,Djomdi D,Pierre G,Delattre C,Ursu A V,Fendri I,Abdelkafi S,Michaud P.Molecules,2020,25(14):3 152.
[27]Cunha L,Grenha A.Mar Drugs,2016,14(3):42.
[28]Cumashi A,Ushakova N A,Preobrazhenskaya M E,D′Incecco A,Piccoli A,Totani L,Tinari N,Morozevich G E,Berman A E,Bilan M I,Usov A I,Ustyuzhanina N E,Grachev A A,Sanderson C J,Kelly M,Rabinovich G A,Iacobelli S,Nifantiev N E.Glycobiology,2007,17(5):541-552.
[29]Xing M,Li G,Liu Y,Yang L,Zhang Y,Zhang Y,Ding J,Lu M,Yu G,Hu G.Carbohydr.Polym.,2023,303:120 470.
[30]Sanjeewa K K A,Jayawardena T U,Kim S Y,Kim H S,Ahn G,Kim J,Jeon Y J.Algal Res.,2019,41:101 561.
[31]Yang F,Hyun J,Nagahawatta D P,Kim Y M,Heo M S,Jeon Y J.Antioxidants,2022,11(12):2 442.
[32]Chiellini F,Morelli A.[M]//PIGNATELLO R.Biomaterials - Physics and Chemistry.InTech.,2011.
[33]Don T M,Liu L M,Chen M,Huang Y C.Algal Res.,2021,58:102 423.
[34]Yaich H,Garna H,Besbes S,Paquot M,Blecker C,Attia H.Food Hydrocoll.,2013,31(2):375-382.
[35]Guidara M,Yaich H,Amor I B,Fakhfakh J,Gargouri J,Lassoued S,Blecker C,Richel A,Attia H,Garna H.Carbohydr.Polym.,2021,253:117 283.
[36]Nishinari K,Fang Y.Food Struct.,2017,13:24-34.
[37]Otero P,Carpena M,Garcia O P,Echave J,Soria-lopez A,Garcia-perez P,Fraga-corral M,Cao H,Nie S,Xiao J,Simal-gandara J,Prieto M A.Crit.Rev.Food Sci.Nutr.,2023,63(13):1 901-1 929.
[38]Zhang Y,Fu X,Duan D,Xu J,Gao X.J Oceanol Limnol.,2019,37(3):815-824.
[39]Ying Z,Han X,Li J.Food Chem.,2011,127(3):1 273-1 279.
[40]Das R S,Tiwari B K,Selli S,Kelebek H,Garcia-vaquero M.Algal Res.,2025,86:103 896.
[41]Kadam S,O′Donnell C,Rai D,Hossain M,Burgess C,Walsh D,Tiwari B.Mar.Drugs,2015,13(7):4 270-4 280.
[42]Hanjabam M D,Kumar A,Tejpal C S,Krishnamoorthy E,Kishore P,Ashok K K.Bioact.Carbohydr.Diet.Fibre.,2019,20:100 200.
[43]Hans N,Pattnaik F,Malik A,Naik S.Algal Res.,2023,74:103 199.
[44]Saravana P S,Cho Y N,Woo H C,Chun B S.J Clean Prod.,2018,198:1 474-1 484.
[45]Nguyen T T,Mikkelsen M D,Tran V H N,Trang V T D,Rhein-knudsen N,Holck J,Rasin A B,Cao H T T,Van T T T,Meyer A S.Mar.Drugs,2020,18(6):296.
[46]Rostami Z,Tabarsa M,You S,Rezaei M.Process Biochem.,2017,58:289-297.
[47]Magnusson M,Yuen A K L,Zhang R,Wright J T,Taylor R B,Maschmeyer T,De N R.Algal Res.,2017,23:28-36.
[48]Boulho R,Marty C,Freile-pelegrín Y,Robledo D,Bourgougnon N,Bedoux G.J.Appl.Phycol.,2017,29(5):2 219-2 228.
[49]Ren B,Chen C,Li C,Fu X,You L,Liu R H.Carbohydr.Polym.,2017,173:192-201.
[50]Imbs T I,Ermakova S P,Malyarenko (Vishchuk) O S,Isakov V V,Zvyagintseva T N.Carbohydr.Polym.,2016,135:162-168.
[51]Shao P,Chen X,Sun P.Int.J.Biol.Macromol.,2013,62:155-161.
[52]Suresh V,Senthilkumar N,Thangam R,Rajkumar M,Anbazhagan C,Rengasamy R,Gunasekaran P,Kannan S,Palani P.Process Biochem.,2013,48(2):364-373.
[53]Zhu F,Du B,Xu B.Crit.Rev.Food Sci.Nutr.,2018,58(8):1 260-1 270.
[54]Wang L,Cui Y R,Wang K,Fu X,Xu J,Gao X,Jeon Y J.Int.J.Biol.Macromol.,2022,222:2 065-2 071.
[55]Pei Y,Yang S,Xiao Z,Zhou C,Hong P,Qian Z J.Front Bioeng.Biotechnol.,2021,9:794 818.
[56]Obluchinskaya E D,Pozharitskaya O N,Shikov A N.Mar.Drugs,2022,20(10):606.
[57]Laurienzo P.Mar.Drugs,2010,8(9):2 435-2 465.
[58]Yim S K,Kim K,Kim I,Chun S,Oh T,Kim J U,Kim J,Jung W,Moon H,Ku B,Jung K.Mar.Drugs,2021,19(4):219.
[59]Wang W,Wu J,Zhang X,Hao C,Zhao X,Jiao G,Shan X,Tai W,Yu G.Sci.Rep.,2017,7(1):40 760.
[60]Pliego C H,Hardouin K,Bedoux G,Marty C,Cérantola S,Freile P Y,Robledo D,Bourgougnon N.Mar.Drugs,2022,20(2):116.
[61]Hentati F,Delattre C,Ursu A V,Desbrières J,Le C D,Gardarin C,Abdelkafi S,Michaud P,Pierre G.Carbohydr.Polym.,2018,198:589-600.
[62]Huo Y F,Li Y T,Xia W,Wang C,Xie Y Y,Wang Y B,Zhou T,Fu L L.Glycoconj J.,2021,38(5):573-583.
[63]Liu Q M,Xu S S,Li L,Pan T M,Shi C L,Liu H,Cao M J,Su W J,Liu G M.Carbohydr.Polym.,2017,165:189-196.
[64]Wang C,Huang L,Huang Y,Tian X,Liu J.Molecules (Basel,Switzerland).,2023,28(23):7 794.
[65]Li N,Liu X,He X,Wang S,Cao S,Xia Z,Xian H,Qin L,Mao W.Carbohydr.Polym.,2017,159:195-206.
[66]Qiu Y,Xu J,Liao W,Wen Y,Jiang S,Wen J,Zhao C.J.Adv.Res.,2023,52:103-117.
[67]Charoensiddhi S,Conlon M,Methacanon P,Parinda T,Parichat H,Zhang W.J.Funct.Foods,2022,96:105 204.