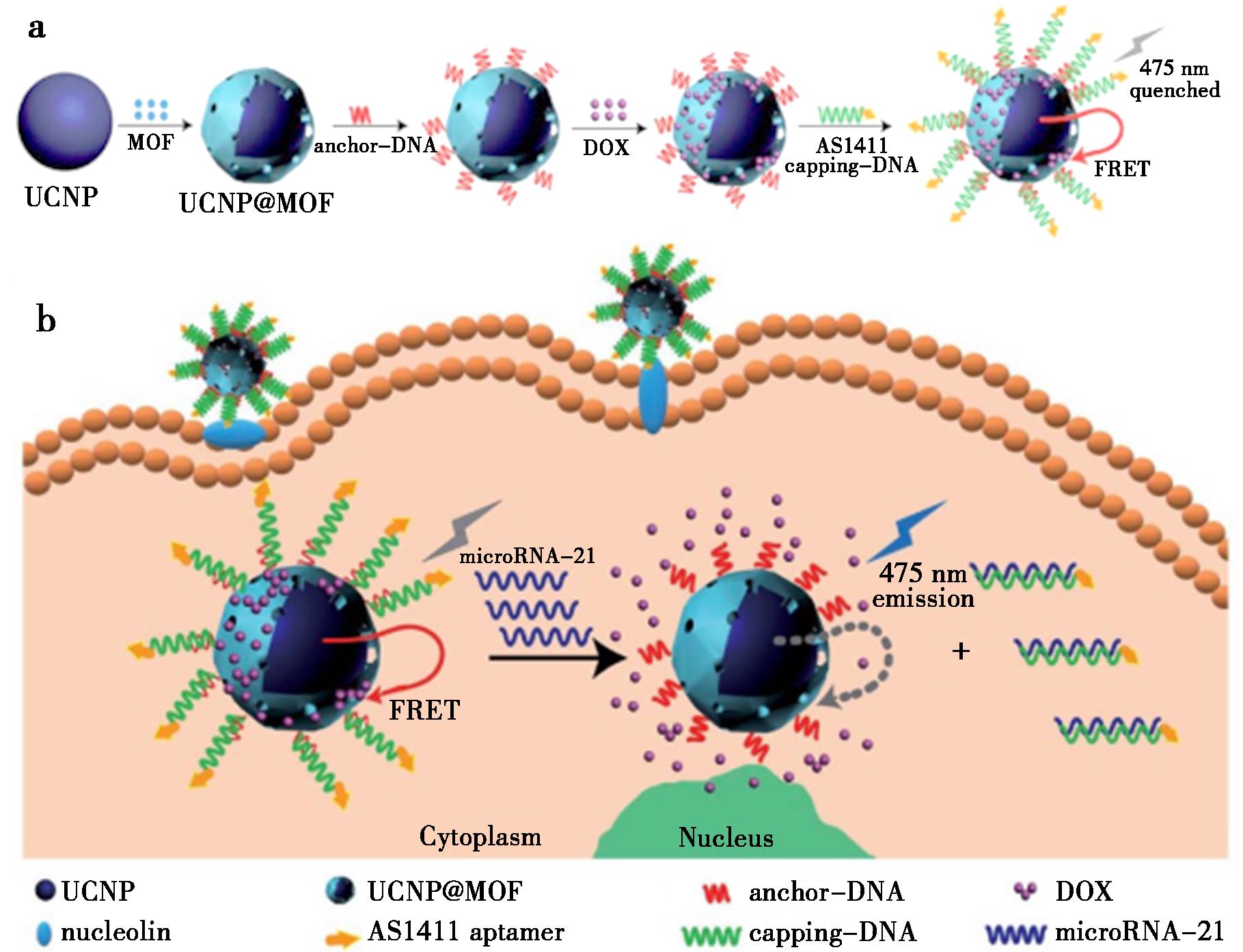
图1 a.多功能纳米探针的合成示意图;b.miRNA检测和靶向响应性药物递送过程[23]
Fig.1 a.Synthetic schematic illustration of multifunctional nanoprobes;b.Processes of miRNA detection and target-responsive drug delivery[23]
肿瘤作为全球以及我国第二大致死病因,给居民健康及社会经济发展带来沉重负担。防治肿瘤是“健康中国”建设的关键一环[1,2],其治疗方法一直是医学领域的研究热点。目前,肿瘤的治疗方法主要有手术治疗、放射治疗、化学治疗、免疫治疗、基因治疗和药物传输等[3]。药物传输是将药物封装于纳米材料上,以其为载体,精准递送至给药部位的技术[4],既解决了传统给药方式受吸收、分布、代谢、排泄等因素制约的问题,也在一定程度上使药物在体内的释放速率和时间等得到可控化,极大地提升了药物疗效、降低了药物副作用[5-9]。因此,近年来,药物传输在医学领域备受关注。
药物传输依赖载体实现靶向诊疗,载体筛选是关键。药物传输载体种类多样,包括有机纳米载体(如脂质体、聚合物纳米粒、胶束)、无机纳米载体(如纳米金、二氧化硅纳米粒子、磁性纳米粒子)、生物载体(如外泌体、红细胞)和稀土掺杂上转换纳米材料等。稀土掺杂上转换纳米材料(Rare-earth-elements-doped Upconversion Nanoparticles,REEs-UCNPs)由基质材料、激活剂和敏化剂(稀土元素)组成,常见的如NaYF4∶Yb,Er、NaYF4∶Yb,Tm等[10]。REEs-UCNPs可通过表面修饰介孔二氧化硅、靶向分子(如叶酸)及生物相容性材料(如PEG)等,实现高效药物负载、精准靶向递送和智能控释,显著提升药物传输效率。作为一种光学性质良好、光稳定性好、组织穿透能力强的纳米载体[11,12],克服了有机载体载药量低、药物递送难控与无机载体生物相容性差、副作用难以预测等诸多问题,具有肾清除率低、可延长血浆半衰期、减小药物损失等优点[13],是肿瘤药物传输载体的理想选择。在药物传输靶向杀死肿瘤细胞的过程中,由于肿瘤组织的血管结构具有高通透性和淋巴回流缺失的特点,即增强的渗透性和滞留效应(EPR效应),纳米级别的REEs-UCNPs能够通过肿瘤组织中异常的血管内皮间隙(通常为100~800 nm)进入肿瘤组织,并在肿瘤部位滞留,从而实现药物在肿瘤组织的被动富集[14-17],并且REEs-UCNPs还能穿过血脑屏障到达中枢神经系统,实现集检测、成像、诊断、治疗于一体的作用[18,19]。
为了深入探究REEs-UCNPs作为载体在肿瘤药物传输治疗中的作用和疗效,本文归纳总结了REEs-UCNPs在肿瘤药物传输中起到的主要作用,梳理了以其为载体在肿瘤药物传输联合治疗的最新研究进展和存在的问题。为肿瘤药物传输治疗研究、功能性REEs-UCNPs制备与应用开发提供科学依据和思路。
药物传输克服传统给药方式的壁垒,可以将药物以特定方式递送到生物体内目标部位。REEs-UCNPs作为一种稀土纳米载体,在肿瘤药物传输中主要发挥以下几方面作用。
REEs-UCNPs的靶向相应性释放作用,是指纳米颗粒凭借自身特性精准定位特定靶标,如肿瘤细胞标志物等,当与靶标结合后,会依据周围环境的特定刺激(酶浓度、pH和温度等)启动内部药物释放机制,使药物在靶区精准释出,从而提升疗效并降低对正常组织的伤害[20,21]。
2021年,Wang等[22]构建了一种靶向成像治疗系统,即可降解肽修饰的纳米粒子Degradable Peptide-modified Nanoparticles(ZUPEA),是将NaYF4∶Yb,Er与聚合物mPEG-PLGA经双乳液合成聚成纳米微球,聚合时引入光敏剂酞菁锌(ZnPc),再用cMBP肽修饰生成ZUPEA。ZUPEA基于cMBP肽对MET的正靶向成像及增强渗透性能在体内特异性识别MDA-MB-231细胞。受特定波长光刺激后,纳米微球中ZnPc被激发,发生光动力反应产生活性氧物种(ROS,如单线态氧等),进而损伤并杀死MDA-MB-231肿瘤细胞。以此实现肿瘤组织处药物精准释放,达到精准治癌的目的,降低对正常组织毒副作用。同年,Zuo等[23]报告了一种多功能基于DNA杂合门控NaYF4∶Yb,Tm@MOF/DOX的上转换纳米探针,原理如图1所示。该探针可在乳腺癌细胞处靶向释放药物阿霉素(Hydroxyldaunorubicin,DOX),该药具有较强的抗肿瘤作用,能抑制肿瘤细胞的合成,有强烈的细胞毒性,微小RNA-21(microRNA-21,miR-21)是致癌miRNA之一,会在乳腺癌中过表达[24],纳米探针与miR-21特异性识别后,触发探针中装载的药物DOX释放,进而减少对正常细胞的危害。2022年,Wang等[25]报告了一种用于肿瘤治疗的近红外上转换控制原位合成大分子治疗剂,此治疗剂含NaYF4∶Yb,Tm、抗CD20适体以及肉桂酸(CA)修饰的线性聚合物[pHEMA(CA)]。CA修饰的聚合物的光交联可诱导受体的聚集[26-28],借助受体-适体相互作用,CA靶向附着于细胞表面,在980 nm近红外激光照射下,细胞表面发生光交联,CD20受体聚集,引发细胞凋亡。该研究不仅展现了REEs-UCNPs的靶向响应释放特性,又为肿瘤治疗开拓新方向,具有临床转化前景。2024年,Liu等[29]研发出一种基于NaYF4∶Yb,Tm@NaYF4的纳米载体,在轴向位置用多靶向八面体铂(Ⅳ)前药和苯丁酸(PHB)提高顺铂的治疗效果,再在载体上连接精氨酸-甘氨酸-天冬氨酸肽(RGD)。PHB可以降低修复铂诱导DNA损伤的能力,从而增强化疗的有效性,肽的连接赋予纳米载体高生物相容性和肿瘤特异性,可以通过上转换发光(UCL)照射和谷胱甘肽(GSH)还原来触发可控地释放Pt(Ⅱ)物质和PHB,引发DNA损伤并最终诱导肿瘤细胞凋亡与坏死,达到可控治疗,该复合物在体内外均展现出优秀的靶向释放肿瘤抑制药物的能力。

图1 a.多功能纳米探针的合成示意图;b.miRNA检测和靶向响应性药物递送过程[23]
Fig.1 a.Synthetic schematic illustration of multifunctional nanoprobes;b.Processes of miRNA detection and target-responsive drug delivery[23]
由于体内复杂状况,以及个体与疾病微环境的多变性,REEs-UCNPs的临床应用目前还有诸多限制,但REEs-UCNPs的靶向释放作用突出,其应用潜力巨大。例如,挖掘各类疾病特异性靶标分子提高靶点识别精准度以减少脱靶情况,深入探究人体内长期代谢、免疫反应及生理机能对药物传输的影响,为REEs-UCNPs临床应用夯实安全基础,促进其从实验室迈向临床实践,推动精准医疗前行。
将REEs-UCNPs应用于肿瘤生物成像领域,可以实现深层组织穿透显影、多模态成像、高灵敏捕捉肿瘤微环境以及长时间动态追踪等。
2022年,Yan等[30]开发了一种用于乳腺癌治疗和肝转移预防的智能药物递送纳米平台REEs-UCNPs@mSiO2@Ce6&α-ketoglutarate&GOx@mMnO2@HA(UCAGMH),该平台由NaYF4∶Yb,Er、α-酮戊二酸(α-ketoglutarate)、葡萄糖氧化酶(GOx)、MnO2、二氢卟吩e6(Ce6)组成。该系统中,MnO2在酸性条件(肿瘤细胞内)下迅速降解,产生大量的Mn2+和O2,Mn2+为磁共振成像(MRI)的造影剂和理想的类芬顿试剂;O2可缓解缺氧状况,并可通过促进葡萄糖氧化酶(GOx)氧化肿瘤内葡萄糖(Glu)的方式促进光动力学治疗(PDT),同时可以实现饥饿治疗(ST)。该纳米平台可以实现多模态成像,即Ce6赋予的荧光成像、REEs-UCNPs提供的计算机断层扫描和Mn2+引导的MRI,可实现可视化的治疗过程,进而精确指导肿瘤治疗。实验证明,经UCAGMH处理的小鼠肿瘤大小显著减小,小于初始肿瘤体积的30%。H&E染色表明,在980 nm照射后,用UCAGMH处理的肿瘤有严重组织损伤,表明该系统有效杀伤了肿瘤细胞,同时充分体现了NaYF4∶Yb,Er在药物传输时优秀的显像作用。2023年,Hu等[31]将环糊精(CD)和谷胱甘肽(GSH)修饰的金纳米团簇(cgAuNCs)偶联在降/升转换纳米颗粒(D/UCNPs)NaErF4@NaYF4的表面,制备了相应纳米组装体,原理如图2所示。cgAuNCs对内源性GSH可增强荧光响应,在808 nm激发光照射下,该组装体显示出3个发射带(波长分别为660、1 060和1 550 nm)输出用于肿瘤成像的荧光信号,同时实现荧光成像和光动力学组合治疗肿瘤,此外,还利用CD的空腔负载阿霉素(DOX)达到了药物传输的效果,为设计用于肿瘤的体内成像和治疗的多功能纳米平台提供了新的方法,使REEs-UCNPs在药物传输中优秀的显像能力在肿瘤微环境中得以应用。

图2 用于肿瘤微环境增强的比率NIR-Ⅱ荧光成像和化学/光动力联合治疗的D/UCNP@cgAuNCs纳米组装示意图[31]
Fig.2 Schematic illustration of the D/UCNP@cgAuNCs nanoassemblies for tumor microenvironment-enhanced ratiometric NIR-Ⅱ fluorescence imaging and chemo-photodynamic combination therapy[31]
尽管REEs-UCNPs应用于肿瘤显像益处良多,然而在复杂的生物体内环境中,其成像分辨率有时难以达到理想状态,清晰度下降可能导致难以准确分辨微小的病变组织或细胞结构。另外,REEs-UCNPs的制备成本较高,难以实现大规模生产,在一定程度上限制了其在临床应用和商业化推广。未来研究应破解这些难题,将REEs-UCNPs精密显像作用融入智能诊疗系统,根据肿瘤微环境变化进行动态调整,助力临床实践,造福患者。
REEs-UCNPs组织穿透能力强,可吸收低能光子发射高能光子。凭借此特性,REEs-UCNPs可载带药物实现药物在体内深层组织穿透。
2022年,Lee等[32]制备了一种透明质酸盐-BP-上转换纳米颗粒Hyaluronate-BP-Upconversion Nanoparticle(HA-BP-UCNPs复合物),该复合物由透明质酸盐(HA)、黑磷(BP)和NaYF4∶Yb,Tm组成,它可以通过非侵入性透皮递送的光声学(PA)生物成像进行深度皮肤穿透。吸湿性HA可以使皮肤屏障的角质层水合,HA主链上的疏水性结构域可增强HA对皮肤的渗透性[33,34],HA-BP-UCNPs复合物中的HA助力BP抵达皮下肿瘤组织。使用REEs-UCNPs作为光输送平台将紫外线蓝光输送到深层组织层中,在980 nm近红外光照射下,REEs-UCNPs可以敏化HA-BP-UCNP复合物中的BP进行PDT。980 nm NIR光转化为UV-蓝光产生ROS,PA成像图显示,HA-BP-UCNP复合物可以在30 min内渗透至 0.206 mm,这足以到达表皮层中约0.1 mm深的皮肤癌部位。该研究在REEs-UCNPs药物传输在深层组织穿透的应用中,实现了跨越性进步。2023年,Juengpanich等[35]针对胆囊癌(GBC)开发了一种用人表皮生长因子受体-2(HER2)靶向GBC治疗的酸性应答性的纳米平台Stimuli-sensitive Tumor-targeted Photodynamic Nanoparticles(STPNs),该平台由NaGdF4∶Yb,Tm@CaF2∶Eu、刺激响应性聚合物配体(SPL)、曲妥珠单抗(TZB)和卟啉衍生物(Pu18)组成,原理如图3所示。STPNs在静脉内给药前接受980 nm激光照射刺激,由于HER2受体靶向GBC肿瘤细胞,所以STPNs可在肿瘤细胞内部深度积聚。由于肿瘤的酸性环境,STPNs被分解成游离的UCNPs,Pu18具有持续发光特性,因此STPNs可持续产生ROS,从而抑制NFκB核转位,导致肿瘤细胞凋亡。深部肿瘤的光疗会受到无效的肿瘤穿透、低肿瘤选择性和光疗剂的高光毒性的阻碍,而STPNs在静脉给药前,用980 nm激光照射预激活的独特能力会绕过这些障碍,其特殊的抗肿瘤特性结合了REEs-UCNPs和Pu18持续发光的优势,代表了极具前景的深层肿瘤光治疗策略,在全身给药前预先激活STPNs的独特设计给临床治疗带来深远影响。

图3 STPNs自组装及其pH响应机制的示意图[35]
Fig.3 Schematic representation of self-assembled STPNs and pH-responsive mechanism of STPNs[35]
REEs-UCNPs增强组织穿透能力的优势明显,但也存在不足,比如个体组织生理特性的差异会影响其穿透效率和路径,肥胖者脂肪组织多,对REEs-UCNPs穿透阻碍大,瘦者相对有利。个体差异使得REEs-UCNPs穿透效果不稳定,难以精准把控和预估在每个个体中的穿透程度,未来相关方面研究还有很大提升空间。
REEs-UCNPs的独特性质使得它们能够作为高效的药物载体,可与多种疗法相结合实现对疾病的协同治疗。目前,以REEs-UCNPs为载体的肿瘤药物传输与其他治疗技术联合在肿瘤治疗领域展现出了巨大的潜力,尤其是与化学治疗、气体治疗、光动力治疗和免疫治疗等联合具有显著增效作用。
化学治疗,即化疗,以起效快,控制病灶迅速为主要特点。同时它还是一种全身性治疗手段,但这种方法具有极大的副作用,如骨髓抑制、消化道反应(恶心、呕吐、腹泻、便秘等)和脱发等[36]。将化疗与药物传输联合应用时,可起到药物增效减毒作用,可降低药物对非靶位正常细胞的毒性。
2023年,Qian等[37]开发了一种集治疗、监测和靶向功能于一体的近红外光触发和肿瘤微环境(TME)响应的药物递送平台(UCSSDH),原理如图4所示。先将光敏剂二氢卟酚e6(Ce6)掺杂在NaYF4∶Yb,Er@NaGdF4中,再将活性氧响应性物质包覆于上一步产物上,最后负载化疗药物DOX,以实现药物的控制释放。由于透明质酸(HA)能够识别CD44受体,从而识别肿瘤细胞,所以将其连接到纳米复合材料的表面以主动区分肿瘤细胞。当该递送平台进入肿瘤细胞时,在近红外光(980 nm)的照射下,NaYF4∶Yb,Er@NaGdF4激发Ce6产生单线态氧(1O2),一方面可引起DOX的突发释放来杀伤肿瘤细胞,另一方面1O2可以直接诱导细胞凋亡。研究结果表明,UCSSDH+NIR处理组相对于对照组表现出明显的肿瘤抑制效应,抑制效率高达95%,且肿瘤部位的H&E染色细胞大量坏死。该研究通过 UCSSDH实现了肿瘤的有效化学治疗,同时实现了药物的靶向递送。2024年,Ning等[38]设计了一种多功能上转换纳米平台(MUCEN),实现了光敏剂二氢卟吩(Ce6)和表阿霉素(EPI)的双重包封,具有自噬抑制、PDT和化疗三重作用,可以增强抗癌治疗。该平台能用于碱性化溶酶体并抑制自噬,在NIR照射下,MUCEN可将980 nm激光转换为可见光,激活Ce6产生ROS以对抗深部组织中的肿瘤细胞,在体内外均表现出了肿瘤抑制作用。体内试验表明,该平台能显著抑制肿瘤生长;免疫组化结果表明,它有效地增加了肿瘤组织中自噬抑制剂的表达。该平台不仅是化疗药物和REEs-UCNPs的优良载体,也为肿瘤治疗提供了一种新的策略。
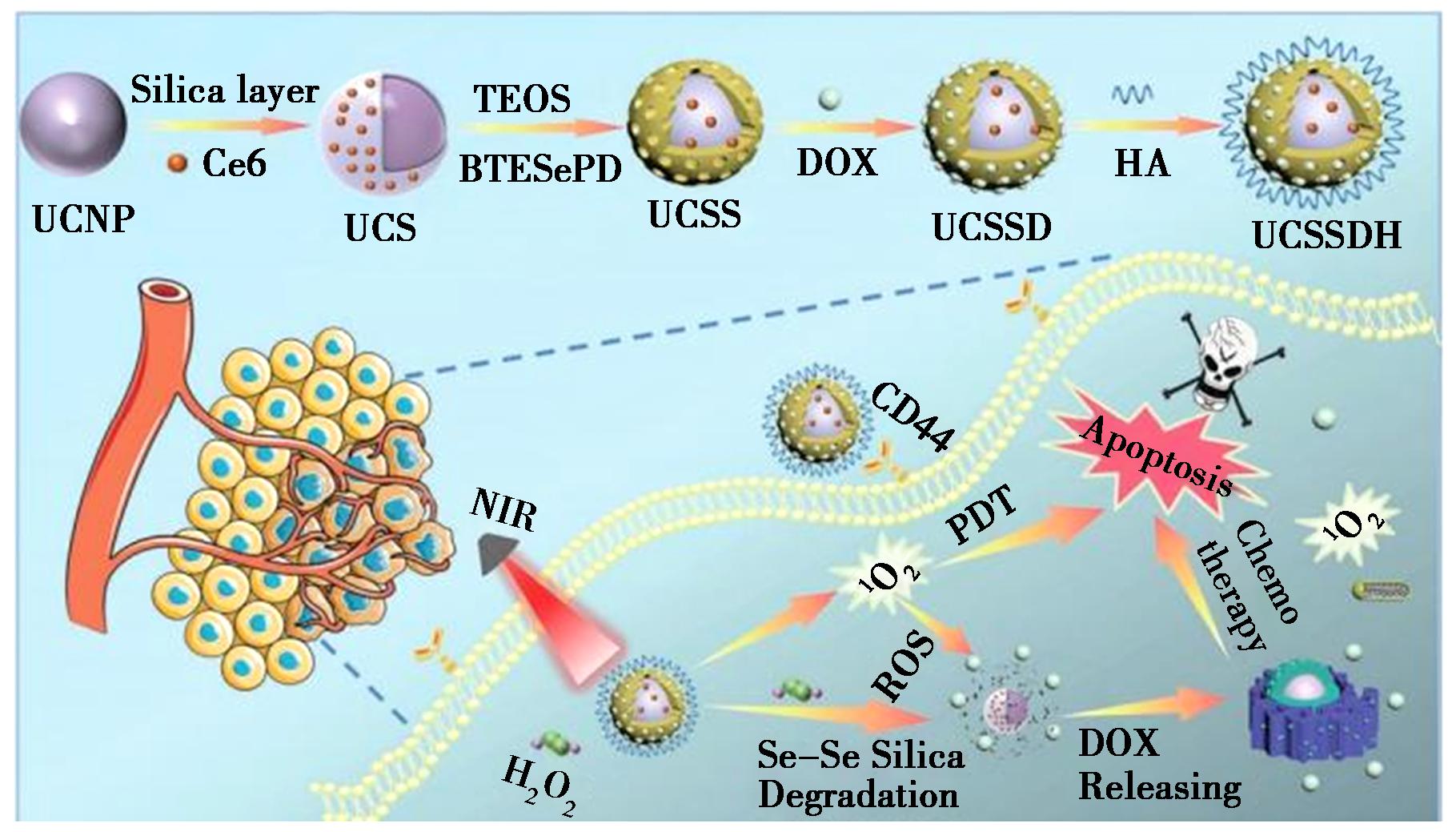
图4 用于肿瘤的协同化学光动力学治疗的UCSSDH和NIR光触发和TME激活的智能纳米平台的合成路线示意图[37]
Fig.4 The illustration for synthetic route of UCSSDH and NIR light triggered and TME-activated intelligent nanoplatform for synergistic chemo-photodynamic therapy of tumors[37]
总之,REEs-UCNPs与化疗联合优势尽显。它不仅能增强药物靶向性,精准作用于肿瘤组织,降低对正常组织的毒副反应,而且能借助NIR实现时空控释,根据治疗需求灵活释药,提升肿瘤局部药物浓度与疗效。另外,REEs-UCNPs产生的光热、光动力效应改变微环境,与化疗药物协同可产生“1+1>2”的效果,药物传输与化疗联合应用有力抑制了肿瘤的生长与转移,为抗癌治疗开拓了新路径。
气体治疗是利用特定气体分子的生物学特性,向机体输送药用气体,凭借其物理化学与生物学效应,精准干预细胞、调节信号通路、改善病理状态,实现疾病预防、诊断与治疗的策略[39,40]。
近年来,纳米技术在癌症治疗领域取得显著进展,其中基于REEs-UCNPs的药物传输联合气体治疗为癌症治疗带来了新的希望。2023年,Opoku-damoah等[41]首次报道了一种脂质涂层的治疗性载气纳米制剂(Therapeutic Gas-loaded Nano-formulations,LUGCF)用于结肠癌的治疗,原理如图5所示。该系统由NaYF4∶Yb,Tm,Ho@NaYF4∶Nd和两种气体释放分子(S-亚硝基谷胱甘肽GSNO和CO释放分子CORM)共同组成。在808 nm的NIR照射下,NaYF4∶Yb,Tm,Ho@NaYF4∶Nd产生360 nm的光子,这些UV光子分别触发上述气体释放分子同时释放NO和CO。实验证明,NO/CO都被释放且随后产生ROS,从而杀伤肿瘤细胞。这种CO/NO组合纳米平台抑制肿瘤生长率高达87.5%,为未来双气体癌症治疗的生物医学应用提供了一种有前途的治疗策略。2024年,Wang等[42]设计了一种近红外光激发的NO纳米牵引器,在NaErF4∶Tm@NaYF4@NaYbF4∶Tm@NaYF4表面用介孔SiO2不对称涂覆,然后装载NO供体和PDT光敏剂(酞菁锌,ZnPc)。在980 nm激光的激发下,NaErF4∶Tm@NaYF4@NaYbF4∶Tm@NaYF4发出的蓝光可以激活NO供体产生NO气体。由于非对称结构,NO气体作为驱动力,以194.42 μm/s的高速实现自推进,NO气体驱动的机械运动对细胞膜产生显著的破裂应力(>0.95 kPa),促进了细胞内吞和肿瘤内渗透。同时,NO气体干扰线粒体功能,抑制细胞呼吸,使氧自由基减少。当将激发波长改变为808 nm近红外光照射时,从NaErF4∶Tm@NaYF4@NaYbF4∶Tm@NaYF4发射的红光可激活ZnPc产生ROS杀伤肿瘤细胞。研究结果表明,该牵引器可以克服缺氧问题并能抑制肿瘤生长,有望成为未来肿瘤治疗的有效工具。
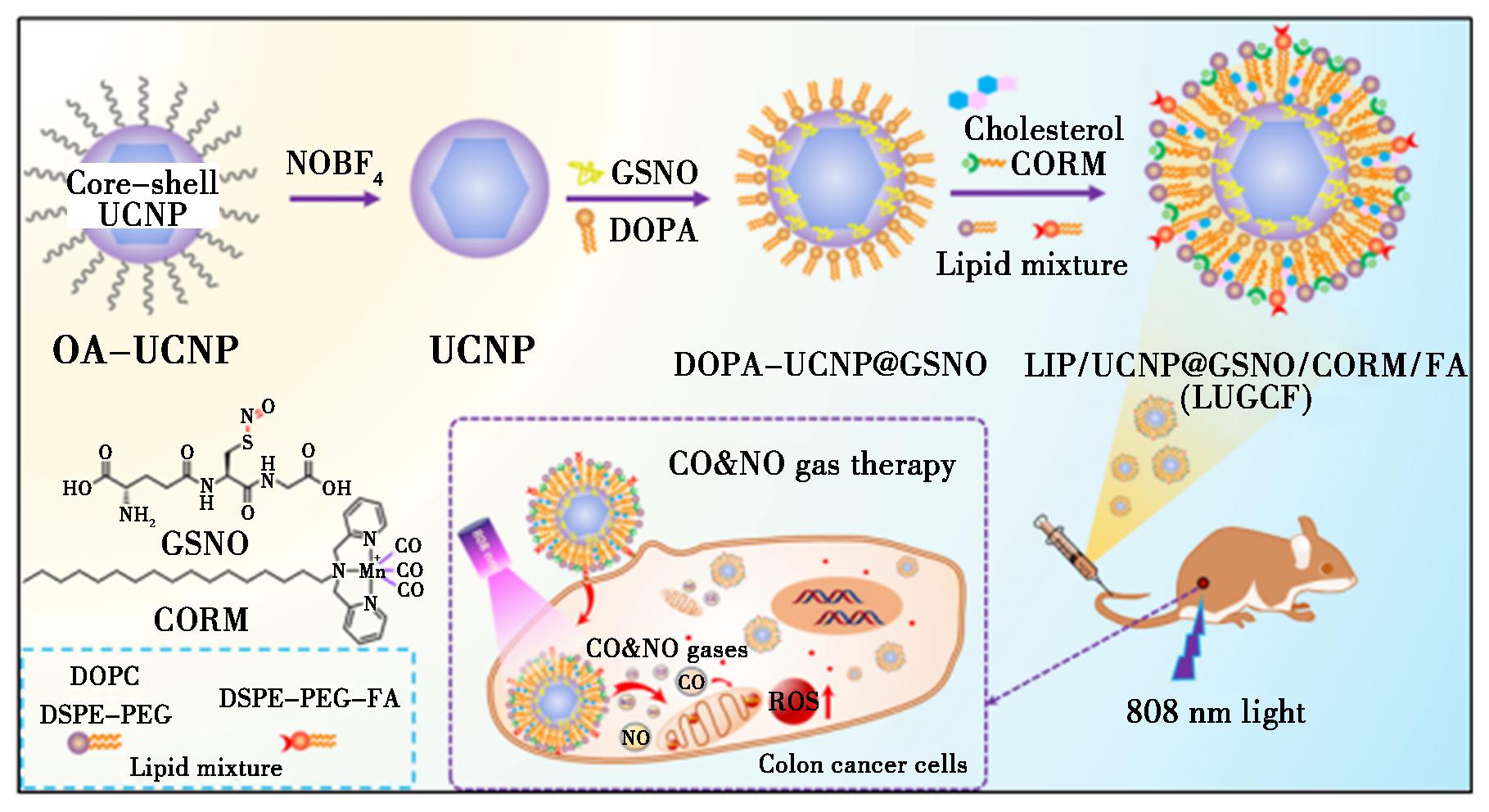
图5 LUGCF合成及气体治疗示意图[41]
Fig.5 Schematic illustration of the synthesis of LUGCF and gas therapy[41]
REEs-UCNPs药物传输与气体治疗联用前景广阔,尤其是肿瘤治疗方面,REEs-UCNPs可制成精准的靶向递药系统,在NIR激发下能定点释药并触发气体释放,增强抗癌力。展望未来,有望打造集诊断、递药与气体治疗于一体多功能纳米平台,实现诊疗一体化。
光动力治疗(Photodynamic Therapy,PDT)是一种联合应用光敏剂、特定波长光照射以及氧分子来选择性破坏靶组织的新型治疗技术[43]。将药物传输与光动力治疗相结合可以提供安全、无创检测与非侵入性治疗。
2023年,Mukherjee等[44]将叶酸(FA)封装于NaYF4∶Yb,Er中,嵌入多孔有机聚合物纳米纤维中,然后将功能化FA与有效靶向癌细胞A549的复合物连接,最后装载抗癌药物DOX,得到了一种用于光动力治疗研究的复合材料(UCNPs@TPDABA@FA),原理如图6所示。DOX可通过pH响应性释放药物。NaYF4∶Yb,Er既有荧光成像特性,又充当了光敏剂亚甲蓝的FRET供体,在光激发时产生ROS。研究发现,相对于对照组,A549细胞内ROS增多,说明该复合物对A549细胞具有较强的体外抑制作用,可作为光动力治疗的有效药物。该研究实现了药物传输与PDT的有效联合应用。2024年,Song等[45]开发了一种多功能DNA/REE-UCNPs复合物,其能够控制CRISPR-Cas9、氯高铁血红素和原卟啉(PP)协同实现PDT。Cas9 RNP可裂解抗氧化调节因子核因子E2(Nrf2),该因子可提高肿瘤细胞对ROS的敏感性,增强PDT的协同效应。NaYF4∶Yb,Er@NaYF4将具有深组织穿透性的NIR辐射转换为具有更短波长的光,激发PP将丰富的O2转化为1O2,基因编辑和PDT的整合使得1O2在癌细胞中大量积累,从而促进细胞凋亡,这种协同PDT在乳腺癌小鼠模型中表现出显著的治疗效果。
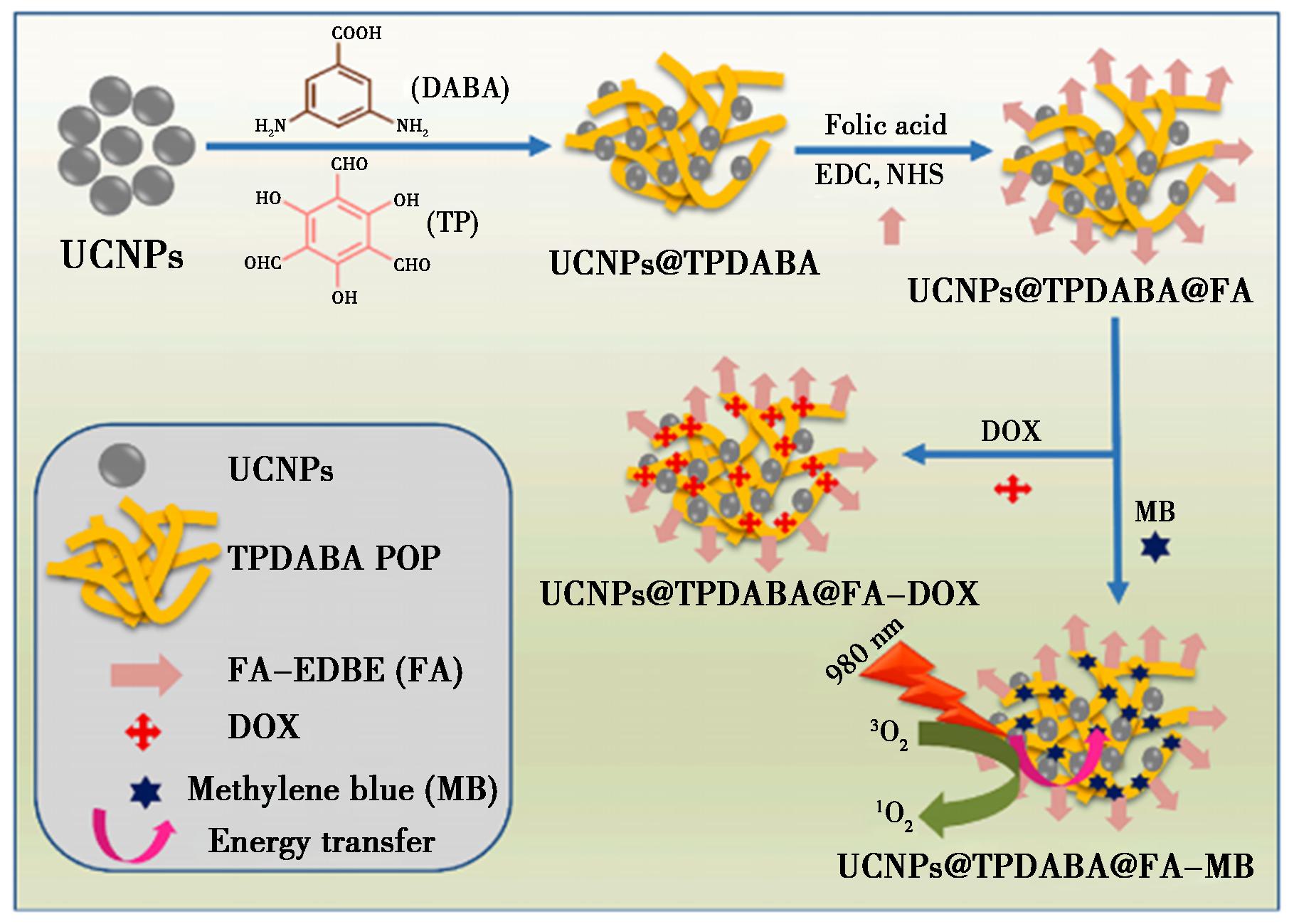
图6 用于化学疗法和光动力疗法的叶酸共轭上转换纳米粒子基POP纳米纤维复合物UCNPs@TPDABA@FA的示意图[44]
Fig.6 Schematic illustration of folic acid conjugated upconversion nanoparticle-based POP nanofiber composite UCNPs@TPDABA@FA for chemotherapy and photodynamic therapy[44]
尽管基于REEs-UCNPs药物传输联合光动力治疗潜力大,但存在光穿透浅、稳定性差、靶向性不准等局限性。未来需开发光子调控技术增加光穿透深度,融合生物技术精准定位靶向肿瘤细胞,为临床应用奠定坚实基础。
免疫治疗是指通过激发、增强或抑制机体自身免疫系统功能,利用人体免疫系统来对抗疾病的一系列治疗方法,在肿瘤学、自身免疫性疾病、感染性疾病等多个医学领域均有应用。通过表面修饰,REEs-UCNPs可以携带免疫刺激剂或基因治疗药物,实现药物的精准传输。这种联合疗法可以进一步增强抗肿瘤效果,并可克服单一疗法的局限性。
2023年,Kou等[46]报道了一种用于对抗乳腺癌的新型仿生药物递送纳米颗粒,可实现免疫原性和癌症免疫治疗。该纳米复合物由NaYF4∶Yb,Tm、免疫佐剂CpG与树突状细胞特异性适配体序列(CpG-Apt)融合组成,将阿霉素插入 Apt-CpG的碱基对中,构建出免疫纳米药物REEs-UCNPs@CpG-Apt/DOX(HR-UCAD),原理如图7所示。靶向分子透明质酸(HA)插入到红细胞膜(RBCm)中形成壳(HR)后可以特异性诱导免疫原性细胞死亡。结果显示,实验组在肿瘤部位显示出最强的上转换信号,表明该纳米颗粒具有靶向4T1肿瘤细胞的能力。TUNEL分析表明,由该纳米颗粒处理引起的凋亡细胞的比例显著高于其他组,证明该纳米复合物具有强大的抗肿瘤免疫反应,与Liu等[47]报道一致,REEs-UCNPs也十分契合靶向乳腺癌治疗的需求,此外,还能够达成免疫治疗与药物传输的双重功效,为乳腺癌的治疗开辟了新路径,有望提升乳腺癌治疗的有效性与精准性,在乳腺癌临床治疗领域展现出极为广阔的应用前景。2024年,Du等[48]提出了一种核-壳REEs-UCNPs@MOF异质结构,其中核NaGdF4∶Yb,Er@NaGdF4∶Yb,Nd作为光转换器,将808 nm处的近红外光辐射转换为UV/可见光,而卟啉MOF壳作为光敏剂和仿生纳米酶可产生多个活性氧化物物种(ROS)。通过Förster共振能量转移原理,能量从NaGdF4∶Yb,Er@NaGdF4∶Yb,Nd转移到MOF壳层。在肿瘤微环境中,MOF壳中节点处的Cu2+离子与过量的过氧化氢和谷胱甘肽(GSH)反应,通过纳米酶促过程和消耗GSH的过程产生更大的ROS效应。结果表明,NIR照射的肿瘤体积得到了显著抑制,并且原发性肿瘤在14 d后得到了完全根除,证明该结构和PDT的协同免疫治疗具有很高的效率。
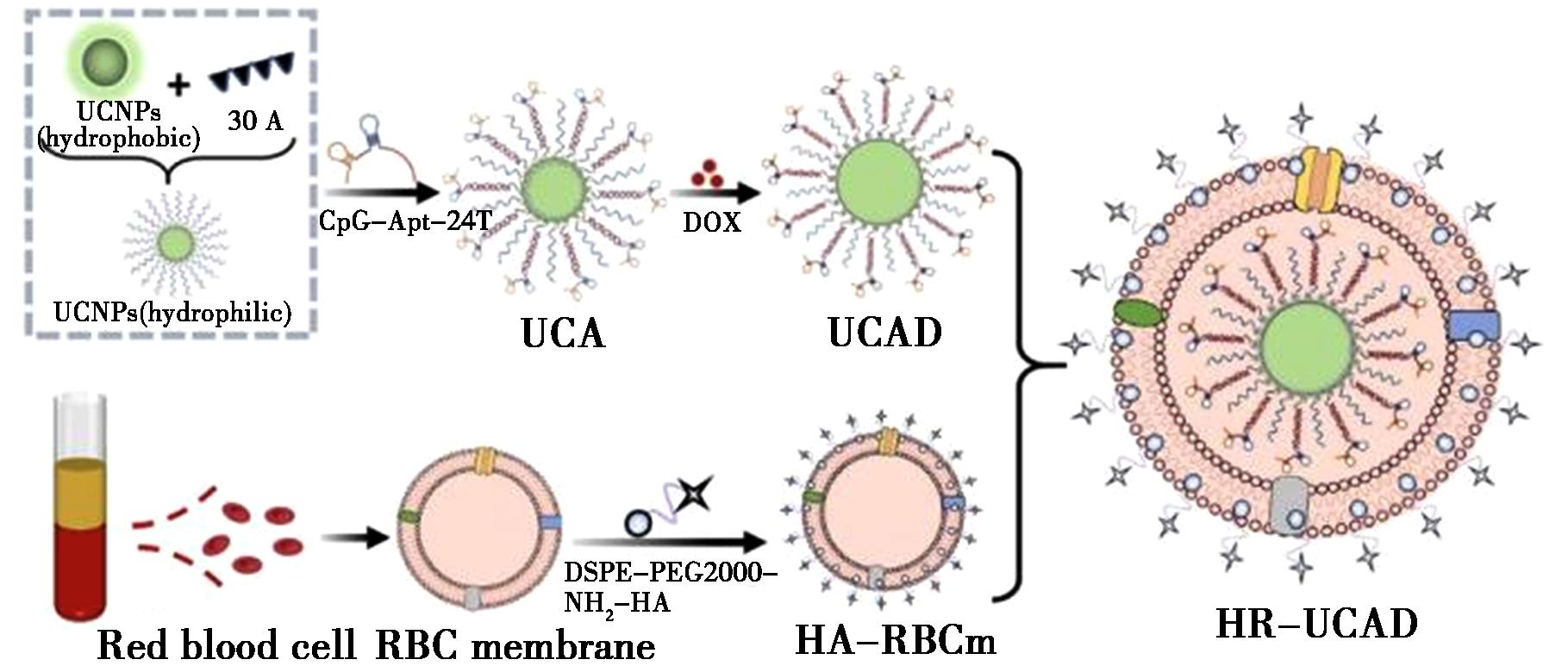
图7 HR-UCAD合成过程的示意图[46]
Fig.7 Schematic illustration of HR-UCAD synthesis process[46]
将免疫治疗与药物传输结合使用,不仅能实现精准治疗与协同增效,而且还能克服肿瘤的免疫逃逸。但是REEs-UCNPs的上转换量子产率相对较低,限制了其在光激活免疫治疗等方面的应用效率,可能导致免疫治疗药物的激活不充分或免疫佐剂的活性激发不足,影响治疗效果。因此,提高REEs-UCNPs量子产率是进一步提升其应用性能的关键之一。另外,在复杂的生物体内环境中,要实现其在肿瘤组织的精准、高效富集以及在肿瘤细胞内的准确摄取和释放,仍面临一定挑战。
本文综述了基于REE-UCNPs的药物传输在肿瘤治疗领域的最新研究进展,首先介绍了REE-UCNPs在肿瘤药物传输中的主要作用,其中靶向控制性释放作用和强组织渗透作用是提高REEs-UCNPs临床应用效果的关键。重点介绍了以REEs-UCNPs为载体的肿瘤药物传输与化学治疗、气体治疗、光动力治疗和免疫治疗等的联合应用,并分析了每一种联合应用的优势和不足。一方面,REEs-UCNPs介导的药物传输具有高效的药物负载与释放能力、精确的靶向定位能力和实时的药物追踪与监测能力,具有极大的应用潜力。另一方面,REEs-UCNPs的实际应用仍然面临着较大的挑战,例如,尽管REEs-UCNPs能显著增加生物传感和生物成像的灵敏度,但仍面临着有限的上转换效率。为此,有考虑利用染料敏化的REEs-UCNPs可以将窄带近红外吸收扩展到更合适的波长范围,但是其在体内和体外的稳定性和安全性有待商榷。针对这些问题,仍需要研究者深入研究改性的REEs-UCNPs的生物相容性、长期毒性以及在实际应用中的稳定性,进一步了解其在体内分布、代谢和排泄过程以及潜在的生物毒性。
总之,深入研究REEs-UCNPs结构和表面性质,进一步优化其制备条件,进而获得性能更加优良的REEs-UCNPs纳米粒子,并实现可控化合成,以提高其生物相容性、稳定性、药物传输可控性、靶向性和定位精度将是未来的重点研究方向。另外,基于REEs-UCNPs在肿瘤药物传输治疗这一研究方向,急需研究人员在材料科学、分析化学、预防医学和临床医学等相关学科交叉界面进行有效融合,积极为肿瘤治疗和人类健康服务作出卓有成效的探索。
[1]Fu J,Xia Y,Zhao R R,Zhou G Q,Li H Y.Chin.Gen.Pract.,2017,20(31):3 841-3 846.
付晶,夏瑶,赵瑞瑞,周光清,李海燕.中国全科医学,2017,20(31):3 841-3 846.
[2]Fu Y H,Rao Q Q,Li R T,Xu T L,Liu J M,Dong W L,Zhou M G,Yu S C,Hu G Q.Chin.J.Epidemiol.,2022,43(1):37-43.
傅晏红,饶蓁蓁,李若曈,徐婷玲,刘江美,董文兰,周脉耕,于石成,胡国清.中华流行病学杂志,2022,43(1):37-43.
[3]Lu X A,Yang Z J,Deng C M,Chen Z N.Acta Chin.Med.,2010,25(6):1 049-1 051.
陆新岸,杨泽江,邓朝明,陈振念.中医学报,2010,25(6):1 049-1 051.
[4]Ansari A A,Parchur A K,Chen G.Coord.Chem.Rev.,2022,457:214 423.
[5]Smolensky M H,Peppas N A.Chronobiology.Adv.Drug Delivery Rev.,2007,59(9/10):828-851.
[6]Xu W J,XiaoY,Zhao M Z,Zhu J H,Wang Y,Wang W B,Wang P,Meng H.Adv.Sci.(Weinh),2023,10(28):2 370 188.
[7]Waheed S,Li Z,Zhang F Y N,Chiarini A,Armato U,Wu J.Nanobiotechnology,2022,20(1):395.
[8]Osman N,Devnarain N,Omolo C A,Fasiku V,Jaglal Y,Govender T.Wiley Interdiscip.Rev.:Nanomed.Nanobiotechnol.,2022,14(1):e1 758.
[9]Park S H,Oh S G,Mun J Y,Han S S.Colloids Surf.B Biointerfaces,2006,48(2):112-118.
[10]Yin H,Meng Y,Qu C,Luo L X,Zhang L Y,Li S R,Meng P J.Chem.Reagents,2023,45(12):33-40.
殷慧,孟颖,曲超,罗利霞,张凌燕,李淑荣,孟佩俊.化学试剂,2023,45(12):33-40.
[11]Sun D,Sun X,Li D,Wang M,Song S,Liu C,Ma N,Yin X,Wang C.Colloids Surf.B Biointerfaces,2024,237:113 860.
[12]Wang Y,Zhu Y,Yu S,Jiang C.RSC Adv.,2017,7(65):40 973-40 989.
[13]Zhao J B,Zheng X L,Schartner E P,Lonescu P,Zhang R,Nguyen T L,Jin D,Ebendorff-heidepriem H.Adv.Opt.Mater.,2016,4(10):1 419.
[14]Wu B,Wang Z,Liu J,Li N,Wang X,Bai H C,Wang C,Shi J,Zhang S,Song J,Li Y.Nat.Commun.,2024,15(1):1-19.
[15]Brodie B B,Hogben C A M J.Pharm.Pharmacol.,1957,9(1):345-380.
[16]Wang C,Xu J,Cheng X,Sun J,Li F,Nie J,Zhang Y.Signal Transduction Targeted Ther.,2024,9(1):89.
[17]Hong G,Antaris A L,Dai H.Nat.Biomed.Eng.,2017,1(1):0 010.
[18]Osman N,Devnarain N,Omolo C A,Fasiku V,Jaglal Y,Govender T.Wiley Interdiscip.Rev.:Nanomed.Nanobiotechnol.,2022,14(1):e1 758.
[19]Zhang K,Wang J,Peng L,Zhang Y,Zhang J,Zhao W,Ma S,Mao C,Zhang S.Colloid Interface Sci.,2023,651:567-578.
[20]Juengpanich S,Li S J,Yang T R,Xie T N,Chen J D,Shan Y K,Lee J Y,Lu Z Y,Chen T,Zhang B,Cao J S,Hu J H,Yu J C,Wang Y F,Topatana W,Gu Z,Cai X J,Chen M Y.Nat.Commun.,2023,14(1):5 699.
[21]Xue Y W,Li L,Li M X,Sheng Q M.Acta Chim.Sin.,2024,82(11):1 180.
[22]Wang Y,Feng M,Lin B,Peng X,Wang Z,Lv R.Nanoscale,2021,13(43):18 125-18 133.
[23]Zuo C,Guo Y,Li J,Peng Z,Bai S,Yang S,Wang D,Chen H,Xie G.RSC Adv.,2021,11(15):8 871-8 878.
[24]Liu Y H,Liu Y.Mater.Chem.B,2022,10(6):958-965.
[25]Wang J,Qi J,Jin F,You Y,Du Y,Liu D,Xu X,Chen M,Shu G,Zhu L,Ying X,Ji J,Li W,Du Y.Nano Today,2022,42:101 360.
[26]Voevodin A,Campos L M,Roy X.J.Am.Chem.Soc.,2018,140(16):5 607-5 611.
[27]Tunc D,Coz L C,Alexandre M,Desbois P,Lecomte P.Carlotti P.Macromolecules,2014,47:8 247-8 254.
[28]Yano S,Iwase T,Teramoto N,Shimasaki T,Shibata M.Carbohydr.Polym.,2018,184:418-426.
[29]Liu X M,Zhu Z Z,He X R,Zou Y H,Chen Q,Wang X Y,Liu H M,Qiao X,Wang X,Xu J Y.ACS Appl.Mater.Interfaces,2024,16(31):40 753-40 766.
[30]Yan J H,Shao K,Wu L,Hu J,Man M,Li X,Kong X Y,Shi J S.ACS Appl.Nano Mater.,2022,5(10):15 473-15 487.
[31]Hu S,Huang L,Zhou L,Wu T,Zhao S,Zhang L.Anal.Chem.,2023,95(7):3 830-3 839.
[32]Lee G,Lee J H,Choi W,Kim C,Hahn S K.Biomacromolecules,2022,23(9):3 602-3 611.
[33]Brown M B,Jones S A.Eur.Acad.Dermatol.Venereol,2005,19:308-318.
[34]Kim H,Jeong H,Han S,Beack S,Hwang B W,Shin M,Oh S S,Hahn S K.Biomaterials,2017,123:155-171.
[35]Juengpanich S,Li S J,Yang T N,Chen J D,Shan Y K,Lee J,L Z Y,Chen T E,Zhang B,Cao J S,Hu J H,Yu J C,Wang Y F,Topatana W.Nat.Commun.,2023,14(1):5 699.
[36]Wang H Y,Quan Y,Luo J.Liaoning J.Tradit.Chin.Med.,2017,44(2):315-317.
王海燕,权毅,罗杰.辽宁中医杂志,2017,44(2):315-317.
[37]Qian Y,Chen F,Wang M,Sun Q,Shao D,Li C.Adv.Opt.Mater.,2023,11(11):2 202 060.
[38]Ning F,Wei D,Yu H,Song T,Li Z,Ma H,Sun Y.Mol.Pharmaceutics,2024,21(9):4 297-4 311.
[39]Song T.Research on the Application of Nanoscale Covalent Organic Frameworks in Nitric oxide (NO) gas combination therapy.Jinan:Shandong Normal University,2024.
宋甜.纳米共价有机框架在NO气体联合治疗中的应用研究.济南:山东师范大学,2024.
[40]Gu R,Zhang T,Si W L,Dong X C.Prog.Pharm.Sci.,45(4):263-272.
顾瑞,张婷,司伟丽,董晓臣.药学进展,45(4):263-272.
[41]Opoku-damoah Y,Zhang R,Ta H T,Xu Z P.ACS Appl.Mater.Interfaces,2023,15(49):56 796-56 806.
[42]Wang J,Zhang Y,Chen H,Wu Y,Liu J,Che H,Zhang Y,Zhu X.Adv.Healthcare Mater.,2024,13(30):2 402 063.
[43]Chen Y X,Xiang Z C,Ma X,Li L L.J.Chin.Soc.Rare Earths,2021,39(3).
陈尧轩,向治楚,马旭,李乐乐.中国稀土学报,2021,39(3).
[44]Mukherjee P,Guha S,Das G,Samui A,Sahu S K.J.Photochem.Photobiol.A:Chem.,2023,443:114 907.
[45]Song N,Fan X,Guo X,Tang J,Li H,Tao R,Li F,Li J,Yang D,Yao C,Liu P.Adv.Mater.,2024,36(15):e2 309 534.
[46]Kou Q J,Huang Yu F,SuY R,Lu L,Li X S,Jian H Y,Huang R,Li J,Nie X M.Nanoscale,2023,15(21):9 457-9 476.
[47]Liu X Y,Lu J J,Zheng Y,Yang J L,Yang X R,Zeng L Y,Qu Y T,Zhang Y.Chem.Reagents,2024,46(11):27-35.
刘炫驿,卢嘉杰,郑瑜,杨嘉琳,杨欣榕,曾琳莹,屈伊婷,张韫.化学试剂,2024,46(11):27-35.
[48]Du J,Jia T,Li F,Li Y,Wang Q,He L,Agren H,Chen G.Adv.Funct.Mater.,2024,34(36):2 401 272.