黄芪为多年生草本豆科植物蒙古黄芪 Astragalus membranaceus(Fisch.) Bunge var.mongholicus (Bunge) Hsiao或膜荚黄芪A.membranaceus(Fisch.) Bunge的干燥根,有益气、固表、托毒生肌和利水退肿等功效[1]。现代研究表明,黄芪的主要成分为皂苷类、黄酮类、多糖类等[2-4]。黄芪皂苷分为有黄芪皂苷、乙酰基黄芪皂苷、异黄芪皂苷和大豆皂苷4大类。活性研究表明皂苷类具有免疫调节、抗心脑损伤、降血糖和抗病毒等活性[5-8]。黄芪黄酮主要包括毛蕊异黄酮、芒柄花素及其糖苷等成分,具有抗辐射损伤、清除氧自由基、增强免疫、调控离子通道蛋白和抗病毒等活性[9-15]。黄芪多糖具有抗衰老、改善认知功能、降血压、抗动脉粥样硬化、抗骨质疏松等活性[16-21]。黄芪产地来源广泛,质量影响因素较多。明确不同基原、不同生长年限、野生与栽培以及不同产地黄芪药材质量的差异,是合理利用黄芪资源的基础性研究工作。基于此,本实验收集了24批黄芪药材,测试了各批次黄芪中总黄酮、总皂苷、总多糖的含量。
自由基因化学性质活跃,在体内蓄积易引发细胞氧化,导致心血管系统、神经系统及免疫系统等疾病[22]。黄芪具有较好的抗氧化活性,可延缓或阻止氧化应激反应[23]。因此,建立快速筛选天然产物复杂体系中的抗氧化活性成分具有突破瓶颈的重要现实意义。DPPH自由基是一种良好的体外抗氧化筛查剂,本文结合UHPLC高效分离能力及QTOF-MS/MS高灵敏度、高精度的化合物定性确认能力,建立DPPH-UHPLC-QTOF-MS/MS方法,通过对比与DPPH自由基反应前后 UHPLC-QTOF-MS/MS谱图中各化合物峰面积的变化,快速筛选天然产物复杂体系中的抗氧化活性成分[24-27]。因此,本实验利用该技术简便快速筛选黄芪中抗氧化活性成分,并利用实验对预测结果进行了验证,以期为今后合理利用黑龙江省黄芪资源及建立黄芪类农产品品牌资源提升提供理论依据。
1 实验部分
1.1 主要仪器与试剂
AB Sciex Triple型TOF 4600质谱仪(美国AB Sciex公司);30A型岛津超高效液相色谱仪(日本岛津公司);20~200、200~1 000、1 000~5 000 μL移液枪(德国Eppendorf公司);AB135-S型分析天平(瑞士Mettler Toledo公司);Safire2型酶标仪(瑞士Tecan公司);B8800型超声波清洗器(美国必能信公司);OSB-2100型旋转蒸发仪(日本EYELA仪器有限公司);Elix Essential 5型UV纯水仪(德国Merck Millipore公司);SHZ-3型循环水多用真空泵(上海沪西分析仪器有限公司)。
芦丁(批号:Lot.No.20170914,纯度>98.0%,国药集团化学试剂有限公司);黄芪皂苷Ⅰ(批号:16061307,纯度>98.0%)、黄芪皂苷Ⅱ(批号:151019,纯度>98.0%)、黄芪甲苷(批号:17073102,纯度>98.0%)、毛蕊异黄酮(批号:17102006,纯度>98.0%)、毛蕊异黄酮苷(批号:17112404,纯度>98.0%)、芒柄花苷(批号:16061401,纯度>98.0%)、刺芒柄花素(批号:151029,纯度>98.0%)、7,2′-二羟基3′,4′-二甲基氧异黄烷(批号:160816,纯度>98.0%)、3-羟基-9,10-二甲氧基紫檀烷(批号:151102,纯度 >98.0%)(成都普菲德生物技术有限公司);葡萄糖(批号:M0509AS,纯度>98.0%,大连美仑生物技术有限公司);ABTS(纯度>98.0%)、DPPH(纯度>97.0%)(东京化成工业株式会社);浓硫酸(分析纯,纯度95.0%~98%)、乙醇(分析纯,纯度>99.7%)、L-(+)抗坏血酸(纯度>99.7%)(天津市科密欧化学试剂有限公司);过硫酸钾(纯度 >99%,优耐德引发剂(上海)有限公司);氢氧化钠(分析纯,纯度>96%,天津市凯通化学试剂有限公司);苯酚(分析纯,天津市元力化工有限公司);香草醛(纯度>99%,天津市光复精细化工研究所);甲醇、乙腈(色谱纯,美国Merck公司);甲酸(质谱纯,美国Thermo Fisher Scientific公司);水为纯化水。
24批黄芪药材由齐齐哈尔医学院黄芪研究院提供(表1)。经齐齐哈尔医学院药学院郭丽娜教授鉴定为豆科植物膜荚黄芪Astragalus membranaceus (Fisch.) Bge.或蒙古黄芪Astragalus membranaceus (Fisch.) Bge.var.mongholicus (Bge.) Hsiao的干燥根。
表1 样品信息
Tab.1 Information of samples

编号地点采摘时间黄芪品种1甘肃陇西11年蒙古黄芪2甘肃陇西21年蒙古黄芪3山西运城1年蒙古黄芪4内蒙古固阳11年蒙古黄芪5内蒙古固阳21年蒙古黄芪6黑龙江大兴安岭2年蒙古黄芪7黑龙江大兴安岭野生(未知)蒙古黄芪8河北安国1年膜荚黄芪9河北唐山11年膜荚黄芪10河北唐山21年膜荚黄芪11内蒙古赤峰1年膜荚黄芪12黑龙江加格达奇1年膜荚黄芪13内蒙古武川1年膜荚黄芪14黑龙江大兴安岭4年膜荚黄芪15黑龙江大兴安岭4年以上膜荚黄芪16黑龙江大兴安岭野生(未知)膜荚黄芪17黑龙江讷河12年膜荚黄芪18黑龙江讷河22年膜荚黄芪19黑龙江讷河11年膜荚黄芪20黑龙江讷河21年膜荚黄芪21黑龙江梅里斯1年膜荚黄芪22黑龙江依安3年膜荚黄芪23黑龙江依安2年膜荚黄芪24黑龙江齐齐哈尔2年膜荚黄芪
1.2 实验方法
1.2.1 总皂苷含量测定
1.2.1.1 供试品溶液的配制
取干燥的黄芪药材粉末(过40目筛)约10.0 g,精密称定,置具塞锥形瓶中,精密加入75%乙醇-水溶液150 mL,称定质量,超声提取1 h,放冷后再称定质量,用75%乙醇-水补足减失的质量,过滤,弃去初滤液,收集续滤液作为测量总皂苷的供试品溶液。
1.2.1.2 标准品溶液的配制
精密称定黄芪甲苷25.0 mg,并置于25 mL容量瓶中。加入无水乙醇溶解并稀释定容至刻度,即得标准品储备液。精密量取标准品储备液0、1、2、3、4、5 mL置于10 mL容量瓶中,并利用无水乙醇定容至刻度,即得系列标准品溶液。
1.2.1.3 黄芪总皂苷的含量测定
取各标准品溶液1 mL于试管,加入1 mL 8%香草醛无水乙醇溶液,充分混匀,置冰浴中缓慢加入72%硫酸溶液10 mL,摇匀后置62 ℃水浴中保温20 min,取出后立即冰浴冷却至室温。利用酶标仪在544 nm处测定吸光度值,以黄芪甲苷标准溶液浓度(C,mg/mL)为横坐标,吸光度(A)值为纵坐标作图,构建标准曲线回归方程。
1.2.1.4 方法学考察
精密度实验:精密移取1.2.1.1标准储备液3.0 mL,置于5 mL容量瓶中,用无水乙醇定容至刻度,用香草醛-硫酸比色法显色后,于544 nm处平行测定吸光度6次,计算RSD值。
重复性实验:取同一黄芪样品5份,按1.2.1.1方法制备,显色后于544 nm处测定吸光度值,计算RSD值。
稳定性实验:精密移取1.2.1.1的供试品溶液,用香草醛-硫酸比色法显色后,分别于0、10、20、30、40、50、60 min测定544 nm处吸光度,计算RSD值。
加样回收率实验:取9份同一已知总皂苷量的黄芪各5.0 g,分别加入相当于样品中总黄皂苷的80%、100%、120%的对照品溶液,每个浓度平行配制3份,按1.2.1.2方法制备,显色后,于 544 nm处测定吸光度值,并计算加样回收率及RSD值。
1.2.2 总黄酮含量测定
1.2.2.1 供试品溶液的配制
供试品溶液的配制方法同1.2.1.1。
1.2.2.2 系列标准品溶液配制
精密称取20.0 mg芦丁标准品,用75%乙醇-水溶解并定容至50 mL,配制成0.4 mg/mL的标准储备溶液,分别取0、0.2、0.4、0.6、0.8、1.0 mL标准品溶液于10 mL容量瓶中,用75%乙醇-水定容,即得系列标准品溶液。
1.2.2.3 黄芪总黄酮的含量测定
取各标准品溶液5 mL于10 mL容量瓶中,加入5% NaNO2溶液0.3 mL,反应6 min。然后向容量瓶中加入10% Al(NO3)3溶液0.3 mL,反应6 min。接着,向容量瓶中加入1 mol/L NaOH溶液4 mL,并用75%乙醇-水定容至10 mL,反应 10 min。利用酶标仪在510 nm处测定吸光度值,以芦丁标准溶液浓度(C,mg/mL)为横坐标,吸光度(A)值为纵坐标作图,构建标准曲线回归方程。
1.2.2.4 方法学考察
精密度实验:精密移取1.2.2.1的标准储备溶液0.6 mL,置于10 mL容量瓶中,用75%乙醇-水溶液定容至刻度,采用NaNO2-AlNO3-NaOH比色法显色后,于510 nm处吸光度6次,计算RSD值为0.58%,表明仪器精密度良好。
重复性实验:取同一黄芪样品5份,按1.2.2.2中方法制备,显色后,于510 nm处测定吸光度值,计算RSD值。
稳定性实验:精密移取1.2.2.1的供试品溶液,采用NaNO2-AlNO3-NaOH比色法显色后,分别于0、10、20、30、40、50、60 min测定510 nm处吸光度,计算RSD值。
加样回收率实验:取9份同一已知黄酮含量的黄芪各5.0 g,分别加入相当于样品中总黄酮量的80%、100%、120%的对照品溶液,每个浓度平行配制3份,按1.2.2.2方法制备,显色后,于510 nm处测定吸光度值,计算加样回收率及RSD值。
1.2.3 黄芪总多糖的含量测定
1.2.3.1 供试品溶液的配制
取干燥的黄芪药材粉末(过40目筛)约10.0 g,精密称定,置具塞锥形瓶中,精密加入超纯水 150 mL,称定质量,超声提取1 h,放冷后再称定质量,用超纯水补足减失的质量,过滤,弃去初滤液,收集续滤液作为测量总多糖的供试品溶液。
1.2.3.2 标准品溶液的配制
精密称取葡萄糖标准品100.0 mg,用蒸馏水溶解并定容至100 mL,配制成1 mg/mL的标准储备液,分别取0、1、2、3、4、5、6 mL标准品溶液于50 mL容量瓶中,用蒸馏水定容至刻度,即得系列标准品溶液。
1.2.3.3 黄芪总多糖的含量测定
取各标准品溶液0.3 mL于试管,加入 0.6 mL 6%苯酚水溶液,充分混匀,加入3 mL 98%浓硫酸,摇匀后置于100 ℃沸水中反应 15 min,立即冷却至室温。利用酶标仪在490 nm处测定吸光度值,以葡萄糖标准溶液浓度(C,mg/mL)为横坐标,吸光度(A)值为纵坐标作图,构建标准曲线回归方程。
1.2.3.4 方法学考察
精密度实验:精密移取1.2.3.1下的标准储备溶液3 mL,于50 mL容量瓶中,用蒸馏水定容至刻度,采用苯酚-硫酸比色法显色后,于490 nm处平行测定吸光度6次。计算RSD值。
重复性实验:取同一黄芪样品6份,按1.2.3.1中方法制备,显色后,于490 nm处测定吸光度值,计算RSD值。
稳定性实验:精密移取1.2.3.1下的供试品溶液,采用苯酚-硫酸比色法显色后,分别于0、10、20、30、40、50、60 min测定490 nm处吸光度,计算RSD值。
加样回收率实验:取9份已知总多糖量的黄芪各5.0 g,分别加入相当于样品中总多糖量的80%、100%、120%的对照品溶液,每个浓度平行配制3份,按1.2.3.1中方法制备,显色后,于 490 nm处测定吸光度值,并计算加样回收率及RSD值。
1.2.4 DPPH-UHPLC-MS法筛选黄芪中的抗氧化活性成分
1.2.4.1 色谱条件与质谱条件
色谱条件:色谱柱:Phenomenex Kinetex C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相A为0.1%甲酸乙腈,流动相B为0.1%甲酸水;梯度洗脱程序为(0.01~1 min,20%~30% A;1~7 min,30%~50% A;7~10 min,50%~70% A;10~15 min,70%~100% A;15~17 min,100% A);流速设置为0.3 mL/min;进样量为2 μL。
质谱条件:离子喷雾电压设置为4.5 kV;离子源温度设置为500 ℃;去簇电压(DP)设置为-100;碰撞能量(CE)设置为-10;氮气为雾化气和辅助气,雾化气0.345 MPa,辅助气0.345 MPa,气帘气0.241 MPa;质量范围为m/z 100~1 200;ESI负离子模式下进行全扫描,积累时间为150 ms;自动校准系统(CDS)对MS自动进行调谐和校正。
1.2.4.2 DPPH溶液配制
分别配制4.00、1.33、0.44、0.15、0.05 mmol/L的DPPH溶液,现用现配,避光保存。
1.2.4.3 DPPH-UHPLC-QTOF-MS/MS实验
实验组为0.3 mL的供试样品溶液与0.9 mL的各浓度DPPH溶液混合均匀,37 ℃下避光孵育30 min。阴性对照组为0.9 mL的乙醇溶液代替DPPH,其他条件相同。孵育结束后,将各反应溶液在14 000 r/min离心10 min。吸取上清液进UHPLC-QTOF-MS/MS分析。利用标准品比对,指认了DPPH-UHPLC-QTOF-MS/MS实验中的9个化合物。采用峰面积法计算不同浓度的DPPH对该9个化合物峰面积的影响。
1.2.5 单体成分的抗氧化活性
1.2.5.1 DPPH实验
取标准品适量,用乙醇配制成1.000、0.500、0.250、0.125、0.625 mg/mL的系列样品溶液。将DPPH配制成200 μmol/L的乙醇溶液,然后加入50 μL上述配制样品溶液和150 μL的DPPH溶液于酶标板中,混匀后置阴暗处反应30 min,然后用酶标仪在517 nm处测定吸收值。每份样品平行操作3次,取平均值。用乙醇溶液代替样品溶液配制阴性对照,用乙醇代替上述方法中的DPPH配制空白对照,计算出清除率。并运用SPSS软件计算样品的IC50。
1.2.5.2 ABTS实验
将ABTS及K2S2O8分别配制成7、2.45 mmol/L的水溶液,使用前将两者混合并在暗处放置12 h以上,使用时用水稀释使混合溶液的吸光度值在734 nm处为0.7~0.8,待用。取40 μL的1.2.5.1样品溶液和160 μL ABTS自由基工作液于酶标板中,混匀后反应15 min后测定吸光度A值。每份样品平行测定3次,取平均值,用乙醇-水溶液代替样品溶液配制阴性对照,用水代替上述方法中的ABTS自由基工作液配制空白对照,计算出清除率。并运用SPSS软件计算样品的IC50。
2 结果与讨论
2.1 总皂苷、总黄酮和总多糖的含量
总皂苷、总黄酮和总多糖的标准曲线回归方程分别为Y1=0.841 6X+0.074 7,r2=0.996 7,Y2=3.021 1X+0.017 6,r2=0.998 4,Y3=2.342X+0.087 2,r2=0.999 0,结果表明线性良好。24批药材的总皂苷、总黄酮、总多糖含量如表2所示,其方法学结果如表3所示。结果显示,上述3种成分的含量测定的重复性、稳定性及加样回收率良好。
表2 总皂苷、总黄酮、总多糖含量
Tab.2 Contents of total saponins,total flavonoids and total polysaccharides (mg/g)
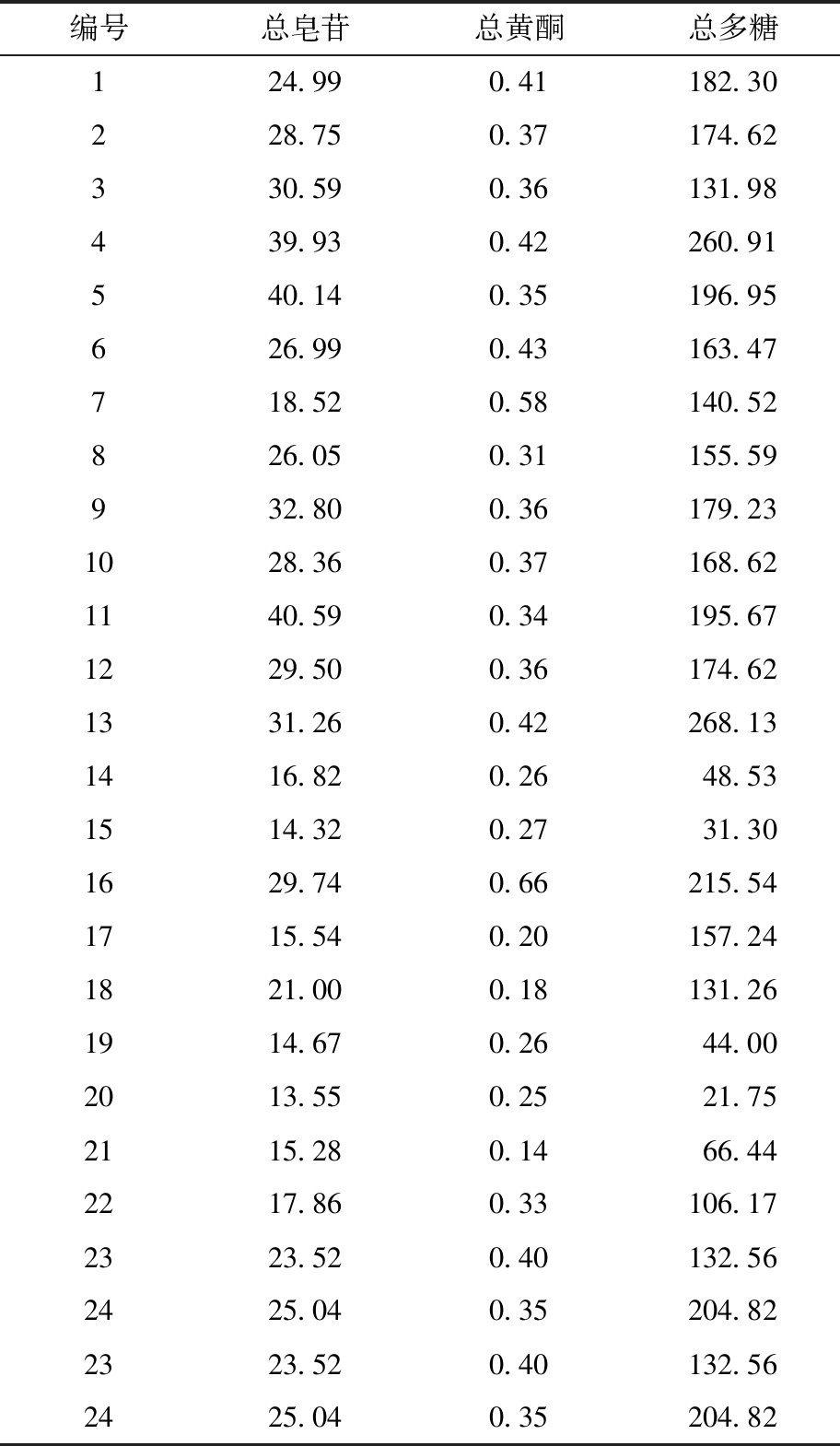
编号总皂苷总黄酮总多糖124.990.41182.30228.750.37174.62330.590.36131.98439.930.42260.91540.140.35196.95626.990.43163.47718.520.58140.52826.050.31155.59932.800.36179.231028.360.37168.621140.590.34195.671229.500.36174.621331.260.42268.131416.820.2648.531514.320.2731.301629.740.66215.541715.540.20157.241821.000.18131.261914.670.2644.002013.550.2521.752115.280.1466.442217.860.33106.172323.520.40132.562425.040.35204.822323.520.40132.562425.040.35204.82
表3 总皂苷、总黄酮、总多糖含量测定的方法学结果
Tab.3 Methodological results of the content determination of total saponins,total flavonoids and total polysaccharides
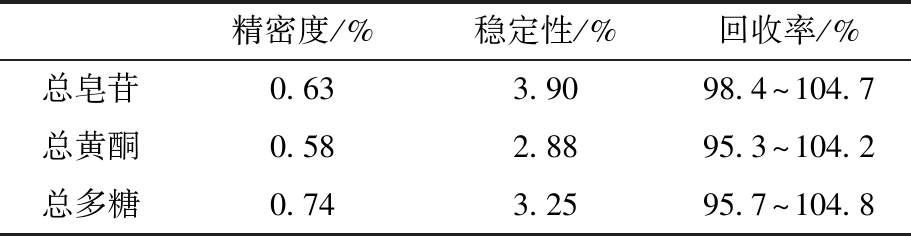
精密度/%稳定性/%回收率/%总皂苷0.633.9098.4~104.7总黄酮0.582.8895.3~104.2总多糖0.743.2595.7~104.8
本研究检测样品中,内蒙古赤峰地区一年的膜荚黄芪的皂苷含量最高,内蒙古武川地区一年的膜荚黄芪的多糖含量最高,黑龙江大兴安岭地区的野生膜荚黄芪的黄酮含量最高。将黄芪样品分为膜荚黄芪和蒙古黄芪两组,采用SPSS 23.0软件对蒙古黄芪和膜荚黄芪中的总皂苷、总黄酮和总多糖的含量进行单因素方差分析,以比较组间差异。两组间P值分别为0.074、0.061、0.155,均大于0.05,即两种黄芪之间各成分含量不存在显著性差异,说明所选择的24批膜荚黄芪和蒙古黄芪对黄芪总皂苷、总黄酮和总多糖含量不存在明显影响。大兴安岭地区4年及4年以上的膜荚黄芪的总皂苷、总黄酮和总多糖的含量都较低,推测可能由于生长年限较长,黄芪中的主要成分发生了变化。将讷河地区和梅里斯地区一年的膜荚黄芪的根,与其他地区一年的黄芪根相比,发现其根极细,可能与其生存土壤、环境及采摘时间等有关;而含量测定结果表明其总皂苷、总黄酮和总多糖的含量也较其他地区的黄芪含量低。野生的蒙古黄芪和膜荚黄芪的黄酮含量高于人工栽培的黄芪黄酮含量,推测野生状态可能更利于黄芪黄酮类成分的富集。在预实验中,分别采用热提法和超声法对总皂苷、总黄酮和总多糖进行提取。结果显示两种提取方式对提取量的影响不大,而超声提取法操作简便且平行性好,因此,采用超声提取法对各批次的黄芪药材进行提取。
2.2 黄芪中抗氧化活性成分的筛选
本实验选择液相色谱串联四级杆飞行时间质谱仪进行检测分析,采用正离子和负离子模式进行扫描,结果显示黄酮类化合物和皂苷类化合物在负离子模式下都有较好的响应值。因此,DPPH-UHPLC-QTOF-MS/MS实验采用了负离子模式。皂苷类化合物和黄酮苷类化合物有较强的[M+COOH]-峰,而黄酮苷元有较强的[M-H]-峰,因此,其定量离子峰分别选择了其响应值较高的离子峰。结果证明提取物中关键成分的含量变化能够说明其抗氧化活性。此方法的优势在于操作简单,柱前衍生化后可以批量的检测各成分的抗氧化活性。在以后的研究中不仅能够对有标准品的化合物进行抗氧化活性的测试,也可以通过化合物质谱数据对化合物结构进行解析,然后通过峰面积的变化预测其抗氧化活性。上述研究可以为今后活性成分的导向分离及活性研究提供指导。
多糖的极性较大,在多糖提取时选择了水溶液进行提取。在预实验中,分别考察了不同溶剂对皂苷和黄酮提取量的影响,结果发现75%乙醇对总皂苷和总黄酮都有着较好的提取率,因此,在总皂苷和总黄酮测试过程中,选择了75%乙醇进行提取。预实验中利用DPPH实验对黄芪75%乙醇提取物和黄芪水提物的抗氧化活性进行了测试,结果显示黄芪75%乙醇提取物的抗氧化活性较强。为了进一步考察多糖的抗氧化活性,预实验中采用了水提醇沉法对多糖成分进行了纯化并测试了抗氧化活性,结果表明多糖类成分活性较弱,因此,选择75%乙醇提取物进行DPPH-UHPLC-QTOF-MS/MS实验。
由于黄芪样品批次较多,为研究其抗氧化活性,选择依安二年的膜荚黄芪作为代表探讨了黄芪的抗氧化活性。利用标准品比对,指认了DPPH-UHPLC-QTOF-MS/MS实验中的9个化合物。采用峰面积法计算不同浓度的DPPH对该9个化合物峰面积的影响。各化合物的XIC图见图1,峰面积减少量见表4。由此可见,化合物毛蕊异黄酮、毛蕊异黄酮苷和7,2′-二羟基3′,4′-二甲基氧异黄烷在DPPH浓度为4.00 mmol/L时峰面积减少明显,推测这3个化合物可能是黄芪中抗氧化的主要活性成分。
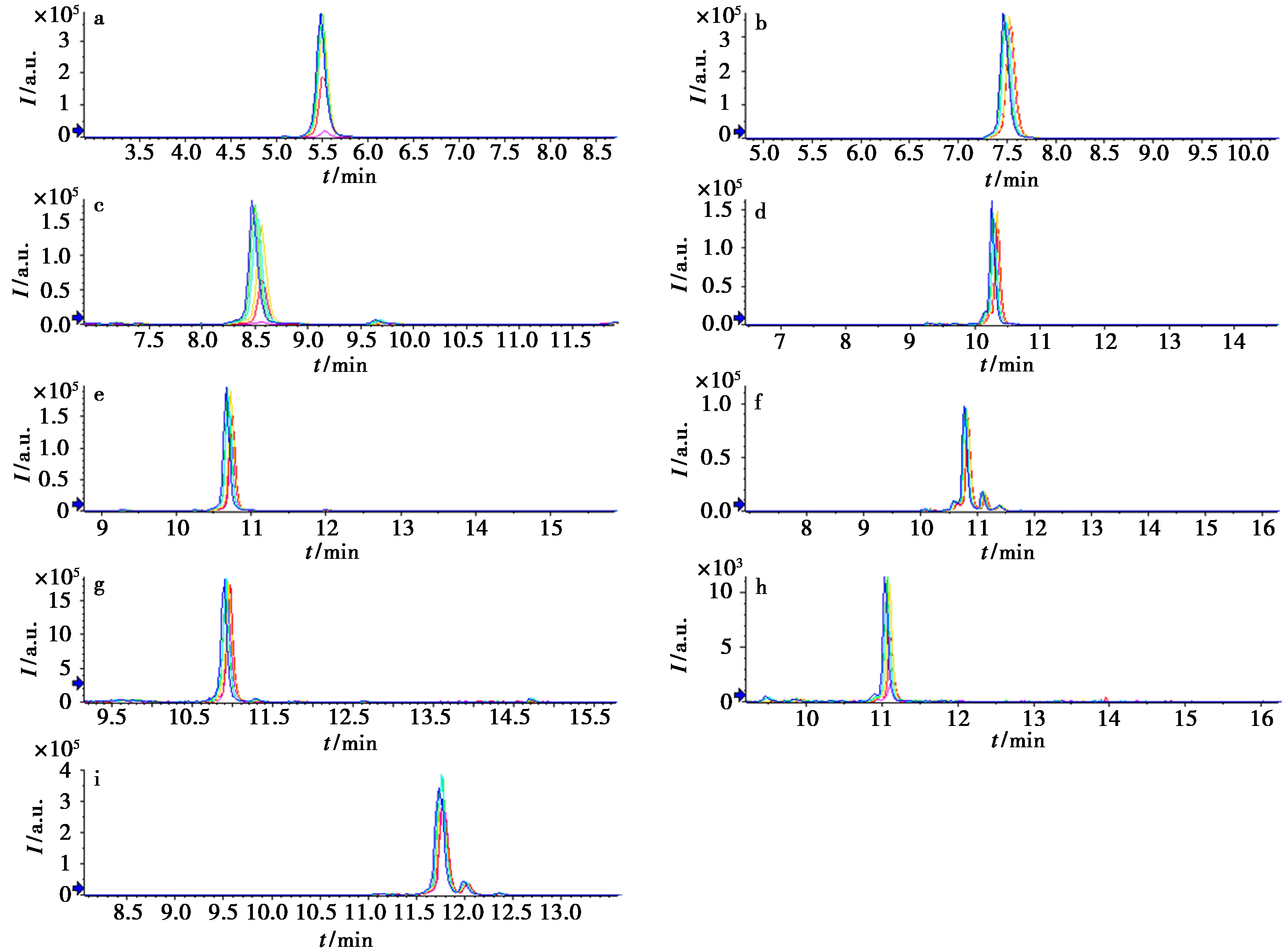
曲线分别为0.05、0.15、0.44、1.33、4.00 mmol/L DPPH组和阴性对照组a.毛蕊异黄酮苷;b.芒柄花苷;c.毛蕊异黄酮;d.黄芪甲苷;e.刺芒柄花素;f.黄芪皂苷Ⅱ;g.3-羟基-9,10-二甲氧基紫檀烷;h.7,2′-二羟基-3′,4′-二甲基氧异黄烷;i.黄芪皂苷Ⅰ
图1 XIC图
Fig.1 XIC chromatograms
表4 各化合物的峰面积减少量注
Tab.4 Peak area reduction of each compound
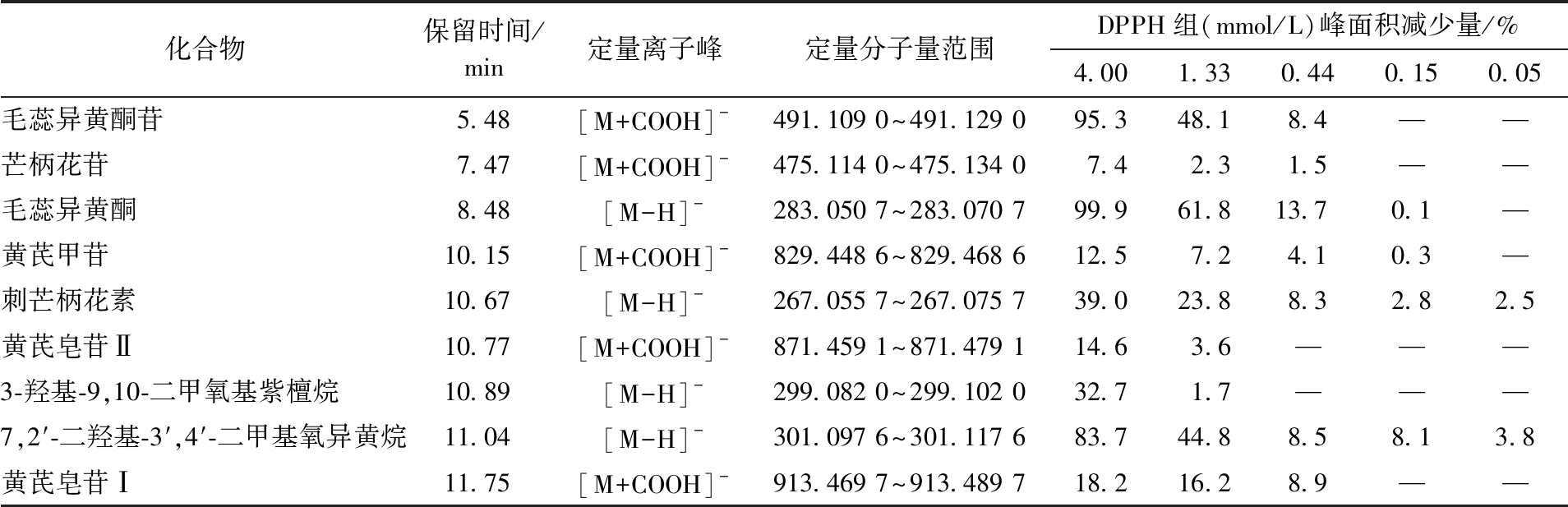
注:“—”为峰面积未减少。
化合物保留时间/min定量离子峰定量分子量范围DPPH组(mmol/L)峰面积减少量/%4.001.330.440.150.05毛蕊异黄酮苷5.48[M+COOH]-491.109 0~491.129 095.348.18.4——芒柄花苷7.47[M+COOH]-475.114 0~475.134 07.42.31.5——毛蕊异黄酮8.48[M-H]-283.050 7~283.070 799.961.813.70.1—黄芪甲苷10.15[M+COOH]-829.448 6~829.468 612.57.24.10.3—刺芒柄花素10.67[M-H]-267.055 7~267.075 739.023.88.32.82.5黄芪皂苷Ⅱ10.77[M+COOH]-871.459 1~871.479 114.63.6———3-羟基-9,10-二甲氧基紫檀烷10.89[M-H]-299.082 0~299.102 032.71.7———7,2′-二羟基-3′,4′-二甲基氧异黄烷11.04[M-H]-301.097 6~301.117 683.744.88.58.13.8黄芪皂苷Ⅰ11.75[M+COOH]-913.469 7~913.489 718.216.28.9——
上述结果显示,筛选的9个化合物的峰面积都随着DPPH浓度的增加,其峰面积减小,说明该9个化合物都有一定的抗氧化活性,且黄酮类化合物的抗氧化活性优于皂苷类成分。其中,化合物毛蕊异黄酮、毛蕊异黄酮苷和7,2′-二羟基-3′,4′-二甲基氧异黄烷在DPPH浓度为4.00 mmol/L时峰面积减少明显,推测它们的抗氧化活性较强。
2.3 单体化合物的抗氧化活性验证
分别利用DPPH法及ABTS法测试单体化合物的抗氧化活性并运用SPSS软件计算样品的IC50(表5)。
表5 单体化合物的抗氧化活性
Tab.5 Antioxidant activities of monomer compounds (n=3)
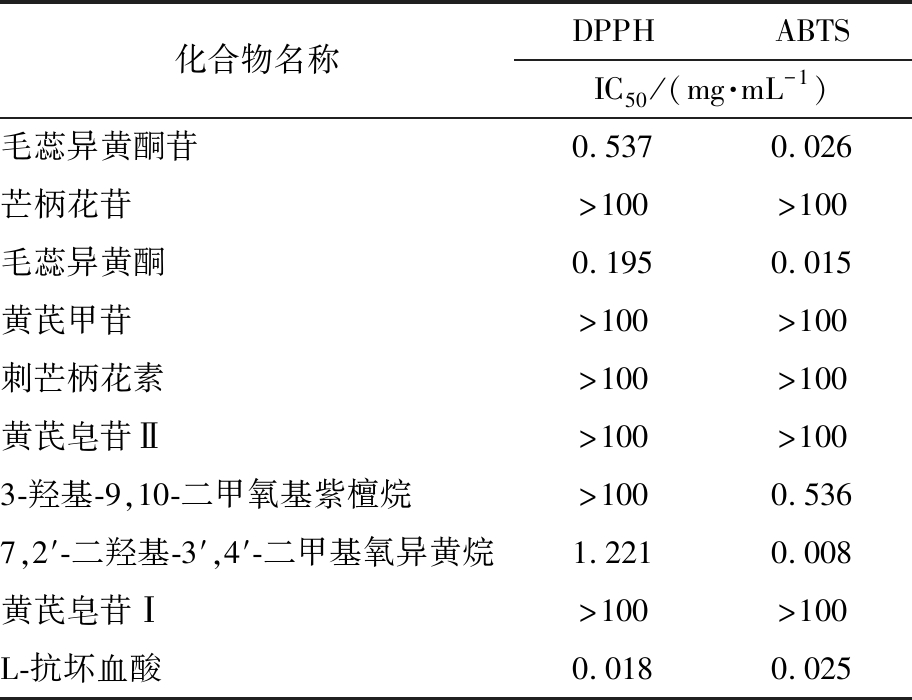
化合物名称DPPHABTSIC50/(mg·mL-1)毛蕊异黄酮苷0.5370.026芒柄花苷>100>100毛蕊异黄酮0.1950.015黄芪甲苷>100>100刺芒柄花素>100>100黄芪皂苷Ⅱ>100>1003-羟基-9,10-二甲氧基紫檀烷>1000.5367,2′-二羟基-3′,4′-二甲基氧异黄烷1.2210.008黄芪皂苷Ⅰ>100>100L-抗坏血酸0.0180.025
单体化合物抗氧化结果与DPPH-UHPLC-MS法预测的抗氧化活性结果相一致。对黄酮类成分的抗氧化活性进行构效关系探讨,将毛蕊异黄酮苷与芒柄花苷及毛蕊异黄酮与刺芒柄花素的峰面积减少量比较,推测黄酮连接的羟基越多,其抗氧化活性越强。将毛蕊异黄酮苷与毛蕊异黄酮及芒柄花苷与刺芒柄花素的峰面积减少量比较,推测黄酮的羟基成苷后,黄酮的抗氧化活性减小。
3 结论
本研究对不同产地、年份、品种的黄芪总黄酮、总皂苷、总多糖的含量进行了测试,并利用DPPH-UHPLC-QTOF-MS/MS对黄芪抗氧化活性物质基础进行了探讨,并进行了构效关系的探讨。本研究产出为今后黄芪研究提供了实验基础,同时为合理利用黄芪资源及建立黄芪类农产品品牌资源提升提供理论依据。
[1]国家药典委员会.中国药典[M].一部.北京:中国医药科技出版社,2020.
[2]马艳春,胡建辉,吴文轩,等.黄芪化学成分及药理作用研究进展[J].中医药学报,2022,50(4):92-95.
[3]张淑娟,张育贵,牛江涛,等.黄芪的研究进展及其质量标志物预测分析[J].中华中医药学刊,2022,40(2):151-155.
[4]郭丽丽,李小兰,田小丽,等.黄芪茎叶总皂苷的响应面提取工艺优化及抗氧化活性研究[J].中国食品添加剂,2023,34(4):158-167.
[5]肖亦菽,王如锋,赵淑娟.中药黄芪皂苷类成分生物合成研究进展[J].上海中医药大学学报,2021,35(5):80-96.
[6]赵灵改,吕学泽,刘毅,等.黄芪中皂苷类成分的研究进展[J].食品安全质量检测学报,2021,12(12):4 937-4 946.
[7]ZHANG J,WU C,GAO L,et al.Astragaloside Ⅳ derived from Astragalus membranaceus:A research review on the pharmacological effects[J].Adv.Pharmacol.,2020,87:89-112.
[8]徐锘,吴晓俊.黄芪皂苷对神经系统疾病的药理作用研究进展[J].中国中药杂志,2021,46(18):4 674-4 682.
[9]ZANG Y,WAN J,ZHANG Z,et al.An updated role of astragaloside Ⅳ in heart failure[J].Biomed.Pharmacother.,2020,126:110 012.
[10]张东霞.黄芪中黄酮类化合物药理作用研究进展[J].内蒙古中医药,2021,40(2):148-149.
[11]苏优拉,陈贵林.黄芪中黄酮类成分的研究进展[J].食品安全质量检测学报,2021,12(3):849-857.
[12]WANG Z,LI X L,HONG K F,et al.Total flavonoids of astragalus ameliorated bile acid metabolism dysfunction in diabetes mellitus[J].Evid.Based Complement Alternat.Med.,2021,2 021:6 675 567.
[13]蔚立涛,赵秉宏,周劭华,等.蒙古黄芪总黄酮对ADHD模型大鼠前额叶BDNF和TRKB的影响[J].中药材,2021,44(8):1 967-1 970.
[14]AN L,LIN Y,LI L,et al.Integrating network pharmacology and experimental validation to investigate the effects and mechanism of astragalus flavonoids against hepatic fibrosis[J].Front.Pharmacol.,2021,11:618 262.
[15]吴冬雪,王淑敏,陈思键,等.无机纳米孔材料快速分离中成药中黄芪皂苷类成分[J].分析试验室,2021,40(6):638-644.
[16]张臻,阙华发.黄芪多糖对糖尿病溃疡大鼠炎症期相关因素的影响[J].中药新药与临床药理,2022,33(5):616-623.
[17]LI C X,LIU Y,ZHANG Y Z,et al.Astragalus polysaccharide:A review of its immunomodulatory effect[J].Arch.Pharm.Res.,2022,45(6):367-389.
[18]ZHENG Y,REN W,ZHANG L,et al.A review of the pharmacological action of astragalus polysaccharide[J].Front.Pharmacol.,2020,11:349.
[19]张玉坤,何东平.黄芪多糖对野百合碱诱导大鼠肺动脉高压的减缓作用及其机制研究[J].中国药房,2022,33(1):64-68.
[20]张石在,王毅,马瑞莲,等.黄芪多糖抑制TGF-β1和Nox4/Akt/m TOR信号通路保护心肌重构的作用研究[J].中国现代应用药学,2021,38(24):3 108-3 114.
[21]李波,李珺铭,刘富饶,等.朝鲜淫羊藿中性多糖与酸性多糖的理化特征及抗氧化活性的比较[J].化学试剂,2022,44(3):369-375.
[22]施树云,郭柯柯,彭胜,等.DPPH-HPLC-QTOF-MS/MS快速筛选和鉴定杜仲黑茶中抗氧化活性成分[J].天然产物研究与开发,2018,30(11):1 913-1 917.
[23]侯敏娜,侯少平,胡亚茹,等.黄芪总黄酮体外抗氧化性及抑菌活性的研究[J].华西药学杂志,2022,37(4):380-384.
[24]邓清平,侯光菡.DPPH-HPLC-QTOF-MS/MS快速筛选和鉴定臭牡丹中抗氧化活性成分[J].华中师范大学学报(自然科学版),2018,52(6):816-821.
[25]尹德航,施乐洋,叶雨涵,等.天然产物及其有效成分在化妆品领域的研究与开发[J].化学试剂,2022,44(7):960-967.
[26]朱家庆,冯军,唐婷范,等.加压毛细管电色谱测定葛根中三种异黄酮类化合物[J].分析试验室,2021,40(9):1 010-1 014.
[27]臧青民,李秋珊,徐燕波,等.超声波辅助双水相体系优化橘红花总黄酮提取工艺及其抗氧化活性[J].化学试剂,2022,44(4):557-563.