根据国际癌症研究机构(International Agency for Research on Cancer,IARC)最新发布的2024年全球各地区在2022年的癌症统计数据显示,女性乳腺癌是全球癌症新发病率的第二顺位,新发病例占所有癌症病例的11.6%,死亡率占所有癌症死亡人数的6.9%,且对于全球女性,乳腺癌是最常见的癌症,也是癌症死亡的主要原因之一[1]。其中三阴性乳腺癌(Triple Negative Breast Cancer,TNBC)是最具侵袭性的亚型。TNBC的免疫组织化学染色雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(Human Epidermal Growth Factor Receptor 2,HER2)均为阴性,占乳腺癌总确诊数的15%~20%[2]。患者因缺乏确定的分子靶标,在手术后不能进行常规的内分泌及靶向治疗,因此目前临床上普遍应用以化疗为主的治疗方案。针对早期TNBC患者的治疗方案包括新辅助化疗(Neoadjuvant Chemotherapy,NACT)和手术治疗;晚期患者一般推荐单药序贯化疗或联合化疗。由于TNBC复发率高、转移风险大、生存率较低,目前对于复发性TNBC还没有统一的化疗方案,传统的化疗药物往往存在骨髓抑制、免疫抑制、消化障碍、肝肾功能异常等毒副作用,严重影响患者的生存质量[3]。因此,迫切需要寻求更为安全高效的治疗方案,增强乳腺癌的靶向治疗效果。
在各类肿瘤的治疗中,前药的应用受到了极大的关注,前药是一种药物分子本身不具活性或活性较低的衍生物,在体内通过化学转化或酶促反应释放真正具备活性物质的药物分子,能够在到达药物作用点之前改变其理化特性(例如,屏蔽电荷或保护电离基团等)[4],降低药物不良反应发生率,提升患者的依从性。前药的出现开辟了抗肿瘤药物研发的新途径。
随着现代医学与高分子化学的深度交叉融合,聚合物前药引起了科研人员的高度关注。目前,采用聚乙二醇(Poly(ethylene glycol),PEG),N-(2-羟丙基)甲基丙烯酰胺(N-(2-hydroxypropyl)methacrylamide,HPMA)和聚乳酸-羟基乙酸共聚物(Poly(lactide-co-glycolide),PLGA)等制备的聚合物前药已进入临床评估,有望在不久的将来进入市场。与单独的前药相比,聚合物前药具有明显优势:(1)增大药物溶解度、稳定性,利于生物降解,提高生物利用度;(2)改善药代动力学,延长药物在体内的半衰期从而实现体内长循环;(3)具有小尺寸效应,易进入细胞,功能化基团、活性中心较多,比表面积大;(4)通过被动或主动靶向释放药物,保护药物在运输到目标器官、组织及细胞之前不失活;(5)联合化疗药物递送,增加胞内药物积累,抑制药物转运泵功能,逆转肿瘤多药耐药(Multi-Drug Resistance,MDR);(6)灵活修饰,制备工艺可控,理化性质可调节[5]。纳米聚合物前药不但可以改变药物性质,减少药物在体内循环过程中的分散;适时对某些刺激做出响应(如酸响应、酶响应、氧化还原响应、多重刺激响应等)并可控性释放;将药物富集于靶部位,提高生物利用度[6]。因此,纳米聚合物前药的研究对恶性肿瘤治疗具有重要意义。本文综述了近10年的文献,从纳米聚合物前药的设计、合成及其在抗乳腺癌中的应用进行了系统地介绍,以期为乳腺癌,特别是TNBC的精准和个性化治疗提供新思路。
1 纳米聚合物前药的概念及分类
纳米聚合物前药就是由药物与聚合物偶联形成聚合物-药物偶联物(Polymer-Drug Conjugates,PDCs)[7],与传统药物相比,纳米聚合物前药将药物分子以可控百分比偶联于聚合物主链骨架或侧链,不仅载药效率高,而且水溶性好、结构稳定。纳米聚合物前药能一定程度的增加药物的渗透性和滞留效应(Enhanced Permeability and Retention Effect,EPR),降低其毒副作用,提升靶向性,改进传统化疗的弊端[8,9]。
根据纳米聚合物前药中聚合物结构的不同,可以将其分为3类:基于线性聚合物、超支化聚合物和超分子聚合物的纳米聚合物前药,其中基于线性聚合物的纳米聚合物前药还可根据其药物偶联位置不同分为聚合物主链型和支链型[10]。
1.1 主链含药物的纳米聚合物前药
主链含药物的纳米聚合物前药,是将药物分子作为主链部分设计构建的线性纳米聚合物前药,其中药物分子与聚合物主链骨架部分进行偶联,如表1所示。目前已有多种药物分子被用于设计和构建主链含药物的纳米聚合物前药,包括阿霉素(Doxorubicin,DOX)、米托蒽醌(Mitoxantrone,MTO)、紫杉醇(Paclitaxel,PTX)、喜树碱(Camptothecin,CPT)、顺铂(Cisplatin,CDDP)等[11]。例如,Zhang等[12]通过酸敏感性腙键将DOX与聚合物主链结合形成基于DOX聚合物前药(PDOX),并进一步修饰近红外吸收染料IR825光热剂和叶酸的靶向配体为自组装的靶向聚合物前药(PDOX/IR825)。由于酸不稳定的腙键在肿瘤的酸性环境中触发降解释放DOX,联合光热疗法显著提高了对乳腺癌和肝癌的抑制效果。
表1 用于乳腺癌治疗的纳米聚合物前药
Tab.1 Nano-polymer prodrugs for breast cancer therapy

药物聚合物前药肿瘤类型文献DOXPDOX/IR825Breast/Liver[12]DOXDiR-DOX-PEGTNBC[13]DOXPBA-PEG-ss-PCL-hyd-DOXTNBC[14]PTX,DOXPGA-PTX-DOXTNBC[9]DOXTPGS2000-DOXBreast[15]
在聚合物主链结构单元中,多种药物也可以按照一定比例整合于聚合物主链,如图1所示[11],联合用药可以克服单一药物的局限性,如:有效药物浓度低、严重的毒副作用、治疗效果欠佳等,以增强其抑瘤效果,提升患者的生存质量。Markovsky等[9]将其以药物协同比例将PTX和DOX与可生物降解的聚谷氨酸(Polyglutamic Acid,PGA)骨架偶联,利用增强的EPR效应,以被动靶向实现了对药物的累积。

图1 递送小分子化疗药物的聚合物药物偶联物结构示意图[11]
Fig.1 Structures of polymer drug conjugates used to deliver combinations of small molecule chemotherapeutic agents[11]
1.2 支链含药物的纳米聚合物前药
支链含药物的纳米聚合物前药是将药物偶联到聚合物支链上,可同时交联多个药物分子,达到协同增效的目的。例如,Chu等[16]通过顺铂前药交联单体(PtMA)、一氧化氮前药单体(StNO)和亲水性单体N,N-二甲基丙烯酰胺(DMA)的共聚反应,制备了支链纳米聚合物前药P(DMA-co-PtMA-co-StNO),在其被人肺腺癌耐顺铂株细胞(A549/DDP)摄取后,在还原性胞质环境中降解并释放NO和CDDP的双亲体药物,对乳腺癌、卵巢癌、膀胱癌和小细胞肺癌等均有显著的抑制作用。如图2所示,Chen等[17]设计开发了一种二硒键(Se-Se)接枝叶酸(Folic Acid,FA)的二聚体前药(FA-SeSe-NPs),用于破坏TNBC的肿瘤细胞内的氧化还原稳态,达到靶向治疗的目的。通过SeSe偶联葫芦素B(Cucurbitacin B,CuB)分子合成二聚体前药,随后与FA-PEG-DSPE组装制成纳米聚合物前药FA-SeSe-NPs。利用FA的主动靶向作用,FA-SeSe-NPs可在TNBC细胞MDA-MB-231中不断蓄积,被细胞特异性内化。在 TNBC中高ROS和GSH环境中二硒键能特异性响应ROS产生Se自由基增加ROS并与GSH反应生成S—Se键消耗GSH,释放CuB可进一步诱导MDA-MB-231细胞中ROS产生。二硒键和CuB的协同作用,可放大产生的氧化应激效应从而达到杀死MDA-MB-231细胞的目的。

图2 纳米聚合物前药FA-SeSe-NP制备过程及其作用机制[17]
Fig.2 Preparation process and mechanism of FA-SeSe NPs as nano-polymer prodrug[17]
1.3 基于超支化聚合物的纳米聚合物前药
超支化聚合物(Hhyperbranched Polymer,HBP)最早由Kim和Webster于1988年提出,是具有三维结晶结构的高度支化大分子[18],因其出色的生物相容性和易多功能化的特点受到广泛关注。超支化聚合物纳米前药是一类基于HBP的新型纳米聚合物前药。HBP为其提供了球状和支化框架的空间结构并使其具有支化程度(Degree of Branch,DB)小于1.0的三维结构、低分子链复杂性、高溶解性、低熔融或溶液粘度和超封装能力等[19],基于HBP的纳米聚合物前药被广泛用于肿瘤治疗的药物递送、成像和治疗诊断学研究。Feng等[20]研究了一种含有比卡鲁胺(Bicalutamide,BLT)和FA的介孔二氧化硅纳米复合材料(COOH-MSNs-HBP@BLT/FA)具有pH刺激响应能够实现主动靶向。以FA为靶标剂和封端氨基对超支化聚合物(COOH-MSNs-HBP@BLT/FA)进行修饰。通过表面羧基功能化提高了药物BLT的吸附能力,通过羧基的改变,其载药能力显著增强。细胞实验结果表明COOH-MSNs-HBP@BLT/FA具有抗人乳腺癌细胞MCF-7和MDA-MB-231增殖作用并导致细胞凋亡,表现出良好的抗乳腺癌功效。
1.4 基于超分子聚合物的纳米聚合物前药
超分子聚合物(Supramolecular Polymeric,SP)是通过非共价相互作用共轭的单体制成,例如氢键、主客体相互作用、芳香族堆积相互作用、金属配位等。SP的组成部分在“聚合”后可以保持其特定的化学结构。与共价键结合的纳米聚合物前药相比,超分子聚合物纳米前药因其独特的结构优势具有更强的酶分解抵抗力,可根据理化性质调节细胞摄取提高组织中的药物蓄积量,且免疫毒性和副作用较低[21]。Su等[22]设计合成了一种基于超分子聚合物的纳米聚合物前药,通过CPT与金属螯合剂DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸)直接共聚制得。DOTA偶联的CPT前药(dCPT-DOTA)自组装成超分子聚合物纳米前药,其在正常生理环境中保持稳定,在肿瘤细胞内高GSH环境下高效释药。细胞毒性实验表明,其对MDA-MB-231及脑癌细胞U87-MG、非小细胞肺癌细胞A549和结肠癌细胞HCT-116等均显示出较强的杀伤作用,能够有效抑制肿瘤细胞增殖。
无论是哪一类纳米聚合物前药,其在乳腺癌治疗方面都具有一定的优势,TNBC是乳腺癌之中最具侵袭性、组织学分级高、易转移复发和不良预后的亚型,因缺乏内分泌治疗及针对HER2的分子靶向治疗的相应靶点,目前临床治疗方案依然以化疗为主。因此如何合理设计开发治疗乳腺癌的纳米聚合物前药是亟待解决的关键问题。
2 纳米聚合物前药的设计合成
2.1 肿瘤微环境
肿瘤微环境(Tumor Microenvironment,TME)是由正常细胞基因异常表达形成的恶性增殖的细胞所导致的独特理化环境,其不仅在肿瘤的发生、进展和转移过程中起着关键作用,而且对治疗效果具有深远的影响[23]。TME与正常细胞环境之间存在较大差异,如TME中酸化、低氧、多种酶和谷胱甘肽(Glutathione,GSH)过表达,血管高渗透性和间质高压等。因此,可以基于TME与正常细胞的生理差异设计不同刺激响应类型的纳米聚合物前药。
2.2 刺激响应纳米聚合物前药
2.2.1 酸响应纳米聚合物前药
由于肿瘤细胞的生长速度极其迅速,主要依靠缺氧条件下的糖酵解产生乳酸及代谢物堆积于细胞内,使肿瘤细胞的pH较低于正常细胞。人血液与正常组织器官pH值约为7.4,肿瘤部位的pH值约为6.5~7.2,而细胞的核内体约为4.5~6.5,溶酶体pH值约为4.0~5.0[24]。故可以将药物与酸响应纳米聚合体键合,以此来提高药物在肿瘤细胞内的释放率。
腙键、酯键、亚胺键、缩醛键、酰胺键等类型化学键均对弱酸环境较敏感[25],可将小分子药物连接在此类化学键,使其在肿瘤细胞中被激活,发生化学键断裂将药物定向释放,从而最大限度地提高载药率,避免提前突释,延长药物的体内循环时间,如图3所示。Zeng等[26]通过协同达沙替尼(Dasatinib,DAS)和奥拉帕利(Olaparib,OLA)设计了具有活性亲水性透明质酸(HA)靶向和酸响应的纳米聚合物前药用于TNBC治疗。其采用酸敏感酯键连接疏水性DAS和HA形成两亲性聚合物前药HA-DAS。以OLA作为核心,HA-DAS作为载体在水溶液中形成纳米胶束(HDO-NPs),如图4所示。基于HDO纳米聚合物前药的性质及体外缓释性能,测定其对MDA-MB-231的细胞毒性、主动靶向性和细胞内的转运行为;以MDA-MB-231荷瘤BALB/c裸鼠模型评价HDO-NPs在肿瘤组织中的积累及其在组织器官的分布,发现其能够有效靶向肿瘤组织,并对TNBC具有良好的治疗效果。

图3 刺激响应释放药物[25]
Fig.3 Drug release in response to stimulus[25]

图4 酸响应聚合物前药HA-DAS的合成路线(a);聚合物前药HDO-NPs体内肿瘤治疗示意图(b)[26]
Fig.4 Synthesis route of acid-responsive polymer prodrug HA-DAS(a);In vivo tumor treatment of polymer prodrug HDO-NPs(b)[26]
2.2.2 氧化还原响应纳米聚合物前药
GSH对维持细胞功能具有至关重要的作用,肿瘤细胞质中的GSH浓度达2~10 mmol/L,远高于正常组织器官如血液、细胞表面、细胞质、细胞器中GSH浓度2~20 μmol/L。因此肿瘤细胞的胞液、线粒体和细胞核处为强还原性环境[27]。将药物与含GSH响应化学键的载体键合,使其在肿瘤细胞的高GSH环境中断裂从而释放药物[28]。
Sun等[29]设计了两种聚合物前药POEG-b-PSSDas(氧化还原敏感型)和POEG-b-PCCDas(氧化还原不敏感型)用于对比得出二硫键在肿瘤治疗中的作用,两种聚合物前药均由寡聚乙二醇甲基丙烯酸酯(Poly(oligo(ethylene glycol) methacrylate),POEG)亲水嵌段和达沙替尼(Dasatinib,DAS)共轭疏水嵌段组成,制备与DOX共递送的双功能载体。与POEG-b-PCCDas胶束相比,将二硫键结合到POEG-b-PSSDas胶束中,有助于前药胶束从肿瘤细胞或组织中降解出DAS,从而在体内外产生更强的抗肿瘤活性。
与二硫键相比,三硫键表现出较高的GSH敏感性,能更有效地促进DOX同二聚体前药的自组装,改善前药纳米组装体的胶体稳定性、药代动力学和肿瘤蓄积性,具有高载药量、高自组装稳定性和高肿瘤选择性的特点[30],如图5所示。

图5 二硫键的GSH响应机理(a);三硫键的GSH响应机理(b)[30]
Fig.5 GSH response mechanism of disulfide bond (a);GSH response mechanism of trisulfide bond (b)[30]
ROS可通过激活一些信号通路,影响细胞分化、增殖、凋亡的信号转导,参与重要细胞过程的调控,如图6所示。在肿瘤细胞中ROS浓度高,因此肿瘤细胞处于氧化应激状态,将含硫醚的ROS响应纳米聚合物与药物相连,在肿瘤细胞中疏水性含硫醚的聚合物被氧化成亲水性亚砜[31],从而提高药物定向释放的能力。
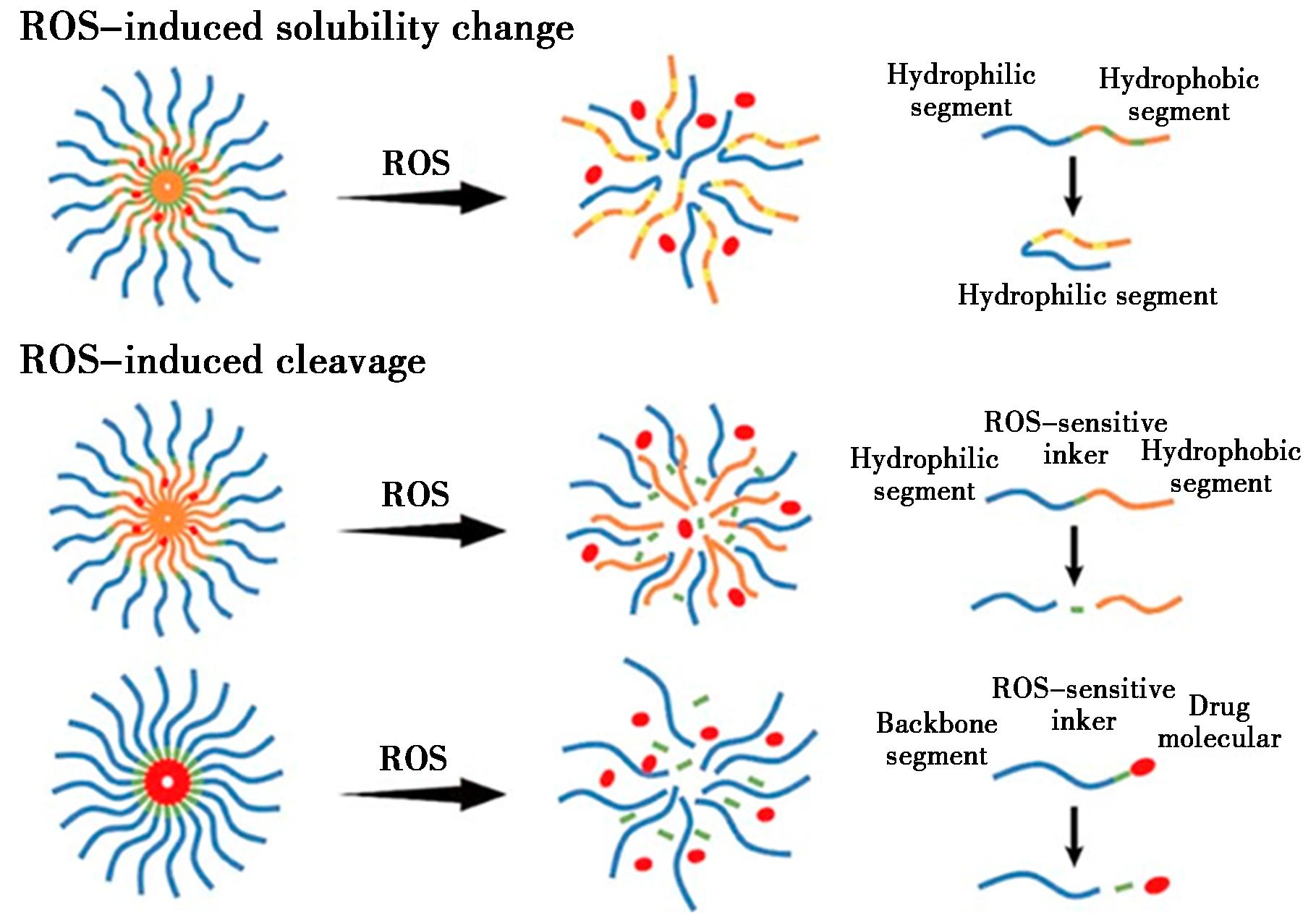
图6 ROS响应药物释放原理[31]
Fig.6 Principle of ROS responsive drug release[31]
2.2.3 酶响应纳米聚合物前药
由于肿瘤细胞的生长和分裂速度比正常细胞快得多,更有可能侵入周围组织并导致TME中异常的酶表达[32],在肿瘤中有许多高水平的特定酶,如基质金属蛋白酶(Matrix Metalloproteinases,MMPs)、胱蛋白酶(Caspase,Casp)、组织蛋白酶B(Cathepsin B,Cat B)等。靶向药物的设计也常常利用到此类酶的特性在聚合物中引入酶敏感的链段,通过特异性作用使其发生化学变化,触发降解使药物释放。Zhang等[33]制备了一种基于酶响应的聚乙二醇化赖氨酸肽树状大分子-吉西他滨(Gemcitabine,GEM)聚合物的纳米颗粒,通过甘氨酰苯丙氨酰亮氨酰甘氨酸四肽作为结合GEM可酶切的单元,这种纳米颗粒在含分泌Cat-B的肿瘤细胞中能更快速的释放出药物,在4T1小鼠乳腺模型中对肿瘤生长具有抑制作用,表现出较好的抗乳腺癌效果,且未表现出明显的全身毒性。
2.2.4 光响应纳米聚合物前药
光作为一种外部刺激具有相对安全,与细胞内交叉牵制小等优点。光作为一种电磁波,能够将其部分能量传递到暴露的物体上,而传递的能量可以相应地触发物体的化学键、化学基团、极性和其他一些性质的变化,实现特异位点的药物分子释放。与紫外光相比,近红外(Near Infrared,NIR)光对血液和软组织的衰减最小可深入穿透几英寸的组织,且对组织和细胞没有明显损伤。因此NIR光可作为体内触发光反应的优良光源[34]。
Kim等[35]合成了一种新的嵌段共聚物光响应DNQ基团修饰的poly(ethylene glycol)-block-poly-l-lysine(PEG-PLL)(PEG-PLL-DNQ),其中含有疏水性光敏DNQs,可在胶束核心内聚合物主链上的相邻DNQs之间产生π-π堆积相互作用,使其在没有光照射时,多西他赛(Docetaxel,DTX)稳定的存在于胶束纳米颗粒中,而在光照射时实现药物的可控性释放。
2.2.5 双响应纳米聚合物前药
除了单一刺激响应性聚合物纳米载体外,多重响应刺激可以进一步提高响应速率以及实现药物在病灶部位的定点释放,如pH和氧化还原、pH和温度、pH和酶、氧化还原和酶、光和ROS敏感性等,已被用于提高特定药物的递送效果。
Wang等[36]报道了一种基于NIR吸收剂氧化石墨烯(Graphite Oxide,GO)和聚酰胺-胺与普朗尼克F68(Polyamidoamine-Pluronic F68,PPF68)之间通过Se—Se键交联,NIR光敏剂吲哚菁绿(Indocyanine Green,ICG)和化疗药物DOX作为有效载荷的封装。GO-PPF68通过EPR效应到达肿瘤部位,PPF68避免包裹的ICG和DOX提前突释;通过NIR激光照射诱导足够ROS产生使Se—Se键断裂,实现DOX的可控性释放。
表2列出了应用于肿瘤治疗的不同刺激响应类型的聚合物前药。
表2 不同类型的刺激响应性纳米聚合物前药
Tab.2 Various types of stimulus-responsive nano-polymer prodrugs

刺激响应类型键型结构聚合物前药文献酸响应腙键PDOX/IR825[12]亚胺键mPEG-PBLA-PVIm(PPBV)-PTX-CUR[37]缩醛键PCurc8[38]酯键HDO-NPs[39]咪唑poly(ethyleneglycol)3400-aconityllinkage-poly(l-glutamicacid)15-poly(l-histidine)10-poly(l-leucine)10andLyP1-poly(ethyleneglycol)1100-poly(l-glutamicacid)15-poly(l-histidine)10-poly(l-leucine)10-DOX[40]酰胺键QT-CA-CS-DOX[41]氧化还原响应二硫键β-CD-b-P(CPTGSH-co-CPTROS-co-OEGMA)(CPGR)[42]三硫键DOX-SSS-DOX[30]二硒键Bi(mPEG-SeSe)-PCL-DOX[43]酶响应硫酯键P(oligo[ethyleneglycol]monomethylethermethacrylate[OEGMA]-co-BUF-co-Oct)[44]温度和ROS硫醚PPS-PNIPAm-DOX[45]
3 主动靶向纳米聚合物前药
向肿瘤部位输送特定有效的药物是所有肿瘤治疗策略的共同目标[46]。纳米聚合物前药能够通过被动或主动靶向,将药物通过全身或局部给药的方式选择性地定位于靶组织、靶器官或靶细胞等,从而发挥其增效减毒的治疗作用[47]。被动靶向充分利用肿瘤组织的EPR效应,以及肿瘤细胞的异常淋巴引流,使药物透过血管壁在肿瘤组织中富集[48]。被动靶向虽然能观察到药物在肿瘤中的积聚,但在细胞选择性吸收和细胞内药物的靶向释放上仍存在问题,即仅使用肿瘤组织的生理特性可能不足以进行有效靶向[49],而主动靶向是将纳米聚合物前药与特定配体功能化,如:蛋白质(抗体、抗体片段、生长因子和转铁蛋白)、肽(如cRGD、奥曲肽、AP肽和tLyp-1肽)、适配体(如A10、AS1411)、多糖(如透明质酸)、小生物分子(如叶酸、半乳糖、甘草酸、生物素、二磷酸盐、DCL(前列腺特异性膜抗原PSMA抑制剂)等[46-48]。He等[50]设计了一种二聚体PTXD-Se纳米聚合物前药(uPA-PTXD NPs),uPA-PTXD NPs具有TNBC靶向配体uPA肽,在TNBC病变中发挥强化药物累积和降低全身毒性的作用,体内外实验都表现出显著的抗TNBC效果。通过配体介导的主动靶向纳米聚合物前药能够被实体瘤细胞、转移性肿瘤细胞、耐药肿瘤细胞和肿瘤干细胞在内的靶细胞特异性识别和内化,使药物作用于特定靶点,定位释药,更加有利于降低药物毒性,提高药物在肿瘤组织中的累积和摄取。
4 总结与展望
近年来,随着纳米聚合物前药研究的不断深入、抗肿瘤药物“纳米时代”的来临,为乳腺癌的治疗提供新的选择。众所周知,化疗仍是乳腺癌全身治疗的基石。肿瘤异质性和缺乏靶向性是治疗面临的严峻问题。近年来研究人员将前药的易功能化与纳米聚合物优异的生物相容性和可控释放性相结合,对各种纳米聚合物前药的抗乳腺癌应用进行了深入研究。科研人员设计开发具有针对性、个性化的纳米聚合物前药,不仅可以提高乳腺癌细胞内的药物富集,同时能降低全身毒性,提升患者的药物依从性和生存质量。然而目前还存在一些亟待解决的关键科学问题,如:纳米药物的药效受纳米材料种类及其物理特性(形貌、粒径、表面电荷、稳定性等)、靶向配体类型、修饰密度的影响等。当纳米药物进入生物体循环系统,体内的各种蛋白质通过共价键、氢键、范德华力以及物理途径吸附到纳米药物表面,改变其电荷特性和稳定性;纳米药物所修饰的主动靶向配体也可能会在体内代谢过程中发生变质发应,从而失去其特异性选择作用;由于纳米药物具有特殊的物理化学性质,需对其安全性进行长期监测与评价;传统体外实验模型缺乏生物组织的复杂性和流体流动的控制,因此成本效益以及肿瘤的多样性与异质性等仍需进一步评估;建立实行良好的生产管理规范,实现从基础研究到商业化生产的平稳过渡。综上所述,纳米聚合物前药在肿瘤治疗中具有广阔的应用前景和市场潜力,但要进入临床应用仍需要科研人员的不懈探索与努力,以期能早日投入市场实现精准有效的靶向化疗,为乳腺癌患者带来福音。
[1] BRAY F,LAVERSANNE M,SUNG H,et al.Global cancer statistics 2022:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA-Cancer J.Clin.,2024,74(3):229-263.
[2] ZAGAMI P,CAREY L A.Triple negative breast cancer:Pitfalls and progress[J].NPJ Breast Cancer,2022,8(1):95.
[3] WON K A,SPRUCK C.Triple-negative breast cancer therapy:Current and future perspectives[J].Int.J.Oncol.,2020,57(6):1 245-1 261.
[4] GIANG I,BOLAND E L,POON G M,et al.Prodrug applications for targeted cancer therapy[J].AAPS J.,2014,16(5):899-913.
[5] KHANDARE J,MINKO T.Polymer-drug conjugates:Progress in polymeric prodrugs[J].Prog.Polym.Sci.,2006,31(4):359-397.
[6] GIRASE M L,PATIL P G,IGE P P.Polymer-drug conjugates as nanomedicine:A review[J].Int.J.Polym.Mater.,2019,69(15):1-25.
[7] DUNCAN R.Polymer conjugates as anticancer nanomedicines[J].Nat.Rev.Cancer,2006,6:688-701.
[8] GRECO F,VICENT M J.Combination therapy:Opportunities and challenges for polymer-drug conjugates as anticancer nanomedicines[J].Adv.Drug Deliv.Rev.,2009,61(13):1 203-1 213.
[9] MARKOVSKY E,BAABUR-COHEN H,SATCHI-FAINARO R.Anticancer polymeric nanomedicine bearing synergistic drug combination is superior to a mixture of individually-conjugated drugs[J].J.Control.Release,2014,187:145-157.
[10] JAVIA A,VANZA J,BARDOLIWALA D,et al.Polymer-drug conjugates:Design principles,emerging synthetic strategies and clinical overview[J].Int.J.Pharm.,2022,623:121 863.
[11] VOGUS D R,KRISHNAN V,MITRAGOTRI S.A review on engineering polymer drug conjugates to improve combination chemotherapy[J].Curr.Opin.Colloid.In.,2017,31:75-85.
[12] ZHANG Y Y,TEH C,LI M H,et al.Acid-responsive polymeric doxorubicin prodrug nano-particles encapsulating a near-infrared dye for combined photothermal-chemotherapy[J].Chem.Mater.,2016,28(19):7 039-7 050.
[13] WANG C,YU H,YANG X H,et al.Elaborately engineering of a dual-drug co-assembled nanomedicine for boosting immunogenic cell death and enhancing triple negative breast cancer[J].Asian J.Pharm.Sci.,2022,17(3):412-424.
[14] WEI X,WANG Y,XIONG X,et al.Codelivery of a π-π stacked dual anticancer drug combination with nanocarriers for overcoming multidrug resistance and tumor metastasis[J].Adv.Funct.Mater.,2016,26(45):8 266-8 280.
[15] TANG L,JIANG W H,WU L,et al.TPGS2000-DOX prodrug micelles for improving breast cancer therapy[J].Int.J.Nanomed.,2021,16:7 875-7 890.
[16] CHU C Y,LYU X M,WANG Z X,et al.Cocktail polyprodrug nanoparticles concurrently release cisplatin and peroxynitrite-generating nitric oxide in cisplatin-resistant cancers[J].Chem.Eng.J.,2020,402:126 125.
[17] CHEN M,ZHANG M,LU X,et al.Diselenium-linked dimeric prodrug nanomedicine breaking the intracellular redox balance for triple-negative breast cancer targeted therapy[J].Eur.J.Pharm.Biopharm.,2023,193:16-27.
[18] KIM Y H,WEBSTER O W.Hyperbranched polyphenylenes[J].Macromolecules,1992,25(21):5 561-5 572.
[19] BELGAONKAR M S,KANDASUBRAMANIAN B.Hyperbranched polymer-based nanocomposites:Synthesis,progress,and applications[J].Eur.Polym.J.,2021,147:110 301.
[20] FENG D X,WANG J,GAO P F,et al.Synergic fabrication of folic acid-targeted hyperbranched polymer (HBP)-modified pH-response drug delivery system for the treatment of breast cancer[J].Process Biochem.,2023,130:191-202.
[21] CHU H W,SUN R,SHENG J,et al.Polymeric prodrug by supramolecular polymerization[J].React.Funct.Polym.,2023,191:105 654.
[22] SU H,CUI Y G,WANG F H.Theranostic supramolecular polymers formed by the self-assembly of a metal-chelating prodrug[J].Biomater.Sci.,2021,9(2):463-470.
[23] WU T,DAI Y.Tumor microenvironment and therapeutic response[J].Cancer Lett.,2017,381:61-68.
[24] WEBB B A,CHIMENTI M,et al.Dysregulated pH:A perfect storm for cancer progression[J].Nat.Rev.Cancer,2011,11:671-677.
[25] DONG X,BRAHMA R K,FANG C,et al.Stimulus-responsive self-assembled prodrugs in cancer therapy[J].Chem.Sci.,2022,13(15):4 239-4 269.
[26] ZENG X L,WANG H R,ZHANG Y W,et al.pH-responsive hyaluronic acid nanoparticles for enhanced triple negative breast cancer therapy[J].Int.J.Nanomed.,2022,17:1 437-1 457.
[27] XIAO X,WANG K W,ZONG Q Y,et al.Polyprodrug with glutathione depletion and cascade drug activation for multi-drug resistance reversal[J].Biomaterials,2021,270:120 649.
[28] WANG Y C,WANG F,SUN T M,et al.Redox-responsive nanoparticles from the single disulfide bond-bridged block copolymer as drug carriers for overcoming multidrug resistance in cancer cells[J].Bioconjug.Chem.,2011,22(10):1 939-1 945.
[29] SUN J J,LIU Y H,CHEN Y C,et al.Doxorubicin delivered by a redox-responsive dasatinib-containing polymeric prodrug carrier for combination therapy[J].J.Control.Release,2017,258:43-55.
[30] YANG Y X,SUN B J,ZUO S Y,et al.Trisulfide bond-mediated doxorubicin dimeric prodrug nanoassemblies with high drug loading,high self-assembly stability,and high tumor selectivity[J].Sci.Adv.,2020,6(45):eabc1 725.
[31] TAO W H,HE Z G.ROS-responsive drug delivery systems for biomedical applications[J].Asian Pharm.Sci.,2018,13(2):101-112.
[32] ZHANG Z T,HUANG-FU M Y,XU W H,et al.Stimulus-responsive nanoscale delivery systems triggered by the enzymes in the tumor microenvironment[J].Eur.J.Pharm.Biopharm.,2019,137:122-130.
[33] ZHANG C Y,PAN D Y,LI J,et al.Enzyme-responsive peptide dendrimer-gemcitabine conjugate as a controlled-release drug delivery vehicle with enhanced antitumor efficacy[J].Acta Biomater.,2017,55:153-162.
[34] ZHOU Y,YE H,CHEN Y B,et al.Photo-responsive drug/gene delivery systems[J].Biomacromolecules,2018,19(6):1 840-1 857.
[35] KIM K N,OH K S,SHIM J,et al.Light-responsive polymeric micellar nanoparticles with enhanced formulation stability[J].Polymers,2021,13(3):377.
[36] WANG M,WU J H,LI Y,et al.A tumor targeted near-infrared light-controlled nanocomposite to combat with multidrug resistance of cancer[J].J.Control.Release,2018,288:34-44.
[37] YANG Z,SUN N,CHENG R,et al.pH multistage responsive micellar system with charge-switch and PEG layer detachment for co-delivery of paclitaxel and curcumin to synergistically eliminate breast cancer stem cells[J].Biomaterials,2017,147:53-67.
[38] TANG H D,MURPHY C J,ZHANG B,et al.Curcumin polymers as anticancer conjugates[J].Biomaterials,2010,31(27):7 139-7 149.
[39] ZENG X L,WANG H R,ZHANG Y W,et al.pH-responsive hyaluronic acid nanoparticles for enhanced triple negative breast cancer therapy[J].Int.J.Nanomed.,2022,17:1 437-1 457.
[40] WANG T W,YEH C W,KUAN C H,et al.Tailored design of multifunctional and programmable pH-responsive self-assembling polypeptides as drug delivery nanocarrier for cancer therapy[J].Acta Biomater.,2017,58:54-66.
[41] MU Y Z,WU G S,SU C,et al.pH-sensitive amphiphilic chitosan-quercetin conjugate for intracellular delivery of doxorubicin enhancement[J].Carbohydr.Polym.,2019,223:115 072.
[42] BAI S,MA X Q,SHI X X,et al.Smart unimolecular micelle-based polyprodrug with dual-redox stimuli response for tumor microenvironment:Enhanced in vivo delivery efficiency and tumor penetration[J].ACS Appl.Mater.Interfaces,2019,11(39):36 130-36 140.
[43] HAILEMESKEL B Z,HSU W H,ADDISU K D,et al.Diselenide linkage containing triblock copolymer nanoparticles based on bi(methoxyl poly(ethylene glycol))-poly(ε-carprolactone):Selective intracellular drug delivery in cancer cells[J].Mater.Sci.Eng.C Mater.Biol.Appl.,2019,103:109 803.
[44] LIU T,JIA T T,YUAN X,et al.Development of octreotide-conjugated polymeric prodrug of bufalin for targeted delivery to somatostatin receptor 2 overexpressing breast cancer in vitro and in vivo[J].Int.J.Nanomed.,2016,11:2 235-2 250.
[45] TANG M Q,HU P,ZHENG Q,et al.Polymeric micelles with dual thermal and reactive oxygen species (ROS)-responsiveness for inflammatory cancer cell delivery[J].J.Nanobiotechnol,2017,15:39.
[46] ZHONG Y N,MENG F H,DENG C,et al.Ligand-directed active tumor-targeting polymeric nanoparticles for cancer chemotherapy[J].Biomacromolecules,2014,15(6):1 955-1 969.
[47] KAMALY N,XIAO Z Y,VALENCIA P M,et al.Targeted polymeric therapeutic nanoparticles:Design,development and clinical translation[J].Chem.Soc.Rev.,2012,41:2 971-3 010.
[48] PÉREZ-HERRERO E,FERN NDEZ-MEDARDE A.Advanced targeted therapies in cancer:Drug nanocarriers,the future of chemotherapy[J].Eur.J.Pharm.Biopharm.,2015,93:52-79.
NDEZ-MEDARDE A.Advanced targeted therapies in cancer:Drug nanocarriers,the future of chemotherapy[J].Eur.J.Pharm.Biopharm.,2015,93:52-79.
[49] 韩凯硕,任婷,李多,等.介孔硅纳米载体应用于肿瘤治疗的研究进展[J].化学试剂,2023,45(9):1-10.
[50] HE X,ZHANG J X,LI C,et al.Enhanced bioreduction-responsive diselenide-based dimeric prodrug nanoparticles for triple negative breast cancer therapy[J].Theranostics,2018,8(18):4 884-4 897.