气相色谱法(Gas Chromatography,GC)、高效液相色谱法(High-Performance Liquid Chromatography,HPLC)、质谱法(Mass Spectrometry,MS)在过去的几十年广泛应用于高效检测领域,为环境质量和食品安全监测提供了有效支持[1]。这些方法虽然具有高准确度、高灵敏度和可接受的基质效应,但严格的预处理要求、高分析成本、复杂的操作、耗时的程序以及对操作人员较高的专业技术要求很大程度上限制了实际应用的便利性。光学比色法具有快捷、高效的可识读特点,而荧光传感器在样品分析中具有简单、快速和高灵敏度的优势,使其成为快速分析的潜在方法之一[2]。随着先进功能纳米材料的发展,部分碳纳米材料因其固有的荧光特性而受到越来越多的关注,在传感、生物成像技术和电子装置方面具有明显优势[3]。荧光碳纳米材料主要包括零维(Zero-Dimensional,0-D)碳点(Carbon Dots,CDs)/石墨烯量子点(Graphene Quantum Dots,GQDs)、二维氮化碳纳米片(g-C3N4)和三维碳基金属/共价有机框架(Metal/Covalent Organic Frameworks,MOFs/COFs),此类材料具有良好的低毒性、化学耐久性、易获取性和出色的生物相容性等优点,是可以克服半导体量子点(Quantum Dots,QDs)和有机荧光染料某些缺点的新兴功能材料。其中,CDs具有独特的荧光特性、突出的光致发光(Photoluminescence,PL)性能、高光稳定性和高荧光量子产率(Quantum Yield,QY)、良好的溶解性、易于制备和功能化等特点,具有低成本、无毒性、生物相容性好、高抗光漂白性[4]等优势。此外,CDs碳核的表面覆盖着丰富的官能团,如氨基、羧基和羰基,为CDs的功能化应用提供了有利条件。因此,CDs在构建快速检测荧光传感方面也获得了极大的关注。本文将从碳点性质、荧光机制、荧光响应机制、传感器构建策略等方面介绍碳点近些年在荧光快速检测方面的研究进展。
1 碳点性质及荧光机制
1.1 碳点性质
2004年,Xu等[5]对单壁碳纳米管进行电泳预处理时发现了具有荧光的碳纳米残留物。2006年,Sun等[6]对石墨粉末进行激光烧蚀时再次发现该物质,并命名为CDs。CDs也被称为碳量子点(Carbon Quantum Dots,CQDs)、碳纳米点(Carbon Nano Dots,CNDs)或荧光碳纳米颗粒(Fluorescent Carbon Nanoparticles)。一般认为,CDs是由直径<10 nm的碳元素组成。CDs具有良好的水稳定性、易于功能化、毒性小、荧光强、光色可调、较高的光稳定性[7]特点(图1)。
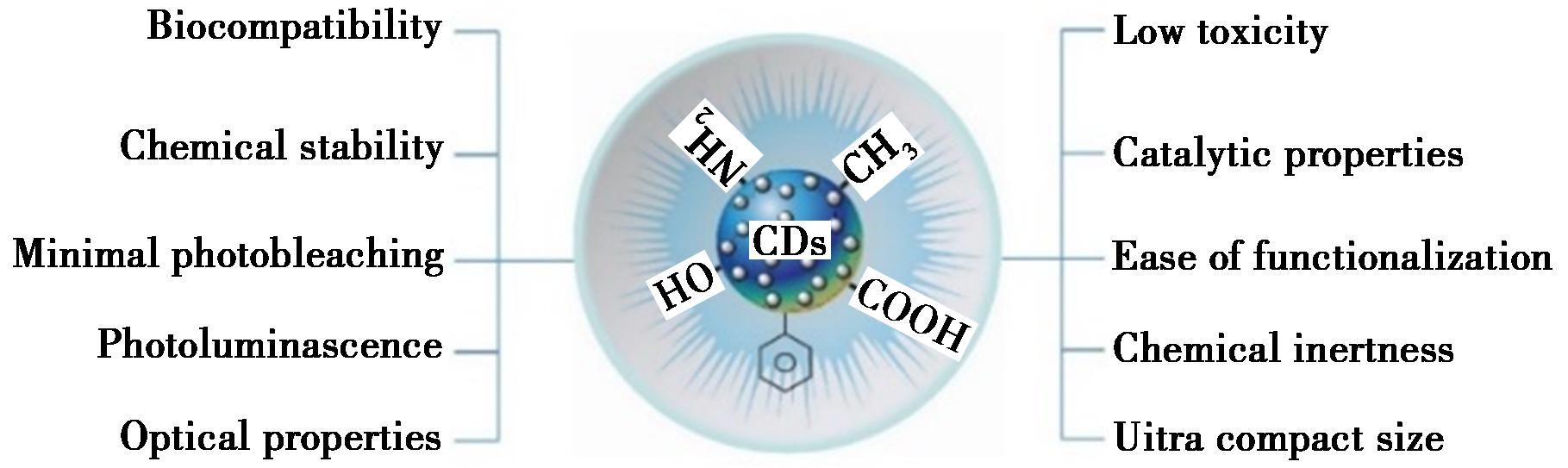
图1 碳点性质[7]
Fig.1 Properties of carbon dots[7]
CDs类似于核壳结构的零维碳材料,包括sp2/sp3杂化碳原子的核心结构和表面包括羧酸、羟基在内的含氧功能分子钝化的壳结构。因其显著的量子限域效应,使CDs成为具有高度可调的光致发光和光电特性的荧光纳米材料[8]。CDs上的含氧表面功能分子改变了CDs颗粒的表面结构和尺寸,当CDs半径小于激子玻尔半径时就会出现量子限域效应[9]。共轭结构的电子能隙转换、表面缺陷状态、元素掺杂和部分荧光分子都会影响CDs的发射颜色[8]。当CDs受到光子激发时,电子会迁移到激发态,最终返回基态,在此过程中部分能量通过非辐射方式释放,而额外的能量以光辐射方式释放造成荧光发射,即光致发光(PL)。此外,电子转移(ET)和CDs储能的特性均可以分离光致产生的电子引起荧光发射[7]。虽然当前对CDs荧光发射机制尚未有定论,本文仅对现有CDs的一般荧光机制归纳,如图2所示。碳核结构相对稳定,而CDs的表面态能级丰富,可通过许多简单的方法调节CDs的溶解度和量子产率以满足各领域应用需要[10-12]。CDs可高效利用全光谱激发,实现近红外光谱区的PL发射以及拥有光电子学、光催化和光诱导电子转移等特性,这些特性共同拓展了其在许多领域的应用场景。
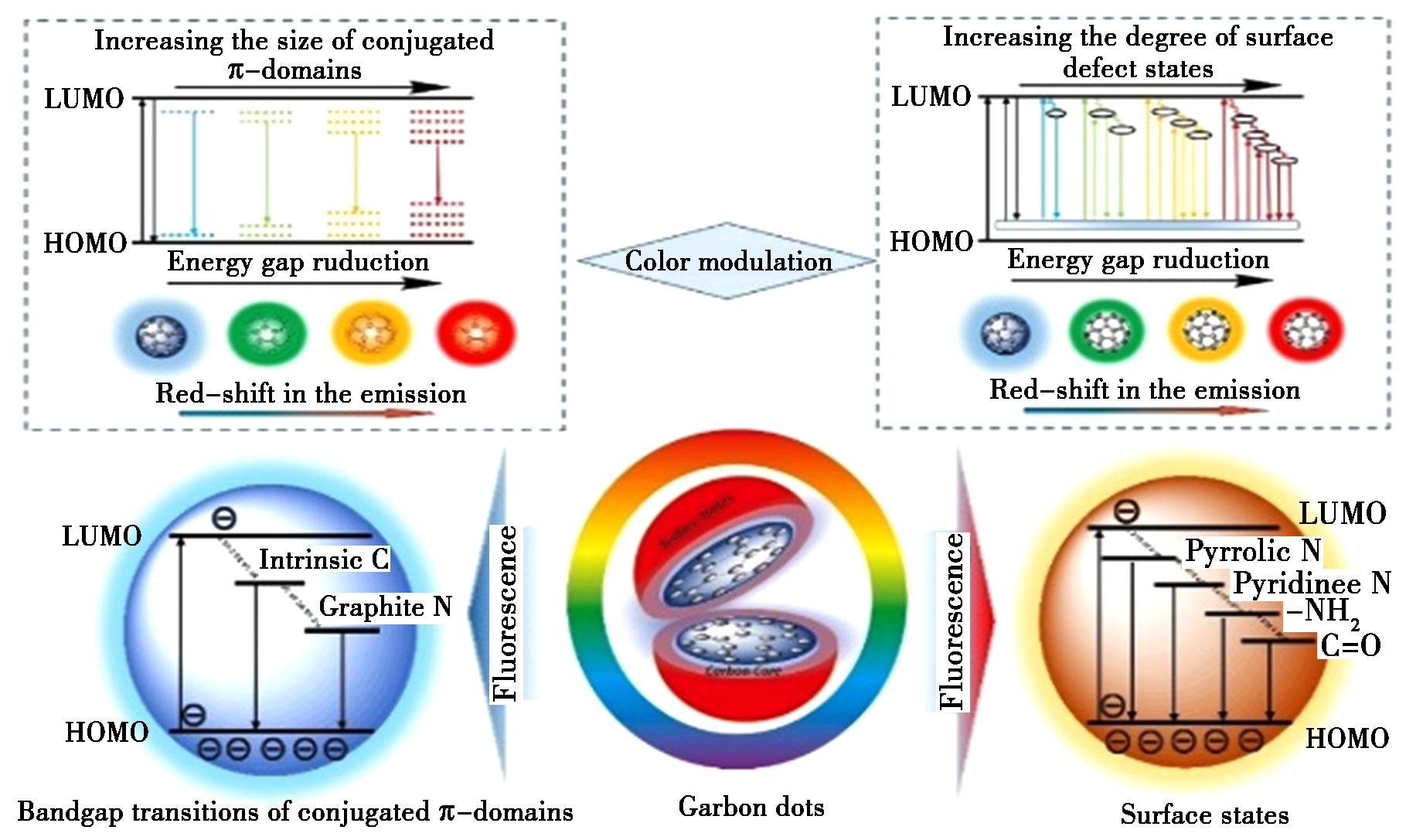
图2 碳点荧光原理
Fig.2 Fluorescence principle of carbon dots
1.2 荧光机制
由于利用不同的制备方法(自上而下法和自下而上法)和各种碳源前体(石墨烯及其衍生物、有机小分子、聚合物和生物质材料)来合成不同结构特征和光学行为的CDs,其荧光发射机制尚未统一。目前,普通认为有4种荧光机制可用于解释CDs荧光的可调谐发射,包括共轭π域的量子限域效应(Quantum Confinement Effect of Conjugated π-Domains)、表面态(Surface State)、分子态(Molecular State)和交叉链接增强发射(Cross-link-Enhanced Emission,CEE)。
1.2.1 量子限域效应
量子点荧光发射高度依赖于量子限域效应[13,14]。当sp2共轭域的尺寸小于激子玻尔半径时,原来的准连续电子能级将转变为离散能级。随着sp2结构域尺寸的增加,有效带隙逐渐增大导致相应的吸收光谱和荧光光谱出现红移。CDs作为一类有机量子点,同样遵循量子限域效应,特别是由石墨烯及其衍生物通过自上而下的方法制备的CDs,离散能级的增加可引起丰富的荧光发射,如图2所示。在1~10 nm范围内,CDs粒径的变化能够引起带隙能量变化,随着CDs粒径变大导致能隙逐渐减少,同时CDs发射的颜色也从短波发射红移至长波发射[15]。
1.2.2 表面态
在大多数情况下,CDs荧光发射与尺寸无关,而表面态对结构复杂的CDs的荧光发射有更大的影响[16]。CDs表面含氧官能团,如羧基和羟基提供吸电子基团和供电子基团,形成表面缺陷的能量陷阱,可作为激子的捕获中心,导致CDs发射波长移动。sp2-杂化碳上C—O—C和C—O基团的增加可以在n-π*能带隙之间产生新的能级,导致产生更多的激发能量和激发波长相关的荧光(图2)[17]。CDs荧光特征在很大程度上取决于CDs表面的氧化物种类,如氮、氧、硫元素掺杂通常能够改变CDs表面态。掺杂原子数量的增加可以减少HOMO和LUMO之间的能带隙,造成能量陷阱的表面缺陷,从而诱导发射波长的红移。除了常见的含氧和含胺基团,有机分子和聚合物也可以用来诱导CDs额外的表面缺陷,进一步影响它们的光学行为。
1.2.3 分子态
分子态是人们在进行CDs透析纯化时发现的一种CDs荧光机制,研究人员发现在一些CDs中,无论分子量如何变化,透析袋内外的产物总是显示出相似的荧光发射,这表明这些CDs的荧光发射可能来自于特定小分子荧光团,而不是上述量子限域效应和表面态机制[18]。CDs表面态荧光机制主要是由于本身具有荧光发射小分子的材料分布于合成CDs表面,造成特有的荧光发射。分子态荧光机制广泛存在于以柠檬酸(Citric Acid,CA)及其衍生物、苯二胺等碳水化合物为碳源的CDs中[19]。具体来说,小分子荧光团在低温下的PL发射占优势,而分子荧光团在高温形成碳核过程中逐渐消耗,导致荧光强度下降。
1.2.4 CEE
CEE效应是用来解释没有共轭π域和分子荧光团的情况下的非共轭CDs荧光增强现象的一种荧光发射机制。CEE效应可通过化学交联(共价键)或物理交联(非共价键)[20],实现交联结构的形成,造成化合物分子链刚性平面结构的生成,从而有效地限制分子链的振动和旋转,促进电子从激发态到基态的辐射转换,以及缩短官能团之间的距离和/或产生新的化学键来产生一些新的能级,造成荧光发射增强。CEE效应造成的CDs内的共价交联不仅可以产生发光中心,也可以促进系间窜越(Intersystem Crossing,ISC)[21],产生有效的室温磷光(Room-Temperature Phosphorescence,RTP)发射。此外,除了CDs之外,CEE效应也被发现存在于发光的聚合物中[22]。
2 制备方法
经过近20年发展,CDs的制备方法趋于简化和高效,制备方法可分为自上而下(Top-Down)和自下而上(Bottom-Up)两种方法[23],如图3所示。自下而上法因其简单高效成为当前常用的CDs制备方法[23]。此外,表面钝化、元素掺杂或功能化可以在CDs制备之后或制备期间进行,以对CDs表面进行修饰达到相应的制备需求。
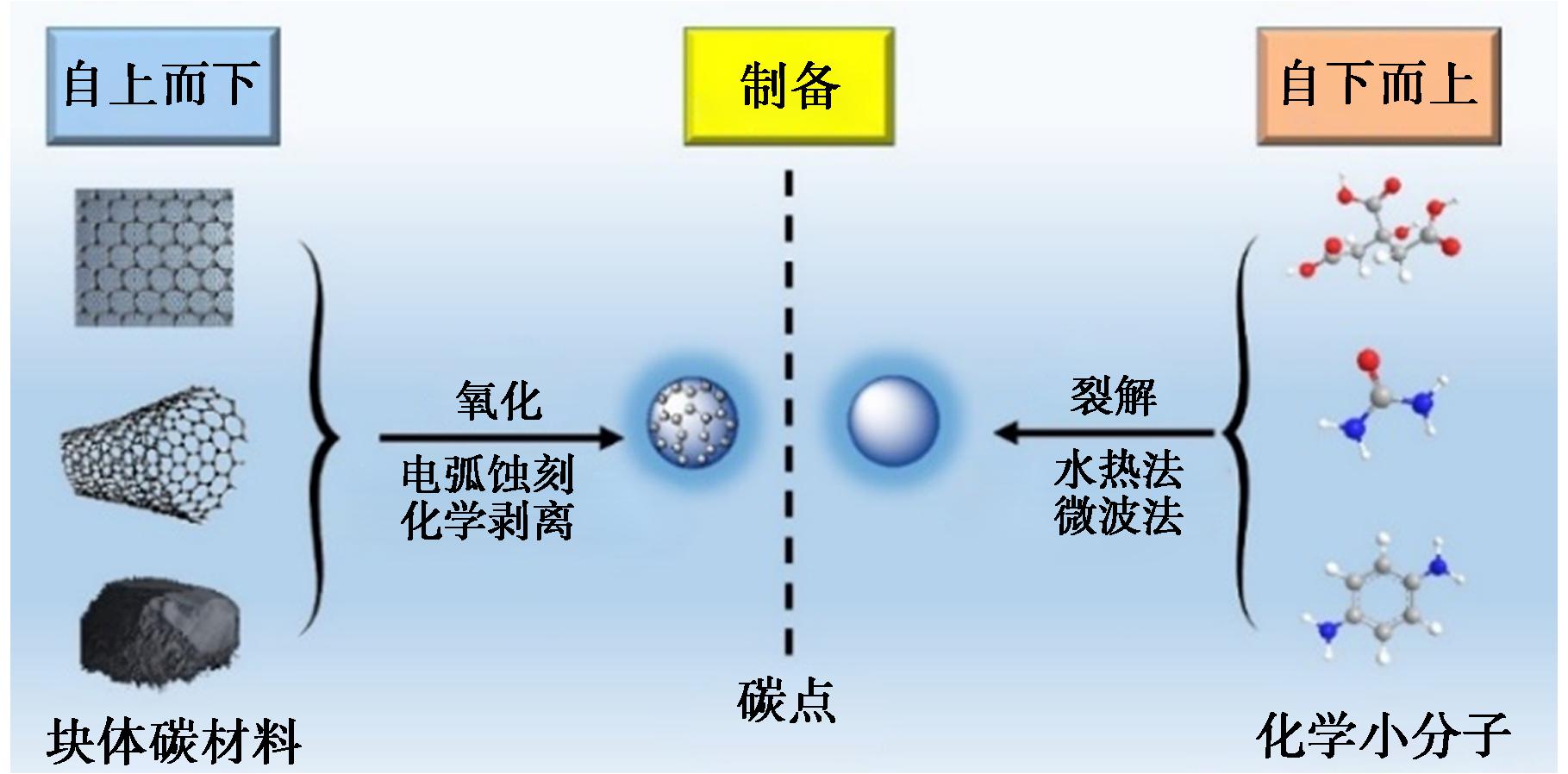
图3 碳点制备方法[23]
Fig.3 Approaches of CDs fabrication[23]
不管是自上而下法还是自下而上法制备CDs,由于碳源前体、制备途径、应用需求等方面对CDs的结构、粒径、表面修饰等都存在一定的不可控影响。因此,所制备CDs的纯化必不可少,以达到研究所需CDs的性能要求。色谱法、透析法、超速离心法和膜过滤法是用于CDs纯化的常见方法[24]。一般来讲,超速离心法可以使碳化的大颗粒杂质快速沉淀,以便于利用微滤膜过滤,然后可利用透析法除去小分子物质,以及利用色谱法对不同粒径和分子量的CDs进一步分级纯化。可进一步选择截留分子量(MWCO)为 300~3 000 Da的膜透析24~48 h,以排除小分子杂质,获得较为纯净的CDs;也可以利用色谱法进一步分离不同粒径的CDs,获得不同发射色的CDs[25]。
3 碳点荧光响应机制
在检测领域,CDs荧光通常用作响应信号构建荧光传感器,当目标分析物与CDs荧光传感器发生相互作用时,往往引起CDs荧光变化包括荧光猝灭或荧光增强,因此通过荧光比色法可实现传感器构建,如图4所示。荧光猝灭大体可分为静态猝灭(Static Quenching Effect,SQE)和动态猝灭(Dynamic Quenching Effect,DQE)[45],在不同猝灭状态情况下又包含不同猝灭途径。一般而言,作为可读信号的CDs荧光对分析物的响应机制包括傅斯特共振能量转移(Förster Resonance Energy Transfer,FRET)[12]、光诱导电子转移(Photo-Induced Electron Transfer,PET)[26]、分子内电荷转移(Intra-Molecular Charge Transfer,ICT)[27]、内滤效应(Inner Filter Effect,IFE)[28]。此外,聚集诱导猝灭(Aggregation-Caused Quenching,ACQ)[29]和聚集诱导的发射(Aggregation-Induced Emission,AIE)[30]也用来分析碳点的荧光变化机制。
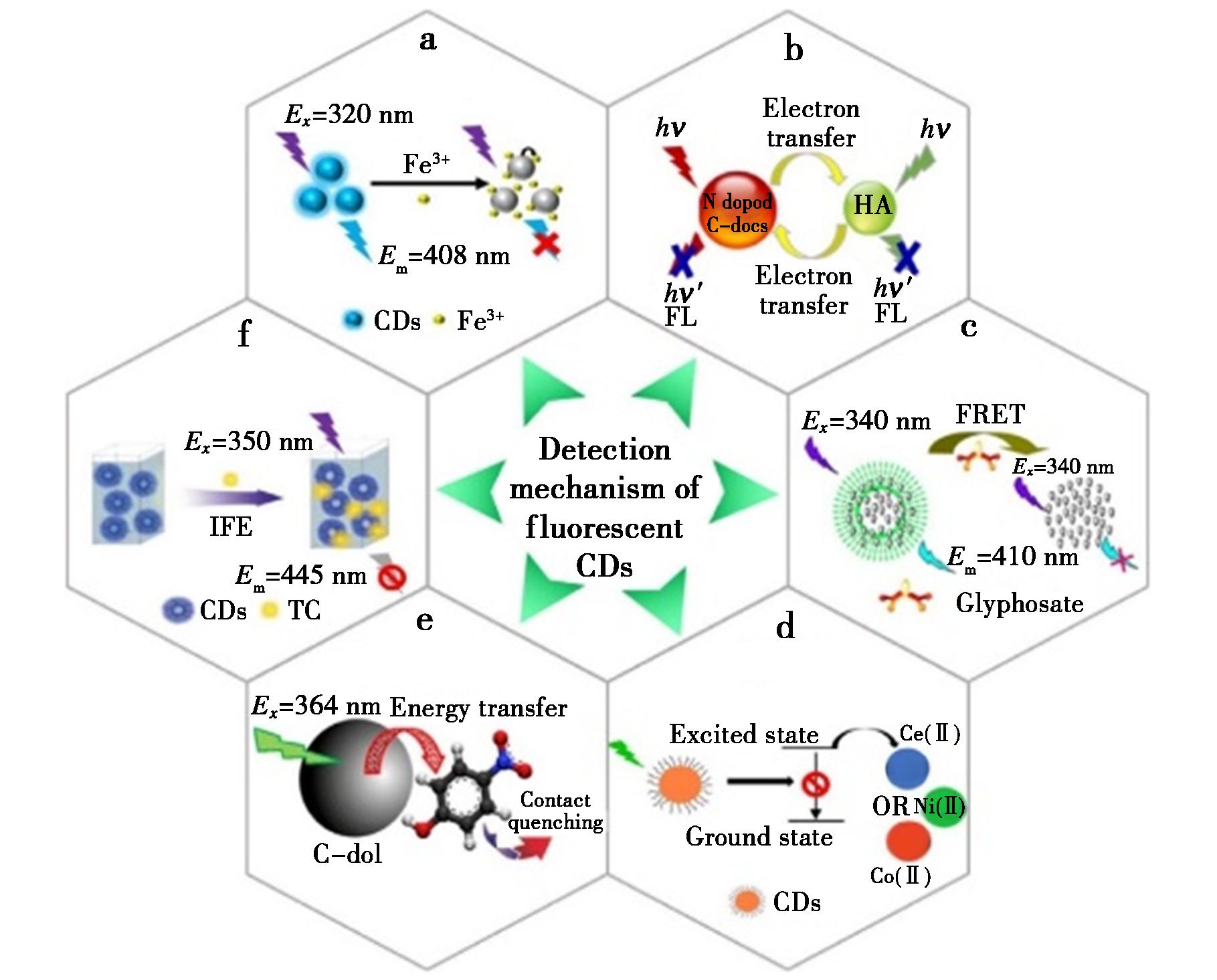
a.SQE;b.DQE;c.FRET;d.PET;e.SET;f.IFE
图4 碳点荧光响应机制
Fig.4 Response mechanism of fluorescent carbon dots
3.1 静态淬灭效应
当荧光CDs与分析物相互作用时,复合物立即回到基态,没有任何光子发射[31],如图4a所示。基态复合物可以改变CDs的吸收光谱。温度升高会使复合物不稳定,从而降低SQE。
3.2 动态淬灭效应
当处于激发态的CDs在与猝灭剂碰撞后通过能量或电荷转移的机制回到基态时引起的荧光猝灭为动态淬灭[32],如图4b所示。DQE的最大特点是CDs的荧光寿命会发生变化。DQE效应可以通过提高温度来加强。动态猝灭往往伴随着能量的限制变化。
3.3 傅斯特共振能量转移
傅斯特共振能量转移(FRET)系统包含两个荧光团,即能量供体和能量受体。如图4c所示,在FRET发生时,必须满足两个条件:(1)供体的发射光谱和受体的吸收光谱之间的重叠[33];(2)供体和受体之间严格保持1~10 nm距离,即在波尔半径内[34]。当利用供体的激发波长激发CDs时,非辐射能量可以从供体转移到受体,为受体的激发态提供电子;而激发态受体返回基态时,以辐射方式释放能量而发出荧光,该荧光发射波长通常高于供体激发波长,出现斯托克斯位移(Stokes Shift)[35]。CDs荧光传感器的很多检测机制也来源于FRET机制。
3.4 光诱导电子转移
光诱导电子转移(PET)是一个失活过程,形成激发态CDs和分析物复合物的内部供给或吸收电子的氧化还原作用,该复合物大多数情况可通过非辐射方式返回基态。因此,电子受体和荧光体之间的电子转移可造成荧光淬灭。在PET中,分析物上的复合物发射经常被离子配位所淬灭。因此PET方法通常被用于离子诱导的“开启”和“关闭”荧光传感器的开发。如图4d所示,在a-PET中,电子受体的最高占有分子轨道(HOMO)的能级远远高于CDs的能级,电子转移是由受体到CDs。相反,在d-PET中,CDs的激发态电子转移到受体的最低未占分子轨道(LUMO)。然而,当受体选择性地识别分析物时,PET过程被中断,这使得CDs的荧光恢复。
3.5 表面能量转移
SET是指从供体分子到纳米粒子表面的能量转移,这种能量转移对能量供体和受体之间的距离没有FRET要求的波尔半径内,可以在两倍的FRET要求距离内实现能量转移[36],如图4e所示。
3.6 分子内电荷转移
分子内电荷转移(ICT)荧光传感器通常有一个电子供体(D)和一个电子受体(A),形成一个大的D-π-A共轭结构。分析物的加入可以调节D或A的吸引或排斥电子的能力,从而导致荧光光谱的蓝移或红移。此外,ICT探针的荧光寿命和量子产率在分析物鉴定后也会发生变化。
3.7 内滤效应
内滤效应(IFE)也取决于CDs光谱和分析物光谱之间的光谱重叠,包括紫外光谱冲动和荧光光谱重叠。不管哪种重叠,都可以引起CDs荧光猝灭,如图4f所示。IFE源于辐射能量转移,而与FRET的非辐射能量转移相反,CDs的能量变化主要发生在基态。因此在IFE中只观察到CDs荧光淬灭,而且CDs荧光寿命没有明显的变化,属于静态猝灭。此外,IFE与FRET的另一个主要区别是,能量供体和受体之间没有距离要求。
3.8 聚集诱导淬灭
大多数CDs在稀溶液中显示出强烈的荧光,但在高浓度或在固体状态下,发光性能下降甚至完全消失,这种现象被称为聚集诱导淬灭(ACQ)。一般认为荧光体和淬灭剂之间的直接接触,以及由于荧光体的高浓度而产生的自我淬灭是导致ACQ的主要原因。ACQ传感器的性能受到堆积、氢键、疏水效应和静电吸引等多种影响因素的影响。
3.9 聚集诱导发射
与ACQ相对的聚集诱导发射(AIE)是一种发光效应。AIE材料在稀溶液中不发光,但在高浓度或固体中却显示出强烈的荧光。这种现象的发生是因为分子在稀溶液中的动态分子内旋转耗散了其激发态能量。在聚集状态下,分子内旋转受到很大阻碍,导致非辐射能量衰减的抑制和荧光的增强。
4 CDs传感器的构建策略
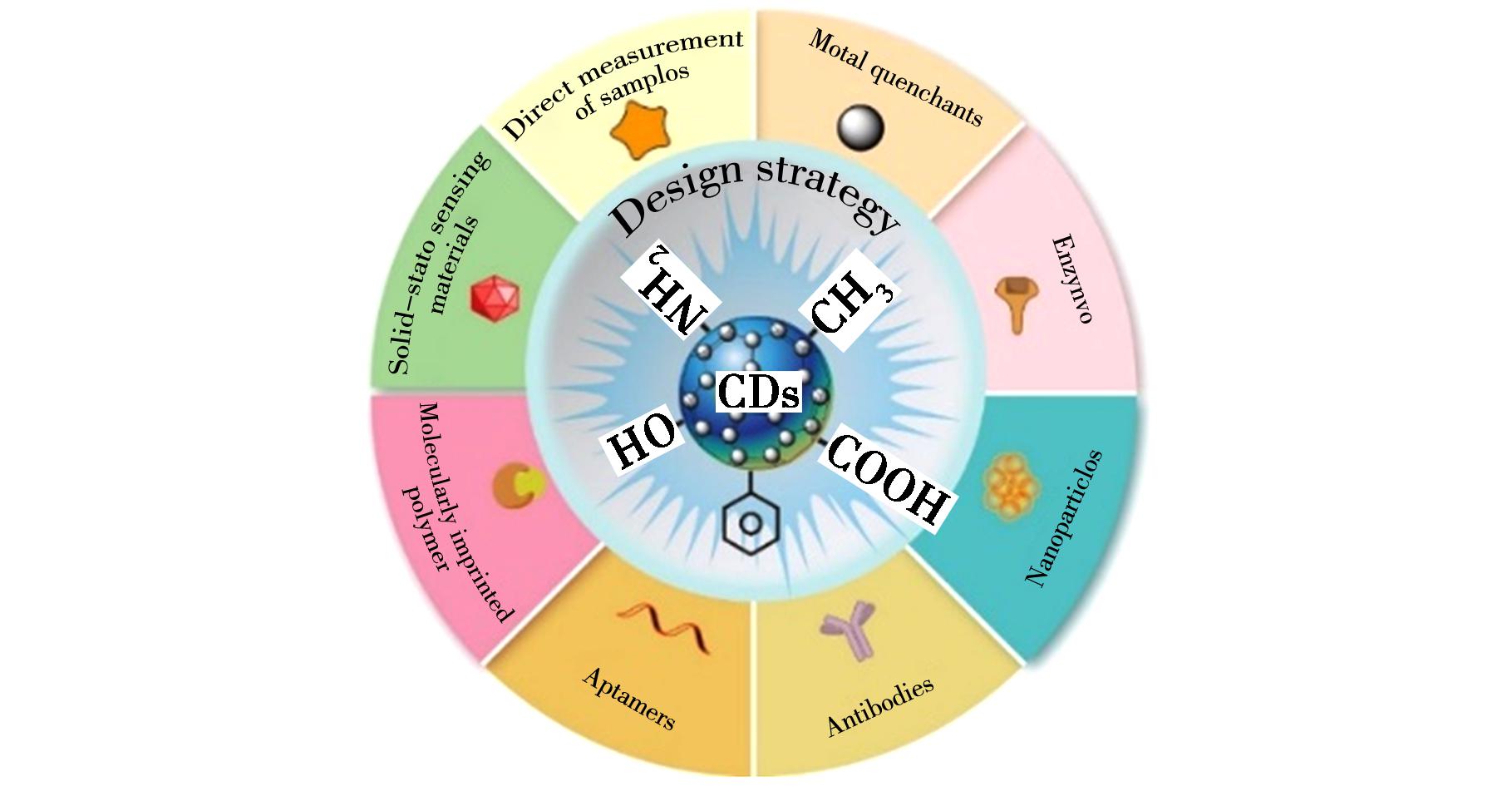
图5 碳点荧光传感器构建策略
Fig.5 Design strategy of fluorescent CDs sensors
传感器构建的基本要求是对目标分析物的特异性识别。根据传感器识别基团和分析目标物之间的相互作用,基于CDs的荧光传感器的设计策略主要可以分为两类:超分子作用和化学反应。传感器识别基团通过超分子相互作用来识别分析物,如氢键、静电相互作用、配位、抗原-抗体相互作用以及适配体与目标分子的特异性结合等。此外,如果分析物可以发生特定的化学反应,如催化反应、氧化还原反应、加成反应、保护和脱保护反应,导致荧光团的光谱特性发生变化,识别基团也能实现识别功能[31]。按照传感器识别目标物核心成分的要素进行分类,可通过酶标记法、抗体标记法、适配体标记法和分子印迹(MIPs)标记法等实现传感器构建及应用,如图5所示。
4.1 酶标记法
由于酶对底物的特异性,基于酶的生物传感器在分析领域受到广泛关注[20]。利用酶标法传感器检测农药可以通过以下两种作用模式进行:(1)抑制机制,即农药通过阻断活性位点来抑制酶的活性,进一步引发信号反应;(2)催化机制,即农药被用作酶的底物来影响催化过程。在这些形式中,以胆碱酯酶为代表的酶抑制型生物传感器在检测农药方面发挥了重要作用[21]。
胆碱酯酶是监测有机磷农药(OPs)和氨基甲酸酯类农药最广泛使用的一类酶,包括乙酰胆碱酯酶(AChE)和丁酰胆碱酯酶(BChE)。其反应机制主要因为OPs上被C、N、O和S原子基团包围的磷酸酯结构,可以通过亲核反应攻击胆碱酯酶的丝氨酸残基(Ser200)生成的磷酸化胆碱酯酶[39],而该酶对底物不具有催化功能,可以阻止底物生成硫代胆碱,硫代胆碱作为中间体与埃尔曼试剂、金属离子和贵金属纳米颗粒(AuNPs/AgNPs)结合,从而直接/间接调节与CDs的反应。
4.2 抗体标记法
免疫机制的高特异性对传感器构建具有重要意义。对于生物传感器来说,抗原和抗体之间的特异性识别和易于原位检测的优势,使抗体作为生物识别单元已经得到了广泛应用[40],荧光免疫传感器已用于环境监测和食品安全控制。尽管荧光免疫传感器已经取得了很大的发展,而基于CDs的荧光免疫传感器的农药检测的文献报道很少[41],主要原因在于农药的种类和数量庞大,进行单一农药抗体的成本偏高但成功率偏低的问题还需要进一步解决[42]。
4.3 适配体标记法
适配体(Aptamer)是指通过指数富集法(SELEX)筛选出的一段单链寡核苷酸序列,它可以通过强亲和力和高特异性与相应的配体/靶标选择性地结合[43]。适配体具有低分子量、易于大量合成/修饰和低成本的特点,是构建生物传感器的优良识别材料[44]。目前基于CDs的适配体传感器的报道较少,大多数检测方法都受到背景干扰的限制,无法实现现场分析[45]。
4.4 MIPs标记法
MIPs是由天然或合成的化合物通过模拟生物系统形成的具有特异性识别和选择性吸附特点的分子识别聚合体[46]。MIPs能够克服酶、抗体、适配体等制备的局限,通过单纯的化学方式获得识别功能体,同时具有高特异性、低成本、良好的机械性能和分离效果等优点[47],因此成为提供传感器识别单元的有效途径之一,如三唑磷[48]、噻苯达唑[49]等。虽然基于CDs的MIPs荧光传感器具有成本低、稳定性好、传质能力强、工程选择多等优点,但现有的缺点包括模板泄漏的可能性、结合位点分布不均、在水介质中不兼容等[50],影响其便捷使用。
4.5 无识别元件直读法
传统的生物传感器可通过组合荧光材料和识别单元构建,荧光材料作为指示信号,而酶、抗体、适配体和MIPs等生物材料用作识别单元。然而,这些单元在实际使用时易变性,促使基于无识别元件的传感器构建策略逐渐受到青睐[51]。CDs本身具有大量活性官能团,因此一些具有出色光学特性的CDs既可作为信号指示器也可作为目标识别单元,CDs可直接响应目标物,而不需要引入中间物。已有部分研究见于报道,如氟啶胺、甲基硫菌灵[52]、噻嗪酮[53]、丙溴磷、对硫磷、乐果、毒死蜱和嘧啶[54]等。由于单发射CDs极易受到样品基质干扰,所以比率荧光比色法成为无识别元件传感器的重要选择[51]。
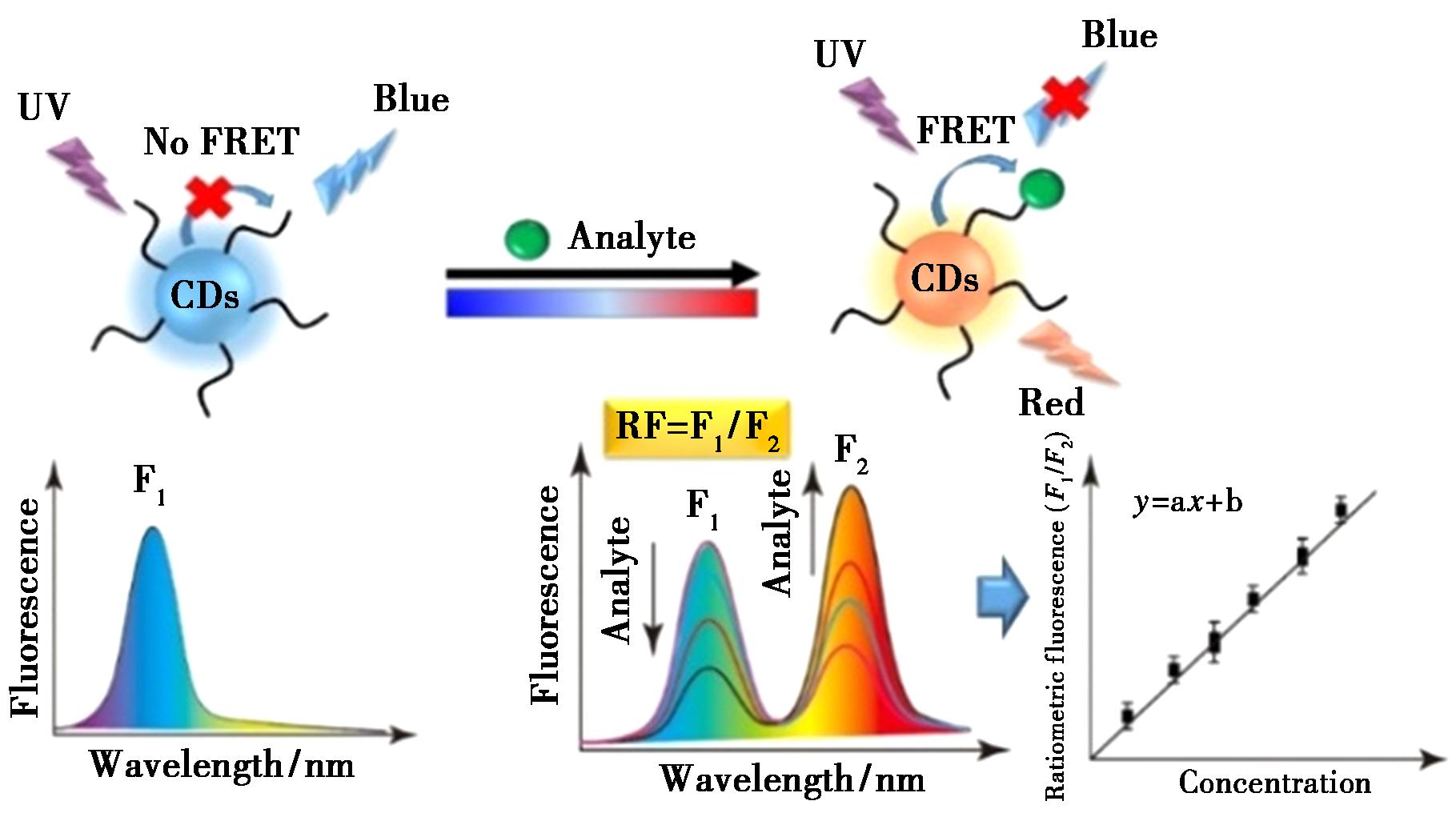
图6 碳点比率荧光传感原理
Fig.6 Ratiometric sensing principle of fluorescent carbon dots
5 局限与展望
在食品安全检测领域,构建新型传感器仍面临严峻的挑战。首先,食品基质异常复杂,不仅包含食品营养元素等活性成分,也包含目标物类似物以及其他衍生物等,会严重干扰传感器的有效工作。若要获得可行的检测样品,样品的前处理又非常复杂,而在样品处理过程中很有可能造成目标物的变化及流失,造成测量不准。其次,食品安全检测具有时效性,尤其是农药检测中的快速、就地、实时检测是食品安全的必要保证。
基于碳纳米材料的荧光传感器的主要挑战和未来趋势包括以下几点:1)从先进的荧光碳纳米材料的发展来看,具有长波窄峰发射的近红外荧光材料可以有效屏蔽复杂生物基质(如生物蛋白和色素)的背景干扰,提高实际样品分析的准确性[14]。2)通过与其他荧光材料的耦合,建立双发射比率荧光探针可以提供自校准,减少仪器和环境影响带来的系统误差[55]。3)便于携带和供电的便携式和小型化设备为现场监测应用提供了最佳策略。4)再加上3D打印技术,手持式分析仪(如智能手机)使其具有低成本和用户友好的优点,用户对其便携性比传统实验室分析要满意的多[56]。5)最后,需要高度重视对传感器系统的毒性评估[57]。此外,当前基于CDs的荧光传感器发展并不完全成熟,与GC-MS或LC-MS方法等认证标准还有一定距离。建立跨学科、科学辅助的全方位方法可以克服上述障碍,并促进目前对基于碳纳米材料的生物传感器的理解,将有望助推环境状况、食品安全和人类健康的现场监测。
6 结论
新型纳米材料的涌现,尤其是有机碳纳米材料的不断出现,为检测领域的传感器构建提供了丰富的来源。碳点以其优异的光学性能和较可靠的安全性为快速检测开辟了新天地。随着对碳点研究的进一步深入,有理由相信碳点荧光传感器在快速检测领域会得到更大的发展。但是碳点因其丰富的表面官能团存在,使其在面对复杂食品基质等目标检测时存在巨大局限,因此窄峰长波发射的近红外光谱结合其他纳米材料的比率荧光传感器将是解决该问题的一个有效策略。此外,食品安全事关重大,纳米材料的毒性分析也需要进一步开展,保证在传感器构建过程中避免对食品和环境的二次污染。最后,基于CDs的荧光传感器用于食品和农产品检测,应充分解析样品基质对传感器的干扰,寻找有效的抗干扰机制,从而促进CDs荧光传感器在食品安全及其他检测领域的广泛应用。
[1]CHA K H,LEE J,KIM J H.Development of a quantitative screening method for pesticide multiresidues in orange,chili pepper,and brown rice using gas chromatography-quadrupole time of flight mass spectrometry with dopant-assisted atmospheric pressure chemical ionization[J].Food Chem.,2022,374:131 626.
[2]NEKOUEIAN K,AMIRI M,SILLANP M,et al.Carbon-based quantum particles:An electroanalytical and biomedical perspective[J].Chem.Soc.Rev.,2019,48(15):4 281-4 316.
[3]YANG W R,RATINAC K R,RINGER S P,et al.Carbon nanomaterials in biosensors:Should you use nanotubes or graphene?[J].Angew.Chem.Int.Ed.Engl.,2010,49(12):2 114-2 138.
[4]GAO X,WANG L,SUN C,et al.Research on preparation methods of carbon nanomaterials based on self-assembly of carbon quantum dots[J].Molecules,2022,27(5):1 690-1 702.
[5]XU X Y,RAY R,GU Y L,et al.Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J].J.Am.Chem.Soc.,2004,126(40):12 736-12 737.
[6]SUN Y P,ZHOU B,LIN Y,et al.Quantum-sized carbon dots for bright and colorful photoluminescence[J].J.Am.Chem.Soc.,2006,128(24):7 756-7 757.
[7]LIU Y H,ZHANG D X,MAO B D,et al.Progress in carbon dots from the perspective of quantum dots[J].Acta Chim.Sinica.,2020,78(12):1 349.
[8]QU J H,WEI Q Y,SUN D W.Carbon dots:Principles and their applications in food quality and safety detection[J].Crit.Rev.Food Sci.,2018,58(14):2 466-2 475.
[9]ZHAO B,MA H Y,ZHENG M Y,et al.Narrow-andwidth emissive carbon dots:A rising star in the fluorescent material family[J].Carbon Energy,2022,4(1):88-114.
[10]ZHOU Y,MINTZ K J,SHARMA S K,et al.Carbon dots:Diverse preparation,application,and perspective in surface chemistry[J].Langmuir,2019,35(28):9 115-9 132.
[11]PANG Y Q,GAO H,WU S H,et al.Facile synthesis the nitrogen and sulfur co-doped carbon dots for selective fluorescence detection of heavy metal ions[J].Mater.Lett.,2017,193:236-239.
[12]DING H,YU S B,WEI J S,et al.Full-color light-emitting carbon dots with a surface-state-controlled luminescence mechanism[J].ACS Nano,2016,10(1):484-491.
[13]PONOMARENKO L A,SCHEDIN F,KATSNELSON M I,et al.Chaotic dirac billiard in graphene quantum dots[J].Science,2008,320(5 874):356-358.
[14]GIRIT Ç Ö,MEYER J C,ERNI R,et al.Graphene at the edge:Stability and dynamics[J].Science,2009,323(5 922):1 705-1 708.
[15]LI H,HE X,KANG Z,et al.Water-soluble fluorescent carbon quantum dots and photocatalyst design[J].Angew.Chem.Int.Ed.Engl.,2010,122(26):4 532-4 536.
[16]XU X Y,BAO Z J,TANG W S,et al.Surface states engineering carbon dots as multi-band light active sensitizers for ZnO nanowire array photoanode to boost solar water splitting[J].Carbon,2017,121:201-208.
[17]PAN X H,ZHANG Y,SUN X B,et al.Carbon dots originated from methyl red with molecular state and surface state controlled emissions for sensing and imaging[J].Luminescence,2018,204:303-311.
[18]MARTA J,KRYSMANN,ANTONIOS,et al.Formation mechanism of carbogenic nanoparticles with dual photoluminescence emission[J].J.Am.Chem.Soc.,2012,134(2):747-750.
[19]ZHANG T X,ZHU J Y,ZHAI Y,et al.A novel mechanism for red emission carbon dots:Hydrogen bond dominated molecular states emission[J].Nanoscale,2017,35(9):13 042-13 051.
[20]TAO S,ZHU S,FENG T,et al.Crosslink-nhanced emission effect on luminescence in polymers:Advances and perspectives[J].Angew.Chem.Int.Ed.Engl.,2020,132(25):9 910-9 924.
[21]PHILIP A M,GUDEM M,SEBASTIAN E,et al.Decoding the curious tale of atypical intersystem crossing dynamics in regioisomeric acetylanthracenes[J].J.Phys.Chem.A,2019,123(29):6 105-6 112.
[22]TAO S Y,LU S Y,GENG Y J,et al.Design of metal-free polymer carbon dots:A new class of room-temperature phosphorescent materials[J].Angew.Chem.Int.Ed.Engl.,2018,57(9):2 393-2 398.
[23]LONG C H,JIANG Z X,GUAN J F,et al.Applications of carbon dots in environmental pollution control:A review[J].Chem.Eng.J.,2021,406:126 848.
[24]ARCUDI F,DORDEVIC L,PRATO M.Synthesis,separation,and characterization of small and highly fluorescent nitrogen-doped carbon nanodots[J].Angew.Chem.Int.Ed.Engl.,2016,55(6):2 107-2 112.
[25]LUO X L,HAN Y,CHEN X M,et al.Carbon dots derived fluorescent nanosensors as versatile tools for food quality and safety assessment:A review[J].Trends.Food Sci.Tech.,2020,95:149-161.
[26]JIANG J J,YE G,WANG Z,et al.Heteroatom-doped carbon dots (CDs) as a class of metal-free photocatalysts for PET-RAFT polymerization under visible light and sunlight[J].Angew.Chem.Int.Ed.Engl.,2018,57(37):12 037-12 042.
[27]SHANG W J,CAI T,ZHANG Y X,et al.Facile one pot pyrolysis synthesis of carbon quantum dots and graphene oxide nanomaterials:All carbon hybrids as eco-environmental lubricants for low friction and remarkable wear-resistance[J].Tribol.Int.,2018,118:373-380.
[28]YAN F Y,ZU F L,XU J X,et al.Fluorescent carbon dots for ratiometric detection of curcumin and ferric ion based on inner filter effect,cell imaging and PVDF membrane fouling research of iron flocculants in wastewater treatment[J].Sensor.Actuat.B-Chem.,2019,287:231-240.
[29]ZHANG M,CHEN J,WANG M,et al.Pyrene-based nonwoven fabric with tunable fluorescence properties by employing the aggregation-caused quenching effect[J].ACS Appl.Mater.Inter.,2021,13(7):9 036-9 042.
[30]QIAN J,TANG B Z.AIE luminogens for bioimaging and theranostics:From organelles to animals[J].Chem-US,2017,3(1):56-91.
[31]LI X C,ZHAO S J,LI B L,et al.Advances and perspectives in carbon dot-based fluorescent probes:Mechanism,and application[J].Coordin.Chem.Rev.,2021,431:213 686.
[32]MOLAEI M J.Principles,mechanisms,and application of carbon quantum dots in sensors:A review[J].Anal.Methods-UK,2020,12(10):1 266-1 287.
[33]HSU C P,HEJAZI Z,ARMAGAN E,et al.Carbon dots and fluorescein:The ideal FRET pair for the fabrication of a precise and fully reversible ammonia sensor[J].Sensor.Actuat.B-Chem.,2017,253:714-722.
[34]KEGEL I,METZGER T H,LORKE A,et al.Nanometer-scale resolution of strain and interdiffusion in self-assembled InAs/GaAs quantum dots[J].Phys.Rev.Lett.,2019,85(8):1 694-1 697.
[35]WANG Z,YANG W,WANG Y.Self-trapped exciton and large stokes shift in pristine and carbon-coated silicon carbide quantum dots[J].J.Phys.Chem.C,2017,121(36):20 031-20 038.
[36]LIU S Y,ZHAO N,CHENG Z,et al.Amino-functionalized green fluorescent carbon dots as surface energy transfer biosensors for hyaluronidase[J].Nanoscale,2015,7(15):6 836-6 842.
[37]LEE S W,LEE K Y,SONG Y W,et al.Direct electron transfer of enzymes in a biologically assembled conductive nanomesh enzyme platform[J].Adv.Mater.,2016,28(8):1 577-1 584.
[38]LIN B X,YAN Y,GUO M L,et al.Modification-free carbon dots as turn-on fluorescence probe for detection of organophosphorus pesticides[J].Food Chem.,2018,245:1 176-1 182.
[39]PUNDIR C S,MALIK A,PREETY.Bio-sensing of organophosphorus pesticides:A review[J].Biosens.Bioelectron.,2019,140:111 348.
[40]MASUD M K,NA J,YOUNUS M,et al.Uperparamagnetic nanoarchitectures for disease-specific biomarker detection[J].Chem.Soc.Rev.,2019,48(24):5 717-5 751.
[41]WANG Y,XU J,LEI L,et al.Multi-functional carbon dots-based nanoprobe for ratiometric enzyme reaction monitoring and biothiol analysis[J].Sensor.Actuat.B-Chem.,2018,264:296-303.
[42]WANG D,LIN B X,CAO Y J,et al.A highly selective and sensitive fluorescence detection method of glyphosate based on an immune reaction strategy of carbon dot labeled antibody and antigen magnetic beads[J].J.Agric.Food Chem.,2016,64(30):6 042-6 050.
[43]ZHOU F,WANG P,PENG Y B,et al.Molecular engineering-based aptamer-drug conjugates with accurate tunability of drug ratios for drug combination targeted cancer therapy[J].Angew.Chem.Int.Ed.Engl.,2019,58(34):11 661-11 665.
[44]SUN Y L,DING C F,LIN Y N,et al.Highly selective and sensitive chemiluminescence biosensor for adenosine detection based on carbon quantum dots catalyzing luminescence released from aptamers functionalized graphene@magnetic beta-cyclodextrin polymers[J].Talanta,2018,186:238-247.
[45]WANG H Y,CHI Z,CONG Y,et al.Development of a fluorescence assay for highly sensitive detection of pseudomonas aeruginosa based on an aptamer-carbon dots/graphene oxide system[J].RSC Adv.,2018,8(57):32 454-32 460.
[46]MOTIB A,GUERREIRO A,AL-BAYATI F,et al.Modulation of quorum sensing in a gram-positive pathogen by linear molecularly imprinted polymers with anti-infective properties[J].Angew.Chem.Int.Ed.Engl.,2017,56(52):16 555-16 558.
[47]AWINO J K,GUNASEKARA R W,ZHAO Y.Selective recognition of d-aldohexoses in water by boronic acid-functionalized,molecularly imprinted cross-linked micelles[J].J.Am.Chem.Soc.,2016,138(31):9 759-9 762.
[48]WU M,FAN Y J,LI J W,et al.Vinyl phosphate-functionalized,magnetic,molecularly-imprinted polymeric microspheres′ enrichment and carbon dots′ fluorescence-detection of organophosphorus pesticide residues[J].Polymers-Basel,2019,11(11):1 770.
[49]KAZEMIFARD N,ENSAFI A A,REZAEI B.Green synthesized carbon dots embedded in silica molecularly imprinted polymers,characterization and application as a rapid and selective fluorimetric sensor for determination of thiabendazole in juices[J].Food Chem.,2020,310:125 812.
[50]FANG M,ZHOU L,ZHANG H,et al.A molecularly imprinted polymers/carbon dots-grafted paper sensor for 3-monochloropropane-1,2-diol determination[J].Food Chem.,2019,274:156-161.
[51]HAN Y,YANG W X,LUO X L,et al.Carbon dots based ratiometric fluorescent sensing platform for food safety[J].Crit.Rev.Food Sci.,2020,62:1-17.
[52]HAN Y,YANG W,LUO X,et al.Cu2+-triggered carbon dots with synchronous response of dual emission for ultrasensitive ratiometric fluorescence determination of thiophanate-methyl residues[J].J.Agric.Food Chem.,2019,67(45):12 576-12 583.
[53]ZHANG Y,ZHAO J R,SUN X B,et al.Fluorescent carbon dots for probing the effect of thiram on the membrane of fungal cell and its quantitative detection in aqueous solution[J].Sensor.Actuat.B-Chem.,2018,273:1 833-1 842.
[54]CARNEIRO S V,DE-QUEIROZ V H R,CRUZ A A C,et al.Sensing strategy based on carbon quantum dots obtained from riboflavin for the identification of pesticides[J].Sensor.Actuat.B-Chem.,2019,301:127 149.
[55]AI H W,HAZELWOOD K L,DAVIDSON M W,et al.Fluorescent protein FRET pairs for ratiometric imaging of dual biosensors[J].Nat.Methods,2008,5(5):401-403.
[56]AYDINDOGAN E,GULER C E,TIMUR S.Paper-based analytical methods for smartphone sensing with functional nanoparticles:Bridges from smart surfaces to global health[J].Anal.Chem.,2018,90(21):12 325-12 333.
[57]LIU J H,WANG Y L,YAN G H,et al.Systematic toxicity evaluations of high-performance carbon “antum” dots[J].J.Nanosci.Nanotechno.,2019,19(4):2 130-2 137.