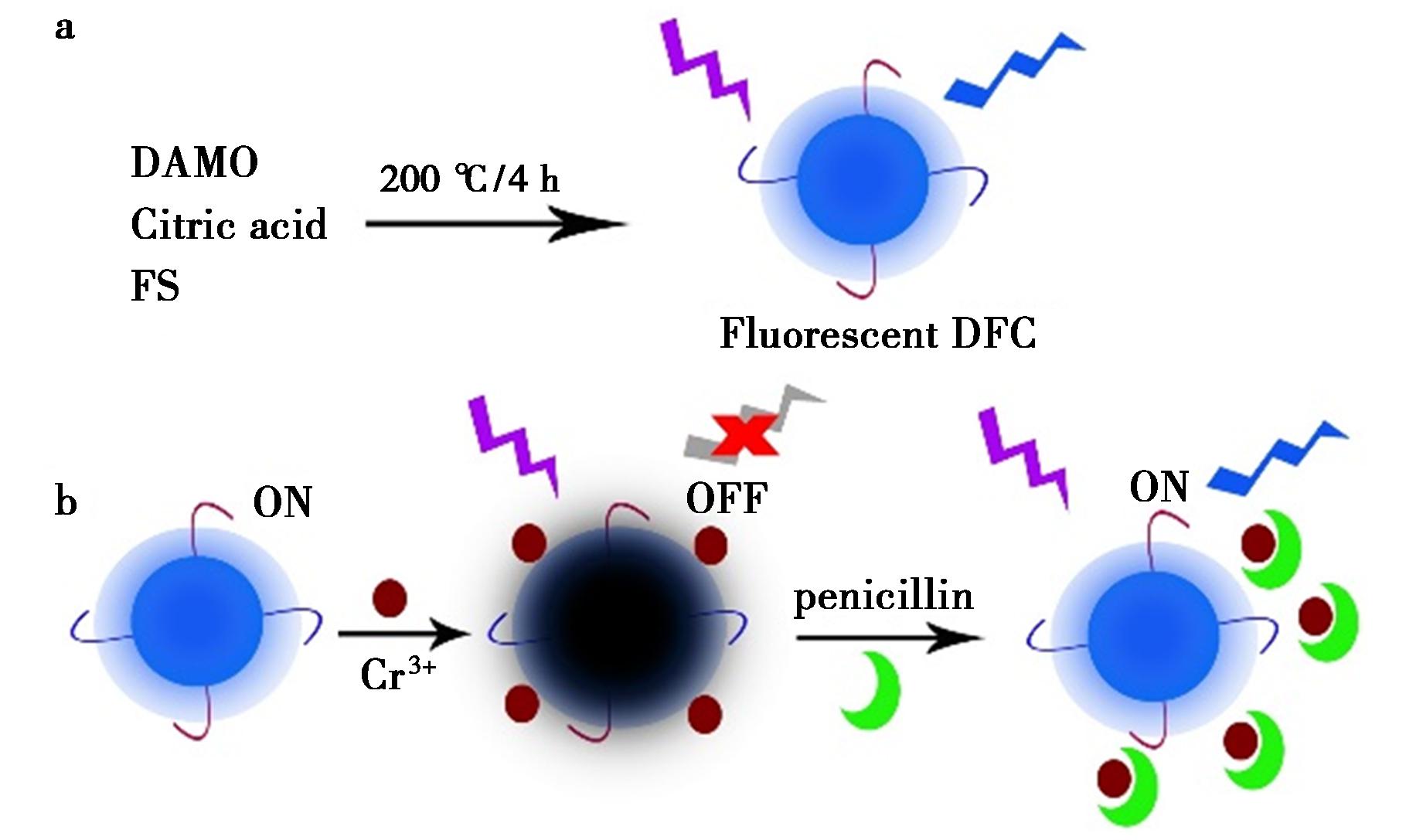
a.DFC的制备;b.DFC检测PG的传感机理
图1 原理示意图
Fig.1 Mechanism schematic diagrams
分析与测试
抗生素是由生物体内产生的具有抵抗病毒次级代谢物,过量抗生素的使用不仅抑制细胞的正常生长,同时也对人类的健康安全造成潜在的威胁[1-3]。特别是抗生素滥用后通过动物食物链的传递而进入人体,当积累的抗生素达到一定量之后,就会对人体健康带来危害。青霉素(Penicillin G,PG)作为抗生素的一种,广泛被应用于畜牧养殖和疾病防治[4,5]。牛奶作为动物源性食品,因其口感好、蛋白含量高,已经成为人们日常生活中必不可少的食品之一,因此牛奶的食品安全保障也成为了人们关心的热点。目前,食品中抗生素检测的方法有高效液相色谱-串联质谱法[6]、液相色谱-紫外-质谱法[7]、液相色谱-荧光检测法[8,9]。仪器检测的方法灵敏度高,准确,但需要比较复杂的样品前处理过程,分析时间比较长。另外抗生素的检测方法又拓展到了酶联免疫分析法[10-12]、微生物法[13]、毛细管电泳法等[14,15]。免疫分析是根据抗原抗体之间的特异性反应进行检测的分析方法,虽然该方法灵敏度高,样品检测数量大,重现性好,但也存在无法检测合适对应抗原的抗生素的缺陷。微生物法因操作简单、检测时间短、成本低,是目前应用最广泛的检测抗生素的方法,但检测的灵敏度比较低,不适合痕量和微量分析。毛细管电泳法虽然检测所用样品量少,检测快,但检测的灵敏度低。因此,建立一种高效、高灵敏、准确度高,低成本的抗生素检测方法是非常必要且具有重要意义。
硅纳米粒子是一种粒径较小(一般在10 nm以下)的纳米微粒[16],其原料在自然界中广泛存在,来源易得。硅纳米粒子具有优异的光学、电学性能和良好的生物相容性,在化学、生物、医学领域具有良好的应用前景[17-19]。2019年,Wei等[20]通过合成绿色荧光硅纳米粒子,实现了灵敏检测血红蛋白。Reddy等[21]以富含硅的马尾草为前体,通过水热法制备了蓝色荧光硅纳米粒子,并通过荧光淬灭的方式实现了铁离子的检测。Huang等[22]通过N掺杂的方式,制备了硅量子点并建立了荧光开关策略,实现了银离子和过氧化氢的双检测,Ren等[23]通过掺杂铕制备了双发射硅点,实现了对四环素灵敏检测和手机成像分析。基于硅纳米粒子优异的荧光性能和应用,本文通过水热法制备了一种水溶性的蓝色荧光硅纳米粒子(DFC),通过金属铬离子(Cr3+)对DFC的荧光淬灭作用构建了荧光探针Cr3+@DFC,其荧光处于“OFF”状态,当PG存在时,Cr3+@DFC的荧光信号得到回升,荧光呈“ON”状态,因此基于荧光“开-关-开”的策略,可建立一种快速、高灵敏检测PG的分析方法(图1)。该方法不仅简单、快速、而且准确度高,具有可应用于实际样品检测的良好前景。

a.DFC的制备;b.DFC检测PG的传感机理
图1 原理示意图
Fig.1 Mechanism schematic diagrams
FL970型荧光光谱仪、UV2500型紫外-可见吸收光谱仪(上海天美科学仪器有限公司);LitesizerTM 500ZETA型电位及纳米粒度分析仪(安东帕(上海)商贸有限公司);PHS-3C+型智能酸度计(成都世纪方舟科技有限公司);Spectrum TwoTM型红外光谱仪(珀金埃尔默企业管理(上海)有限公司);LVO-0B型真空干燥箱(上海龙跃仪器设备有限公司);EX125DZH型电子分析天平(奥豪斯仪器(常州)有限公司);XD-52A型旋转蒸发器(上海贤德实验仪器有限公司)。
N-氨乙基-Y-氨丙基三甲氧基硅烷(DAMO,上海麦克林生化科技股份有限公司);荧光素钠(FS,上海碧云天生物技术股份有限公司);柠檬酸、氯化铬、抗坏血酸、氨基酸(分析纯,上海阿拉丁生化科技股份有限公司);青霉素(98%,广州齐迈克林科技有限公司)。此外,实验用水均采用Milli-Q(Millipore)超纯水净水器纯化后的超纯水(18.2 MΩ·cm,25 ℃)。
准确称取30 mg荧光素钠溶于8 mL去离子水中,向其加入2 mL DAMO混合,然后再加入 1 mmol柠檬酸,充分混合均匀后,将溶液转入聚四氟乙烯反应釜内衬于200 ℃反应4 h,得到蓝色荧光硅纳米粒子。用分子截留量1 KD的透析袋透析24 h,期间每4 h换一次超纯水,收集透析液并减压浓缩,浓缩液预冷后进行真空冷冻干燥,得到橙色硅纳米粒子粉末。
固定DFC体积20 μL,加100 μL Cr3+标准溶液,然后加水定容至500 μL,涡旋混合均匀,测体系的荧光强度。
利用DFC与Cr3+构建的淬灭体系(Cr3+@DFC)作为检测探针,将青霉素加入Cr3+@DFC淬灭体系,混合均匀,静置一段时间后测试荧光强度。
以超市某品牌纯牛奶为测试对象,将500 mL(0.1 moL/L)柠檬酸溶液与312.5 mL(0.2 moL/L)磷酸氢二钠溶液混合,氢氧化钠溶液调至pH 3.95~4.05,将30.25 g乙二胺四乙酸二钠放入其中,使其混合均匀。准确称取5 g纯牛奶,加入上述缓冲溶液定容至50 mL,涡旋混合1 min,冰水浴超声10 min,转至50 mL离心管中冷却至0~4 ℃,5 000 r/min离心10 min,再用快速滤纸过滤,得到牛奶测试样品。
为测试荧光探针Cr3+@DFC对PG的选择性,实验测试了在相同条件下一些常见抗生素、氨基酸等小分子物质如链霉素(STR)、氯霉素(CHL)、葡萄糖(L-GIu)、甘氨酸(L-GIy)、半胱氨酸(L-Cys)、丝氨酸(L-Ser)、天冬氨酸(L-Asp)、酪氨酸(DL-Tyr)等存在下体系的荧光强度。
利用UV-Vis和荧光光谱仪对DFC进行了光谱性质测试。在波长400 nm处DFC具有较为明显的紫外吸收,荧光发射峰和激发峰峰型对称,强度相当,且无明显拖尾现象。说明制备的DFC颗粒均匀,并且在水溶液中具有良好的分散性能。在紫外暗箱下,DFC发出明亮的蓝色荧光(图2a和内插图)。通过扫描不同激发波长下DFC的荧光发射,发现DFC的荧光发射峰不随激发波长的改变而改变,具有典型的硅纳米粒子特性,在 360 nm激发下,DFC在450 nm处具有最强的荧光信号,因此后续进行荧光测试实验时,均选择360 nm作为最佳激发波长进行扫描(图2b)。
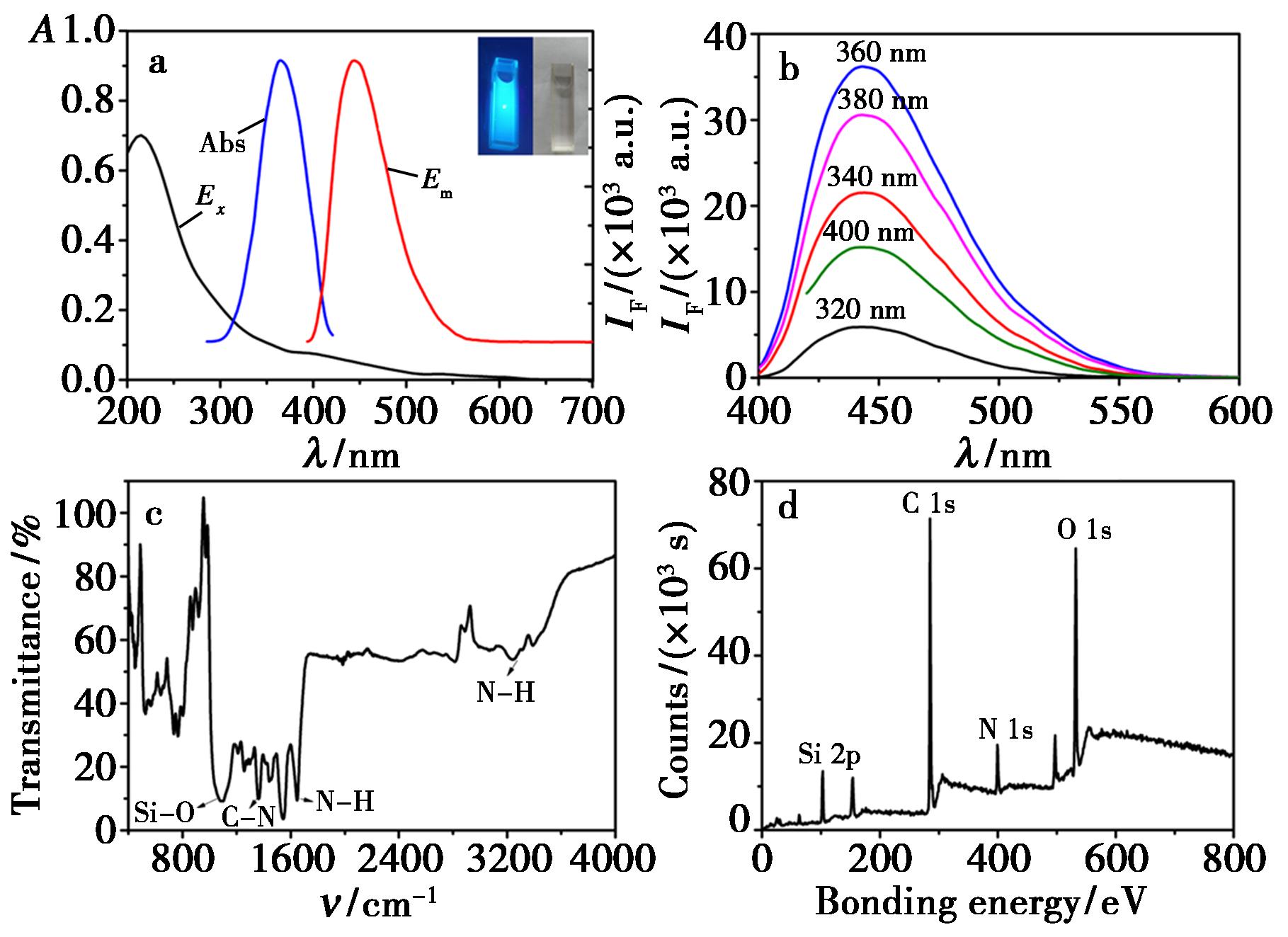
图2 a.DFC的UV-Vis及荧光光谱,Abs:吸收光谱,Ex:激发光谱,Em:发射光谱(内插图分别为在日光及暗箱下的颜色);b.DFC在不同激发下的荧光光谱(320~400 nm);c.红外光谱图;d.XPS扫描全谱
Fig.2 a.UV-Vis absorbance spectrum and fluorescence spectra of DFC,Abs:absorbance spectrum,Ex:excitation spectrum,Em:emission spectrum (inset is in daylight and dark,respectively);b.Fluorescence spectra of DFC under different excitation wavelength (320~400 nm);c.FT-IR spectrum of DFC;d.XPS full scan of DFC
通过FT-IR对DFC进行红外光谱表征,在 1 099 cm-1处为Si—O键的吸收峰,在1 366 cm-1处为C—N键的伸缩振动吸收峰,在1 646、3 242 cm-1处出现吸收峰,说明有N—H官能团(图2c)。通过X-射线光电子能谱仪对DFC进行XPS全谱扫描可知,Si2p、C1s、N1s、O1s的信号分别出现在102.4、248.8、400.08、532.22 eV处,与DAMO相比,C的含量最高达到65.21%,Si的含量为18.60%,N的含量为13.69%,说明制备的DFC表面含有氨基(图2d)。进一步通过TEM对DFC进行形貌和粒径表征,DFC呈规则的球形,具有非常好的分散性,基本没有团聚现象,且颗粒大小比较均匀,粒径约为4.2 nm(图3a),通过Zeta电位及粒径分析仪测试了DFC的表面带电性能,发现DFC的Zeta电位值为-21.2 eV(图3b)。

图3 a.DFC的透射电镜图及粒径分布;b.Zeta电位
Fig.3 a.TEM image and diameter distribution of DFC;b.Zeta potential of DFC
实验首先对DFC的用量进行了优化,固定Cr3+的浓度,然后依次加入不同体积的DFC,使其终浓度分别为10、20、30、40、50、60、70、80、90、100 μg/mL,通过测试体系的荧光强度发现,当DFC浓度较低时,Cr3+对DFC的淬灭效率达到90%以上,当DFC在40~70 μg/mL浓度范围内时,淬灭效率几乎保持在85%左右,继续增大DFC用量,淬灭效率出现下降趋势(图4a)。为保持DFC淬灭体系的稳定性和节约试剂,后续实验控制DFC的最终浓度为50 μg/mL。其次探针的稳定性是建立准确分析方法的关键因素,实验继续测试了Cr3+@DFC随时间变化的动力学行为。当向DFC中加入Cr3+后,DFC的荧光出现显著淬灭,并随时间延长而逐渐减弱,当时间达到1 200 s后,体系的荧光强度基本处于稳定状态。因此选择1 200 s作为反应时间(图4b)。实验进一步测试了 Cr3+@DFC探针在不同pH条件下的稳定性,在pH<3强酸和pH>11强碱性条件下,Cr3+@DFC探针的荧光强度不稳定,在pH 4~10时,Cr3+@DFC探针的荧光强度基本处于稳定状态(图4c),水刚好处于探针稳定存在的环境,因此后续实验选择在超纯水中进行。温度也是影响探针荧光稳定性的一个重要因素,实验分别在4、25、37、55 ℃ 4个不同的温度下测试了探针的荧光变化。结果表明,随温度升高探针的淬灭出现微弱上升趋势,淬灭效率仅有5%的微小变化(图4d),考虑后续实际样品检测,实验选择在室温下进行。
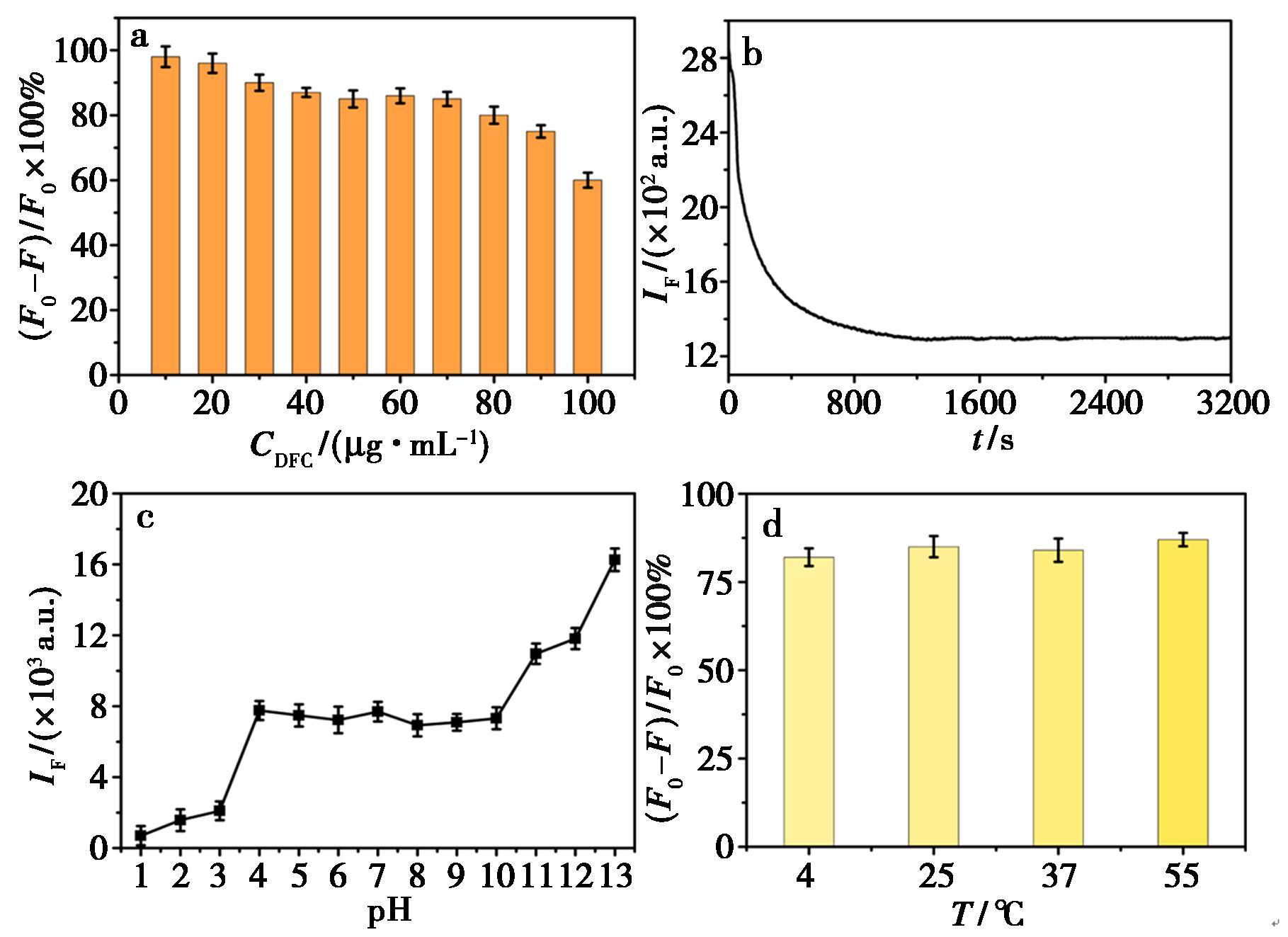
图4 a.不同浓度DFC对淬灭效率的影响;b.Cr3+对DFC的动态荧光淬灭;c.pH对Cr3+@DFC稳定性的影响;d.温度对Cr3+@DFC稳定性的影响
Fig.4 a.Effect of different concentrations of DFC on the quenching efficiency;b.Dynamic fluorescence quenching of DFC in the presence of Cr3+;c.Effect of pH on the stability of Cr3+@DFC;d.Effect of temperature on the stability of Cr3+@DFC
为测试Cr3+对DFC的荧光淬灭性能,在优化条件下,向固定浓度的DFC中加入不同浓度的Cr3+,充分反应之后测体系的荧光强度。随Cr3+浓度的增加,DFC的荧光强度逐渐降低,淬灭效率((F0-F)/F0×100%,F0:DFC的荧光强度,F:加入Cr3+之后体系的荧光强度)逐渐增强(图5a),当Cr3+浓度达到10 μmol/L,DFC的荧光淬灭效率接近90%,继续增加Cr3+至100 μmol/L时,淬灭效率也只增加了6%(图5b),说明Cr3+淬灭DFC荧光后形成了比较稳定的Cr3+@DFC探针并处于稳定状态。
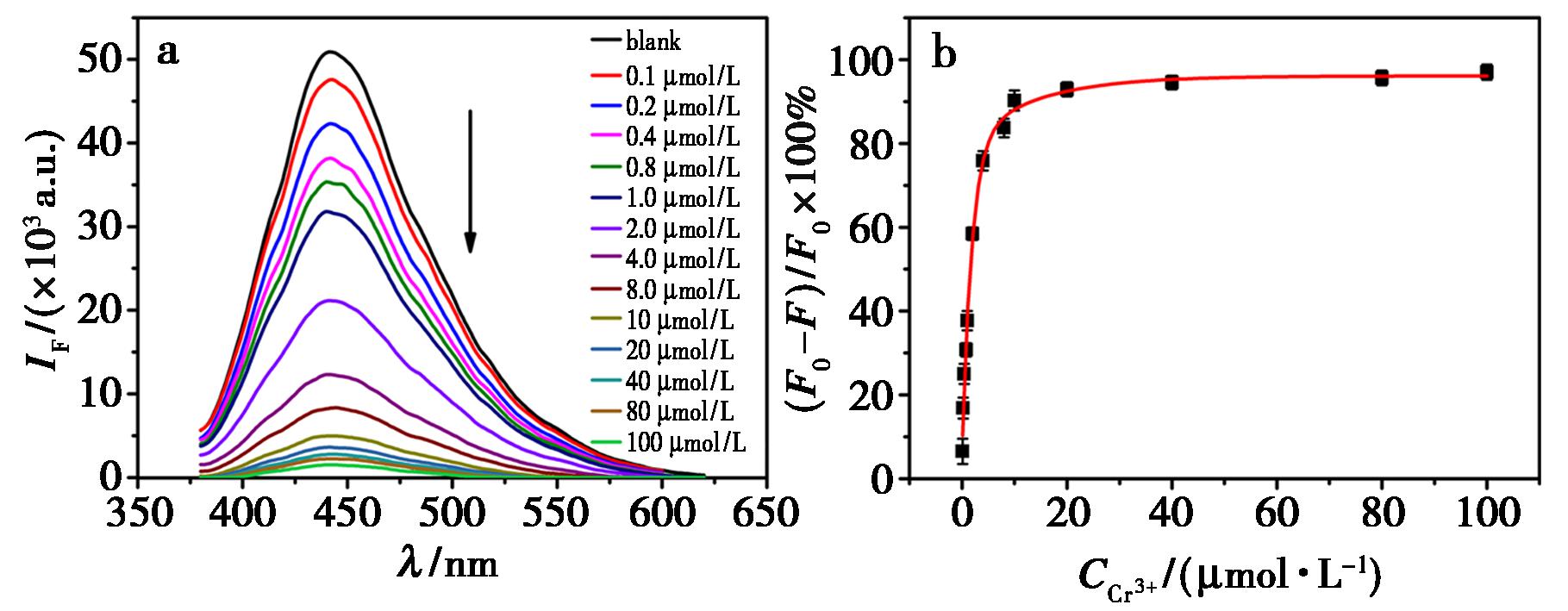
图5 Cr3+(0~100 μmol/L)对DFC的荧光光谱(a)和淬灭效率(b)
Fig.5 Fluorescence spectra (a) and quenching efficiency (b) of Cr3+ (0~100 μmol/L) toward DFC
固定探针Cr3+@DFC的量,然后加入不同浓度的PG,在相同条件下测试体系的荧光强度。当加入PG后,Cr3+与PG分子上的N与—COOH之间形成稳定的螯合物,使Cr3+脱离了DFC的吸附,因此DFC的荧光得以回升。随PG浓度的增加,体系的荧光强度逐渐回升,说明PG能够回升Cr3+@DFC探针荧光,荧光回升效率也随之增加(图6a),(回升效率(F-F0)/F×100%,F0:Cr3+淬灭DFC后的荧光强度,F:向淬灭体系中加入青霉素后回升的荧光强度),在0.1~1.0 μg/mL浓度范围内,PG与荧光回升效率之间呈良好线性关系,拟合得到线性方程y=71.26x+0.478,R2=0.99,LOD为0.023 μg/mL,在高浓度范围2.0~10.0 μg/mL内,拟合的线性方程为y=1.244x+74.25,R2=0.97(图6b),说明在较高浓度范围内也可以准确检测PG。实验还进一步考察了PG加入后,Cr3+@DFC探针荧光回升随时间变化的动力学行为。可以看出,当PG加入后,Cr3+@DFC的荧光逐步回升,在前1 000 s内,由于PG浓度比较高,因此荧光回升比较快,随着时间延长,PG浓度逐渐降低,体系荧光回升速率也逐渐减缓,当时间增加至3 000 s时,Cr3+@DFC的荧光回升基本达到稳定状态,继续延长时间,回升效率保持不变(图7a),说明构建的Cr3+@DFC探针可以实现对PG的高灵敏及快速检测。

图6 a.加入不同浓度PG后,Cr3+@DFC的荧光谱图;b.回升效率与PG浓度之间关系
Fig.6 a.Fluorescence spectra of Cr3+@DFC with different concentrations of PG;b.Relationship between the recovery efficiency and concentrations of PG

图7 a.Cr3+@DFC在PG存在时的荧光回升动力学;b.不同干扰物质存在下,Cr3+@DFC对PG的选择性
Fig.7 a.Dynamic of fluorescence recovery of Cr3+@DFC in the presence of PG;b.Specificity of Cr3+@DFC toward PG against different interferents
为验证建立的分析方法可以广泛应用于实际样品中PG的检测,对潜在的干扰物质在相同的实验条件下进行了荧光回升测试。结果显示,PG存在下探针的荧光回升效率达83.7%,而其他干扰物质存在时,探针的荧光回升效率仅为0.8%~5.2%(图7b),说明本方法对PG的检测具有极高的选择性。
为验证分析方法的准确性,将构建的方法应用于牛奶样品中进行检测,并进行加标回收实验。结果如表1所示,加标回收率在92.5%~105.5%之间,RSD在0.06%~0.47%之间,表明所构建的分析方法准确度高,可应用于实际样品中PG的检测。
表1 加标回收实验结果
Tab.1 Results of spiked recovery experiment (n=3)

SampleAddedamountofPG/(μg·mL-1)FoundamountofPG/(μg·mL-1)Recovery/%RSD/%Milk0.10.20.40.0950.2100.37095.5105.592.50.470.060.12
本文通过水热法制备出了一种发射蓝色荧光的纳米粒子DFC,Cr3+对DFC具有强烈的荧光淬灭效果,构成了一种稳定、选择性高的Cr3+@DFC探针。PG能够回升Cr3+@DFC探针的荧光,回升效率与PG的浓度呈现良好的线性关系。在浓度0.1~1.0 μg/mL范围内,拟合的线性方程为y=71.26x+0.478,R2=0.99,检出限0.023 μg/mL。因此建立了一种对PG检测具有高灵敏及高选择性的分析方法,该方法可用于实际样品中PG的检测,方法准确度高,本文所建立的分析方法,也启发了通过构筑高灵敏探针的方式,以期实现对更多抗生素生物分子的检测。
[1]Rizzetti T M,Souza M P D,Presters O D,Adaime M B,Zanella R.Food Chem.,2018,246(25):404-413.
[2]Lv K,Liu X W,Deng C X,Zheng K,Li L L,Shi J H,Guo W.Environ.Chem.,2019,38(11):2 415-2 424.吕凯,刘晓薇,邓呈逊,郑坤,李兰兰,史江红,郭伟.环境化学,2019,38(11):2 415-2 424.
[3]Zhao C Q,Liang J J,Li Z M,Xu X Y,Liu Z.Anal.Lab,2023,42(8):1 066-1 073.赵超群,梁晶晶,李志梅,徐潇颖,刘柱.分析试验室,2023,42(8):1 066-1 073.
[4]Zhou L,Chen G,Chen M,Lu X Y,Xi Y J,Zhi Y.Food Addit.Contam.A,2022,39(3):488-498.
[5]Zhang Y Y,Li J Y,Zhang D H,Li H,Jin Y D,Peng W.J.Hebei North Univer.Nat.Sci.,2018,34(6):56-61.张岩蔚,李佳仪,张冬昊,栗慧,金艳丹,彭伟.河北北方学院学报(自然科学版),2018,34(6):56-61.
[6]Xu X,Xu X Y,Han M,Qiu S,Ho X.Food Chem.,2019,276(15):419-426.
[7]Bailac S,Barron D,Barbosa J.Anal.Chim.Acta,2006,580(2):163-169.
[8]Posyniak A,Mitrowska K.B Vet.I Pulawy,2008,52(3):427-430.
[9]Cheng W X,Zhang Q X,Liu Y,Zou L K.Spectrosc.Spectral Anal.,2024,44(5):1 245-1 254.程文轩,张庆贤,刘宇,邹立扣.光谱学与光谱分析,2024,44(5):1 245-1 254.
[10]Yang S,Carlson K.Water Res.,2004,38(14):3 155-3 166.
[11]Ashu T R,Pinacho D G,Pascual N,Granados M,Companyo R,Marco M P.Food Control,2015,57:195-201.
[12]Le T,Yi S H,Wei S,Liu J.Food Agr.Immunol.,2015,26(6):804-812.
[13]Zheng Y,Fan L X,Dong Y J,Liang J Y,Yuan X X,Wang L,Zhang B C,Zhao S C.Qual.Safe.Agr.,2019,3:65-69.郑颜,范丽霞,董燕婕,梁京芸,苑学霞,王磊,张丙春,李峰,赵善仓.农产品质量与安全,2019,3:65-69.
[14]Mohammad R,Ayatghasmi V,Mahdi L,Zahra E,Ali A R,Sajad S M.Microchim.Acta,2019,186(6):1-10.
[15]Li F,Wang X,Sun X,Guo Y.RSC Adv.,2017,7(62):38 981-38 988.
[16]Sato K,Yokosuka S,Takigami Y,Hirakuri K,Fujioka K,Manome Y,Sukegawa H,Iwai H,Fukata N.J.Am.Chem.Soc.,2011,133(46):18 626-18 633.
[17]Kryievski A,Mihavlov D,Kilin D.J.Phys.Chem.Lett.,2018,9(19):5 759-5 764.
[18]Rowe D J,Kortshagen U R.Nano Lett.,2013,13(3):1 317-1 322.
[19]Long Y,Zhang L,Yu Y,Lin B,Cao Y,Guo M.Luminescence,2019,34(6):544-552.
[20]Li Q,Peng K T,Yu Y C,Ruan X Y,Wei Y.Electrophoresis,2019,40(16):2 129-2 134.
[21]Adinarayana T V S,Ayushi M,Ishu S,Reddy R K.Nanoscale Adv.,2020,2:4 125-4 132.
[22]Zhu H,Huang D Y,Liu L R,Yin Y H,Wu Y T,Huang Y Q.Anal.Lett.,2020,33(1):1-17.
[23]Ren X H,Ma Z B,Zhang H R,He X W,Li W Y,Zhang Y K.Talanta,2024,278(1):126 432-126 439.