
图1 Lindlar催化剂氢化还原炔烃反应通式
Fig.1 Chemical reaction formula for semi-hydrogenation of alkyne with Lindlar catalyst
炔烃的选择性还原一直受到科学界和工业界重点关注,其中林德拉(Lindlar)催化剂催化氢气选择性还原炔成顺式烯烃是最经典的反应之一[1,2]。Lindlar催化剂是由负载在碳酸钙上的钯,并经醋酸铅毒化失活制备而成(图1),其钯负载量通常在5%~10%之间。在反应过程中,常加入少量喹啉以进一步抑制钯的活性。因其毒化作用,使其能高选择性将炔转化为顺式烯烃。

图1 Lindlar催化剂氢化还原炔烃反应通式
Fig.1 Chemical reaction formula for semi-hydrogenation of alkyne with Lindlar catalyst
近两年,本课题组多次使用Lindlar催化剂催化氢气还原内炔[3-5],然而在反应过程中,炔烃的还原并非完全发生顺式还原,同样存在反式还原[4]和过度还原(成烷烃)[3]等情况。相关文献表明,Lindlar催化剂催化性能受供应商和批次影响存在一定波动[6,7],同时还存在重现性不佳等问题[8]。基于此,本论文简要归纳了近几十年来有关Lindlar催化剂的研究,重点探讨选择性催化的影响因素,综述其在非经典顺式还原中的一些应用,旨在为Lindlar催化剂的高效使用提供参考。
值得注意的是,除了顺式选择性还原炔烃外,Lindlar催化剂还具备将炔烃进一步还原为烷烃的能力。并且,Lindlar催化剂作为一种高效催化剂在其他官能团还原中也有一定的应用,这主要是通过调控各类碱性添加剂(喹啉、吡啶等)的使用量,来实现特定官能团转化。尽管该领域已有大量报道,但大多聚焦于具体应用及反应分析,缺乏系统性梳理。鉴于此,本文综述了近年来Lindlar催化剂的各种非经典还原应用,希望能给广大同行在使用Lindlar催化剂时提供有益参考。本文着重归纳了Lindlar催化剂高效控制炔烃顺式还原的主要影响因素——碱性添加剂的使用和各类非炔还原中的应用。
Lindlar催化剂在炔烃选择性氢化中的应用主要涉及两个关键问题:化学选择性(部分还原生成烯烃vs.完全还原生成烷烃)以及立体选择性(顺式vs.反式加成)。研究证实,碱性催化剂在调控这类选择性方面发挥决定性作用。
自1952年Lindlar[1]首次报道该催化体系以来,其开创性通过引入4 wt%喹啉作为钯的失活助剂,成功实现顺式烯烃的高选择性合成(85%产率,图2)。然而,后续研究表明碱性添加剂的用量与选择性控制之间存在复杂关联,不同研究团队甚至得出了相互矛盾的结论:Adlof[9]、Gronquist[10]、Itoh[11]等学者主张无需添加喹啉等碱性物质即可实现高效选择性还原,而 Nicolaou[12]、Pyne[13]、Britton[14]、Campos[15]等研究团队则强调必须使用超过1 equiv的碱性添加剂以避免过度还原。以下通过典型案例分析揭示这一矛盾现象背后的科学规律。

图2 Lindlar报道的催化氢化反应[1]
Fig.2 Semi-hydrogenation reaction reported by H.Lindlar[1]
1986年,Adlof等[9]在用Lindlar催化剂催化还原癸-3,6-二炔-1-醇(图3)时发现,引入喹啉会显著抑制氢化进程。而摒弃喹啉并采用相当于原料质量87%的Lindlar催化剂时,反应8 h后双烯产物产率可达96%。

图3 无添加剂下Lindlar催化剂催化部分氢化还原偕二炔[9]
Fig.3 Base additives-free semi-hydrogenation of geminal dialkynes by quasi-equivalent Lindlar catalyst[9]
同样的情况,Gronquist等[10]和Itoh等[11]在孤立二炔体系的还原中同样观察到(图4),在无喹啉等碱性添加剂条件下,通过催化量Lindlar催化剂(原料质量的15%)和较短反应时间(≤1.5 h),即可高效得到约85%~89%产率的顺式烯烃产物。

图4 无碱性添加剂的催化剂量Lindlar催化剂催化氢化还原偕二炔[10,11]
Fig.4 Base additives-free semi-hydrogenation of geminal dialkynes by catalytic amount of Lindlar catalyst[10,11]
以上3个案例的底物均为亚甲基偕二炔类衍生物,其优异的化学选择性可能来自二炔和金属钯的特殊配位模式,通过空间位阻效应抑制过度还原,这提示底物结构本身对选择性控制具有重要影响,并非所有体系依赖碱性添加剂。
在多数Lindlar催化选择性氢化案例中,碱性添加剂的调控作用不可或缺。除了喹啉外,吡啶、乙二胺等含氮碱也常见于毒化Lindlar催化剂。
1986年,Nicolaou等[12]在全合成12-羟基二十碳四烯酸(12-HETE,一种花生四烯酸代谢产物)过程中(图5),通过添加1.4 equiv喹啉降低Lindlar催化剂的催化活性,成功实现体系中的共轭三键的选择性氢化,得到了75%产率的顺式双键产物。

图5 Lindlar氢化在12-HETE全合成中的应用[12]
Fig.5 Lindlar hydrogenation in total synthesis of 12-HETE[12]
1997年,Pyne等[13]在进行共轭芳炔的还原时,使用1 equiv喹啉,得到80%产率的顺式烯烃产物,5%~6%产率的反式烯烃产物和4%~7%产率的烷烃还原产物(图6)。

图6 Lindlar催化剂催化咪唑类芳炔的氢化还原[13]
Fig.6 Hydrogenation of imidazolyl alkyne by Lindlar catalyst[13]
2007年,Britton团队[14]在合成绵古毒蛾(Orgyia postica)性信息素posticlure中,研究了喹啉用量对选择性的影响(图7)。结果表明,喹啉用量不足1 equiv时,会出现大量过度还原产物,而1 equiv喹啉的引入,使顺式烯烃中间体的两步总产率达到84%。值得一提的是,该还原过程必须在0 ℃进行,若室温进行,则会生成一些难以鉴定的副产物。
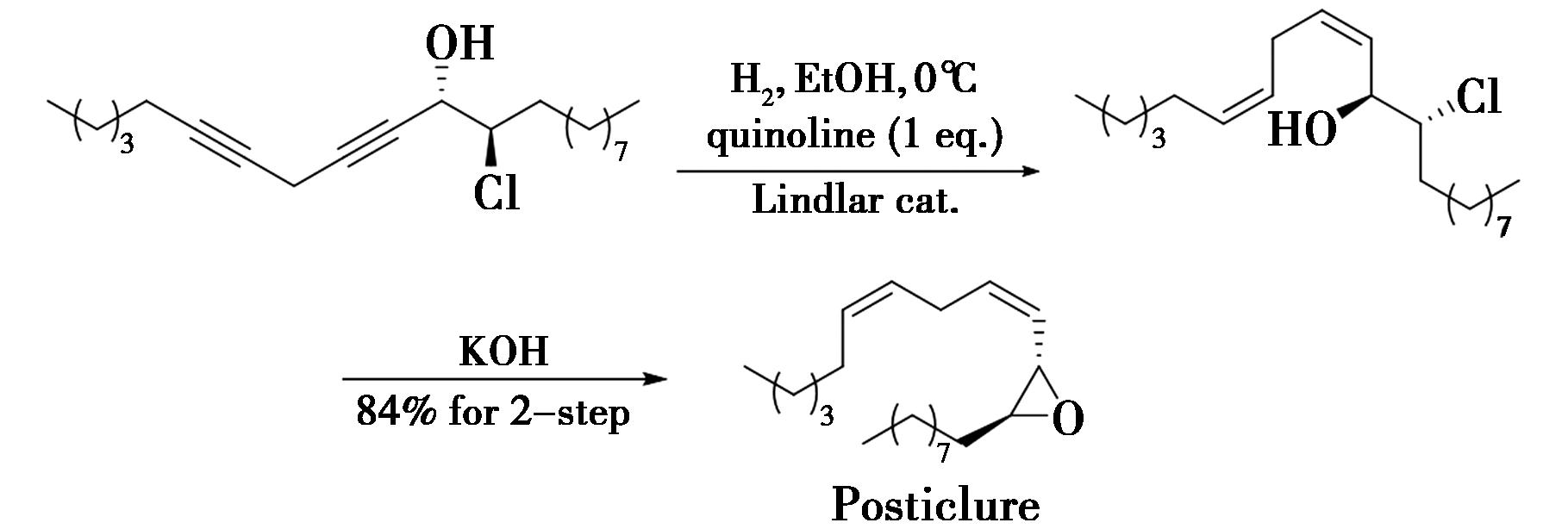
图7 绵古毒蛾性信息素全合成中Lindlar催化氢化[14]
Fig.7 Semi-hydrogenation by Lindlar catalysis in the total synthesis of sex pheromone of posticlure[14]
而其他更具挑战行的共轭烯炔体系,单一碱性添加剂难以实现理想选择性。如Kumar团队[16]在合成天然产物(9S,10E,12Z)-9-羟基十八碳-10,12-二烯酸时,发现传统喹啉调控无法避免过度还原(图8a)。采用V(乙酸乙酯)∶V(吡啶)∶V(1-辛烯)=10∶1∶1的混合溶剂体系,利用过量吡啶抑制催化剂活性,同时通过1-辛烯的竞争性吸附保护目标烯烃免受进一步氢化,最终将顺式烯烃产率提升至95%。受此项工作启发,2013年Hansen等[17](图8b)和2021年Aursnes等[18](图8c)在各自的研究中,通过该条件验证了此方法的合理性,并分别将其应用于天然产物Protectin D1和resolvin E4类似物的合成中。

图8 溶剂优化后的Lindlar催化选择性氢化还原[16-18]
Fig.8 Selective hydrogenation of Lindlar catalyst with optimized solvents[16-18]
2001年,Campos等[15](图9)在氨基内炔的选择性还原中发现,Lindlar催化剂催化氢化时,通过加入1.2 equiv的乙二胺(EDA)能实现高效顺式氢化,产率97.6%。这一结果不仅拓展了碱性添加剂的选择范围,更揭示了氨基配位对选择性的特殊影响。后续DFT研究[19]从理论层面阐明了作用机制:铅(Pb)掺杂通过减少催化剂表面游离氢浓度并降低烯烃吸附能,而喹啉等碱性添加剂则通过占据活性位点阻断炔烃过度还原。

图9 乙二胺控制Lindlar催化剂选择性氢化炔胺分子[15]
Fig.9 Ethylenediamine-mediated selective semi-hydrogenation of alkynylamine by Lindlar catalyst[15]
综合文献证据表明,Lindlar催化剂本质上具备将炔烃完全还原为烷烃的能力,碱性添加剂的引入通过毒化部分活性位点来抑制这一过程。抑制方法主要通过加入不少于1 equiv的碱性添加剂以及过量1-辛烯来控制。反应时间的精密控制同样关键——延长反应时间必然导致完全氢化,这为选择性还原提出了严格的动力学控制要求。
前文中,Campos团队[15]在进行炔伯胺还原时发现,不加入碱性添加剂的情况下,当靠近碳碳叁键位置存在伯胺时,碳碳叁键在1 h内会被迅速还原(表1)。随着时间延长,顺式烯烃逐渐转化成反式烯烃,并伴随完全氢化成烷烃(表1)。8 h后,烷烃产物达到50%,18 h后,则得到完全氢化产物。值得一提的是,将上述反应中的伯胺替换成羟基后,该反应选择性停留在顺式烯烃阶段。
表1 Lindlar催化炔胺分子的选择性氢化
Tab.1 Selective hydrogenation of alkynyl amine under Lindlar catalyst

EntryTime/hCis-b/%Trans-c/%d/%1188.08.13.82270.117.812.13430.736.333.04810.040.149.951800100
该实验结果表明特定原子或特定官能团对Lindlar催化氢化还原双键起到了定位和导向作用,促进了烯烃的进一步氢化。伯胺中氮原子的导向作用显著,而邻近的羟基氧原子无法起到导向作用。
简言之,通过对喹啉、吡啶、乙二胺等碱性添加剂用量的总结,不难发现,Lindlar催化剂本身具有将炔烃还原为烷烃的能力,这种能力可以通过喹啉等碱性添加剂的作用而失活。从另一个角度看,若控制碱的量或者不加碱,则可以提高Lindlar催化剂的催化性能,使其在一些重键的完全氢化以及部分官能团的选择性还原中具有特定功能。此外,反应时间也是一个重要因素,理论上,延长时间一定会将炔烃最终还原成烷烃,因此反应过程中的及时检测十分重要。
传统观点认为Lindlar催化剂专注于炔烃的顺式选择性氢化,但近年研究表明其在特定C![]() C双键的选择性还原中同样展现出独特优势。该特性在复杂分子(如多烯烃、α,β-不饱和羰基化合物)的精准修饰中具有重要价值。本节结合孤立双键与共轭烯酮两类典型体系,系统解析Lindlar催化剂对C
C双键的选择性还原中同样展现出独特优势。该特性在复杂分子(如多烯烃、α,β-不饱和羰基化合物)的精准修饰中具有重要价值。本节结合孤立双键与共轭烯酮两类典型体系,系统解析Lindlar催化剂对C![]() C双键的化学选择性调控机制。
C双键的化学选择性调控机制。
植物油,如菜籽油、葵花籽油等主要存在亚麻酸(Linolenic Acid)、亚油酸(Linoleic Acid)、油酸(Oleic Acid)不饱和酸和少量的硬脂酸(Stearic Acid)。植物油的氢化在工业上意义重大(表2),通常以Pd/C或Ni催化剂,但此类催化剂倾向于过度还原生成硬脂酸。而Laverdura等[20]使用Lindlar催化剂对植物油进行还原时,发现离羧基较远的两个非共轭C![]() C双键更容易被氢化还原,从而得到高浓度油酸油品(表2)。具体如下,在180 ℃、0.4 MPa下,经1 h可获得油酸为主要产物(88%;entry 3)。值得一提的是,时间延长至5 h,即可以92%产率得到硬脂酸(Stearic Acid;entry 5)。这一现象揭示了反应动力学对选择性的主导作用——远端双键由于位阻较小更易被活化。
C双键更容易被氢化还原,从而得到高浓度油酸油品(表2)。具体如下,在180 ℃、0.4 MPa下,经1 h可获得油酸为主要产物(88%;entry 3)。值得一提的是,时间延长至5 h,即可以92%产率得到硬脂酸(Stearic Acid;entry 5)。这一现象揭示了反应动力学对选择性的主导作用——远端双键由于位阻较小更易被活化。
表2 Lindlar催化剂催化氢化还原菜籽油
Tab.2 Lindlar catalyst catalyzed hydrogenation of canola oil

EntryTime/ha/%b/%c/%d/%10102168120.53982331.01188943.000326755.000692
如图10所示,在戊吗烯酮氢化制备戊吗酮(Pentamorphone)的反应中,因戊吗酮结构中存在一孤立碳碳双键和共轭烯酮中共轭碳碳双键,其选择性还原也具有一定挑战。通过Lindlar催化剂催化氢气还原(图10),Filer团队[21,22]成功地将富电子的孤立烯烃进行了选择性还原。Filer认为末端双键的小位阻和富电性是其选择性还原的关键,此外结构中两个氮原子导向作用也是该双键选择性还原的重要因素。此案例表明,通过合理设计底物结构引入导向基团,可提升Lindlar催化剂对孤立双键的还原效率。

图10 Lindlar催化氢化还原戊吗酮前体[21,22]
Fig.10 Lindlar catalyzed hydrogenation of the precursor of Pentamorphone[21,22]
Lindlar催化剂对孤立双键的还原相对困难,在没有导向基团加速反应进行时,多数情况需要在更加剧烈的条件下方可进行。
如图11所示,β-大马烯酮中(β-damascenone),羰基两边存在3个碳碳双键,其选择性还原颇具挑战。1971年,Büchi等[23]使用Lindlar催化剂,经 1.5 h得到90%产率β-大马酮(β-damascone)。该还原位点处于环上羰基最远端双键,表明电子效应对该反应的选择性有一定贡献,富电子烯烃更容易被还原。

图11 Lindlar催化氢化还原β-大马烯酮合成
β-大马酮[23]
Fig.11 Hydrogenation of β-damascenone to β-damascone by Lindlar catalyst[23]
针对α,β-不饱和羰基化合物(醛/酮/酯),1996年,Righi等[24]系统研究了Lindlar催化剂对这类分子的选择性氢化,部分反应如图12所示。在不加入任何碱性添加剂的前提下(即不降低 Lindlar催化剂活性),常温常压Lindlar催化氢化,除了在对反式肉桂醛(g)还原时得到V(苯丙醛)∶V(苯丙醇)=7∶3的混合物外,其余反应均得到近乎定量的α,β-碳碳双键(C![]() C)选择性还原产物。根据不同底物结构,该还原过程特点如下:a.硅醚和缩酮均不受还原影响;b.四取代双键因位阻较大没有被还原;c.共轭二烯酮的还原,羰基两侧碳碳双键中首先被还原的双键改变了分子原有的平面空间构型,烷基增大的空间位阻,阻碍了第二个碳碳双键进一步还原;d.在(2E,4E)-2,4-癸二烯醛氢化中,得到了定量的癸醛,两个共轭双键均被还原;e.反应底物中存在的孤立双键在反应过程中不受影响。f与g中,肉桂酸酯和肉桂醛中的C
C)选择性还原产物。根据不同底物结构,该还原过程特点如下:a.硅醚和缩酮均不受还原影响;b.四取代双键因位阻较大没有被还原;c.共轭二烯酮的还原,羰基两侧碳碳双键中首先被还原的双键改变了分子原有的平面空间构型,烷基增大的空间位阻,阻碍了第二个碳碳双键进一步还原;d.在(2E,4E)-2,4-癸二烯醛氢化中,得到了定量的癸醛,两个共轭双键均被还原;e.反应底物中存在的孤立双键在反应过程中不受影响。f与g中,肉桂酸酯和肉桂醛中的C![]() C双键的还原优先于C
C双键的还原优先于C![]() O双键。
O双键。

图12 Lindlar催化剂催化共轭双键的选择性还原[24]
Fig.12 Selective reduction of conjugated alkenes with Lindlar catalyst[24]
Righi的研究表明α,β-不饱和羰基分子中 C![]() C比C
C比C![]() O优先被还原,C
O优先被还原,C![]() C双键取代基增多空间位阻较大时抑制氢化过程(四取代烯烃不反应),反应过程中孤立的碳碳双键不受影响。
C双键取代基增多空间位阻较大时抑制氢化过程(四取代烯烃不反应),反应过程中孤立的碳碳双键不受影响。
Righi的成果,在1997年Kishi等[25]合成伏马菌素B2(Fumonisin B2)中亦有体现。使用Lindlar催化剂对酯基α,β-位双键进行氢化,成功将α,β-不饱和酯中共轭的碳碳双键(C![]() C)进行了选择性还原。值得一提的是,结构式中,叔丁氧羰基(Boc)、苄氧基和苄胺基均未受到影响(图13),验证了Lindlar催化剂对α,β-不饱和酯中碳碳双键高选择性氢化还原能力。
C)进行了选择性还原。值得一提的是,结构式中,叔丁氧羰基(Boc)、苄氧基和苄胺基均未受到影响(图13),验证了Lindlar催化剂对α,β-不饱和酯中碳碳双键高选择性氢化还原能力。

图13 Lindlar催化剂催化氢气还原α,β-不饱和酯
中的C![]() C双键[25]
C双键[25]
Fig.13 Selective hydrogenation of C![]() C bond in α,β-unsaturated esters with Lindlar catalyst[25]
C bond in α,β-unsaturated esters with Lindlar catalyst[25]
在Kishi的基础上,1998年,Ghosh等[26]详细研究了Lindlar催化氢化反应对各类官能团的耐受性。结果表明:Lindlar催化剂能够与苄醚、苄胺等基团相兼容,但会脱除Cbz保护基团(图14)。

图14 Lindlar催化氢解反应中的官能团耐受性[26]
Fig.14 Functional group tolerance in the Lindlar catalyst catalyzed hydrogenation[26]
基于上述研究,Lindlar催化剂具有还原烯烃的能力,其还原选择性受以下5个因素协同控制:1)碱性添加剂:通过毒化活性位点调节催化剂选择性;2)空间位阻:决定底物分子和金属催化剂的结合;3)电子效应:富电子双键更易亲电氢化;4)导向基团:通过配位作用引导双键的定向吸附;5)反应动力学:通过时间、双键共轭稳定性等实现阶段性还原。此外,Lindlar催化剂可以脱除苄氧羰基(Cbz),但不会切除苄醚和苄胺中的苄基。
Lindlar催化剂除了选择性还原叁键和双键外,还可催化氢化选择性还原硝基成胺基和脱卤素反应。具体如下:
硝基苯可以在多种金属催化剂下催化氢化还原成苯胺,而在还原过程中加入酸可以经 Bamberger重排选择性变成对氨基苯酚(图15)[27]。该路线是工业上制备解热镇痛药对乙酰氨基酚最重要的工艺。

图15 Lindlar催化剂催化硝基苯选择性氢化成苯胺和为对氨基苯酚的简化机理图[27]
Fig.15 Simplified mechanism of Lindlar catalyst-catalyzed selective hydrogenation of nitrobenzene to aniline and p-aminophenol[27]
He[28]通过Lindlar催化剂加压下催化氢化,在CO2/H2O体系中实现了硝基苯(NB)选择性还原成苯胺(AN)及对氨基苯酚(PAP)。研究表明,硝基首先被吸附在催化剂表面,与吸附的氢气反应生成N-苯基羟胺(PHA)。若PHA持续吸附于催化剂表面,会进一步与催化剂表面游离氢发生反应,完全氢化为苯胺。若催化剂表面的PHA解吸附,则游离的PHA可在酸性水溶液体系中,经Bamberger重排为对氨基苯酚。
研究还发现,上述反应中喹啉用量对对氨基苯酚的选择性还原影响较大。将喹啉/Pd物质的量比(表3)从0逐步提高至0.167,发现喹啉/Pd物质的量比在0.1时,得到的对氨基苯酚产率最高(68%)。但喹啉用量进一步增大时,会使得Lindlar催化剂活性降低,导致硝基苯的转化率从99%下降至92%(entry 5)。
表3 喹啉与Pd物质的量比对对氨基苯酚产率的影响
Tab.3 Effect of molar ratio of quinoline to Pd on the yield of p-aminophenol

EntryQuinoline/PdConv.yield of NB/%Yield of PAP/%10994320.017985230.040996140.100996850.1679263
钯催化下卤苯的脱卤氢化为科学界所熟知,而选择性脱卤,则需要降低钯活性。
1979年,Dixon等[29]首次使用Lindlar催化剂对芳香体系进行Lindlar脱氯氚化(图16)。该反应中,羰基的间位和对位均有氯原子,而通过Lindlar催化剂,可选择性氚解对位氯原子。

图16 Lindlar催化剂催化氯代芳烃的选择性脱氯[29]
Fig.16 Selective dehalogenation of chloroarene under Lindlar catalyst[29]
Filer等[30,31]在对麦角乙脲(Lisuride,一种多巴胺受体)进行氚标记的过程中,尝试通过对其溴代前体进行催化氚化脱卤来实现标记(图17)。该反应的重要挑战是切除溴同时,需要保留结构中的碳碳双键。实验中发现,常规的钯碳催化剂还原能力过强,在脱溴同时,也产生了大量双键还原产物。而Lindlar催化剂凭借着其高选择性,实现了对溴原子的精确氚代,得到高放射活性的氚化产物。

图17 Lindlar催化麦角乙脲溴代前体氚代脱卤[30,31]
Fig.17 Dehalogen-Tritiumination of 2-bromo Lisuride by Lindlar catalyst[30,31]
Lindlar催化剂是目前广泛应用的炔烃部分氢化还原催化剂,通过对添加剂的选择与优化,能够得到理想的顺式烯烃产物。然而Lindlar催化剂具备将炔烃全还原成烷烃能力,研究表明,Lindlar催化剂的选择性本质源于底物不同反应位点的电子效应与立体化学控制的动态平衡,其催化行为受以下多个因素调控:(1)碱性添加剂(如喹啉)对钯活性表面的毒化能力;(2)底物空间构型与配体结合能力的协同作用;(3)不饱和键的电子密度分布;(4)导向基团(羟基/氨基等)的配位诱导;(5)反应动力学的精准控制等。因此,本文综述了碱性添加剂对Lindlar催化剂选择性氢化的影响和各类Lindlar催化剂的非经典应用场景,具体包括炔烃的全还原,碳碳双键和共轭烯酮的选择性还原,硝基的选择性还原为羟胺、胺基,卤代芳烃的脱卤氚化标记等。
总之,Lindlar催化剂具有强大的应用潜力,随着对其独特选择性不断深入研究,Lindlar催化剂将拥有更高的反应活性和更广阔的应用范围。
[1]Lindlar H.Helv.Chim.Acta,1952,35(2):446-450.
[2]Oger C,Balas L,Durand T,Galano J.Chem.Rev.,2013,113(3):1 313-1 350.
[3]Li J J,Hu J,Jin D N,Huo H N,Chen N,Lin J Q,Lu X G.J.Nanobiotechnol.,2024,22:672.
[4]Fu Y Q,Leng Y J,Bai H T,Xu J X,Chen N.Org.Chem.Front.,2024,11:3 263-3 269.
[5]Wu Q Y,Chen N,Xu J X.ChemistrySelect,2022,7(4):202 103 943.
[6]Feutrill J T,Rizzacasa M A.Aust.J.Chem.,2003,56:783.
[7]Lee S E,Vyle J S,Williams D M,Grasby J A.Tetrahedron Lett.,2000,41(2):267-270.
[8]Kluwer A M,Koblenz T S,Jonischkeit T,Woelk K,Elsevier C J.J.Am.Chem.Soc.,2005,127(44):15 470-15 480.
[9]Adlof R O,Emken E A.J.Labelled.Compd.Rad.,1986,23(2):149-160.
[10]Gronquist M R,Meinwald J.J.Org.Chem.,2001,66(4):1 075-1 081.
[11]Itoh S,Kuwahara S,Hasegawa M,Kodama O.Biosci.Biotechnol.Biochem.,2002,66(7):1 591-1 596.
[12]Nicolaou K C,Ladduwahetty T,Taffer I M,Zipkin R.Synthesis,1986,1 986(4):344-347.
[13]Cliff M D,Pyne S G.J.Org.Chem.,1997,62(4):1 023-1 032.
[14]Kang B,Britton R.Org.Lett.,2007,9(24):5 083-5 086.
[15]Campos K R,Cai D,Journet M,Kowal J J,Larsen J J,Reider P J.J.Org.Chem.,2001,66(10):3 634-3 635.
[16]Naidu S V,Gupta P,Kumar P.Tetrahedron,2007,63(32):7 624-7 633.
[17]Aursnes M,Tungen J E,Vik A,Dalli J,Hansen T V.Org.Biomol.Chem.,2013,12(3):432-437.
[18]Reinertsen A F,Primdahl K G,Shay A E,Serhan C N,Hansen T V,Aursnes M.J.Org.Chem.,2021,86(4):3 535-3 545.
[19]García-mota M,Gómez-díaz J,Novell-leruth G,Vargas-fuentes C,Bellarosa L,Bridier B,Pérez-ramírez J,López N.Theor.Chem.Acc.,2011,128(4/6):663-673.
[20]Laverdura U P,Rossi L,Ferella F,Courson C,Zarli A,Alhajyoussef R,Gallucci K.ACS Omega,2020,5(36):22 901-22 913.
[21]Filer C N.J.Radioanal.Nucl.Ch.,2020,326(3):1 727-1 732.
[22]Ahern D G,Egan J A,Nugent R P,Filer C N.J.Radioanal.Nucl.Ch.,2013,295(2):1 029-1 031.
[23]Büchi G,Wüest H.Helv.Chim.Acta,1971,54(7):1 767-1 776.
[24]Righi G,Rossi L.Synth.Commun.,1996,26(7):1 321-1 327.
[25]Shi Y,Peng L F,Kishi Y.J.Org.Chem.,1997,62(17):5 666-5 667.
[26]Ghosh A K,Krishnan K.Tetrahedron Lett.,1998,39(9):947-948.
[27]Juang T,Hwang J,Ho H,Chen C.J.Chin.Chem.Soc.,1988,35(2):135-140.
[28]He C.Lindlar Pd Catalyzed Hydrogenation of Nitrobenzene to Prepare p-aminophenol in Pressurized CO2/H2O System.Liaoning:Dalian University of Technology,2014.
何聪.加压CO2/H2O体系Lindlar-Pd催化硝基苯氢化制备对氨基苯酚的研究.辽宁:大连理工大学,2014.
[29]Dixon R,Lucek R,Earley J,Perry C.Chlordiazepoxide:J.Pharm.Sci.,1979,68(2):261.
[30]Rauh J J,Lahm G P,Pahutski T F,Ullas G V,Filer C N.J.Labelled.Compd.Rad.,2010,53(1):51-52.
[31]Filer C N,Hainley C H,Nugent R P.J.Radioanal.Nucl.Ch.,2006,267(2):345-348.